·基础研究·
【摘要】 目的 研究单核细胞来源微颗粒对泡沫细胞形成的影响。方法 用氧化低密度脂蛋白或者低密度脂蛋白刺激RAW264.7细胞形成泡沫细胞,采用油红染色法对阳性的泡沫细胞进行染色,通过real-time PCR和Western印迹法测定微颗粒对RAW264.7细胞的受体或酶CD36、SR-A、ACAT1、nCEH、ABCA1、ABCG1、SR-BI的影响。结果 单核细胞来源的微颗粒影响RAW264.7细胞的活力;单核细胞来源的微颗粒可促进RAW264.7细胞的泡沫化形成;低浓度(20μl/ml)微颗粒可轻微促进巨噬细胞对低密度脂蛋白的吞噬,但对氧化低密度脂蛋白的吞噬却没有影响;过氧化物酶体增殖物激活受体-α(PPAR-α)的激动剂可增强泡沫细胞形成,拮抗剂作用相反。单核细胞来源微颗粒可下调SR-BI在mRNA和蛋白质水平的表达。PPAR-α激动剂可下调单核细胞来源微颗粒对RAW264.7巨噬细胞中SR-BI蛋白表达,PPAR-α拮抗剂没有影响。结论 单核细胞来源的微颗粒通过引起过氧化物酶体增殖物激活受体-α的表达,进而使巨噬细胞表面SR-BI的表达降低,从而促进RAW264.7泡沫细胞形成。
【关键词】 单核细胞微颗粒; 巨噬细胞; 泡沫细胞; 过氧化物酶体增殖物激活受体-α; 动脉粥样硬化
动脉粥样硬化被认为是一种慢性炎症的过程,多项研究证实泡沫细胞的形成和沉积是其重要的环节,同样这一环节也有炎症的参与。泡沫细胞的形成是在动脉粥样硬化形成的初期阶段,其主要是由于巨噬细胞中胆固醇吸收、酯化和外排的不平衡所造成的[1]。巨噬细胞表面影响细胞脂类代谢的受体或酶包括: CD36、清道夫受体A(scavenger receptor A, SR-A)、酰基辅酶A: 胆固醇酰基转移酶-1(Acyl-CoA: Cholesterol acyltransferase-1, ACAT1)、中性胆固醇酯水解酶(neutral cholesterol ester hydrolase, nCEH)、ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1, ABCA1)、ATP结合盒转运蛋白G1(ATP-binding cassette transporter G1, ABCG1)和清道夫受体B1型(scavenger receptor type B1, SR-BI)。CD36和SR-A与巨噬细胞摄取胆固醇有关;ACAT1和nCEH负责胆固醇酯化;ABCA1、ABCG1及SR-BI调节胆固醇的流出;进而影响着泡沫细胞的形成。研究表明,不同来源的微颗粒参与了炎症反应,临床研究证实,微颗粒与动脉粥样硬化的进展以及斑块的不稳定有关[2]。本研究观察单核细胞来源微颗粒对泡沫细胞形成及相关酶和受体的影响,探讨微颗粒对泡沫细胞形成影响的可能机制。
1.1 试剂与仪器
DMEM培养基RPMI 1640培养基TRIzol试剂购自美国Life technologies公司;PPAR-α激动剂非诺贝特、抑制剂GW6471、油红染料、低密度脂蛋白、3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物、青霉素-链霉素购自美国Sigma公司;胎牛血清购自美国Biological Industries(BI)公司;所用抗体购自美国Novus Biologicals公司。
离心机、低温离心机5424R购自Eppendorf公司;FACS AriaⅡ流式细胞仪购自BD公司;超低温冰箱(REVCO MOF-382E型);ViiA 7 real-time PCR仪购自Life Technologies公司;倒置显微镜购自奥林巴斯公司。
1.2 方法
1.2.1 单核细胞来源微颗粒形成 在THP-1单核细胞增殖至浓度1×106/ml[3]后,通过饥饿诱导凋亡 48h。将上清液以半径为 6.25cm,2307r/min,离心5min以除去细胞,再以半径6.25cm,3997r/min,离心15min以除去细胞碎片。将所得上清液在4℃以半径为 6.25cm,14593r/min,离心 15min 以获取微颗粒。将微颗粒悬浮在DMEM培养液中并在 -80℃ 下储存。应用双抗体(抗CD14+FITC和抗Annexin V-PE)标记的方法对微颗粒进行荧光标记,加入 50μl 流式计数微球。应用 1.1μm 微珠来框定微颗粒大小。微颗粒的绝对计数使用以下公式: 每 2μl 微颗粒计数=(50μl×流量计荧光球测定浓度)/(在Q2区域中的总流量计数)。
1.2.2 流式细胞术分析 使用双抗体抗CD14+FITC和抗Annexin V-PE在室温下避光将单核细胞微颗粒标记30min。通过 50μl 流动计数珠,使用流式细胞术分析单核细胞来源的微颗粒的浓度。通过BD FACSDiva软件分析数据。
1.2.3 细胞活力测定 将不同浓度的微颗粒(从20μl至120μl)与RAW264.7细胞共培养48h。向每个孔中加入浓度为5mg/ml MTT并在37℃孵育30min来测量细胞活力。温育后,除去上清液,向板中加入DMSO。使用全波长微板读数器在540nm的波长下测量光密度(D540)。
1.2.4 油红染色 将低浓度的微颗粒、LDL(100μg/ml)或oxLDL(50ng/ml)分别与RAW264.7细胞共培养48h,经过处理的RAW264.7细胞,先用PBS洗涤细胞并在4%多聚甲醛(PFA)中固定 30min,然后用0.3%油红溶液染色30min。用PBS洗涤3次后,通过倒置显微镜捕获图像;再对被油红染色的泡沫细胞进行计数。
1.2.5 RNA提取和RT-PCR 在与单核细胞来源微颗粒孵育后,用PBS洗涤RAW264.7细胞,并使用TRIzol提取RNA。每1ml的TRIzol加入200μl的甲醛;加入后震荡,然后再静止2min;加入4℃离心机里,离心半径为6.25cm,11304r/min,离心 15mim;每 1ml 的TRIzol加入 500μl 的异丙醇,静置 10min,室温;准备酒精75%,之后离心半径为 6.25cm,11304r/min,10min,4℃;将上清液吸走,加入75%的酒精,5min,离心半径为6.25cm,8937r/min,4℃离心;吸掉上清液,尽量去除干净,然后在超净台下吹干;接下来RNA浓度测定;根据RNA所测的浓度配置熔解反应所需的试剂,上下轻微颠倒混匀,进行短暂离心后放置冰上待用。使用天根试剂盒配制反转录反应液,进行反转录及定量PCR实验。引物如下。CD36上游引物: 5′-CTACGCTGTGTTCGGATCTG-3′,下游引物: 5′-TTGCCAATGTCTAGCACACC-3′;SR-A上游引物: 5′-GGAGTGTAGGCGGATCAACC-3′,下游引物: 5′-CACTGGCCTTGGTGGAAGAT-3′;ACAT1上游引物: 5′-ATATCTCACGGCAGGAACAGG-3′,下游引物: 5′-TTCTTCATCTTCTTTCACCACCAC-3′;nCEH上游引物: 5′-TGATGTCATCCGTGCCACTA-3′,下游引物: 5′-CAGGCTGGCAACGTAGGTAA-3′;ABCA1上游引物: 5′-CCTGCTTCCGTTATCCAACT-3′,下游引物: 5′-CCTCTGAGCGTCTGAGAACA-3′;ABCG1上游引物: 5′-TCCTGCTTCCAAGTGGTGTC-3′,下游引物: 5′-GGCACGAGAT TGGAGACCT T-3′;SR-BI上游引物: 5′-AACGGCCAGAAGCCAGTAGT-3′,下游引物: 5′-CTCTGAGCCATGCGACTTG T-3′;18S上游引物: 5′-AGGCCCTGTAATTGGAATGAGTC-3′,下游引物: 5′-GCTCCCAAGATCCA ACTACGAG-3′。反应体系 10μl,95℃ 10min预变性;95℃ 10s;57℃ 20s,共40个循环。
1.2.6 Western印迹法分析 将RAW246.7细胞接种在6孔板中,先加入单核细胞来源微颗粒处理,按照分组再分别加入PPAR-α激动剂/拮抗剂。按照文献[4]方法进行样品的上样、电泳及转膜。在 4℃ 冰箱中,将膜与外排受体清道夫受体B1(SR-BI)一抗(1∶1000)及β-Actin(1∶1000)过夜孵育,第2天进行二抗的孵育。通过Image J软件定量Western印迹的信号强度。
1.3 统计学处理
数据表示为![]() 所有实验重复3次;数据都使用Student’s t-检验进行分析,P<0.05为差异有统计学意义。
所有实验重复3次;数据都使用Student’s t-检验进行分析,P<0.05为差异有统计学意义。
2.1 单核细胞来源微颗粒浓度
单核细胞来源微颗粒的浓度约2.216×106/ml。流式细胞术测定结果见图1。

图1 微颗粒(R1)与绝对计数微球(R2)
Fig.1 Microparticles (R1) and Absolute Count Microspheres (R2)P1用于判定微颗粒的大小,P1区域代表所有微颗粒直径小于1.1μm;P2表示在P1区域内标准计数微球的数目;Q2表示单核细胞微颗粒在双抗体共同标记下的数目
2.2 单核细胞来源的微颗粒对RAW264.7细胞活力的影响
不同浓度的微颗粒与RAW264.7细胞共培养后,细胞活力实验结果显示,与对照组相比,80、120μl/ml 浓度的微颗粒可明显降低细胞活力,差异有统计学意义(P<0.05),见图2。
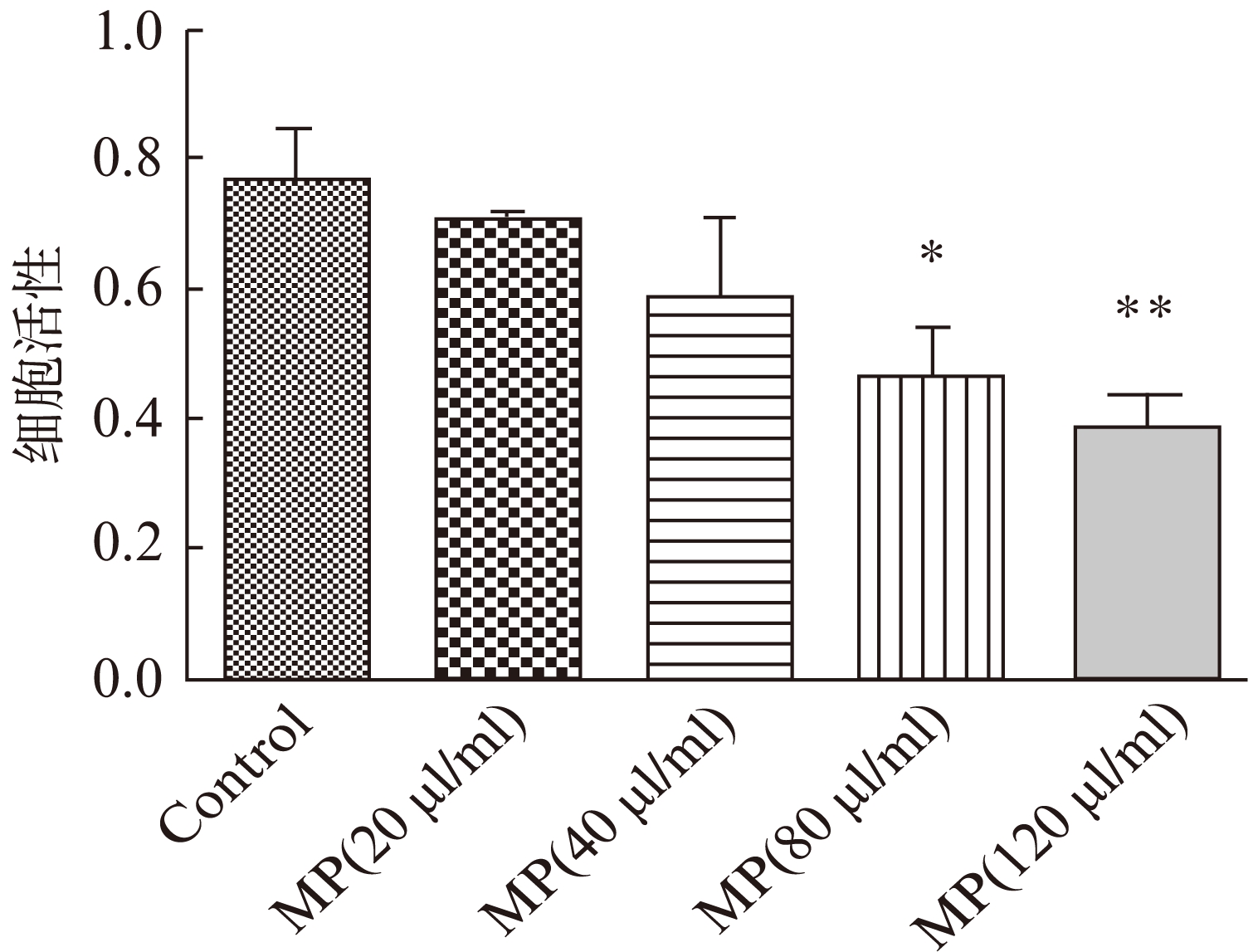
图2 不同浓度下的微颗粒对RAW264.7细胞活性的影响
Fig.2 Effect of microparticles at different concentrations on the activity of RAW264.7 cells
与对照组相比,*P<0.05,**P<0.01
2.3 单核细胞来源微颗粒对细胞泡沫化的影响
油红染色测定结果显示,单核细胞来源微颗粒可促进泡沫细胞形成。微颗粒在40μl或80μl浓度时,可促进巨噬细胞的泡沫化。微颗粒在低浓度(20μl/ml)时,对巨噬细胞无明显影响,干预结果阴性,见图3。
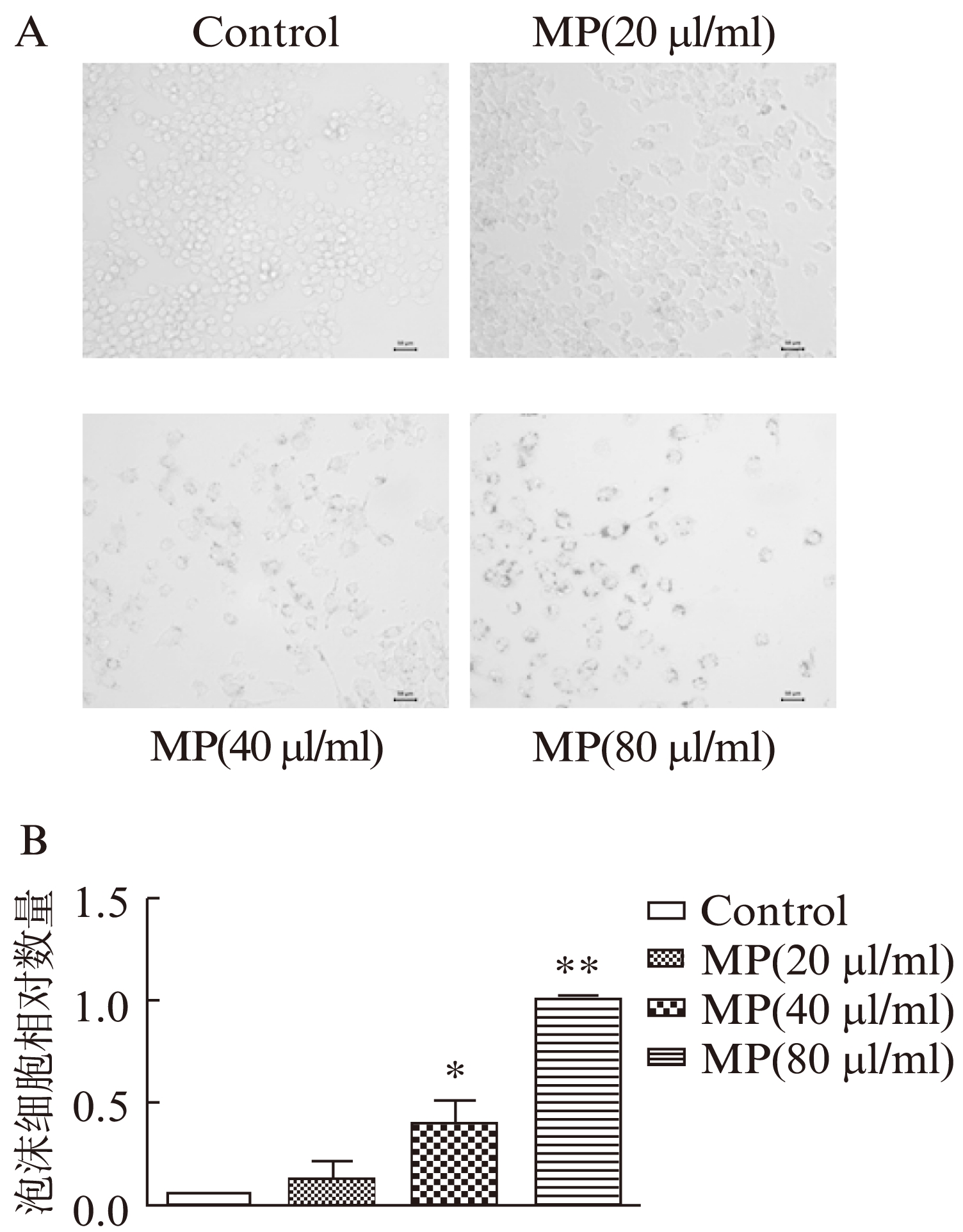
图3 不同浓度微颗粒对泡沫细胞形成的影响与对照组相比
Fig.3 Effects of different concentrations of microparticles on foam cell formation
A: 不同浓度微颗粒对泡沫细胞形成的影响(油红染色,×40);B: 泡沫细胞计数;与对照组相比,*P<0.01,**P<0.001
2.4 低浓度微颗粒对影响细胞摄入LDL的影响
在低密度脂蛋白、氧化低密度脂蛋白存在的条件下,采用低浓度微颗粒(20μl/ml)与RAW264.7细胞共培养48h,结果显示在脂质存在的情况下,低浓度微颗粒可轻微促进巨噬细胞对低密度脂蛋白的吞噬,但对氧化低密度脂蛋白的吞噬没有影响,见图4。
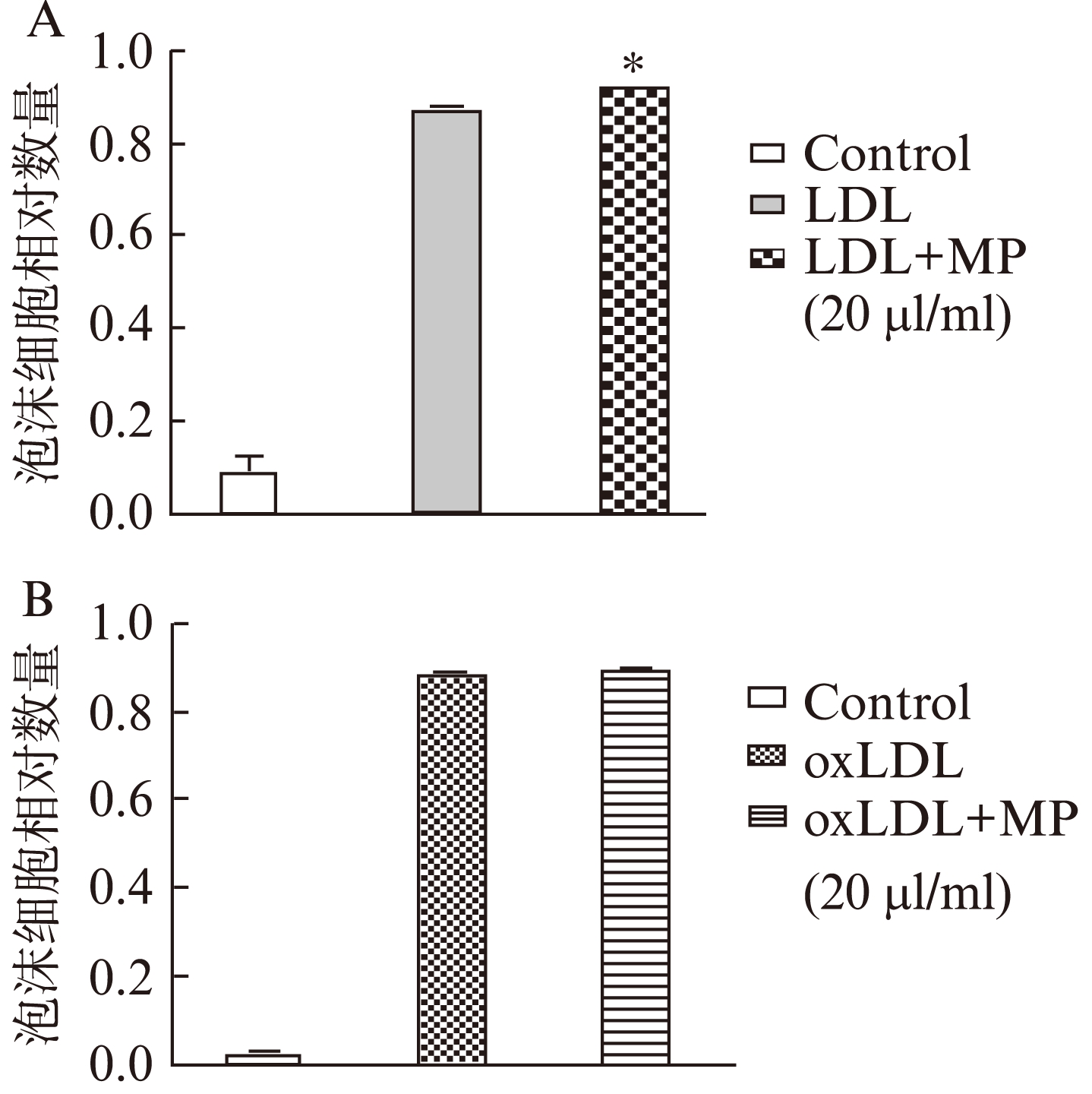
图4 油红染色测定低浓度微颗粒影响外源性脂类摄入的影响
Fig.4 The low concentrations of microparticles influence exogenous lipid intake by oil red staining. Compared with the control group, oil-red staining positive cells
A: LDL;B: oxLDL;与对照组相比,*P<0.05
2.5 PPAR-α激动剂、拮抗剂对强泡沫细胞形成的影响
选用较高的微颗粒浓度(40μl/ml)同时在加入PPAR-α激动剂或拮抗剂,分别测定RAW264.7细胞泡沫化,结果显示,PPAR-α激动剂可以增强微颗粒促进泡沫细胞形成的作用,而PPAR-α拮抗剂的作用相反(图5),结果提示是PPAR-α在微颗粒促进泡沫化过程中起到重要的作用。
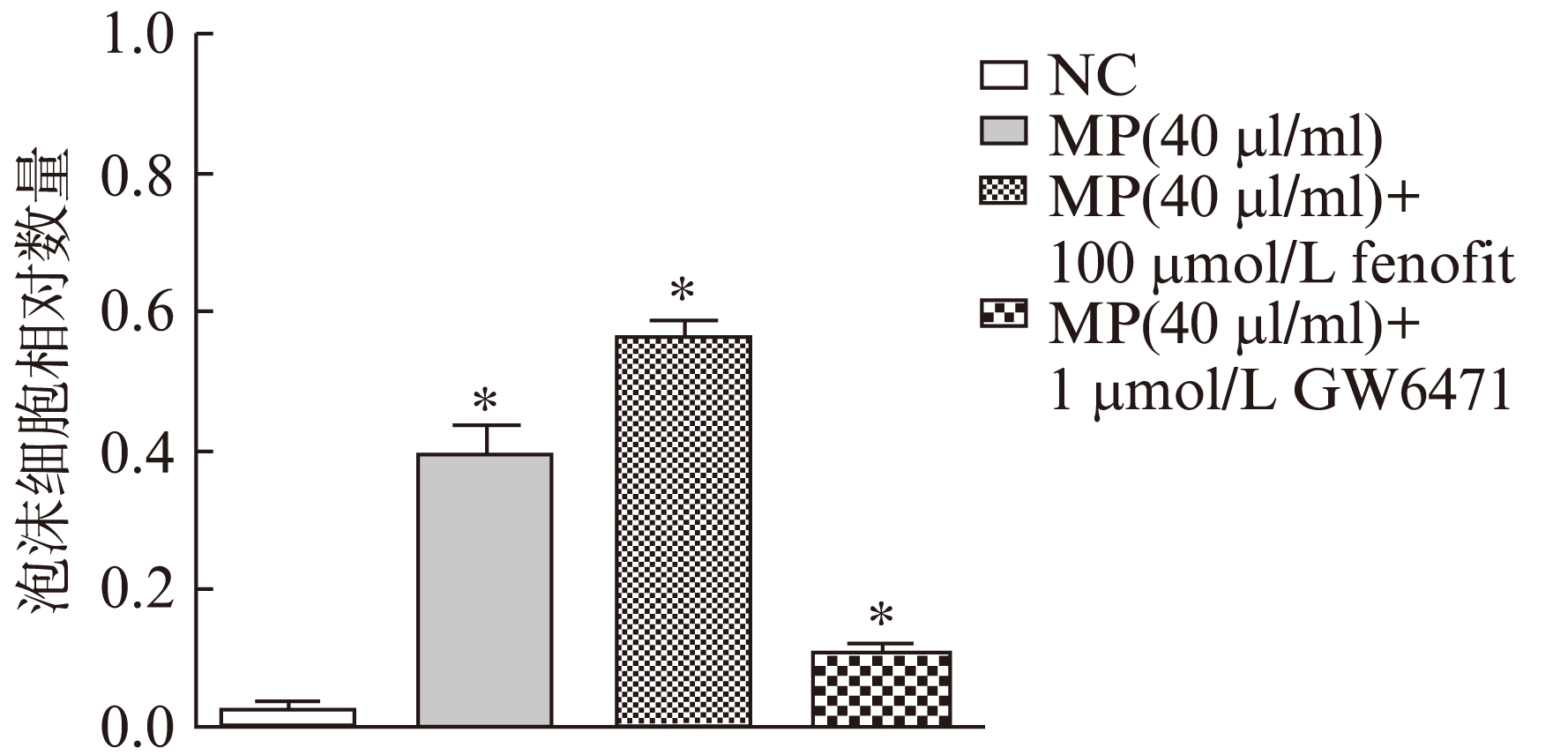
图5 油红染色测定PPAR-α抑制剂和激动剂对泡沫细胞形成的影响
Fig.5 Effect of PPAR-α inhibitors and agonists on monocyte-derived microparticles-induced foam cell formation by oil red staining
与对照组相比,*P<0.05
2.6 单核细胞来源微颗粒对泡沫细胞形成相关酶及受体mRNA水平的影响
将RAW264.7细胞分为对照组与单核细胞来源微颗粒处理组,分别处理24、48h,real-time PCR测定与泡沫细胞形成相关的酶(ACAT1, nCEH)和受体(ABCA1, ABCG1, CD-36, SR-A、SR-BI)的变化。real-time PCR结果提示,24h微颗粒可引起RAW264.7细胞表面SR-BI表达的明显减少;同时,再测定SR-BI蛋白的表达也减少约46.1%。但其他相关酶和受体: ABCA1, ABCG1, CD-36, SR-A, ACAT1, nCEH未见明显异常,见图6。
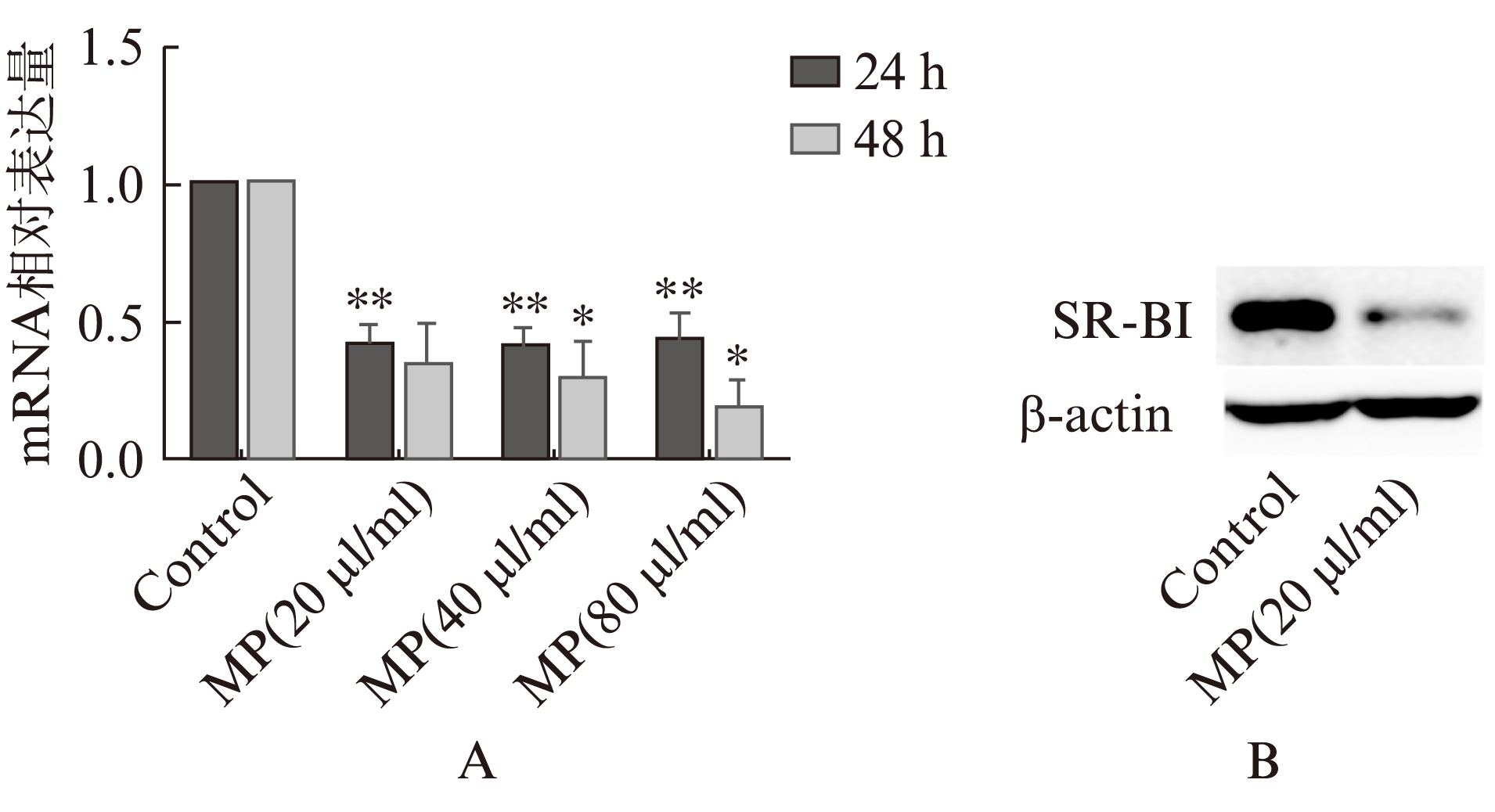
图6 单核细胞来源微颗粒对SR-BI表达的影响
Fig.6 Effect of monocyte-derived microparticles on expression of SR-BI
A: 单核细胞来源微颗粒对RAW264.7细胞SR-BI mRNA的影响;B: 单核细胞来源微颗粒对RAW264.7细胞SR-BI蛋白的影响;与对照组相比,*P<0.05,**P<0.01
2.7 PPAR-α激动剂/拮抗剂刺激下,单核细胞来源微颗粒对RAW264.7巨噬细胞中SR-BI蛋白表达的影响
在RAW264.7细胞培养时,加入非诺贝特,微颗粒降低RAW264.7细胞SR-BI的蛋白水平(49.9%),加入GW6471不影响SR-BI的表达,见图7。
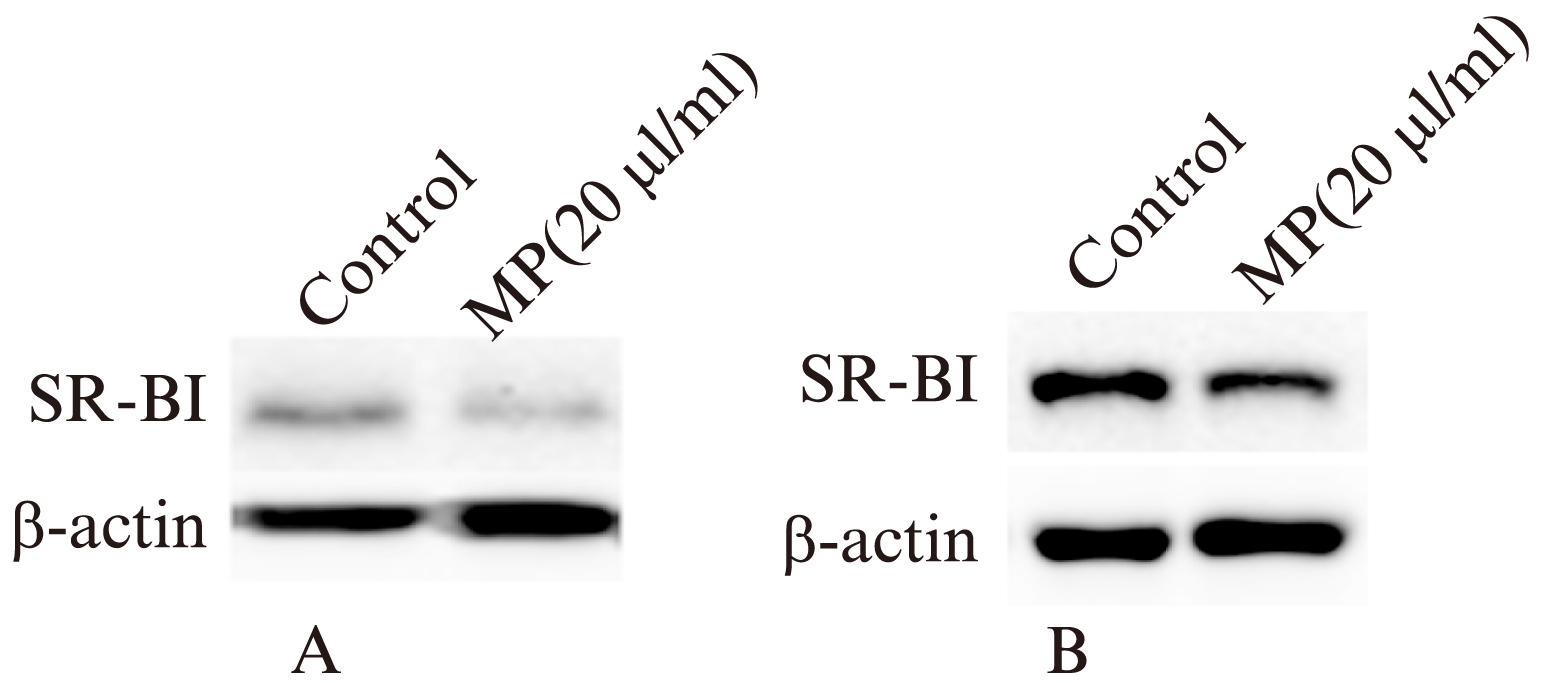
图7 单核细胞来源的微颗粒对SR-BI表达的影响
Fig.7 Effect of monocyte-derived microparticles on expression of SR-BI associated with foam cell formation
A: 非诺贝特刺激下,单核细胞来源微颗粒对RAW264.7细胞SR-BI蛋白的影响;B: GW6471刺激下,单核细胞
来源微颗粒对RAW264.7细胞SR-BI蛋白的影响
动脉粥样硬化一种以慢性炎症为特征的疾病,以内皮细胞损伤,单核细胞/巨噬细胞浸润及脂质在内皮下细胞中的积累为主要的炎症发生过程。其中,泡沫细胞的形成是在动脉粥样硬化形成的初期阶段,其主要是由于巨噬细胞中胆固醇吸收,酯化和外排的不平衡所造成的[1]。与其相关的受体或酶包括: CD36和清道夫受体A(SR-A)与巨噬细胞摄取胆固醇有关;酰基辅酶A: 胆固醇酰基转移酶-1(ACAT1)和中性胆固醇酯水解酶(nCEH)负责胆固醇酯化;ATP结合盒转运蛋白A1(ABCA1),ATP结合盒转运蛋白G1(ABCG1)和清道夫受体B1型(SR-BI)调节胆固醇流出。巨噬细胞表面的这些受体或酶都影响细胞内的脂类代谢情况,进而影响着泡沫细胞的形成。
关于单核细胞来源微颗粒在心血管疾病中的研究,之前早有报道。一方面是临床发现: 在家族性高胆固醇血症[5],急性冠状动脉综合征患者的血液中单核细胞来源微颗粒的浓度升高。另一方面是基础研究: 单核细胞来源微颗粒的作用是促进炎症的发展并诱导内皮细胞的损伤[6-7],以及引起的免疫反应[8]等等。目前的研究表明,在心血管疾病中或在介导细胞间的相互联系时,微颗粒可能作为一种新的生物标志物[9]。在体外的研究中,单核细胞来源的微颗粒的直径大小约50~1000nm,也有人报道单核细胞来源的微颗粒大小在100~300nm,这需要继续去验证;其可与内皮细胞相互作用并激活内皮细胞,这一免疫炎症过程损害了内皮细胞的完整性并使得内皮细胞的功能出现障碍[10]。此外,对小鼠(ApoE-/-)鼠尾静脉注射单核细胞来源的微颗粒,经过8周高脂肪饮食后,单核细胞来源微颗粒处理组和对照组相比,动脉粥样硬化斑块形成面积是增加的[3],但在体外,单核细胞来源微颗粒是怎样参与到细胞的脂类代谢,这一点是未知的。
泡沫细胞主要由巨噬细胞或平滑肌细胞吞噬掉过量的脂类而形成,是动脉粥样硬化初期重要的病理生理过程。来自膜的磷脂可以被巨噬细胞所吞噬,这被认为是在体外形成泡沫细胞的一种新方法。微颗粒作为细胞膜的一部分,同样含有磷脂的成分,本研究结果显示,在没有外源性脂质存在的情况下,巨噬细胞吞噬了微颗粒,可诱导巨噬细胞形成泡沫细胞,而且结果显示单核细胞来源微颗粒在泡沫细胞形成上是存在明显的浓度依赖性效应。与Keyel等[11]先前报道的结果一致,他们发现来自TA3/Ha腺癌或B16黑素瘤细胞外泌体或自发释放的囊泡可促进泡沫细胞形成。结合以前的研究结果分析,如果细胞含有丰富的磷脂或其他形式的脂溶性分子,则其细胞来源的微颗粒也可以促进泡沫细胞的形成。除此之外,低浓度的单核细胞来源微颗粒可促进巨噬细胞对低密度脂蛋白的吞噬,但对氧化的低密度脂蛋白却没有影响。分析也可能与巨噬细胞中的低密度脂蛋白受体有关[12],同时氧化的低密度脂蛋白也诱导CD36受体的表达[1],同样可增加脂质的摄取。另外,氧化低密度脂蛋白也可影响外排受体清道夫受体B1(SR-BI)的表达降低及ATP结合盒转运蛋白A1(ABCA1)表达增加,这都对泡沫细胞的形成有关。
泡沫细胞的形成,主要涉及的是巨噬细胞脂类代谢平衡,这其中过氧化物酶体增殖物激活受体-α(PPAR-α),是调节脂质代谢的核受体之一,本实验结果表明PPAR-α激动剂(非诺贝特)增强了泡沫细胞形成,而PPAR-α拮抗剂(GW6471)抑制了泡沫细胞的形成。关于PPAR-α,目前的研究发现PPAR-α的激活与巨噬细胞或泡沫细胞的胆固醇流出有关。PPAR-α的表达增加也可能对其下游相关受体或酶所产生影响。本研究的数据证实,单核细胞来源微颗粒可诱导SR-BI表达的降低,而引起脂质摄取的受体或胆固醇酯化并不受单核细胞来源微颗粒的影响。在PPAR-α激动剂存在的情况下,单核细胞来源微颗粒诱导SR-BI的表达降低。然而,在PPAR-α拮抗剂处理过细胞中,单核细胞来源微颗粒对SR-BI表达没有影响。Chinetti等[13]认为PPAR-α激活降低ACAT1活性和降低酯化速率,但不改变ACAT1基因表达。他们还表明PPAR-α配体促进ABCA1的蛋白质表达,从而增强胆固醇流出。在他们的另一项研究中,PPAR-α激活剂诱导SR-BI的表达。SR-BI表达与胆固醇流出的关系已经在许多研究中提及。在一项研究中氧化的低密度脂蛋白可能增加SR-BI的mRNA水平,诱导胆固醇流出。本研究认为PPAR-α可被单核细胞来源微颗粒激活,然后诱导SR-BI表达的减少,进而减少脂类的排出促进泡沫细胞形成。Keyel等[11]认为TA3/Ha腺癌或B16黑素瘤细胞来源的微颗粒可以作为Toll样受体(TLR)配体,通过活化TLR以促进泡沫细胞形成。此外,他们还认为NF-κB和IFN信号通路也是泡沫细胞形成的必要条件。同样有研究发现,T细胞来源的外泌体虽然可促进胆固醇积累,然而,并没有报道与胆固醇摄取,酯化和外排相关的受体之间的关系。本研究结果发现单核细胞来源微颗粒的磷脂可能激活PPAR-α或作为与PPAR-α结合的配体,从而降低巨噬细胞表面的SR-BI的表达,进而促进了泡沫细胞形成。以前的研究表明氧化的低密度脂蛋白或磷脂可以通过磷脂酶A2从而激活PPAR-α,从这一点看单核细胞来源微颗粒的磷脂可在泡沫细胞形成中起重要作用。
本研究也存在着一些局限: 并没有具体找到单核细胞来源微颗粒中哪一个分子或者成分可作为PPAR-α的配体,然后激活PPAR-α以促进泡沫细胞形成。另外,本实验是体外实验,且为小鼠巨噬细胞的实验,可能和人类血液循环不完全一样。此外,单核细胞来源微颗粒是一个复杂化合物,其含有多种内容物。未来的研究中,可着手更深入的研究,从而确定具体是哪些分子在起作用。这项研究可以清楚地表明高浓度的单核细胞来源微颗粒可促进动脉粥样硬化的过程,这也同时证明降低在血液循环中单核细胞来源微颗粒的浓度是降低冠心病风险的一种新的途径。
【参考文献】
[1] Yu X H, Fu Y C, Zhang D W, et al. Foam cells in atherosclerosis[J]. Clin Chim Acta, 2013,424: 245-252.
[2] Baka Z, Senolt L, Vencovsky J, et. al. Increased serum concentration of immune cell derived microparticles in polymyositis/dermatomyositis[J]. Immunol Lett, 2010,128(2): 124-130.
[3] Hoyer F F, Giesen M K, Nunes França C, et al. Monocytic microparticles promote atherogenesis by modulating inflammatory cells in mice[J]. J Cell Mol Med, 2012,16(11): 2777-2788.
[4] Kämmerer I, Ringseis R, Biemann R, et al. 13-hydroxy linoleic acid increases expression of the cholesterol transporters ABCA1, ABCG1 and SR-BI and stimulates apoA-I-dependent cholesterol efflux in RAW264.7 macrophages[J]. Lipids Health Dis, 2011,10: 222.
[5] Suades R, Padró T, Alonso R, et al. Circulating CD45+/CD3+ lymphocyte-derived microparticles map lipid-rich atherosclerotic plaques in familial hypercholesterolaemia patients[J]. Thromb Haemost, 2014,111(1): 111-121.
[6] Wang J G, Williams J C, Davis B K, et al. Monocytic microparticles activate endothelial cells in an IL-1β dependent manner[J]. Blood, 2011,118(8): 2366-2374.
[7] Mastronardi M L, Mostefai H A, Soleti R, et al. Microparticles from apoptotic monocytes enhance nitrosative stress in human endothelial cells[J]. Fundam Clin Pharmacol, 2011,25(6): 653-660.
[8] Chaturvedi S, Cockrell E, Espinola R, et al. Circulating microparticles in patients with antiphospholipid antibodies: characterization and associations[J]. Thromb Res, 2015,135(1): 102-108.
[9] Alexandru N, Costa A, Constantin A, et al. Microparticles: From biogenesis to biomarkers and diagnostic tools in cardiovascular disease[J]. Curr Stem Cell Res Ther, 2017,12(2): 89-102.
[10] Aleman M M, Gardiner C, Harrison P, et al. Different contributions of monocyte- and platelet-derived microparticles towards thrombin generation and fibrin formation and stability[J]. J Thromb Haemost, 2011,9(11): 2251-2261.
[11] Keyel P A, Tkacheva O A, Larregina A T, et al. Coordinate stimulation of macrophages by microparticles and TLR ligands induces foam cell formation[J]. J Immunol, 2012,189(9): 4621-4629.
[12] Morishita M, Ariyoshi W, Okinaga T, et al. A. actinomycetemcomitans LPS enhances foam cell formation induced by LDL[J]. J Dent Res, 2013,92(3): 241-246.
[13] Chinetti G, Gbaguidi G F, Griglio S, et al. CLA-1/SR-BI is expressed in atherosclerotic lesion macrophages and regulated by activators of peroxisome proliferator-activated receptors[J]. Circulation, 2000,101: 2411-2417.
Monocyte-derived microparticles promote RAW264.7 foam cell formation via the PPAR-α-SR-BI pathway
【Abstract】 Objective To investigate the role of the monocyte-derived microparticles (mono-MPs) in the formation of foam cells. Methods Mouse macrophage RAW264.7 cells were stimulated with oxidized low density lipoprotein or low density lipoprotein to form foam cells. Positive foam cells were stained with oil red staining. Real-time PCR and Western blotting were used to determine RAW264.7 Cell receptor or enzyme CD36, SR-A, ACAT1, nCEH, ABCA1, ABCG1, SR-BI. Results Mono-MPs affected the activity of RAW264.7 cells. Mono-MPs promoted the formation of RAW264.7 foam cells; low concentration (20μl/ml) microparticles slightly promoted the phagocytosis of macrophages to low-density lipoproteins, but did not affect the intake of oxidized low-density lipoproteins. Peroxisome proliferator-activated receptor-alpha (PPAR-α) agonists enhanced foam cells formation, while the effect of PPAR-α antagonist was reversed. Mono-MPs reduced the expression of SR-BI mRNA and protein levels. PPAR-α agonists reduced the expression of SR-BI protein in RAW264.7 macrophages, while PPAR-α antagonist had no effect. Conclusion The mono-MPs, causing activation of the PPAR-α, induce the RAW264.7 foam cell formation via lipid uptake and the PPAR-α-SR-BI pathway.
【Key words】 monocyte-derived microparticles; macrophage; foam cell; PPAR-α; atherosclerosis
doi: 10.16118/j.1008-0392.2017.04.002
收稿日期: 2016-12-29
基金项目: 上海市浦东新区科委课题(PKJ2013-Y19)
【中图分类号】 R541.4
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0006-07