·基础研究·
【摘要】 目的 探讨上皮性卵巢癌(epithelial ovarian cancer, EOC)转移相关基因3(metastasis associated gene 3, MTA3)的表达及其与肿瘤侵袭转移的关系。方法 收集晚期(FIGO Ⅲ-Ⅳ期)EOC术中冰冻标本(8例)及石蜡标本(21例),qRT-PCR和IHC检测卵巢部位肿瘤组织和转移瘤组织中MTA3的表达;Transwell细胞迁移实验观察下调MTA3、下调β-hCG、同时下调MTA3和β-hCG的EOC细胞株(SKOV3和ES-2)体外迁移力的变化。EOC细胞体外分别转染50、100、200nmol/L siRNA-MTA3,qRT-PCR检测分析MTA3和β-hCG的表达相关性;qRT-PCR及Western印迹法检测分析下调MTA3对β-hCG以及上皮间质转化(EMT)标记物E-cadherin、N-cadherin表达的调控作用。结果 qRT-PCR、IHC示EOC转移瘤组织中MTA3的表达显著低于卵巢部位肿瘤组织(P<0.05);Transwell细胞迁移实验示下调MTA3显著增强了EOC细胞的迁移能力(P<0.001),下调β-hCG显著降低了EOC细胞的迁移能力(P<0.001),下调MTA3下调β-hCG显著降低了EOC细胞的迁移能力(P<0.001);qRT-PCR示MTA3与β-hCG的表达呈显著负相关(P<0.05);qRT-PCR、Western印迹法示MTA3下调时,β-hCG和N-cadherin的表达显著上调,而E-cadherin的表达则显著下调。结论 MTA3可能通过β-hCG干预EMT进程,进而调控上皮性卵巢癌侵袭转移。
【关键词】 上皮性卵巢癌; MTA3; β-hCG; EMT; 肿瘤转移
卵巢癌是女性生殖系统常见的三大恶性肿瘤之一,其起病隐匿,进展迅速且极易发生侵袭转移。目前,肿瘤细胞减灭术和以铂类化疗药物为主的联合化疗是晚期卵巢癌的主要治疗策略,可暂时缓解病情,但其广泛的盆、腹腔转移,极大的降低了肿瘤细胞减灭术的满意率,致使术后复发率极高,患者5年生存率不足30%[1-3]。因此对卵巢癌转移机制的探索以期发现有效的抗肿瘤转移治疗方案具有重要意义。Guo等[4]的研究证实,β-hCG能促使永生化人卵巢表面上皮细胞发生恶性转化,增强其体外迁移能力,具有类似转化癌基因的功能;上皮性卵巢癌(epithelial ovarian cancer, EOC)转移瘤组织中β-hCG的表达显著高于卵巢部位的肿瘤组织[5]。因此,推测β-hCG在卵巢癌侵袭转移过程中发挥重要作用。Chen等[6]在人绒毛膜癌BeWo细胞中通过染色质免疫共沉淀技术(chromatin immunoprecipitation, ChIP)证实,MTA3通过结合β-hCG的转录启动子区域抑制β-hCG的表达,抑制细胞的体外转移功能。本研究旨在探讨MTA3在卵巢癌中能否通过β-hCG调控转移。
1.1 一般资料
收集2014年9月至2016年1月在石河子大学第一附属医院妇产科进行初次手术切除、经病理科医师确诊晚期卵巢癌(FIGO分期Ⅲ-Ⅳ)的8对术中冰冻组织(卵巢部位肿瘤组织和转移瘤组织成对)和临床资料。收集2013年1月至2016年1月在石河子大学第一附属医院妇产科进行初次手术切除,经病理科医师确诊晚期卵巢癌(FIGO分期Ⅲ-Ⅳ)21例的石蜡切片和临床资料,其中卵巢部位肿瘤组织石蜡标本21例、转移瘤组织石蜡标本18例。以上病例均无其他恶性肿瘤疾病史,术前未经放化疗及生物治疗,临床资料及病理资料完整。
1.2 主要试剂
人上皮性卵巢癌细胞株SKOV3、ES-2,购自ATCC细胞库,用含有10%胎牛血清(FBS)的RPMI 1640培养液培养,由本课题组保存。
siRNA-MTA3、siRNA-β-hCG、siRNA-Negative Control购自广州锐博生物科技有限公司,MTA3购自美国Abcam公司,β-hCG购自美国Abgent公司,E-cadherin、N-cadherin购自美国CST公司,转染试剂购自瑞士Roche公司,反转录试剂盒购自日本TaKaRa公司,荧光定量试剂盒购自天根生化科技(北京)有限公司,免疫组化试剂盒购自基因科技(上海)股份有限公司,24孔迁移板购自美国Corning公司,荧光染料calcein AM购自美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 qRT-PCR检测术中冰冻组织中MTA3的表达 提取组织总RNA,按照日本TaKaRa公司Prime Script RT reagent Kit反转录试剂盒、天根公司Super Real PreMix Plus(SYBR Green)试剂盒说明书,进行qRT-PCR反应。所用引物序列如下。β-actin上游引物: 5′-AACTCCATCATGAAGTGTGACG-3′,下游引物: 5′-GATCCACATCTGCTGGAAGG-3′;MTA3上游引物: 5′-TGTACCGGGTCGGAGATTATG-3′,下游引物: 5′-CTGCTTATCGGTCAAGTCAGC-3′。20μl 反应体系,95℃ 15min预变性15min,95℃ 10s,60℃ 1min,45个循环。以β-actin作为内参,通过2-ΔΔCT法计算基因表达水平的差异。
1.3.2 免疫组织化学法检测石蜡标本肿瘤组织中MTA3的表达 采用免疫组织化学EnVision两步法染色。MTA3表达情况采用半定量法判定。每张切片在高倍镜(×400)下随机选取5个视野,观察染色阳性细胞比例及染色强度。以胞核中出现棕黄色或棕褐色颗粒为阳性表达。已知乳腺癌石蜡切片作为阳性对照,PBS代替一抗作为阴性对照。由两位病理专家双盲阅片并评分,两位专家意见不一致时请第三位病理专家阅片,最终判定免疫组化结果。
1.3.3 siRNA转染 按照瑞士ROCHE公司的X-treme GENE HP DNA Transfection Reagent试剂说明书转染。于转染后30h收集细胞做功能实验,于转染后36、48h 分别提取细胞总RNA、总蛋白,qRT-PCR、Western印迹法检测表达情况。
1.3.4 Transwell迁移实验 siRNA转染细胞30h后,收集细胞用2% FBS培养基重悬,迁移板上室加入细胞悬液200μl(1×104个细胞),下室加入 800μl 10% FBS培养液。选择18h作为ES-2、SKOV3细胞迁移的最佳时相点,用荧光染料AM(终浓度0.625μg/ml) 37℃孵育20min后,每孔取6个随机视野(×100)荧光显微镜拍照,计数穿膜细胞数目即迁移细胞数量。
1.3.5 Western印迹法检测蛋白表达 10%SDS-PAGE电泳,PVDF膜350mA转膜2h,5%BSA室温封闭2h,一抗4℃孵育过夜,TBST洗膜,二抗室温摇床孵育 2h,TBST洗膜,暗室曝光显影。
1.4 统计学处理
采用Prism作图分析软件,数据以![]() 表示,组间比较用χ2检验、t检验。P<0.05为差异有统计学意义。
表示,组间比较用χ2检验、t检验。P<0.05为差异有统计学意义。
2.1 MTA3在EOC组织中的表达
转移瘤组织中MTA3的相对表达量为0.99±0.08,卵巢部位肿瘤组织中为0.41±0.06,转移瘤组织中MTA3的表达显著低于卵巢部位肿瘤组织,差异有统计学意义(P<0.001),见图1。

图1 EOC组织中MTA3的mRNA表达情况
Fig.1 The mRNA expression levels of MTA3 in EOC tissue
与卵巢部位肿瘤组织相比,**P<0.001
MTA3表达于胞核,在卵巢部位肿瘤组织中呈深棕色,表达较强(图2A),在转移瘤组织中呈浅棕色,表达较弱(图2B)。转移瘤组织共18例,阳性表达3例(中度阳性2例,强阳性1例),阴性表达15例(弱阳性5例,阴性10例);卵巢部位肿瘤组织共21例,其中阳性表达15例(中度阳性9例,强阳性6例),阴性表达6例(其中弱阳性2例,阴性4例)。MTA3在转移瘤组织、卵巢部位肿瘤组织中的阳性表达率分别为16.7%(3/18),71.4%(15/21),转移瘤组织中MTA3的表达显著低于卵巢部位肿瘤组织,差异具有统计学意义(P<0.05)。
2.2 转染MTA3、β-hCG基因后EOC细胞的体外转移能力变化
转染siRNA-MTA3后,SKOV3和ES-2细胞MTA3的相对表达量分别为0.31±0.02和0.51±0.01;转染siRNA-β-hCG后,SKOV3和ES-2细胞β-hCG的相对表达量分别为0.44±0.02和0.49±0.01;转染siRNA-MTA3下调β-hCG后,SKOV3和ES-2细胞MTA3、β-hCG的相对表达量分别为(0.37±0.03、0.67±0.02)和(0.43±0.02、0.74±0.01)。
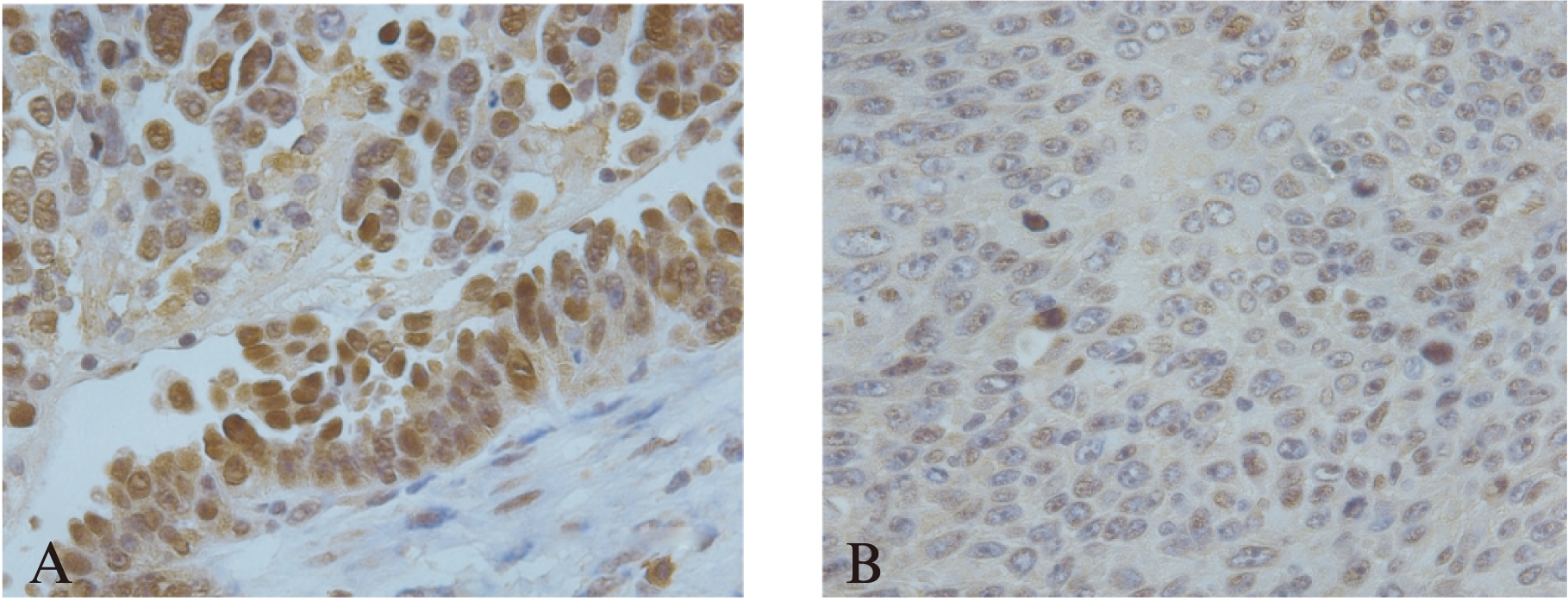
图2 IHC检测EOC组织中MTA3的表达情况(×400)
Fig.2 The expression of MTA3 in EOC tissues by IHC(×400)A: 卵巢部位肿瘤组织;B: 转移部位肿瘤组织
ES-2和SKOV3转染siRNA-NC,穿膜细胞数量分别为124.5±3.6和107.7±5.6;转染MTA3,穿膜细胞数量分别为249.0±4.8和225.2±5.1;转染β-hCG,穿膜细胞数量分别为86.2±3.6和83.2±5.7,下调MTA3显著增强了细胞的迁移能力,下调β-hCG显著减弱了细胞的迁移能力,差异具有统计学意义(P<0.001)。ES-2和SKOV3转染MTA3-NC,穿膜细胞数量分别为127.0±2.6和182.8±5.3;转染MTA3-β-hCG,穿膜细胞数量分别为 95.7±4.2和142.2±10.7,下调MTA3同时下调β-hCG显著减弱了细胞的迁移能力,差异具有统计学意义(P<0.001),见图3。

图3 转染MTA3和β-hCG基因后EOC细胞的体外转移能力变化(标尺: 200μm)
Fig.3 Migration assay transfection with MTA3 and β-hCG in EOC cell lines(staff: 200μm)
2.3 EOC细胞转染MTA3基因后β-hCG的表达情况
分别转染50、100、200nmol/L siRNA-MTA3后,qRT-PCR检测SKOV3中MTA3的相对表达量分别为0.88±0.01、0.75±0.01、0.59±0.03,β-hCG 的相对表达量分别为1.81±0.08、2.14±0.07、3.02±0.15;ES-2中MTA3的相对表达量分别为对照组的0.87±0.01、0.71±0.02、0.52±0.01,β-hCG的相对表达量分别为1.60±0.03、2.13±0.06、2.77±0.01。在EOC中,MTA3与β-hCG的表达呈显著负相关。
2.4 EOC中MTA3、β-hCG、E-cadherin和N-cadherin的表达情况
qRT-PCR检测转染siRNA-MTA3后,SKOV3中MTA3、E-cadherin的相对表达量分别的0.73±0.02、0.79±0.03,β-hCG、N-cadherin的相对表达量分别为2.44±0.01、1.59±0.03;ES-2中MTA3、E-cadherin的相对表达量分别为0.75±0.01、0.83±0.01,β-hCG、N-cadherin的相对表达量分别为 1.78± 0.09、1.30±0.01;Western印迹法检测转染siRNA-MTA3后,MTA3、E-cadherin的条带相比对照组变细变浅,β-hCG、N-cadherin的条带变宽变深(图4)。在EOC中,MTA3与β-hCG、N-cadherin的表达呈显著负相关,与E-cadherin呈正相关。
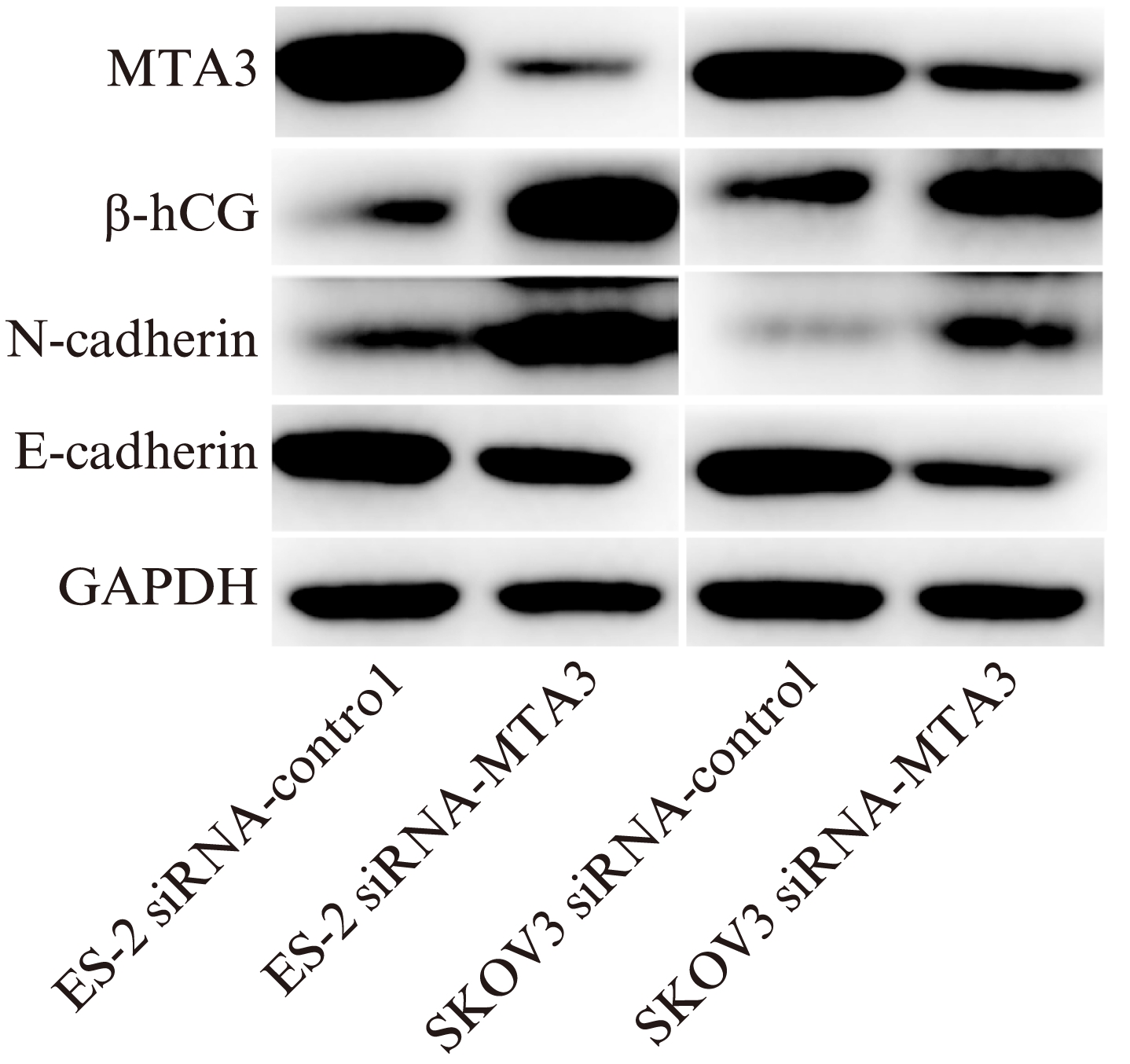
图4 EOC中MTA3、β-hCG、E-cadherin和N-cadherin的表达情况
Fig.4 The expression of EOC cell lines transfection with MTA3
卵巢癌起病隐匿,进展迅速极易发生侵袭转移,在妇科肿瘤中死亡率最高[1-3],但有关其转移的分子机制尚不明确。近年来研究发现,β-hCG在多数晚期恶性肿瘤细胞中高表达,在肿瘤侵袭、转移等进程中发挥重要的促进作用[7]。本研究在EOC细胞中下调β-hCG发现细胞体外迁移能力显著减弱,结合课题组前期研究[4-5],进一步证实β-hCG在卵巢癌转移过程中发挥重要作用。在人绒毛膜癌BeWo细胞中,Chen等[6]通过染色质免疫共沉淀技术(ChIP)证实MTA3通过结合β-hCG的转录启动子区域,抑制β-hCG的转录降低其表达从而抑制细胞迁移侵袭能力。MTA3在卵巢癌中能否通过β-hCG调控转移需进一步探索。
MTA3发现于MTA(metastasis associated gene)家族,其通过改变染色质结构和促进黏连蛋白结合于DNA来调节基因表达[8]。国内外学者[6,9-13]发现MTA3的异常低表达与乳腺癌、宫颈癌、滋养细胞肿瘤等的侵袭转移关系密切,但是,Zheng等[14]发现在非小细胞肺癌中MTA3的高表达与淋巴结转移及不良预后相关。Bruning等[9]报道在正常卵巢上皮组织中MTA3的表达量显著高于卵巢癌组织,说明MTA3低表达可能参与了卵巢癌的发生,然而,MTA3在卵巢癌转移中的作用及其机制尚见报道。本研究检测EOC卵巢部位肿瘤组织和转移瘤组织中MTA3的表达情况,发现相较于卵巢部位肿瘤组织,MTA3在转移瘤组织中表达减弱或丢失明显;同时在EOC细胞中下调MTA3后发现细胞体外迁移能力显著增强,结合Bruning等[9]的研究推测MTA3的异常低表达在上皮性卵巢癌发生和转移中起重要作用,这与目前报道的大多数研究结果一致。为了阐明MTA3、β-hCG在EOC中的作用关系,本研究在EOC细胞中下调MTA3同时下调β-hCG,发现细胞的体外迁移能力减弱;接着,通过梯度下调MTA3证实,β-hCG与MTA3呈显著负相关,这与Chen等[6]的研究结果相符。初步证实了MTA3通过β-hCG调控卵巢癌转移。
Fujita等[10]在乳腺癌中证实,MTA3通过抑制上皮间质转化(EMT)减弱细胞的转移能力。EMT是指在生理或病理条件下上皮细胞向间质细胞表型转化的过程,已被证实在多种恶性肿瘤局部浸润和转移扩散中起着至关重要的作用[15]。在EMT过程中,上皮细胞的形态学发生改变、细胞骨架重组,上皮表型标记物表达下调,间质细胞表型标记物上调,如E-cadherin,Vimentin,N-cadherin的表达均发生改变[16]。研究[5,17-18]通过免疫组织化学法在人卵巢癌组织石蜡切片发现,相对于卵巢部位的肿瘤组织,转移瘤组织中β-hCG的表达显著增高,并伴有EMT标记物表达水平的改变,结合本研究中免疫组织化学法结果推测MTA3可能通过β-hCG干预EMT过程调控卵巢癌转移。qRT-PCR、Western印迹法证实在EOC细胞中MTA3表达降低时,β-hCG表达显著升高,EMT标记物N-cadherin表达增加,E-cadherin表达减少,这一结果与Fujita等的结果[10]一致。
通过上述研究结果证实,MTA3的异常低表达与上皮性卵巢癌的转移密切相关,其可能通过β-hCG干预EMT从而调控转移,然而,MTA3在上皮性卵巢癌中是否通过影响β-hCG转录发挥作用仍需进一步验证。本研究初步阐明了MTA3在上皮性卵巢癌转移中作用的分子机制,为卵巢癌的治疗提供了新的靶点。
【参考文献】
[1] BACHMAYR-HEYDA A, AUER K, SUKHBAATAR N, et al. Small RNAs and the competing endogenous RNA network in high grade serous ovarian cancer tumor spread[J]. Oncotarget, 2016,7(26): 39640-39653.
[2] JELOVAC D, ARMSTRONG D K. Recent progress in the diagnosis and treatment of ovarian cancer[J]. CA Cancer J Clin, 2011,61(3): 183-203.
[3] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016,66(1): 7-30.
[4] GUO X, LIU G, SCHAUER I G, et al. Overexpression of the beta subunit of human chorionic gonadotropin promotes the transformation of human ovarian epithelial cells and ovarian tumorigenesis[J]. Am J Pathol, 2011,179(3): 1385-1393.
[5] 耿欣,刘彦芳,高玉梅,等,β-HCG、ERK1/2及MMP-2在卵巢癌中的表达及意义[J].广东医学,2015(9): 1371-1374.
[6] CHEN Y, MIYAZAKI J, NISHIZAWA H, et al. MTA3 regulates CGB5 and Snail genes in trophoblast[J]. Biochem Biophys Res Commun, 2013,433(4): 379-384.
[7] COLE L A. HCG variants, the growth factors which drive human malignancies[J]. Am J Cancer Res, 2012,2(1): 22-35.
[8] FUJITA N, JAYE D L, GEIGERMAN C, et al. MTA3 and the Mi-2/NuRD complex regulate cell fate during B lymphocyte differentiation[J]. Cell, 2004,119(1): 75-86.
[9] BRUNING A, JUCKSTOCK J, BLANKENSTEIN T, et al. The metastasis-associated gene MTA3 is downregulated in advanced endometrioid adenocarcinomas[J]. Histol Histopathol, 2010,25(11): 1447-1456.
[10] FUJITA N, JAYE D L, KAJITA M, et al. MTA3, a Mi-2/NuRD complex subunit, regulates an invasive growth pathway in breast cancer[J]. Cell, 2003,113(2): 207-219.
[11] 刘晓霞,丰有吉,赵凤娣,等.4,5,7-三羟基异黄酮对绒癌耐药细胞株JAR/MTX增殖、凋亡和侵袭的影响及相关机制[J].中国病理生理杂志,2007(2): 236-241.
[12] 何春兰,苗毅,陈平,等.MTA1和MTA3与ER在乳腺癌组织中的表达及相关性研究[J].中国现代普通外科进展,2009(5): 438-441.
[13] 黄海花,吴秀浅,李振华,等.MTA3和E-cadherin在宫颈癌转移中的作用研究[J].中国医学创新,2016(28): 14-18.
[14] ZHENG S, DU Y, CHU H, et al. Analysis of MAT3 gene expression in NSCLC[J]. Diagn Pathol, 2013,8: 166.
[15] JUNG H Y, FATTET L, YANG J. Molecular pathways: linking tumor microenvironment to epithelial-mesenchymal transition in metastasis[J]. Clin Cancer Res, 2015,21(5): 962-968.
[16] Kalluri R, Weinberg R A. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009,119(6): 1420-1428.
[17] 高玉梅,郭晓青,刘彦芳,等,N-cadherin在卵巢癌发生和进展中的作用及意义[J].中国妇幼保健,2015,30(13): 2071-2073.
[18] 何波,郭晓青.E-cadherin在晚期卵巢癌原发灶和转移灶中的表达及意义[J].中国妇幼保健,2014(9): 1420-1423.
Expression of MTA3 in epithelial ovarian cancer and its relation to tumor invasion and metastasis
【Abstract】 Objective To investigate the expression of metastasis associated gene 3 (MTA3) in epithelial ovarian cancer (EOC) and its relation to tumor invasion and metastasis. Methods The frozen tissue (8 cases) and paraffin embedded tissue (21 cases) specimens of advanced EOC (FIGO Ⅲ-Ⅳ) were collected. The expression of MTA3 in ovarian cancers tissues and metastasis tissues were detected by qRT-PCR and immunohistochemical staining (IHC). Human epithelial ovarian carcinoma SKOV3 and ES-2 cells were transfected with siRNA-MTA3, siRNA-β-hCG, both siRNA-MTA3 and siRNA-β-hCG, respectively. The migration of transfected SKOV3 and ES-2 cells was examined by Transwell assay. EOC SKOV3 and ES-2 cells were transfected with 50, 100, 200 nmol/L siRNA-MTA3 and qRT-PCR was used to detect the correlation of MTA3 and β-hCG. The mRNA and protein expression of β-hCG, E-cadherin and N-cadherin was detected by qRT-PCR and Western blotting after down-regulated MTA3. Results The expression of MTA3 in metastatic tissue of ovarian cancer was significantly lower than that in primary ovarian tumor (P<0.05). Transwell assay showed that the migration ability of EOC cells was significantly enhanced after down-regulation of MTA3; while it was decreased after down-regulation of β-hCG; when MTA3 and β-hCG were both down-regulated the cell migration ability was markedly decreased (P<0.001). qRT-PCR showed a significant negative correlation between the expression of MTA3 and β-hCG in EOC cell lines (P<0.05). qRT-PCR and Western blotting showed that down-regulation of MTA3 reduced the epithelial markers E-cadherin, while increased the expression of β-hCG and mesenchymal marker N-cadherin. Conclusion MTA3 may up-regulate β-hCG expression to enhance the invasion and metastasis in epithelial ovarian carcinoma through epithelial-mesenchymal transition.
【Key words】 epithelial ovarian cancer; MTA3; β-hCG; EMT; tumor metastasis
doi: 10.16118/j.1008-0392.2017.04.001
收稿日期: 2017-03-12
基金项目: 国家自然科学基金面上项目(81372305)
【中图分类号】 R737.31
【文献标志码】 A
【文章编号】 1008-0392(2017)04-0001-05