表1 复发性肝癌临床病理资料统计分析
Tab.1 Clinical pathological data of recurrent hepatocellular carcinoma ![]() ±s, n(%)]
±s, n(%)]
·基础研究·
【摘要】目的 探讨miR-133a在不同复发时间间隔复发性肝癌中的表达差异,并研究其对肝癌细胞侵袭、迁移、增殖等生物学功能的影响。方法 通过miRNA芯片筛选复发性肝细胞癌病例差异表达的miRNA;将miR-133a mimic及inhibitor转染入人肝癌细胞株SMMC-7721,通过CCK8检测细胞增殖能力,Transwell实验检测细胞迁移及侵袭能力;利用生物信息学方法预测miR-133a的可能靶基因。结果 芯片结果发现miR-133a在早期复发肝癌样本中表达明显升高;转染miR-133a的mimic或inhibitor入肝癌细胞SMMC-7721后,细胞增殖能力无显著差异(P>0.05);转染mimic后,细胞的侵袭及迁移能力明显增强(P<0.05),而转染inhibitor后,细胞的侵袭及迁移能力明显减弱(P<0.05)。结论 miR-133a的表达在不同复发间隔的肝细胞癌组间有显著差异,在短期复发肿瘤组织内明显升高;miR-133a可以促进肿瘤细胞的侵袭和迁移,而对增殖无明显作用,提示miR-133a水平升高可能通过促进肿瘤细胞侵袭从而增加肝细胞癌肝内转移复发风险。
【关键词】miR-133a; 肝细胞癌; 生物学功能
肝细胞癌(hepatocellular carcinoma, HCC)是全球第5大癌症,第3大致死性恶性肿瘤[1]。2012年全球有78.2万新发肝癌病例,并有74.5万人死于肝癌,其中,中国的新发病例数及死亡病例数均占50%左右[2]。目前手术切除仍然是HCC最为有效的治疗手段,但术后复发率居高不下导致了HCC患者预后并不理想。微小RNA(microRNA)是近年来研究较多的内源性非编码小RNA,可以参与细胞发育、增殖、分化、凋亡等一系列重要生物学进程,并在肿瘤的发生和发展过程中起着重要作用[3]。越来越多的研究证实miRNA与肝细胞癌的生物学行为相关。有研究表明,miR-133a在多种肿瘤发生发展中起到重要作用,但其在复发性肝细胞癌中的研究未见报道。本研究通过对复发性肝细胞癌不同复发间期组间筛选出差异表达的miRNA,并通过细胞功能研究确定其生物学功能,利用生物信息学预测其可能作用的靶基因,以期阐明其在肝细胞癌复发中的功能和可能机制。
1.1 一般资料
筛选东方肝胆外科医院复发性肝细胞癌病例80例,按复发时间间隔分为短期复发组(<2年)及远期复发组(2~5年),每组41例,收集患者临床病理资料进行统计学分析。
1.2 试剂与仪器
miRNeasy FFPE Kit购自美国QIAGEN公司;TaqMan® MicroRNA Reverse Transcription Kit、7500型定量PCR仪购自美国ABI公司;Premix Ex TaqTM (Probe qPCR)购自日本TaKaRa公司;LipofectamineTM 2000购自美国Invitrogen公司;miR-133a的mimic和inhibitor购自广州锐博生物科技有限公司。
1.3 方法
1.3.1 石蜡组织miRNA提取及芯片检测 随机选取8例复发性肝细胞癌病例(短期、远期复发各4例),使用miRNA抽提试剂盒提取石蜡组织中的miRNA,并检测浓度及质量,符合要求后进行后续实验;使用Agilent Human miRNA V16.0芯片筛选两组间差异表达的miRNAs分子,并通过定量PCR扩大样本验证。miRNA反转录反应体系: 10×反转录缓冲液1.0μl, 100mmol/L dNTPs (dTTP) 0.1μl, RNase抑制剂 0.127μl, RT引物混合物 0.4μl, MultiScribeTM 反转录酶 0.67μl, RNA样本 3μl (30ng) 加DEPC水至 10μl。反转录反应条件 16℃ 30min,42℃ 45min,85℃ 5min。将10μl反转录产物用DEPC水稀释至90μl后进行PCR反应。PCR定量反应体系: 2×real-time PCR混合物 8μl;miRNA引物 0.5μl;RT产物稀释至 7.5μl。反应条件50℃ 2min,95℃ 10min后,95℃变性15s,60℃退火60s,40个循环。
1.3.2 转染细胞功能实验 合成miR-133a的mimic和inhibitor进行过表达及干扰实验。用质粒转染方法将miR-133a mimic及inhibitor分别转染至SMMC-7721细胞内,并同时设NC对照组。
转染步骤: 将5μl 20μmol/L的miR-133a mimics与NC(或inhibitor与NC)分别与250μl无血清无双抗的DMEM培养基混合,另将 5μl LipofectamineTM 2000与 250μl 无血清无双抗的DMEM培养基混合,室温孵育5min,然后将这两种孵育液轻轻混合,室温孵育20min;将孵育后的混合转染液缓慢加入相应的含有细胞的6孔板内,置于37℃、5%CO2培养箱中培养6~8h后,各孔更换新的含10%胎牛血清培养基2ml,继续培养至转染后48h,用于后续实验。
1.3.3 CCK8检测细胞增殖能力 CCK8试剂盒(Dojindo公司)说明书操作,酶标仪检测450nm 吸光度值(D450)。
1.3.4 Transwell实验检测细胞迁移及侵袭能力 使用实时无标记动态细胞分析技术对转染mimic后肝癌细胞的迁移能力进行实时监测。
1.3.5 利用生物信息学方法预测miR-133a可能的靶基因 miR-133a可能的靶基因使用TargetScan软件预测与miR-133a存在潜在结合位点的靶基因。
1.4 统计学处理
采用SPSS 18.0统计软件,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异具有统计学意义。
2.1 不同复发时间间隔的肝细胞癌患者临床病理资料分析
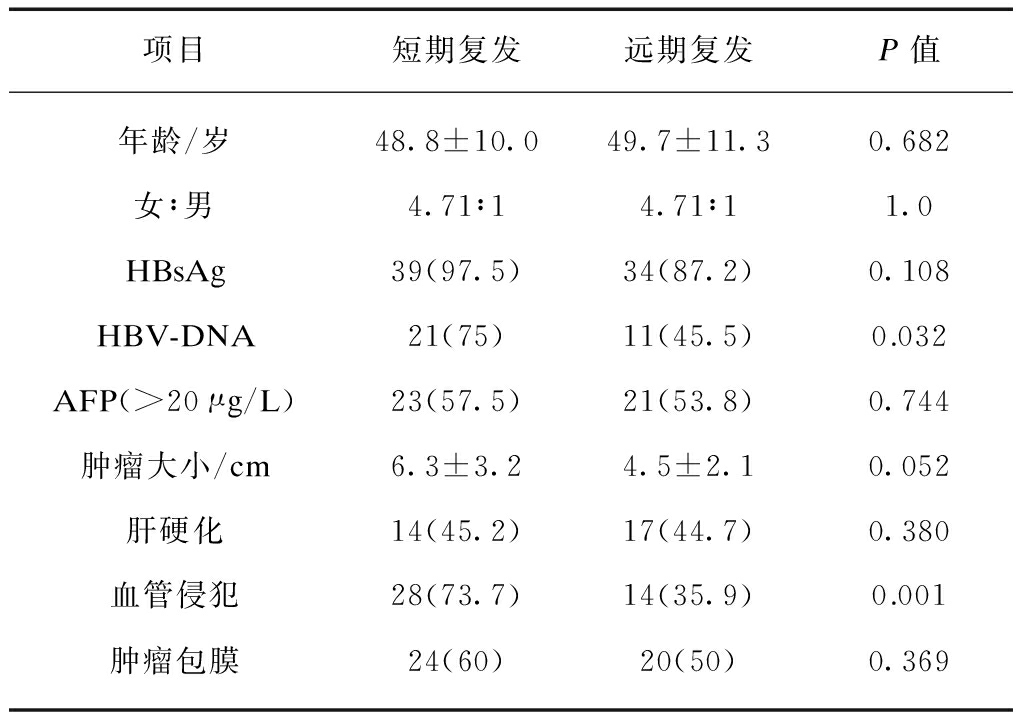
筛选东方肝胆外科医院复发性肝细胞癌病例,按复发时间间隔分为短期复发组(<2年)及远期复发组(2~5年)收集患者临床病理资料并统计分析,结果显示HBV-DNA及血管侵犯在两组间差异有统计学意义,见表1。短期复发组的HBV-DNA及血管侵犯阳性率较远期复发组高,这与临床实践中所见的情况相一致。
表1 复发性肝癌临床病理资料统计分析
Tab.1 Clinical pathological data of recurrent hepatocellular carcinoma ![]() ±s, n(%)]
±s, n(%)]
2.2 不同复发时间间隔的肝细胞癌病例组织中miRNA的表达差异
miRNA芯片筛选不同复发时间间隔的肝细胞癌组织内miRNA的表达差异,结果显示miR-133a在短期复发及远期复发肝癌组织中有差异(高于2倍)。进行定量PCR检测,结果进一步验证了miR-133a 在短期复发组较远期复发组表达显著升高(0.48±0.17 vs 0.04±0.02)。
2.3 细胞转染及功能实验
使用肝癌细胞株SMMC-7721进行细胞功能实验,首先分别转染miR-133a的mimic及inhibitor,并设立对照组NC;转染后定量PCR结果显示转染mimic后的miR-133a 的表达水平显著升高104倍(P<0.01),表示转染成功且效率较高。
对转染成功的SMMC-7721细胞进行功能实验,Transwell实验检测细胞迁移及侵袭能力的变化,空穿细胞数与NC组(18.00±3.6)比较,转染miR-133a mimic组(42.20±3.0)差异有统计学意义(P<0.01);胶穿细胞数与NC组(13.20±1.5)比较,mimic组(38.00±2.2)差异有统计学意义(P<0.01),转染mimic后细胞的迁移及侵袭能力显著增强,见图1。而实时无标记动态细胞分析也进一步证实了这种差异,见图2。
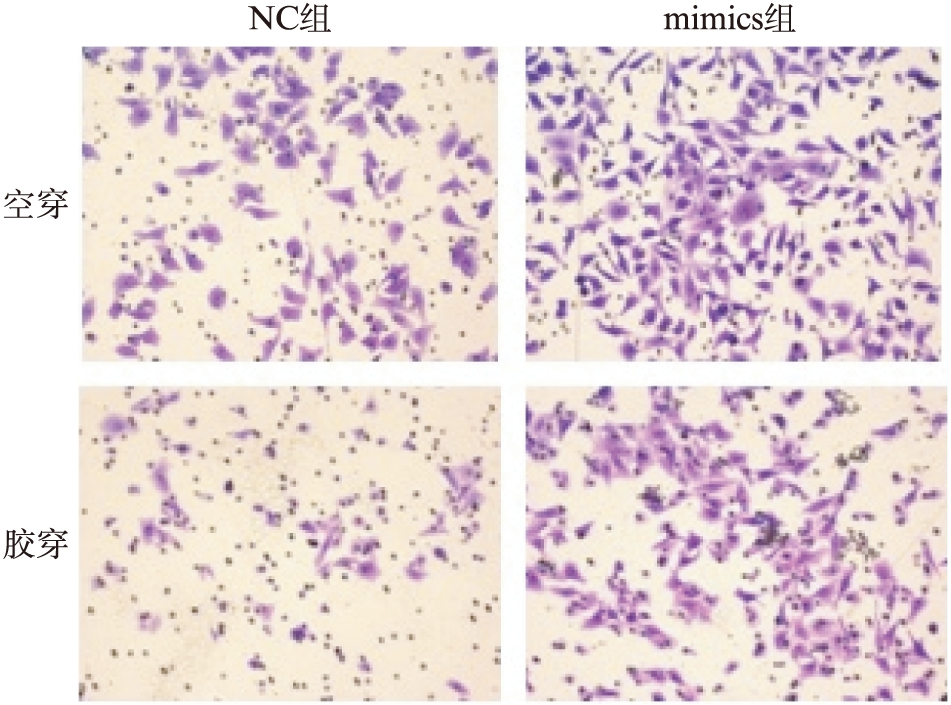
图1 细胞转染mimic后,迁移及侵袭能力增强明显
Fig.1 Cell migration and invasion were significantly enhanced after transfection of mimic
转染inhibitor后细胞的迁移及侵袭能力明显减弱,空穿细胞数与NC组(103.8±4.5)比较,转染miR-133a inhibitor组(49.60±3.5)差异有统计学意义(P<0.01);胶穿细胞数与NC组(36.60±3.2)比较,inhibitor组(18.20±5.4)差异有统计学意义(P<0.05),见图3。
对转染后的SMMC-7721细胞进行CCK8实验,检测细胞增殖能力,结果显示,与NC组相比,细胞增殖能力差异无统计学意义,见图4。
2.4 miR-133a靶基因预测及作用机制
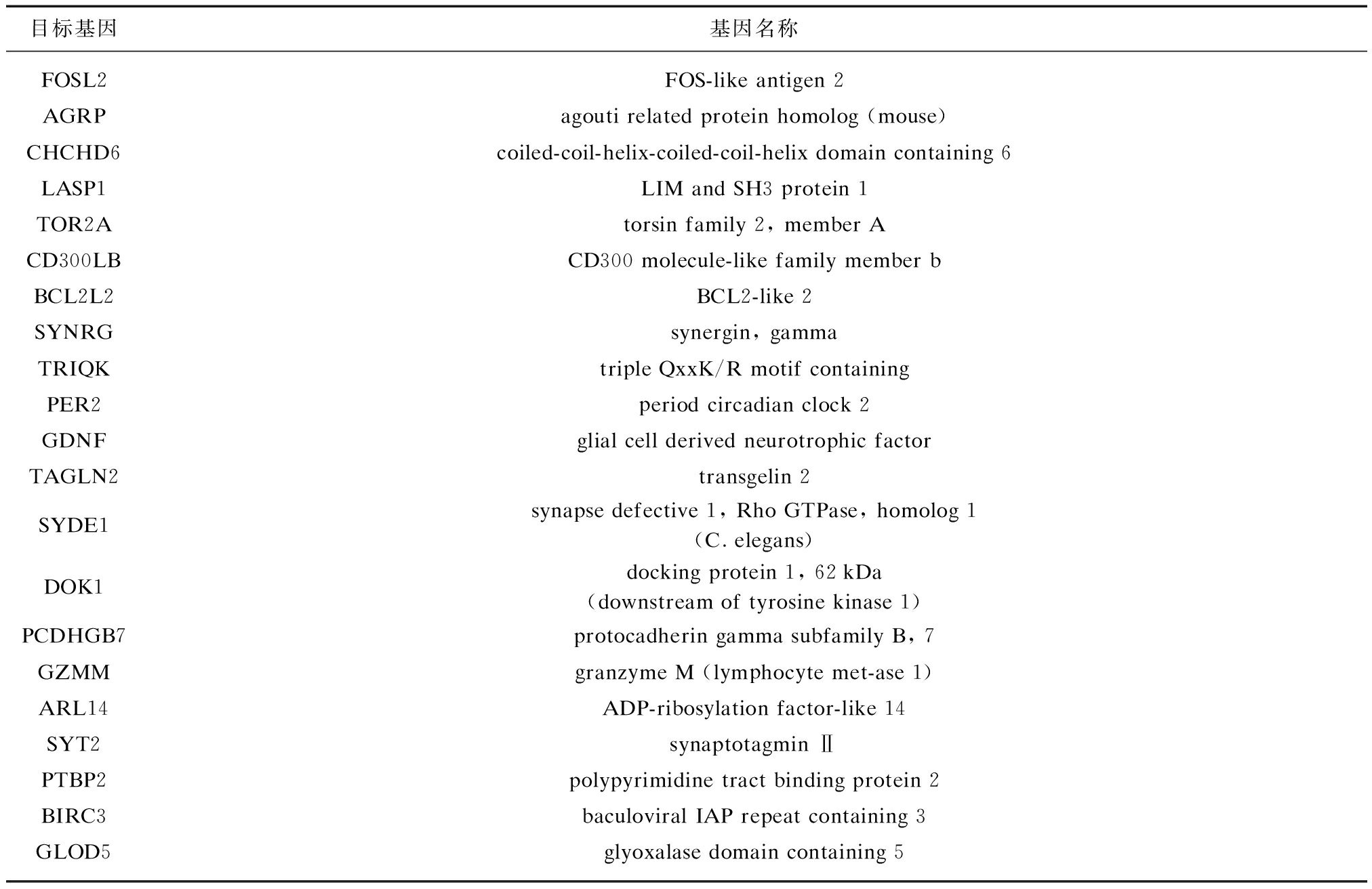
进一步通过生物信息学分析,利用预测软件(TargetScan)预测了miR-133a可能作用的下游靶基因(表2),其中部分基因是肿瘤发生发展通路上的分子(图5),其中MCL-1等基因是PI3K-Akt信号通路中的重要分子,其功能涉及细胞周期调控、凋亡的启动、血管生成、端粒酶活性和细胞侵袭性等诸多方面。
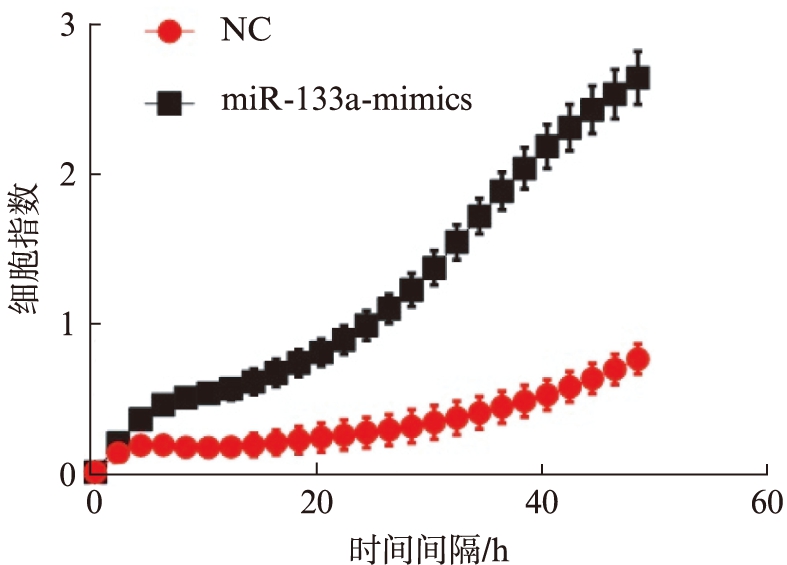
图2 转染mimic后较对照组迁移细胞指数显著提高
Fig.2 The cell migration index was significantly increased after transfection with mimic
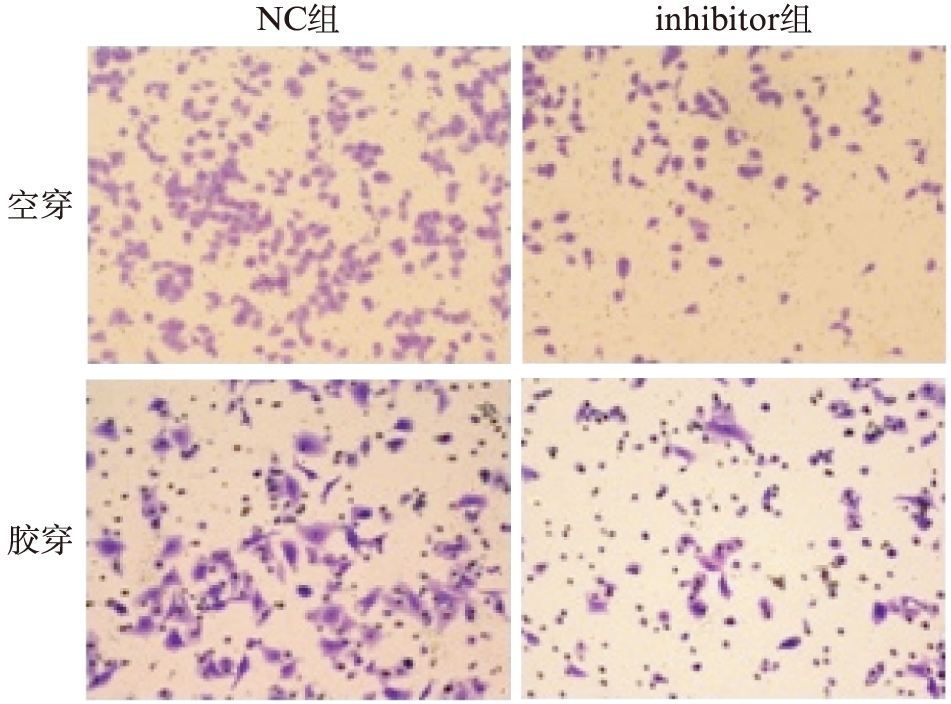
图3 转染inhibitor后可明显抑制肿瘤细胞的迁移及侵袭能力
Fig.3 The migration and invasion of tumor cells are inhibited by transfection with inhibitor
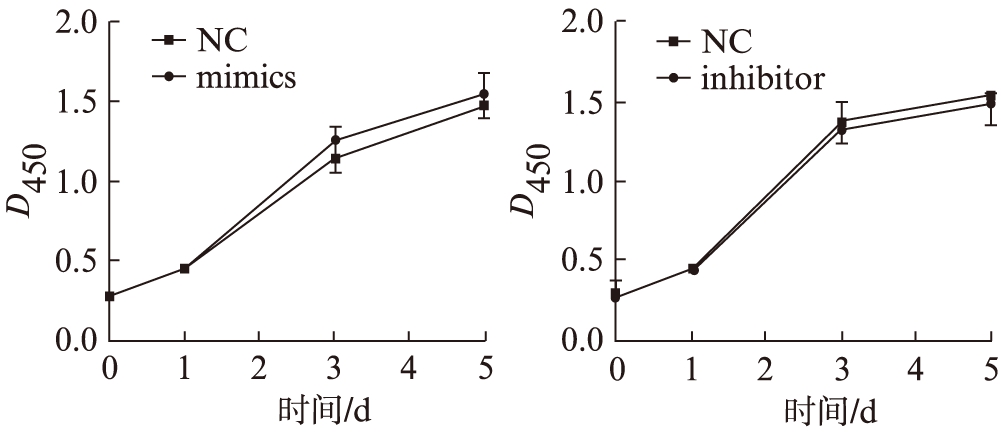
图4 转染mimic或inhibitor后SMMC-7721细胞增殖能力比较
Fig.4 Cell proliferation in SMMC-7721 cells transfected with miR-133a mimic or inhibitor
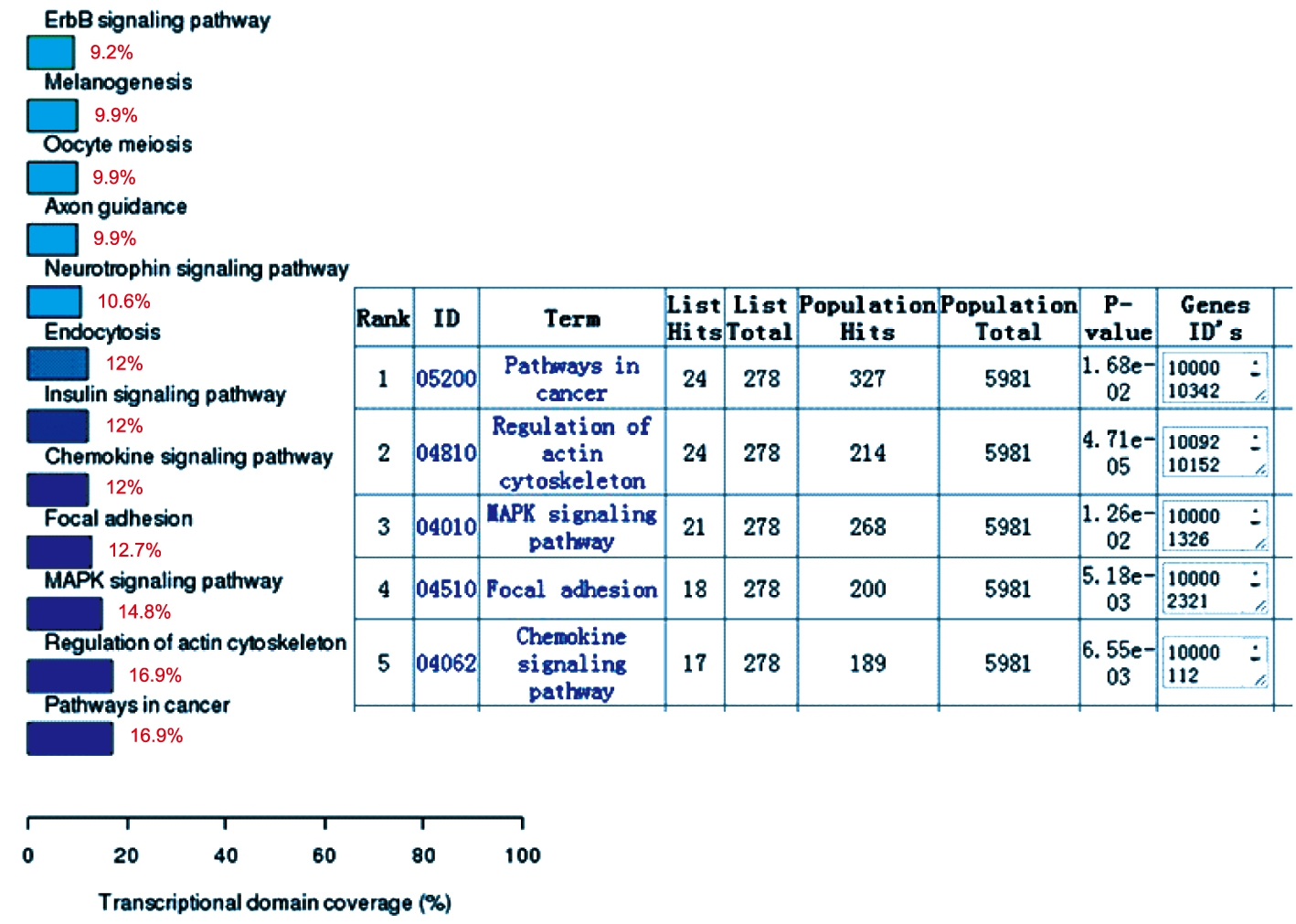
图5 KEGG pathway富集分析
Fig.5 KEGG pathway enrichment analysis
表2 TargetScan预测miR-133a可能作用的下游靶基因
Tab.2 TargetScan predicts downstream target genes of miR-133a
目标基因基因名称FOSL2FOS-likeantigen2AGRPagoutirelatedproteinhomolog(mouse)CHCHD6coiled-coil-helix-coiled-coil-helixdomaincontaining6LASP1LIMandSH3protein1TOR2Atorsinfamily2,memberACD300LBCD300molecule-likefamilymemberbBCL2L2BCL2-like2SYNRGsynergin,gammaTRIQKtripleQxxK/RmotifcontainingPER2periodcircadianclock2GDNFglialcellderivedneurotrophicfactorTAGLN2transgelin2SYDE1synapsedefective1,RhoGTPase,homolog1(C.elegans)DOK1dockingprotein1,62kDa(downstreamoftyrosinekinase1)PCDHGB7protocadheringammasubfamilyB,7GZMMgranzymeM(lymphocytemet-ase1)ARL14ADP-ribosylationfactor-like14SYT2synaptotagminⅡPTBP2polypyrimidinetractbindingprotein2BIRC3baculoviralIAPrepeatcontaining3GLOD5glyoxalasedomaincontaining5
项目短期复发远期复发P值年龄/岁48.8±10.049.7±11.30.682女∶男4.71∶14.71∶11.0HBsAg39(97.5)34(87.2)0.108HBV-DNA21(75)11(45.5)0.032AFP(>20μg/L)23(57.5)21(53.8)0.744肿瘤大小/cm6.3±3.24.5±2.10.052肝硬化14(45.2)17(44.7)0.380血管侵犯28(73.7)14(35.9)0.001肿瘤包膜24(60)20(50)0.369
HCC的高复发转移的生物学特点严重影响手术切除的肝癌患者预后和疗效。从多角度探讨早期复发性肝癌的生物学特点,寻找特异性的分子标记,可以有效评估术后患者的预后,并为临床个体化诊治提供理论支持。
影响患者复发预后的因素很多,普遍认为主要与肿瘤的病理生物学特点(肿瘤大小、分化程度、包膜及血管侵犯等)[4]及肿瘤的微环境(乙肝、肝硬化情况等)[5-6]相关。本实验对复发性肝癌病例临床病理分析的结果显示,肿瘤血管侵犯及血清HBV-DNA 水平在不同复发时间间隔的两组间有显著性差异,提示肿瘤的复发与肿瘤的侵袭能力及患者HBV-DNA水平相关,对于术后病理提示肿瘤周边微血管或大血管侵犯的患者要密切注意随访或术后积极治疗,而对于HBV-DNA水平较高的患者可积极进行抗病毒治疗,降低患者复发风险。
miRNA作为近年来肿瘤研究中较为成熟的分子标志物,有研究表明其在肿瘤的诊断、预后分析中具有一定的价值[7-8]。研究[9-10]显示,miR-133a与心肌肥厚、椎间盘变性等多种疾病的发生发展相关。在肿瘤的相关研究[11]中发现,miR-133a可以通过调节MT1-MMP蛋白抑制神经胶质瘤细胞的增殖及迁移能力;也可以下调食管癌细胞中EMT调节蛋白SOX4的表达抑制细胞迁移及侵袭能力[12];miR-133a 在非小细胞肺癌组织中表达下调,且表达水平与肿瘤的大小、淋巴结转移、TNM分期等相关[13];研究[14]显示,miR-133a可以提高喉癌细胞对化疗药物的敏感性,影响肿瘤的治疗效果。这些研究表明miR-133a可以影响多种肿瘤的生物学行为,而在不同肿瘤中的作用也不尽相同,这一点也符合miRNA在不同肿瘤中呈现多种功能的特点。
通过文献复习,miR-133a在肝细胞癌中的研究较少,在复发性肝细胞癌中未见报道。研究[15-16]显示,miR-133a可抑制肝母细胞瘤细胞株HepG2的增殖及迁移能力,这一结果似乎与本研究在前期临床中观察到的现象不符,分析可能的原因是HepG2来自肝母细胞瘤患者,并非典型的肝细胞癌细胞株,其迁移及侵袭能力较差,加之表型上的差异,HepG2更多的被用于代谢研究[17]。本实验主要研究肝细胞癌的复发机制,所以在实验设计中希望选取肝细胞癌特征更为明显,且多被用于迁移侵袭方面研究的细胞株,本研究经过比较筛选最终确定迁移能力较强的SMMC-7721细胞作为实验研究对象。结果显示miR-133a对SMMC-7721的迁移及侵袭能力有促进作用,这与短期复发组miR-133a高表达的结果相一致,进一步证实了miR-133a表达水平升高可促进肿瘤细胞的迁移和侵袭,临床病理表现为肿瘤周边的微血管侵犯及早期肝内转移。而CCK8实验表明其对细胞增殖能力没有明显影响,提示肿瘤的增殖能力并没有显著提高,在miR-133a高表达的早期复发性肝细胞癌中肿瘤细胞的增殖可能并非主要原因。
综上结果miR-133a可以通过促进肝细胞的迁移和侵袭,造成肝内早期转移或血管侵犯,而在手术无法对微血管侵犯及微小转移灶进行完全清除,从而导致患者术后早期复发,而最终影响患者预后,因此术后复发风险评估显得尤为重要。
由于miRNA分子量较小,在石蜡组织中不易降解等特点[18],使其成为分子病理研究中应用前景广阔的有效候选标志物[19-20],而石蜡包埋组织较新鲜组织易保存,并可在明确诊断后进行检测,保证检测样本的准确性,因此miRNA可以作为分子病理诊断理想的标志物。通过检测患者miR-133a表达水平可以进行术后复发风险评估,如患者术后早期复发风险增高,可以进行介入、化疗等预防性治疗,并密切随访,延长患者生存时间,为患者术后个体化诊治提供理论依据。
【参考文献】
[1] CLARK T, MAXIMIN S, MEIER J. Hepatocellular carcinoma: review of epidemiology, screening, imaging diagnosis, assessment, and treatment[J]. Curr Probl Diagn Radiol, 2015,44(6): 479-486.
[2] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics 2012[J]. CA Cancer J Clin, 2015,65(2): 87-108.
[3] XIE K L, ZHANG Y G, LIU J, et al. MicroRNAs associated with HBV infection and HBV-related HCC[J]. Theranostics,2014,4(12): 1176-1192.
[4] SHIMODA M, TAGO K, SHIRAKI T, et al. Risk factors for early recurrence of single lesion hepatocellular carcinoma after curative resection[J]. World J Surg, 2016;40(10): 2466-2471.
[5] SOHN W, PAIK YH, KIM JM, et al. HBV DNA and HBsAg levels as risk predictors of early and late recurrence after curative resection of HBV-related hepatocellular carcinoma[J]. Ann Surg Oncol,2014,21(7): 2429-2435.
[6] ZHANG X, LIU S, SHEN C, et al. DNA methylation consistency implicates the primary tumor cell origin of recurrent hepatocellular carcinoma[J]. Epigenomics, 2015,7(4): 581-592.
[7] 陈昊,范理宏.血清miRNA生物标志物对NSCLC的诊断价值[J].同济大学学报(医学版),2016,37(4): 51-54.
[8] WANG J, LI J, SHEN J, et al. MicroRNA-182 downregulates metastasis suppressor 1 and contributes to metastasis of hepatocellular carcinoma[J]. BMC Cancer, 2012,12: 227.
[9] HUANG L, XI Z, WANG C, et al. Phenanthrene exposure induces cardiac hypertrophy via reducing miR-133a expression by DNA methylation[J]. Sci Rep, 2016,1;6: 20105.
[10] XU Y Q, ZHANG Z H, ZHENG Y F, et al. Dysregulated miR-133a mediates loss of type Ⅱ collagen by directly targeting matrix metalloproteinase 9 (MMP9) in human intervertebral disc degeneration[J]. Spine (Phila Pa 1976), 2016,41(12): E717-724.
[11] SAKR M, TAKINO T, SABIT H, et al. miR-150-5p and miR-133a suppress glioma cell proliferation and migration through targeting membrane-type-1 matrix metalloproteinase[J]. Gene,2016,587(2): 155-162.
[12] LI S, QIN X, LI Y, et al. MiR-133a suppresses the migration and invasion of esophageal cancer cells by targeting the EMT regulator SOX4[J]. Am J Transl Res, 2015,7(8): 1390-1403.
[13] LAN D, ZHANG X, HE R, et al. MiR-133a is down regulated in non-small cell lung cancer: a study of clinical significance[J]. Eur J Med Res,2015, 20: 50.
[14] WANG X, ZHU W, ZHAO X, et al. miR-133a enhances the sensitivity of Hep-2 cells and vincristine-resistant Hep-2v cells to cisplatin by downregulating ATP7B expression[J]. Int J Mol Med, 2016,37(6): 1636-1642.
[15] ZHANG W, LIU K, LIU S, et al. MicroRNA-133a functions as a tumor suppressor by targeting IGF-1R in hepatocellular carcinoma[J]. Tumour Biol,2015, 36(12): 9779-9788.
[16] WANG G, ZHU S, GU Y,et al. MicroRNA-145 and MicroRNA-133a inhibited proliferation, migration, and invasion, while promoted apoptosis in hepatocellular carcinoma cells via targeting FSCN1[J]. Dig Dis Sci, 2015,60(10): 3044-3052.
[17] MORRIS K M, ADEN D P, KNOWLES B B, et al. Complement biosynthesis by the human hepatoma-derived cell line HepG2[J]. J Clin Invest, 1982,70(4): 906-913.
[18] GOMES BC, SANTOS B, RUEFF J,et al. Methods for studying MicroRNA expression and their targets in Formalin-Fixed, Paraffin-Embedded (FFPE) breast cancer tissues[J]. Methods Mol Biol, 2016,1395: 189-205.
[19] 陆新元,谷晓媛,丛文铭.肝细胞癌相关微小RNA研究进展[J].同济大学学报(医学版),2016,37(4): 124-127.
[20] TOMIMARU Y, EGUCHI H, NAGANO H,et al. Circulating microRNA-21 as a novel biomarker for hepatocellular carcinoma[J]. J Hepatol,2011,56(1): 167-175.
Differential expression and biological function of microRNA-133a in recurrent hepatocellular carcinoma
【Abstract】Objective To investigate the expression of miR-133a in recurrent hepatocellular carcinoma and its relation to biological functions of tumor cells. Methods Differential expression of miRNA was screened in recurrent hepatocellular carcinoma by miRNA microarray . MiR-133a mimic or inhibitor was transfected into human hepatocellular carcinoma SMMC-7721 cells. Cell proliferation was detected by CCK8 assay and cell migration and invasion was examined by Transwell assay. The bioinformatics method was used to predict possible target genes of miR-133a. Results The expression of miR-133a was significantly increased in the early-recurrent HCC. There was no significant difference in cell proliferation activity between SMMC-7721 cells transfected with miR-133a mimic and those transfected with miR-133a inhibitor (P>0.05); however, the cell invasion and migration ability significantly enhanced (P<0.05) in SMMC-7721 cells after transfected with mimic, and decreased significantly after trasfected with miR-133a inhibitor (P<0.05). Conclusion The expressions of miR-133a is increased in hepatocellular carcinoma with early recurrence; miR-133a can promote the invasion and migration of tumor cells, and has no significant effect on cell proliferation, suggesting that elevated miR-133a levels may increase the risk of intrahepatic metastasis and recurrence of hepatocellular carcinoma.
【Key words】miR-133a; hepatocellular carcinoma; biological function
doi:10.16118/j.1008-0392.2017.02.007
收稿日期:2016-06-14
基金项目:国家自然基金青年项目(81602603);国家自然基金面上项目(81272662);上海市卫生和计划生育委员会青年科研项目(2013Y121、20144Y0047)
【中图分类号】R 735.7
【文献标志码】A
【文章编号】1008-0392(2017)02-0033-06