·基础研究·
【摘要】目的 探究2-脱氧-D-葡萄糖(2-Deoxyglucose, 2-DG)对成体神经再生的影响。方法 体外培养大鼠神经干细胞,将其分为正常生长组和诱导静息组,加入2-DG后定时观测细胞增殖情况。利用LIF(leukemia inhibitory factor, LIF)和BMP4(bone morphogenic protein4, BMP4)诱导大鼠神经干细胞定向分化为星形胶质细胞,同时加入2-DG,免疫荧光染色检测分化效率。qRT-PCR进一步检测实验组和对照组中,细胞周期相关基因CDK2和CDK4以及控制神经干细胞命运选择的Hes1基因的mRNA表达水平。结果 Incucyte机器实时监测细胞增殖显示,加入2-DG后,正常生长和静息的神经干细胞增殖均受到抑制。免疫荧光染色显示,加入2-DG后神经干细胞向星型胶质细胞分化的效率显著增高(P<0.05)。qRT-PCR结果表明,加入2-DG后CDK2和CDK4表达量下降,Hes1表达量显著上升。结论 2-DG抑制神经干细胞增殖,促进其向星形胶质细胞分化。
【关键词】2-脱氧-D-葡萄糖; 神经干细胞; 细胞增殖; 星型胶质细胞分化; 大鼠
2-脱氧-D-葡萄糖(2-Deoxyglucose, 2-DG)是一种葡萄糖类似物,它可以抑制糖酵解过程中的关键酶—己糖激酶,从而调控糖酵解过程。在肿瘤的病理发生过程中,2-DG可通过阻碍ATP的生成从而抑制肿瘤细胞的生长[1]。近年研究发现2-DG可有效控制阿尔茨海默症、帕金森病及中风等神经退行性疾病过程中的神经元损失[2],还可以通过增强后放电阈值(after discharge threshold, ADT)抑制小鼠癫![]() 发生的频率[3]。
发生的频率[3]。
在哺乳动物中,成体神经再生(Adult neurogenesis) 是指成体神经干/前体细胞(Neural stem/progenitor cell, NSC/NPC) 产生具有功能的神经元(Neuron)这一过程, 它主要发生在脑室下区的侧脑室(Sub-ventricular zone, SVZ)和海马齿状回的颗粒下区(Sub-granular zone, SGZ)。在成体神经再生的过程中,神经干细胞不断地增殖,其中部分神经干细胞分化迁移至特定位置产生特定类型的神经元。然而,在成体中枢神经系统中,大部分神经干细胞处于静息(Quiescence)状态,它们被机体微环境内的信号激活后,可以重新进入细胞分裂周期, 增殖并迁移分化,产生新生神经元[4-5]。研究发现,成体神经再生在慢性的神经退行性疾病中发生了明显的变化[6]。如在阿尔茨海默症患者大脑的SGZ区和CA1区(Region I of hippocampus proper),不成熟神经元明显增多[7];在帕金森病患者的大脑SGZ和SVZ区,增殖的神经前体细胞受损非常严重[8]。成体神经再生其实是神经中枢自我修复的一种代偿性反应,在受到损伤或处于慢性疾病过程中,它会相应地做出正向或负向的动态调控[9]。但是这种损伤和疾病应激的分子、细胞学机制,例如神经干细胞的增殖、分化及命运选择,仍有待研究。因此,在本研究中,探索2-DG,这种可抑制神经母细胞瘤并缓解神经退行性疾病中神经元损失的药物,对正常生长、静息及分化中的神经干细胞会有何影响。
1.1 材料
2-DG购自美国Sigma公司,用ddH2O配置成1M,使用时用细胞培养液按照1∶1000稀释至工作浓度1mM。DMEM/F12培养基、N2 supplement、双抗(Penicillin-Streptomcyin)、0.05% Trypsin-EDTA购自美国Gibco公司;bFGF、BMP4购自美国Humanzyme公司;GFAP(glial fibrillary acidic protein)和S100β(S100 calcium-binding protein β)抗体购自美国Millipore公司;二抗CF488和CF543购自美国Biotium公司;反转录试剂盒和荧光定量PCR试剂盒购自中国天根公司。
1.2 细胞培养
大鼠神经干细胞培养在含有20ng/ml,bFGF,100×N2 suppliment,100×青霉素-链霉素,100×Glutamax的DMEM/F-12培养基中,培养条件为37℃,5% CO2。每3天传一次代,实验时取对数生长期细胞。正常传代24h后,换至无bFGF含LIF+BMP4的培养基内,诱导其向星型胶质细胞分化。(感谢美国SALK研究所的Fred Gage博士赠送HCN神经干细胞)。
1.3 Incucyte细胞增殖观测
将神经干细胞以2×104/孔接种于24孔板中,过夜贴壁培养,第2天换至不同处理的培养基中: bFGF 20ng/ml;bFGF 20ng/ml 2-DG 1mmol;bFGF 20ng/ml BMP4 50ng/ml;bFGF 20ng/ml BMP4 50ng/ml 2-DG 1mol。将培养皿放入Incuctye机器,每隔2h 拍照一次,按照视野内细胞密度来观测细胞生长速度。
1.4 免疫荧光染色
吸出培养基,用1×PBS洗一次,加入500μl 4%多聚甲醛固定液,室温放置10min;吸出固定液,用1×PBS洗三次,每次5min;吸出PBS,加入500μl 0.25%PBST透化液,室温放置15min;吸出透化液,加入200μl 3%BSA封闭液,室温放置1h;吸出封闭液,加入200μl免疫染色一抗孵育液,4℃孵育过夜;吸出一抗孵育液,用1×PBS洗三次,每次5min;吸出PBS,加入200μl免疫染色二抗孵育液,室温孵育45min;吸出二抗孵育液,用1×PBS洗三次,每次5min;吸出PBS,加入200μl DAPI染色液,室温孵育10min;吸出DAPI染色液,用1×PBS洗三次,每次5min;在荧光显微镜下镜检并拍摄照片。
1.5 qRT-PCR
不同处理的细胞,用Trizol试剂提取其总RNA。按照试剂盒步骤,将其反转录成总cDNA后,用RNase-Free水稀释10倍备用。取稀释后的模板4μl, 2×Premix 10μl,10μmol/L基因引物0.6μl,50×ROX 0.4μl,RNase-Free水4.4μl,在 7500 实时荧光定量PCR仪进行PCR扩增。引物序列: 内参18S上游5′-CATTCGAACGTCTGCC-CTATC-3′,下游5′-CCTGCTGCCTTCCTTGGA-3′;CDK2上游5′-CTTTGCCGAAATGGTGACCC-3′,下游5′-TAACTCCTGGCCAAACCACC-3′;CDK4上游5′-TGGATTGCCTCCAGAAGACG-3′,下游5′-CAGATTCCTCCATCTCCGGC-3′;Hes1上游5′-GCGCCGGGCAAGAATAAATG-3′,下游5′-GGA-ATGCCGGGAGCTATCTT-3′。
1.6 统计学处理
所有数据运用SPSS 17统计软件进行分析,每组样本均为3例。P<0.05表示差异有统计学意义。
2.1 2-DG抑制大鼠神经干细胞增殖
体外培养大鼠神经干细胞,正常传代后第2天加入2-DG(1mol),分别在24h、48h和72h拍照记录。将细胞放入Incucyte机器中观测其生长速度,结果显示,加入2-DG明显抑制大鼠神经干细胞增殖,见图1A。2-DG加入48h后可明显看到正常生长的神经干细胞增殖减缓,24h即可看到静息的神经干细胞增殖受阻,见图1B。
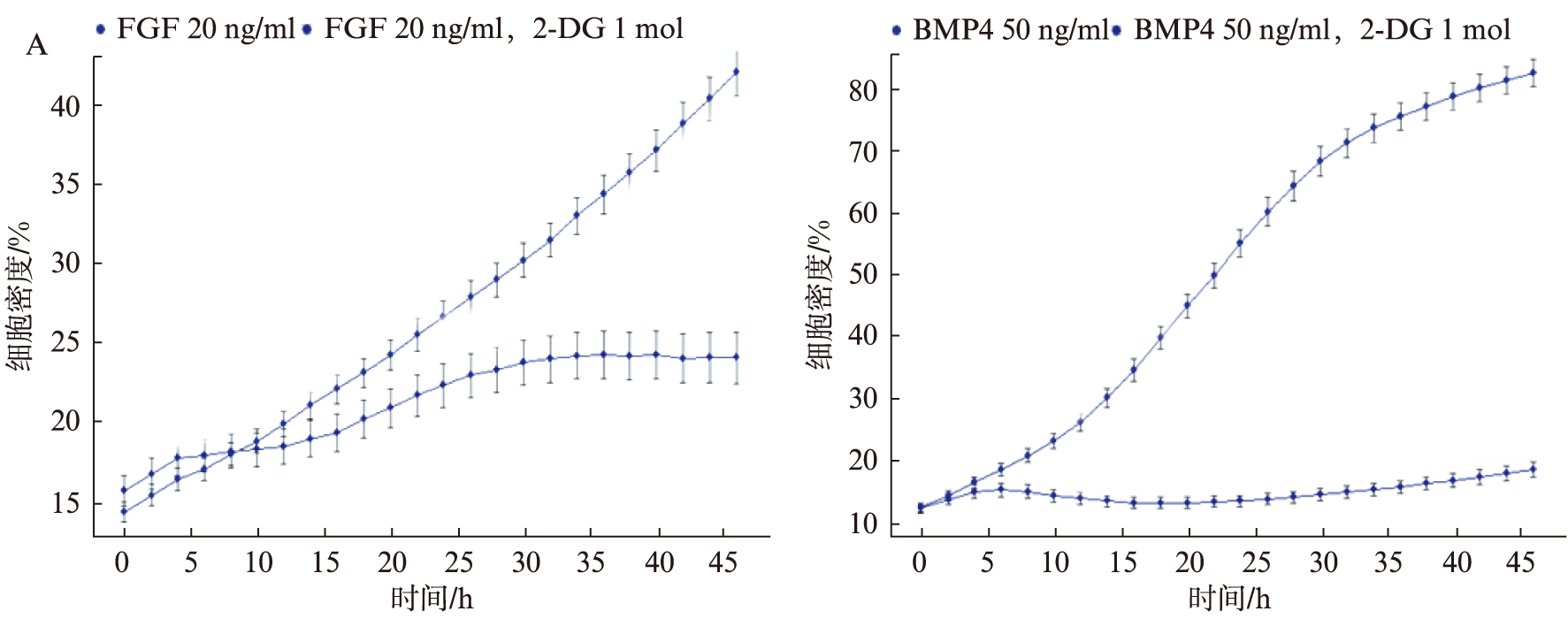
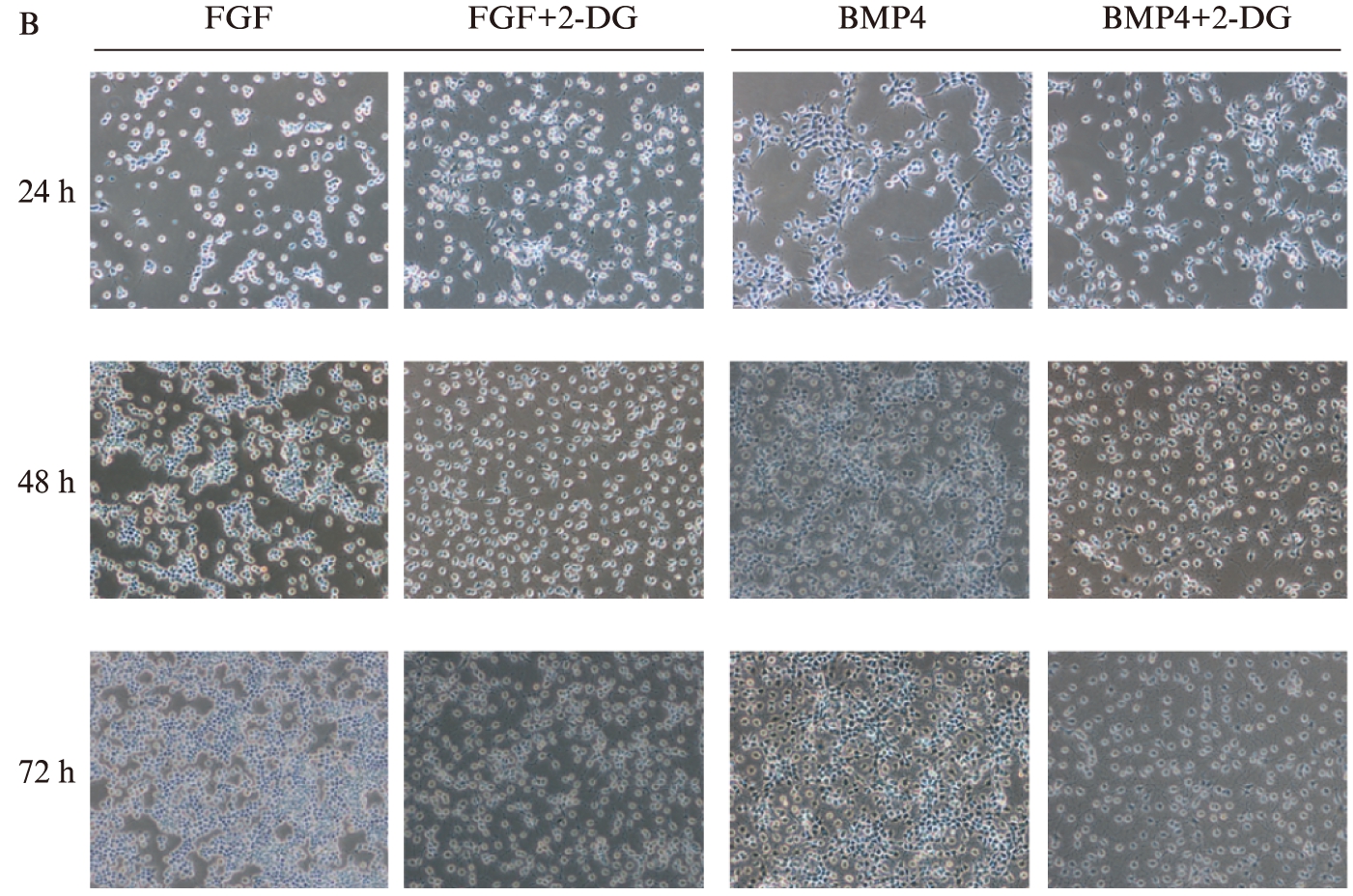
图1 2-DG阻止神经干细胞增殖
Fig.1 2-DG inhibits the proliferation of neural stem cell
A. Incucyte观测神经干细胞增殖;B. 显微镜下观测2-DG处理后神经干细胞形态及增殖情况
2.2 2-DG促进大鼠神经干细胞向星形胶质细胞分化
体外定向诱导神经干细胞向星形胶质细胞分化,同时加入2-DG(1mmol),分化3d后固定细胞,免疫荧光染色结果显示,加入2-DG后星型胶质细胞特异性蛋白GFAP和S100β均增多,见图2A。细胞计数结果发现,神经干细胞向星形胶质细胞的分化效率明显提升,见图2B。
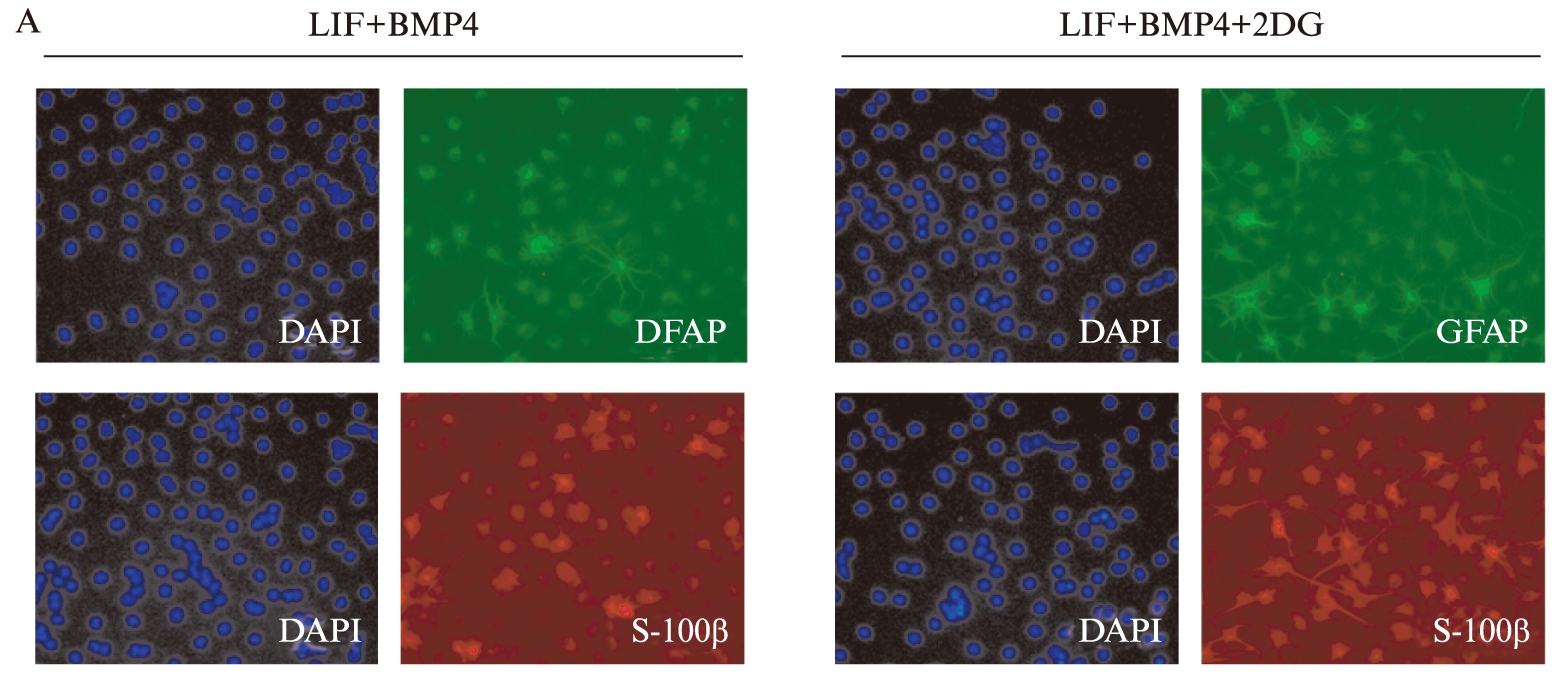
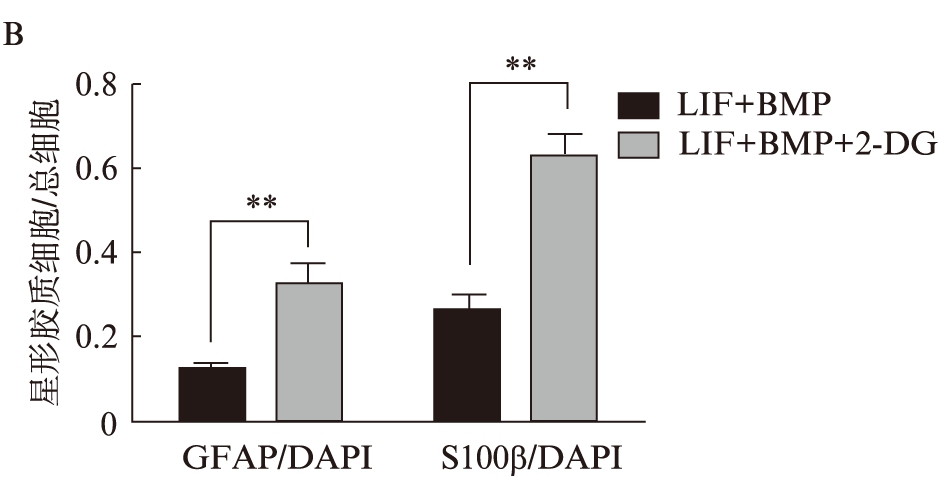
图2 2-DG促进神经干细胞向星形胶质细胞分化
Fig.2 2-DG promotes the differentiation of neural stem cells to astrocytes
A. 免疫荧光染色检测星形胶质细胞的分化;B. 免疫荧光染色的计数结果。**P<0.01
2.3 2-DG影响神经干细胞细胞周期,调控神经干细胞命运抉择
qRT-PCR结果显示,加入2-DG后,在正常生长的神经干细胞中,调控细胞周期相关基因CDK4的表达量明显下降(P<0.01),见图3A;在诱导静息的神经干细胞中,同样看到调控细胞周期相关基因CDK2表达量明显下降(P<0.05),见图3B。而在定向诱导星形胶质分化的细胞中,加入2-DG后,调控神经干细胞向星形胶质细胞分化的基因Hes1表达量明显升高(P<0.01),见图3C。
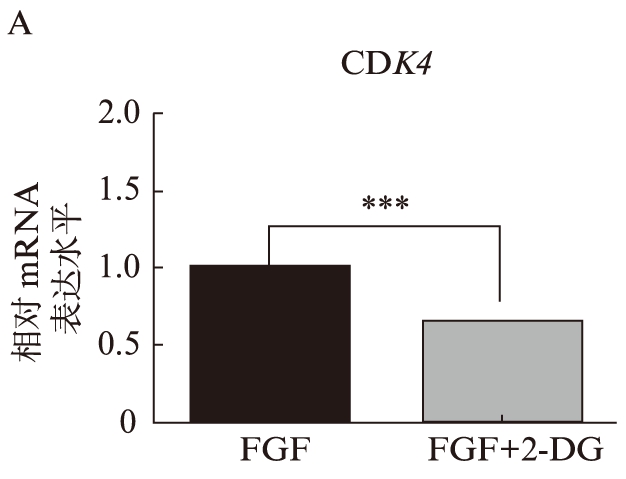
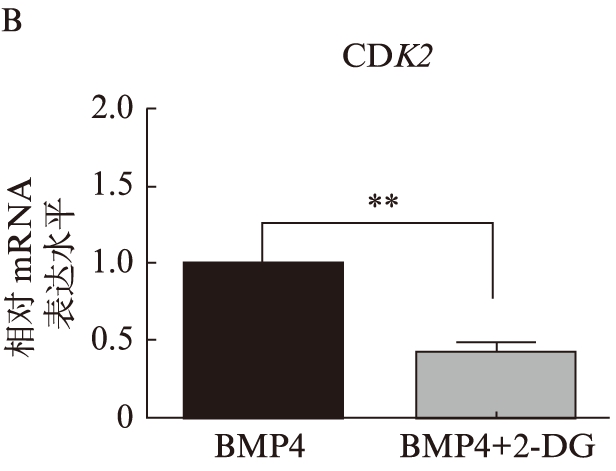
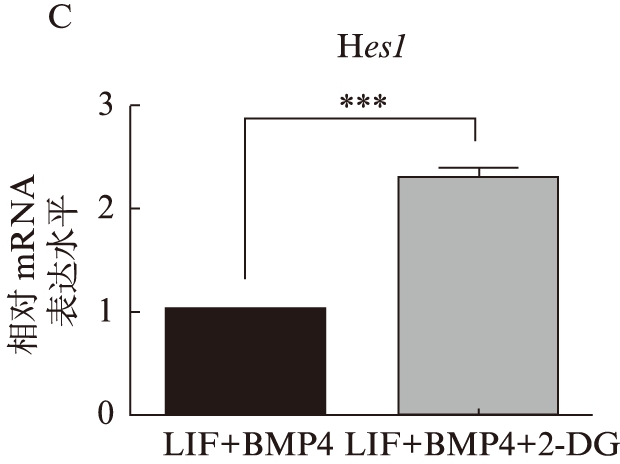
图3 2-DG加入后促进细胞周期相关基因表达下降,而调控神经干细胞分化的相关基因表达上升
Fig.3 The expression levels of cell cycle-related genes in neural stem cells are down-regulated by 2-DG treatment, while the gene related to astrocytic differentiation is up-regulated
A. 2-DG加入前后CDK4在正常增殖的神经干细胞中基因表达水平;B. 2-DG加入前后CDK2在静息的神经干细胞中基因表达水平; C. 2-DG加入前后Hes1在神经干细胞诱导向星形胶质细胞分化中基因表达水平。**P<0.01;***P<0.001
成体干细胞一般以静息和激活两种互相转化的状态存在。在体内,干细胞静息和激活的平衡对机体再生、修复和稳态至关重要。与激活状态相比,静息的干细胞表现为: 细胞周期停滞于DNA二倍体时期,染色体浓缩,核糖体RNA合成减少,蛋白翻译减少,各种应激抗性的增强[10-16]。
葡萄糖是动物细胞生长的主要碳源和氮源,对于中枢神经系统而言,葡萄糖供给能源尤为重要。瓦氏效应认为癌细胞的生长速度高于正常细胞是能量来源的差别所造成的。癌细胞有别于正常细胞通过有氧循环获能,而更偏向于通过糖酵解途径获能。这一观点的提出,引发了不少研究者的好奇,是否能通过诱导癌细胞恢复正常有氧代谢,切断其糖酵解能量供应来阻止癌细胞生长。与此同时,有科学家开始对神经系统的糖代谢产生兴趣[17]。 2004年,日本科学家研究发现,对增殖条件下的神经干细胞低糖处理会减慢其增殖,而分化条件下对神经干细胞做低糖处理则会加速其向神经元和星形胶质细胞分化[18]。
2-DG杀伤神经母细胞瘤的有效浓度在5~10mol,选用略低于此浓度的2-DG作用于正常神经干细胞,以此来探索该药物的正常生理学作用。以往的研究发现2-DG可通过抑制葡萄糖代谢来抑制细胞的增殖,在此基础上体外验证了2-DG抑制成体神经干细胞的增殖[2],同时还发现静息神经干细胞的葡萄糖代谢水平较正常细胞显著降低,但在加入相同浓度的2-DG后,生长过程仍明显受到阻滞。这也提示,2-DG可能存在其他途径影响神经干细胞增殖。此外,在基因水平验证了2-DG处理后,细胞周期相关基因CDK2和CDK4的表达均明显下降。这与Mikyung等在小鼠神经干细胞系中的实验结果相吻合。
成体神经干细胞具有多向分化潜能,在体内可以分化成神经元、星型胶质细胞和少突胶质细胞[19-21]。为进一步研究2-DG对成体神经再生的影响,在体外定向诱导神经干细胞向星型胶质细胞分化,结果表明加入2-DG(1mol)后神经干细胞向星型胶质细胞分化的效率明显增高。此前,文献证实bHLH(Basic helix-loop-helix)家族的转录因子在神经干细胞自我更新和三向分化过程中扮演着重要的角色,其中Ascl1/Mash1,Hes1和Olig2分别调控神经元、星型胶质细胞和少突胶质细胞的命运选择[22-24]。在Itaru等的最新研究中,利用实时成像荧光显微镜观察到在神经干细胞中,Ascl1/Mash1,Hes1和Olig2呈振荡性表达,这表明了正是相应的转录因子主导了神经干细胞分化的命运选择[25]。在加了2-DG的样本中检测到了Hes1基因相对高表达,这解释了2-DG促进神经干细胞向星型胶质细胞分化的现象。
2-DG作为一种可能的抗肿瘤药物引起国内外不少学者的关注,其抑制肿瘤生长的作用在体外实验和动物模型中均得到验证。目前,对于2-DG的研究大多聚焦于它的抗肿瘤机制,然而在抑制肿瘤生长的同时,对正常干细胞是否存在一定程度的影响却鲜有报道。本研究立意于此,在验证了2-DG阻止神经干细胞增殖的基础上,进一步探讨了2-DG对成体神经再生的影响,阐明其用于肿瘤患者后可能出现的隐患,为2-DG的临床应用提供新了思路。
【参考文献】
[1] Shutt DC, O’Dorisio MS, Aykin BN, et al. 2-deoxy-D-glucose induces oxidative stress and cell killing in human neuroblastoma cells[J]. Cancer Biol Ther, 2010,9(11): 853-861.
[2] Park M, Song KS, Kim HK, et al. 2-Deoxy-d-glucose protects neural progenitor cells against oxidative stress through the activation of AMP-activated protein kinase[J]. Neurosci Lett, 2009,449(3): 201-216.
[3] Garriga CM, Schoenike B, Qazi R, et al. 2-Deoxy-D-glucose reduces epilepsy progression by NRSF-CtBP-dependent metabolic regulation of chromatin structure[J]. Nat Neurosci, 2006,9(11): 1382-1387.
[4] Mira H, Andreu Z, Suh H, et al. Signaling through BMPR-IA regulates quiescence and long-term activity of neural stem cells in the adult hippocampus[J]. Cell Stem Cell, 2010,7(1): 78-89.
[5] Wang YZ, Plane JM, Jiang P. Concise review: Quiescent and active states of endogenous adult neural stem cells: identification and characterization[J]. Stem Cells, 2011,29(6): 907-912.
[6] Ming GL, Song H. Adult neurogenesis in the mammalian central nervous system[J]. Annu Rev Neurosci, 2005,28: 223-250.
[7] Curtis MA, Penney EB, Pearson AG, et al. Increased cell proliferation and neurogenesis in the adult human Huntington’s disease brain[J]. Proc Natl Acad Sci USA, 2003,100(15): 9023-9027.
[8] Jin K, Peel AL, Mao XO, et al. Increased hippocampal neuroge-nesis in Alzheimer’s disease[J]. Proc Natl Acad Sci USA, 2004,101(1): 343-347.
[9] Ming GL, Song H. Adult neurogenesis in the mammalian brain: significant answers and significant questions[J]. Neuron,2011,70(4): 687-702.
[10] Gray JV, Petsko GA, Johnston GC, et al. “Sleeping beauty”: quiescence in Saccharomyces cerevisiae[J]. Microbiol Mol Biol Rev, 2004,68(2): 187-206.
[11] Werner WM, Braun E, Johnston GC, et al. Stationary phase in the yeast Saccharomyces cerevisiae[J]. Microbiol Rev, 1993,57(2): 383-401.
[12] Cooper TG. Yeast genetics and molecular biology[J]. Nature, 1981,289(5794): 119-120.
[13] Johnston GC, Pringle JR, Hartwell LH. Coordination of growth with cell division in the yeast Saccharomyces cerevisiae[J]. Exp Cell Res, 1977,105(1): 79-98.
[14] Pinon R. Folded chromosomes in non-cycling yeast cells: evidence for a characteristic go form[J]. Chromosoma, 1978,67(3): 263-274.
[15] Werner WM, Braun EL, Crawford ME, et al. Stationary phase in Saccharomyces cerevisiae[J]. Mol Microbiol, 1996,19(6): 1159-1166.
[16] Fuge EK, Braun EL, Werner WM. Protein synthesis in long-term stationary-phase cultures of Saccharomyces cerevisiae[J]. J Bacteriol, 1994,176(18): 5802-5813.
[17] Faubert B, Boily G, Izreig S, et al. AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo[J]. Cell Metab, 2013,17(1): 113-124.
[18] Knobloch M, Braun SM, Zurkirchen L, et al. Metabolic control of adult neural stem cell activity by Fasn-dependent lipogenesis[J]. Nature, 2013,493(7431): 226-230.
[19] Fishell G, Kriegstein AR. Neurons from radial glia: the consequences of asymmetric inheritance[J]. Curr Opin Neurobiol, 2003,13(1): 34-41.
[20] Gotz M, Huttner WB. The cell biology of neurogenesis[J]. Nat Rev Mol Cell Biol, 2005,6(10): 777-788.
[21] Kriegstein A, Alvarez-Buylla A. The glial nature of embryonic and adult neural stem cells[J]. Annu Rev Neurosci, 2009,32: 149-184.
[22] Vasconcelos FF, Castro DS. Transcriptional control of vertebrate neurogenesis by the proneural factor Ascl1[J]. Front Cell Neurosci, 2014,8: 412.
[23] Imayoshi I, Kageyama R. bHLH factors in self-renewal multipotency and fate choice of neural progenitor cells[J]. Neuron, 2014,82(1): 9-23.
[24] Imayoshi I, Kageyama R. Oscillatory control of bHLH factors in neural progenitors[J]. Trends Neurosci, 2014,37(10): 531-538.
[25] Imayoshi I, Ishidate F, Kageyama R. Real-time imaging of bHLH transcription factors reveals their dynamic control in the multipotency and fate choice of neural stem cells[J]. Front Cell Neurosci, 2015,9: 288.
2-DG inhibits proliferation and promotes astrocytic differentiation of neural stem cells
【Abstract】Objective To investigate the effects of 2-Deoxyglucose(2-DG) on proliferation and astrocytic differentiation of neural stem cells. Methods Rat neural stem cells were cultured under proliferating and quiescent conditions. At indicated time points after 2-DG treatment, the proliferation rate of cells was examined. The growth factors of LIF and BMP4 were used to induce astrocytic differentiation of neural stem cell and differentiation efficiency was quantified by immunofluorescence staining. qRT-PCR was used to determine the expression of cell cycle geneCDK2, CDK4 and fate-determining gene Hes1. Results 2-DG inhibited neural stem cell proliferation under both proliferating and quiescent conditions and prompted astrocytic differentiation(P<0.05). Consistent with the phenotypical changes, 2-DG dramatically suppressed the expression of CDK2 and CDK4 but induced the expression of Hes1. Conclusion 2-DG inhibits the proliferation of neural stem cells and promotes the differentiation of neural stem cells to astrocytes.
【Key words】2-Deoxyglucose; neural stem cells; cell proliferation; astrocytic differentiation; rat
收稿日期:2016-06-14
基金项目:国家自然科学基金面上项目(31371497);国家自然科学基金青年项目(31301063)
【中图分类号】Q 2
【文献标志码】A
【文章编号】1008-0392(2016)06-0035-06
doi:10.16118/j.1008-0392.2016.06.008