·基础研究·
【摘要】目的 观察糖基化终末产物(advanced glycation end products, AGEs)及其受体(receptor of advanced glycation end products, RAGE)对巨噬细胞胆固醇流出功能的影响。方法 培养THP-1细胞株并用佛波酯诱导分化使其成为巨噬细胞,与100μg/ml的氧化LDL(oxidized LDL, oxLDL)孵育细胞使其转化为泡沫细胞。分别以浓度为300μg/ml的AGEs、600μg/ml的AGEs对细胞进行刺激,用浓度为10μg/ml的抗RAGE抗体对细胞进行预处理,通过油红“O”染色测定来反映细胞内脂质含量,通过RT-PCR及Western Blot的方法来检测各组巨噬细胞RAGE表达以及与胆固醇流出相关因子ATP-结合盒转运子(ATP-binding cassette, ABC)G1、ABCA1及肝X受体-α(Liver X Receptor-α, LXR α的表达变化),通过将干预后的巨噬细胞与荧光标记的oxLDL共同孵育,并加入HDL及载脂蛋白A1(apolipoprotein A1, apoA1)介导胆固醇流出,测定细胞培养基中的荧光强度,动态观察巨噬细胞在不同干预条件下胆固醇流出功能变化。结果 经AGEs诱导后,巨噬细胞内脂质含量增加,RAGE表达增加,ABCG1表达下降,巨噬细胞胆固醇流出能力减弱。AGEs效应呈浓度依赖性。应用抗体阻断RAGE功能后,AGEs引起的改变均有明显恢复。结论 AGEs-RAGE相互作用可以抑制巨噬细胞流出胆固醇,增加细胞内脂质累积,从而易于形成泡沫细胞。
【关键词】糖基化终末产物; 糖基化终末产物受体; 巨噬细胞; 胆固醇流出; ATP-结合盒转运子G1
糖尿病患者心血管疾病的发病率和病死率都高于血糖正常的人群。约有50%的糖尿病相关性死亡和大血管并发症尤其是动脉粥样硬化相关[1]。动脉粥样硬化作为心血管疾病的病理基础,其发生和发展中关键一步为巨噬细胞胆固醇代谢紊乱,从而形成泡沫细胞[2]。糖基化终末产物(advanced glycation end products, AGEs) 是非酶糖基化反应的终末产物,主要由蛋白质、脂质或核酸等大分子在没有酶参与的条件下,自发地与葡萄糖或其他还原单糖反应所生成的稳定的共价加成物。已经有明确证据证明,AGEs可以促使糖尿病大血管病变的发生和发展[3- 4],但是AGEs对巨噬细胞脂质代谢紊乱及泡沫细胞形成的影响目前尚无明确结论。本研究应用AGEs干预人单核细胞株分化的巨噬细胞,对巨噬细胞胆固醇流出改变进行研究,并检测其对AGEs受体(receptor of advanced glycation end products, RAGE)以及巨噬细胞胆固醇流出相关因子ATP-结合盒转运子(ATP-binding cassette, ABC)A1及G1、肝X受体-α(Liver X Receptor -α, LXR-α)表达的影响,从而明确AGEs对巨噬细胞胆固醇流出功能的影响及可能机制。
1.1 主要材料
THP-1细胞株购自中国科学院细胞库;RPMI-1640培养基为Gibco公司产品;胎牛血清为美国Invitrogen公司产品;人血清白蛋白、佛波酯(phorbol myristate acetate, PMA)、油红“O”染色液均为美国Sigma公司产品;D-葡萄糖为美国Amersco公司产品;载脂蛋白A1(apolipoprotein A1, apoA1)、HDL、ox-LDL、荧光标记ox-LDL(Dil-oxLDL)为上海经科生物工程有限公司产品;台盼蓝为上海国药集团产品;反转录、PCR试剂盒为日本TAKARA产品;PCR引物由上海生工合成;兔抗人RAGE、ABCA1、ABCG1、LXR-α、GAPDH单克隆抗体购自美国Abcam公司;辣根过氧化物酶标记羊抗兔二抗购自北京博奥森公司;BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;Trizol购自美国Invitrogen公司。
1.2 AGEs 的制备
采用人血清白蛋白(human serum albumin, HAS)与D- 葡萄糖37℃孵育12周方法制备AGE-HAS[5],经筛选鉴定后,制备成冻干粉,4℃保存待用。
1.3 THP-1细胞培养及诱导分化
THP-1细胞株应用含10%胎牛血清的RPMI-1640细胞培养基在37℃,5%CO2的细胞培养箱中培养,培养基加入青霉素、链霉素各0.06g/L,取对数生长期细胞进行实验。实验前加入160nmol/L PMA, 置恒温培养箱中静置培养48h。显微镜下观察细胞形态及贴壁情况。
1.4 巨噬细胞分组干预
将诱导分化成功的巨噬细胞换用无血清培养基培养3~5h后,加入处理因素。按干预因素不同分成如下4组: 第一组: 对照组,不加入任何干预试剂;第二组: 低浓度AGE组,加入终浓度为 300μg/ml 的AGEs 进行干预;第三组: 高浓度AGE组,加入终浓度为600μg/ml的AGEs进行干预;第四组: 抗RAGE抗体组,在加入600μg/ml的AGEs进行干预之前,先加入10μg/ml抗RAGE抗体进行预处理。四组细胞分别与干预试剂共同孵育2h,然后与100μg/ml ox-LDL共同孵育48h,台盼蓝染色检测细胞活率。
1.5 油红“O”染色
用50%异丙醇固定2min,PBS轻缓冲洗3次,油红“O”染色液(Sigma)染色10min,用75%酒精漂洗,去离子水冲洗3次,每次2min,中性树胶封片,显微镜下观察细胞内脂质沉积情况。采用 518nm 波长下油红“O”提取物的光密度值(D)对巨噬细胞脂质含量进行半定量分析。
1.6 荧光定量RT-PCR检测
用Trizol法提取干预后6组细胞的总RNA,进行纯度及完整度鉴定应用RT reagent kit试剂盒,按说明书配成反应体系,反转录为cDNA。以β-actin作为内参照基因。引物序列如下: RAGE: Forward primer GAAACTGAACACAGGCCGGA;Reverse primer CACGGACTCGGTAGTTGGAC;ABCG1: Forward primer TGTCTGATGGCCGCTTTCT;Reverse primer CACCTCATCCACCGAGACAC;ABCA1: Forward primer AGGGAGAGCACAGGCTTTGAC;Reverse primer CCCCACTCACTCTCGCTCG;LXR-α: Forward primer AGCCAAGGTACAGGTAACGA;Reverse primer GATTACAACGGTGATGGCGG。应用SYBR Green RT-PCR试剂盒,按说明书配成体系后进行PCR反应,对各组细胞的靶基因表达进行检测。反应条件为: 95℃ 30s,循环1次;95℃ 5s,60℃ 30s,循环40次;反应结束后,确认扩增曲线和融解曲线,得出Ct值,计算RAGE基因的Ct值与β-actinCt值的差值ΔCt,以2-ΔΔCt作为RAGE mRNA的相对含量。
1.7 Western Blot 检测
RIPA裂解液提取细胞蛋白,10000r/min,离心半径10cm,离心3~5min,取上清液,用BCA蛋白定量试剂盒(碧云天)测定蛋白浓度。根据定量结果,加入5×上样缓冲液,混匀,沸水中加热 10min 变性,经12% SDS-PAGE凝胶电泳,转至硝酸纤维膜上,5%脱脂奶粉室温封闭1h,RAGE、ABCA1、ABCG1、LXR-α、GAPDH一抗加入封闭液中稀释到1∶1000浓度,和膜室温孵育2h。加入1∶5000稀释HRP标记的二抗,与膜37℃孵育 1h。ECL化学发光检测,应用凝胶电泳图像扫描仪对PVDF膜进行图像扫描,并对电泳条带进行D值分析,计算目标靶蛋白条带与GAPDH内参条带值之比,其代表各组细胞的目标蛋白表达水平。
1.8 胆固醇流出实验
如1.4所述方法干预细胞后,应用40μg/ml Dil-oxLDL代替oxLDL孵育(室温下)48h。撤去含Dil-oxLDL培养基,以PBS缓冲液洗涤细胞2次,改用普通培养基培养。并分别加入100μg/ml HDL及10μg/ml apoA1,37℃,5% CO2培养箱中孵育24h,留取细胞培养基,离心半径10cm,12000r/min,离心10min,除去细胞碎片,荧光化学发光微孔板检测仪读取培养基荧光强度。
1.9 统计分析
所有数据均以![]() ±s来表示,应用SPSS 21.0软件对各组实验数据进行统计学分析,采用单因素方差分析One-way ANOVA进行组间两两比较,P<0.05视为差异有统计学意义。
±s来表示,应用SPSS 21.0软件对各组实验数据进行统计学分析,采用单因素方差分析One-way ANOVA进行组间两两比较,P<0.05视为差异有统计学意义。
2.1 油红“O”染色检测各组巨噬细胞内脂质沉积
经油红“O”染色后,各组巨噬细胞内均可见红染物质。其中经AGEs诱导后的巨噬细胞(包括低浓度AGEs及高浓度AGEs),其细胞内红染颗粒明显较对照组增多,颜色深于对照组,且高浓度AGEs诱导后期红染颗粒增加更加明显。应用高浓度AGEs及抗RAGE抗体双重干预后的细胞,其细胞内红染颗粒较高浓度AGEs组明显减少。各组细胞油红“O”染色图片进行分析,半定量分析结果显示,与对照组相比,高AGEs诱导组巨噬细胞内脂质沉积显著增加(P<0.01),低浓度AGEs诱导组巨噬细胞内脂质沉积有所增加(P<0.05),经过抗RAGE抗体预处理组其脂质沉积量,与高浓度AGEs组相比有统计学意义(P<0.05),见图1。
2.2 AGEs对巨噬细胞RAGE表达的影响
qRT-PCR结果显示,AGEs干预后巨噬细胞RAGE mRNA表达量与对照组相比有明显升高,其中高浓度AGEs(19.5±0.43 vs 1.15±0.07,P=0.000)干预后其升高程度较低浓度AGEs(3.53±0.57 vs 1.15± 0.07,P=0.049)更为显著。加入抗RAGE抗体进行预处理后,RAGE表达明显低于高浓度AGEs干预组(5.70±0.45 vs 19.5±0.43),见图2A。
Western Blot显示RAGE在蛋白水平表达趋势与mRNA水平具有一致性,见图2B。
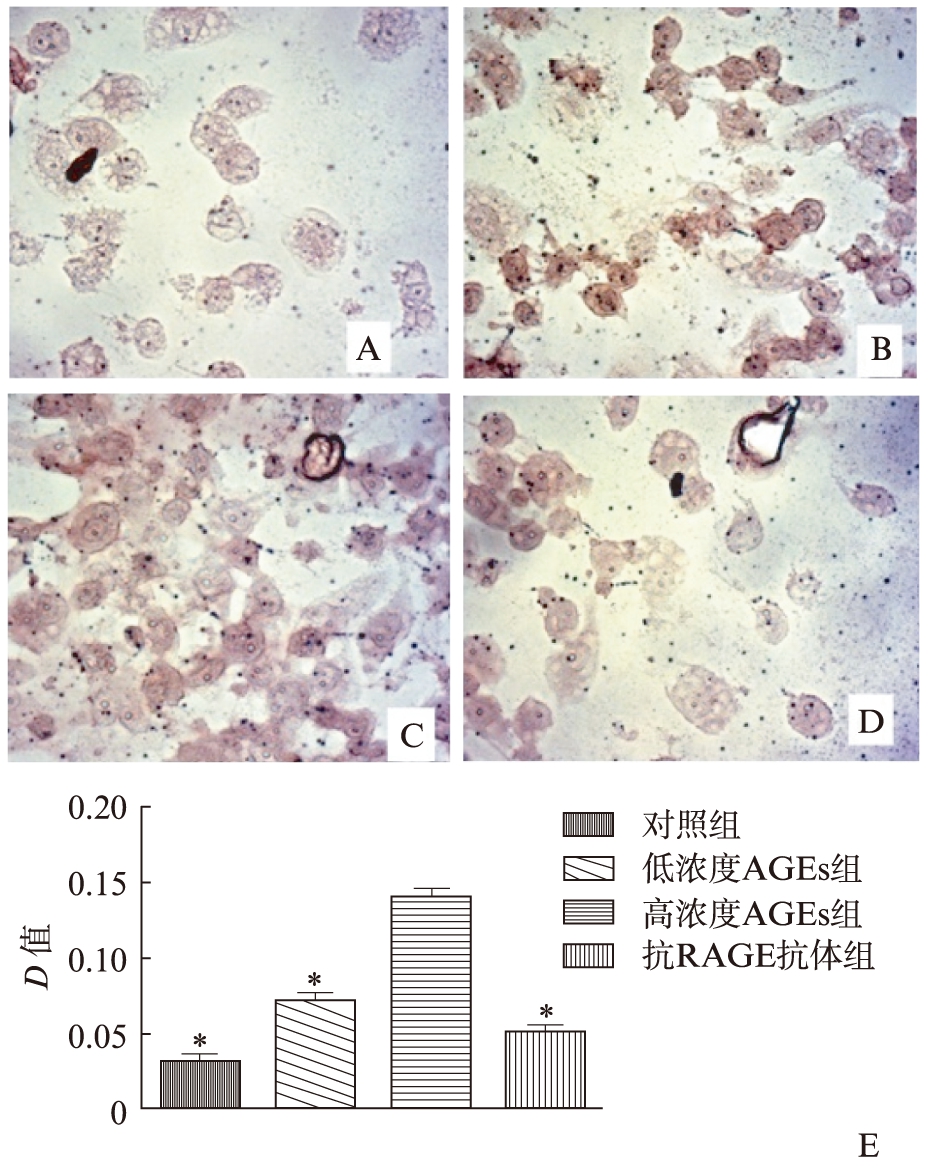
图1 AGEs浓度依赖性增加巨噬细胞脂质累积
Fig.1 AGEs increase lipid accumulation in macrophages in a concentration-dependent manner
A~D: 各组巨噬细胞油红“O”染色结果,可见AGEs干预后巨噬细胞内红染颗粒增多且颜色较深,以高浓度AGEs组更为明显,加入抗RAGE抗体后红染颗粒明显减弱;A: 对照组;B: 低浓度AGEs组;C: 高浓度AGEs组;D: 抗RAGE抗体组;E为对油红“O”染色结果进行半定量分析结果。高浓度AGEs组*P<0.05
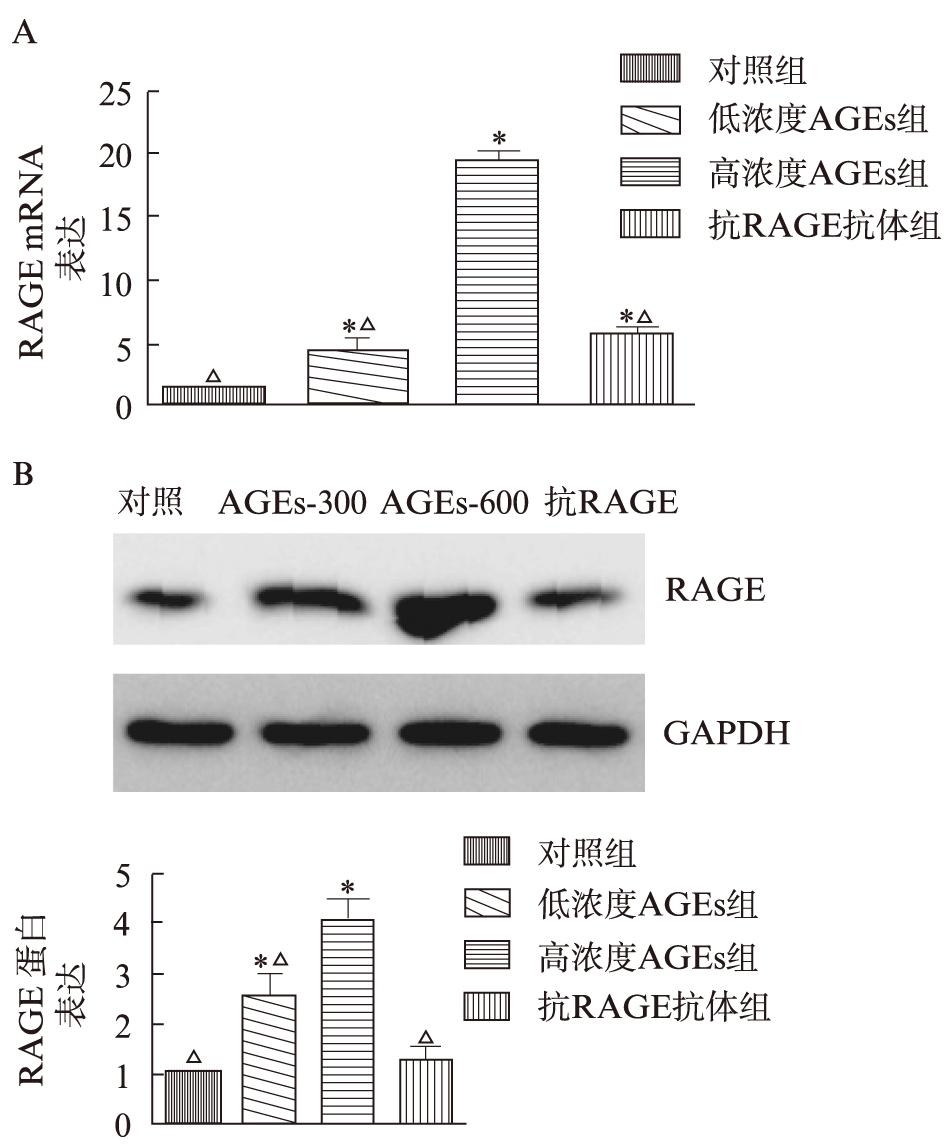
图2 AGEs干预巨噬细胞引起RAGE表达变化
Fig.2 Effect of AGEs on RAGE expression in macrophages
A: 各组巨噬细胞RAGE mRNA表达水平;B: 各组巨噬细胞RAGE蛋白表达水平表达及半定量分析结果。对照组*P<0.05;高浓度AGEs 组△P<0.05
2.3 AGEs对巨噬细胞胆固醇流出功能的影响
如图3所示,在加入HDL共同孵育后,高浓度AGEs干预组其培养基荧光强度低于对照组,且具有统计学意义(P<0.01)。应用抗RAGE抗体预处理组,其培养基荧光强度则明显强于高浓度AGEs干预组并具有统计学意义(P<0.05)。而加入apoAI共同孵育组各组培养基荧光强度并无显著差异。
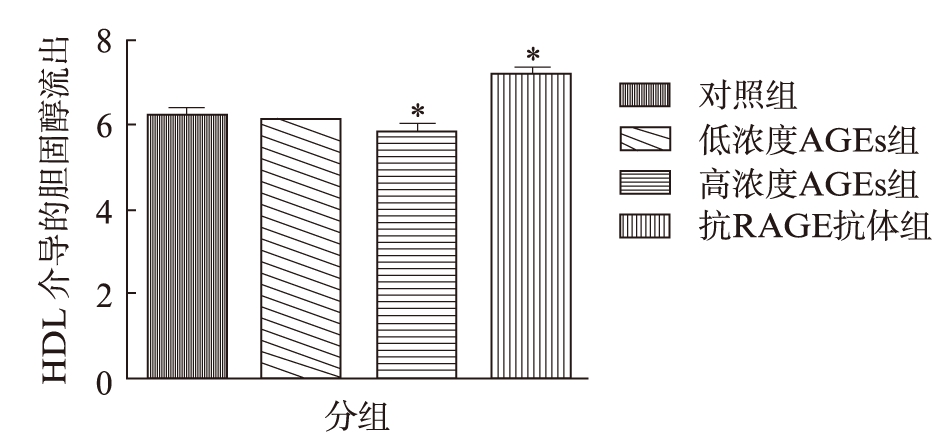
图3 AGEs通过上调RAGE表达降低由HDL介导的巨噬细胞胆固醇流出
Fig.3 AGEs decreased cholesterol efflux to HDL in macrophages through regulating expression of RAGE
各组细胞分别与Dil-oxLDL共同孵育,并加入HDL介导胆固醇流出。测定细胞培养基的荧光强度并以此来表示巨噬细胞流出能力。对照组*P<0.05;高浓度AGEs组△P<0.05
2.4 AGEs对巨噬细胞胆固醇流出相关因子表达的影响
qRT-PCR结果显示,经低浓度AGEs干预后,巨噬细胞与胆固醇摄取相关的分子ABCG1 mRNA的表达均较对照组已有明显改变且具有统计学差异(P<0.05),用高浓度AGEs干预后其表达进一步下降,与对照组相比有显著统计学差异(P<0.01)。抗RAGE抗体干预后,ABCG1 mRNA表达较高浓度AGEs组有明显下降(P<0.01),见图4B。应用WB的方法检测ABCG1的蛋白水平表达,结果与mRNA表达有较好一致性,见图4E。
而对另一与巨噬细胞胆固醇流出有密切关系的分子ABCA1进行检测,发现无论是mRNA水平还是蛋白水平,AGEs干预后其表达均无明显变化(图4A、D)。对ABCG1及ABCA1经典调控因子LXR-α进行检测,得出其表达与ABCG1呈完全相反的趋势,见图4C、F。
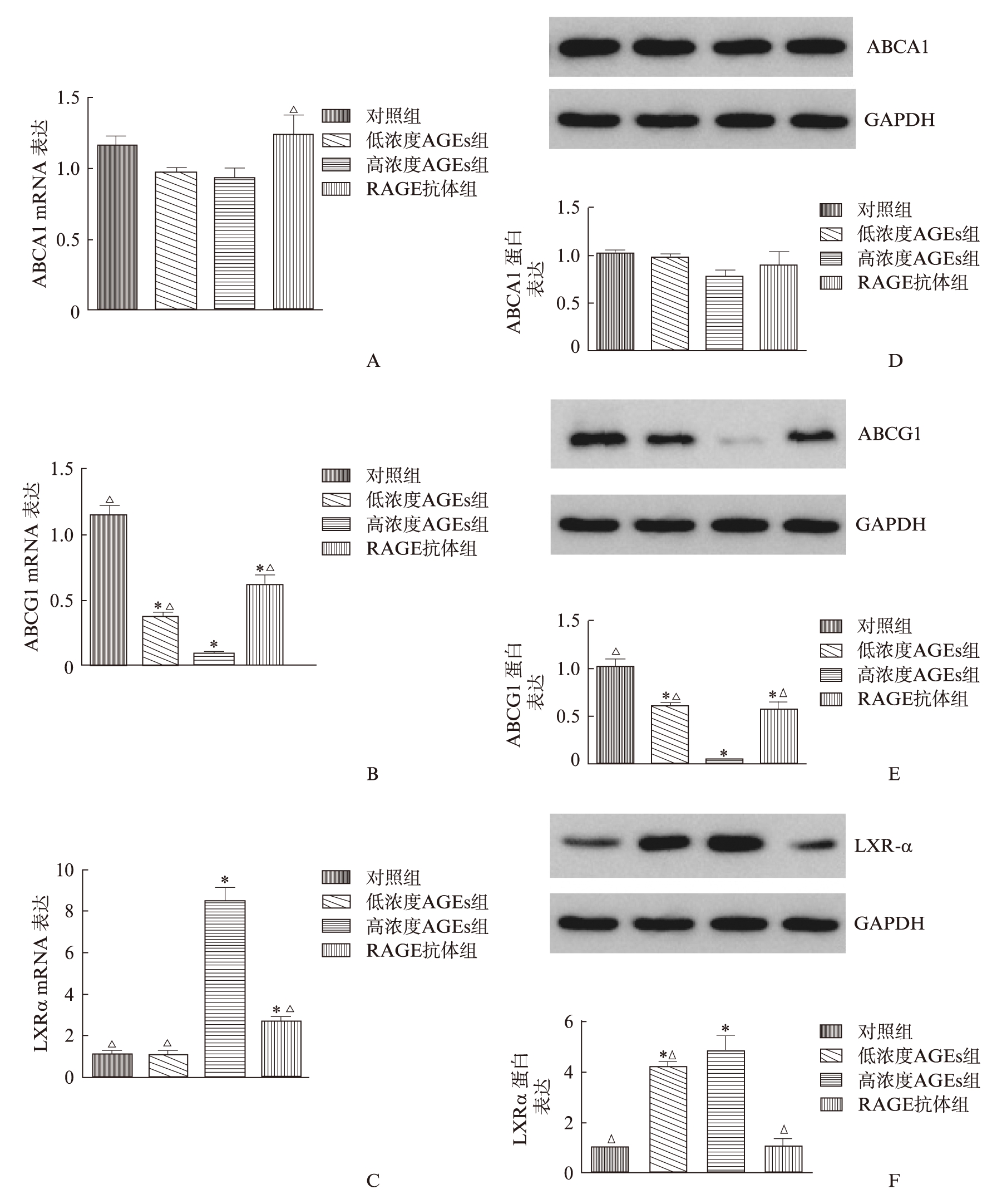
图4 AGEs通过 RAGE下调ABCG1表达
Fig.4 AGEs down-regulate ABCG1 expression in macrophages via RAGE
A: 各组巨噬细胞ABCA1 mRNA表达水平;B: 各组巨噬细胞ABCG1 mRNA表达水平;C: 各组巨噬细胞LXR-α mRNA表达水平;D: 各组巨噬细胞ABCA1蛋白表达水平;E: 各组巨噬细胞ABCG1蛋白表达水平;F: 各组巨噬细胞LXR-α蛋白表达水平。对照组*P<0.05;高浓度AGEs组△P<0.05
巨噬细胞胆固醇代谢平衡是防止动脉粥样硬化形成的重要环节。而巨噬细胞胆固醇流出功能障碍在胆固醇代谢失衡进而脂质累积形成泡沫细胞的过程中起到重要作用[6]。胆固醇流出是清除巨噬细胞内过剩胆固醇从而防止其累积的重要途径,在这一过程中,脂质转运蛋白ABCA1和ABCG1发挥重要的作用,介导了脂质分别向相关载脂蛋白apoAI及细胞外载体HDL转运[7]。目前的研究认为巨噬细胞ABCA1及ABCG1的表达主要受到LXRα依赖性信号途径的调节[8]。
目前,有充足的研究证据表明AGEs与其受体RAGE结合,与糖尿病大血管与微血管并发症的发生和发展均有密切的关系[9]。关于AGEs-RAGE通路对巨噬细胞胆固醇流出功能的影响,目前研究较少,且观点并不一致。有研究认为AGEs主要通过影响ABCA1的表达,减弱巨噬细胞胆固醇流出功能[10],也有研究认为AGEs可能主要通过影响ABCG1表达来发挥作用[11]。
本部分研究采用油红“O”染色及酶法检测细胞内胆固醇酯含量两种方法证明,AGEs可以诱导巨噬细胞脂质累积增加,且这种增加对AGEs呈浓度依赖性,即AGEs浓度越高,其诱导下的巨噬细胞内脂质含量越高。这也可能是血糖控制不佳的患者其大血管动脉粥样硬化发展较快且程度较重的病理基础之一。同时,AGEs上调了巨噬细胞表面RAGE在mRNA 和蛋白水平的表达,且也呈明显的浓度依赖性。在应用了抗RAGE抗体对巨噬细胞表面RAGE进行封闭后,AGEs诱导后升高的脂质含量明显下降,这提示AGEs-RAGE相互作用确实可以增加巨噬细胞的脂质累积。对RAGE进行检测,发现其表达量也明显下降,考虑与AGEs-RAGE正反馈调节相关,由于配体的下降或功能的降低而引起受体表达的下降[12]。
利用将巨噬细胞与荧光标记的oxLDL共同孵育,并加入HDL或apoAI协助流出胆固醇,最后对细胞培养液内的胆固醇荧光水平进行检测的方法,本实验证实AGEs干预后加入HDL,巨噬细胞外流胆固醇能力确实较对照组下降。其机制进行进一步研究发现,AGEs干预后巨噬细胞ABCG1的表达无论从mRAN水平还是蛋白水平都有明显下降,且呈浓度依赖性,这与巨噬细胞胆固醇流出能力变化相符合,且与RAGE表达变化相一致。在加入抗RAGE抗体阻断了AGEs-RAGE通路后,巨噬细胞胆固醇流出能力有所恢复,而ABCG1的表达也明显升高,这提示AGEs作用发挥需要依赖RAGE的存在。值得注意的是,本研究并未发现AGEs干预对ABCA1有明显的影响。且无论分子水平还是蛋白水平,高浓度AGEs干预后巨噬细胞LXRα的表达水平都有明显的升高,与ABCG1表达趋势正好相反,这与通常认为的胆固醇外流调节途径并不相符。根据实验结果,推测AGEs与RAGE结合后,不通过LXRα途径,而是通过核因子κB(nuclear factor κB, NFκB)途径,通过调节过氧化物酶增殖物激活受体γ(peroxisome proliferator-activated receptorsγ-γ, PPAR-γ)反应启动子元件[11]或固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP)[13]直接下调巨噬细胞ABCG1的表达,而此通路对ABCA1的影响较小。由此可进一步推测,2型糖尿病患者巨噬细胞胆固醇流出可能更多依赖于ABCG1而不是ABCA1来进行。本研究中显示加入HDL组其胆固醇外流增强,而加入apoA1组胆固醇外流并未发生明显变化也间接证实了这个观点。
本研究阐明AGEs对巨噬细胞脂质累积以及胆固醇流出功能的影响主要是通过上调RAGE的表达实现的,且与ABCG1及HDL的联系更为密切。这为深入了解AGEs在糖尿病大血管并发症尤其是动脉粥样硬化发生发展中的作用提供了理论支持,并提出了HDL可能在糖尿病患者中具有特别意义的假设。同时,由于在本研究中AGEs的作用呈浓度依赖性,故而再次强调了糖尿病患者严格控制血糖的重要性。
【参考文献】
[1] Grundy SM, Benjamin IJ, Burke GL, et al. Diabetes and cardiovascular disease: a statement for healthcare professionals from the american heart association[J]. Circulation, 1999,100(10): 1134-1146.
[2] Sukhorukov VN, Karagodin VP, Orekhov AN. Atherogenic modification of low-density lipoproteins[J]. Biomed Khim, 2016,62(4): 391-402.
[3] McNair E, Qureshi M, Prasad K, et al. Atherosclerosis and the hypercholesterolemic AGE-RAGE Axis[J]. Int J Angiol, 2016,25(2): 110-116.
[4] Cuccurullo C, Iezzi A, Fazia ML, et al. Suppression of RAGE as a basis of simvastatin-dependent plaque stabilization in type 2 diabetes[J]. Arterioscler Thromb Vasc Biol, 2006,26(12): 2716-2723.
[5] 臧攀攀, 冯波.阿托伐他汀对大鼠糖基化终末产物水平的影响[J].同济大学学报: 医学版,2013,34(2): 26-29.
[6] Pennings M, Meurs I, Ye D, et al. Regulation of cholesterol homeostasis in macrophages and conse-quences for atherosclerotic lesion development[J]. FEBS Lett, 2006,580(23): 5588-5596.
[7] Phillips MC. Molecular mechanism of cellular cholesterol efflux[J]. J Biol Chem, 2014,289(35): 24020-24029.
[8] Schuster GU, Parini P, Wang L, et al. Accumulation of foam cells in liver X receptor-deficient mice[J]. Circulation, 2002,106(9): 1147-1153.
[9] Koulis C, Watson AMD, Gray SP, et al. Linking RAGE and Nox in diabetic miro-and macrovascular complications[J]. Diabetes Metab, 2015,41(4): 272-281.
[10] Passarelli M, Tang C, McDonald TO, et al. Advanced glycation end product precursors impair ABCA1-dependent cholesterol removal from cells[J]. Diabetes, 2005,54(7): 2198-2205.
[11] Daffu G, Shen X, Senatus L, et al. RAGE suppresses ABCG1-Mediated macrophage cholesterol efflux in diabetes[J]. Diabetes, 2015,64(12): 4046-4060.
[12] Ramasamy R, Shekhtman A, Schmidt AM. The multiple faces of RAGE-opportunities for therapeutic intervention in aging and chronic disease[J]. Expert Opin Ther Targets, 2016,20(4): 431-446.
[13] Wong J, Quinn CM, Brown AJ. SREBP-2 positively regulates transcription of the cholesterol efflux gene, ABCA1, by generating oxysterol ligands for LXR[J]. Biochem J, 2006,400(3): 485-491.
doi: 10.16118/j.1008-0392.2016.06.012
AGEs-RAGE interaction decreases the cholesterol efflux in macrophages
【Abstract】Objective To investigate the interaction of advanced glycation end products(AGEs) and receptor of advanced glycation end products(RAGE) in cholesterol efflux of macrophage. Methods Human THP-1 monocytes were treated with PMA(100ng/ml) for 48h, and then induced with oxLDL(100μg/ml) Dil-oxLDL(40μg/ml) for differentiating to macrophage foam cells. Cells was pretreated by AGEs(300μg/ml or 600μg/ml) for 2h, and pre-stimulated with antibody for RAGE(10μg/ml). The staining of oil red O and testing of cholesterol ester in macrophages were used for evaluating the accumulation of lipid in macrophages. RT-PCR and Western blotting analysis were using to test the expression of RAGE, ABCG1, ABCA1 and LXR-α. After adding HDL and apoAI to mediate cholesterol efflux, the fluorescence intensity in the cell medium was tested to reflect the ability of cholesterol efflux in macrophages. Results AGEs can increase the content of lipid and RAGE expression in macrophages in a concentration-dependent manner. The ability of macrophage for cholesterol efflux was decreased accompanied with the reduction of ABCG1 expression after treating with AGEs. For blocking up the AGEs-RAGE axis by antibody for RAGE, all the changes were reversed. Conclusion AGEs-RAGE interaction can decrease cholesterol efflux in macrophages, which can easily transform to foam cell.
【Key words】AGEs; RAGE; macrophage; cholesterol efflux; ABCG1
doi:10.16118/j.1008-0392.2016.06.005
收稿日期:2016-06-28
基金项目:国家自然科学基金青年项目(81300699);上海市卫生与计划生育委员会青年科研项目(20124Y106);上海市浦东新区优秀青年医学人才计划(PWRq2013-04)
【中图分类号】R 587
【文献标志码】A
【文章编号】1008-0392(2016)06-0023-06