·基础研究·
【摘要】目的 从信号转导及细胞凋亡角度,研究亚低温对大鼠脑缺血再灌注损伤(I/R)的脑保护作用及机制。方法 72只雄性健康SD大鼠,随机分成假手术组(S组)、缺血再灌注组(IR组)、亚低温组(M组),每组24只;三组缺血10min后分别按再灌注12h、24h、48h,再分为3个亚组,各亚组动物均为8只。大鼠脑缺血再灌注损伤模型制作采用改良四血管阻滞法,免疫组化SP法动态观察各个时间点海马CA1区caspase-3蛋白的变化;光镜和电镜分别观察再灌注48h亚组海马CA1区神经细胞形态和线粒体超微结构的改变。结果 (1) 大鼠脑缺血再灌注损伤后12h海马CA1区caspase-3即有明显表达,24h达高峰,48h后仍有较高表达;(2) IR组和M组各时间点caspase-3表达水平比S组明显升高(P<0.05);24h亚组线粒体超微结构和神经细胞形态受损严重;(3) M组各个时间点caspase-3表达水平较IR组明显下降(P<0.05或P<0.01);24h亚组线粒体超微结构和神经元形态均有不同程度的改善。结论 亚低温对caspase-3依赖的线粒体凋亡通路有干预作用,通过维持线粒体膜稳定,抑制释放和激活caspase-3蛋白,保护线粒体的形态功能,从而减少神经细胞凋亡的发生,发挥脑保护作用。
【关键词】亚低温; 脑缺血再灌注损伤; caspase-3
亚低温(核心温度32~34℃)对脑缺血再灌注损伤(I/R)后的神经保护作用已在临床上得到肯定,目前认为亚低温的脑保护作用与大多数脑保护剂具有同等功效,但其作用机制尚不清楚。脑I/R与细胞凋亡有着密切的联系,凋亡被认为是脑I/R后神经元死亡的重要方式之一。近来研究发现,低温能选择性地抑制神经细胞凋亡的发生[1-2]。本实验旨在通过检测亚低温对急性脑I/R 后大鼠海马CA1区神经细胞病理形态和线粒体超微结构改变,以及对caspase依赖的线粒体凋亡通路中的关键蛋白caspase-3表达的影响,从信号转导及细胞凋亡角度研究亚低温对脑I/R的保护作用及机制。
1.1 实验动物与分组
72只健康雄性SD大鼠,体质量280~320g,随机分为假手术组(S组)、缺血再灌注组(IR组)、亚低温组(M组),每组24只,三组缺血10min 后分别按再灌注12h、24h、48h,再分为3个亚组,各亚组动物均为8只。所有动物由同济大学医学院动物实验中心提供,实验前3d适应环境,自由饮水和进食。
1.2 制作模型
大鼠全脑缺血再灌注损伤模型采用改良的四血管阻滞法建立。(1) 称质量及麻醉: 使用10%水合氯醛,按0.35ml/100g剂量腹腔注射,麻醉大鼠,待其四肢瘫软后取出。(2) 毁损或分离双侧椎动脉: 将大鼠腹卧位固定在定位仪上,头与躯干向前屈曲30°,正中颈后切口长约1cm,将第一颈椎两侧横突翼小孔暴露;凝闭双侧椎动脉,消毒后缝合肌肉和皮肤,回笼。(3) 夹闭或分离双侧颈总动脉和脑电监测: 24h后大鼠称质量,再次给予10%水合氯醛按0.35ml/100g剂量腹腔麻醉,待麻醉后将银制电极分别插入背部皮下额部及鼻颞部供脑电监测。记录正常脑电图打标并保存。大鼠重新背位固定,颈正中切口2~3cm,分离暴露双侧颈总动脉,在颈总动脉下备留一根5-0丝线备用,缺血时,提拉两端线头,待动物清醒后,用动脉夹夹闭双侧颈总动脉,造成全脑缺血,并及时记录脑电图和记录时间,脑电图波幅下降至缺血前波幅25%以下,或呈一直线标志为全脑缺血模型成功。松开动脉夹恢复脑血流 10min 后即为再灌注。约15min后,脑电图逐渐回复至原图形波幅高度,缝合创口,回笼饲养。(4) 分 组造模: S组仅分离出双侧颈总动脉而不夹闭,暴露双侧椎动脉不凝闭。M组在脑缺血开始后立即向大鼠背部喷洒乙醇,用冰袋覆盖其身,鼓膜温度在10min之内可低至33±0.5℃,改变灯泡、冰袋位置维持此温度3h,亚低温完成后用白炽灯烘烤使鼓膜温度达到正常至苏醒;S组,I/R组在整个手术过程中鼓膜温度始终维持在37±0.5℃至苏醒。(5) 在整个实验过程中,用白炽灯照射动物,以维持鼓膜温度在37℃左右直到恢复活动。再灌注前后观察动物翻正反射、瞳孔变化、脑电图等,以判断是否发生全脑I/R。
1.3 模型成功标准
手术过程中无大出血,双侧颈总动脉夹闭10min 内,吊尾圆锥运动无挣扎,翻正反射消失,瞳孔散大,提示全脑缺血成功。大鼠脑电图波幅下降至缺血前25%波幅以下,或一直线提示全脑I/R模型形成;缺血10min后,松开血管夹,1~2min后血流恢复,上述症状消失,约15min后,脑电图逐渐恢复至原波幅高度。大鼠存活期内未见![]() 性发作,表明脑I/R制作模型成功,否则失败,弃去不用。
性发作,表明脑I/R制作模型成功,否则失败,弃去不用。
1.4 采集标本
所有大鼠分别于再灌注12h、24h、48h后用10%水合氯醛按0.35ml/100g剂量腹腔注射麻醉,处死暴露心脏,用0.9%生理盐水250ml经心脏快速灌注,随后以体积分数为4%的多聚甲醛磷酸盐缓冲液(PBS,40℃,pH 7.14)250ml经心脏灌注冲洗约0.5h。冰上快速取脑,在脑冠状切面,视交叉后约1.5mm处切开脑组织,向后切取标本5mm。4℃ 4%多聚甲醛固定24h后,常规冲洗、脱水、透明、包埋,连续冠状切片,片厚5μm,做免疫组化实验。同时,每组随机抽取再灌注24h亚组大鼠两只,麻醉后处死,取视交叉后1.5mm厚脑海马组织浸泡于4℃ 3%戊二醛中固定、脱水、透明、包埋、切片、染色,做超微电镜观察。
1.5 指标检测
1.5.1 caspase-3蛋白检测 免疫组化SP法按试剂盒说明进行操作,检测caspase-3蛋白表达水平。显微镜下控制DAB显色时间,常规封片。阳性细胞为棕黄色颗粒出现在胞浆中,胞核不着色。切片图像分析采用HPIAS-2000图像分析系统(同济大学医学院病理教研室提供),分析过程中光源强度相同,所有切片放大400倍,测试每张切片caspase-3阳性细胞的平均光密度值。
1.5.2 光镜观察 所有切片采用苏木精伊红(H-E)染色,通过光镜观察各组再灌注24h亚组海马CA1区神经细胞形态改变。
1.5.3 透射电镜观察 锇酸和戊二醛双重固定,脱水、环氧树脂包埋,超薄切片,采用硝酸铅和醋酸铀双重染色,透视电镜(日立H-600型,同济大学医学院病理教研室提供)观察大鼠海马CA1区线粒体超微结构改变。
1.6 统计学分析
所有数据用![]() ±s表示,采用SPSS 19.0统计软件进行分析处理。采用ANOVA分析(Post Hoc Tests,两两比较采用SNK法)比较组内和组间差异,并定义P<0.05为差异有统计学意义。P<0.01为差异有显著统计学意义。
±s表示,采用SPSS 19.0统计软件进行分析处理。采用ANOVA分析(Post Hoc Tests,两两比较采用SNK法)比较组内和组间差异,并定义P<0.05为差异有统计学意义。P<0.01为差异有显著统计学意义。
2.1 caspase-3免疫组化结果
(1) 脑I/R后大鼠海马CA1区caspase-3蛋白在再灌注12h即有明显表达,于再灌注24h达高峰,48h仍有较高表达;(2) S组海马CA1区仅有极少量的caspase-3表达,各亚组间比较,无统计学意义(P>0.05)。IR组和M组各时间点caspase-3表达水平比S组明显升高,差异具有统计学意义(P<0.05 或P<0.01);(3) M组各个时间点caspase-3表达水平较IR组明显下降,差异具有统计学意义(P<0.05或P<0.01),见表1,图1。
表1 脑I/R后caspase-3的活化表达
Tab.1 Expression of caspase-3 after I/R injury![]()
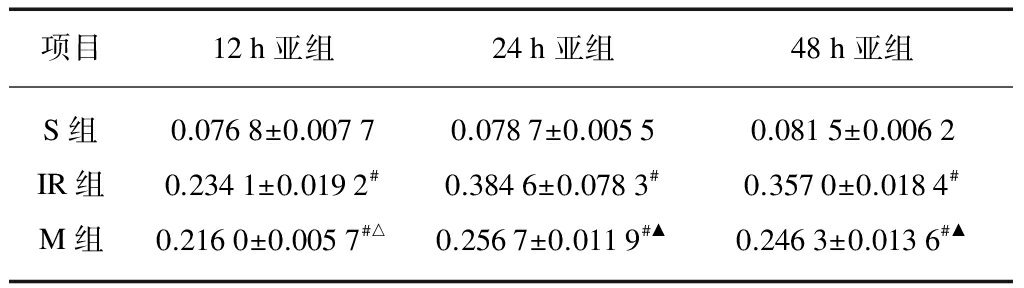
项目12h亚组24h亚组48h亚组S组0.0768±0.00770.0787±0.00550.0815±0.0062IR组0.2341±0.0192#0.3846±0.0783#0.3570±0.0184#M组0.2160±0.0057#△0.2567±0.0119#▲0.2463±0.0136#▲
#P<0.01, vs S group;△P<0.05,▲P<0.01, vs IR group
2.2 H-E染色光镜观察
S组海马CA1区神经细胞排列规整,无明显水肿或皱缩,细胞间隙大致正常,数量无明显增减,无炎性细胞浸润,见图2A。IR组较S组神经细胞破坏严重,排列紊乱,细胞水肿破坏明显,极少见正常神经细胞,部分细胞胞浆呈强嗜酸性变,胞核浓缩深染明显,可见核仁消失,细胞核固缩、碎裂和溶解,可见大量炎性细胞浸润,细胞间隙明显增宽,见图2B。相比IR组,M组神经细胞受损情况明显减轻,接近于S组,神经细胞呈轻度皱缩或水肿,细胞间隙稍增宽,数量大致正常,排列较整齐,浸润的炎性细胞也较IR组明显减少,见图2C。
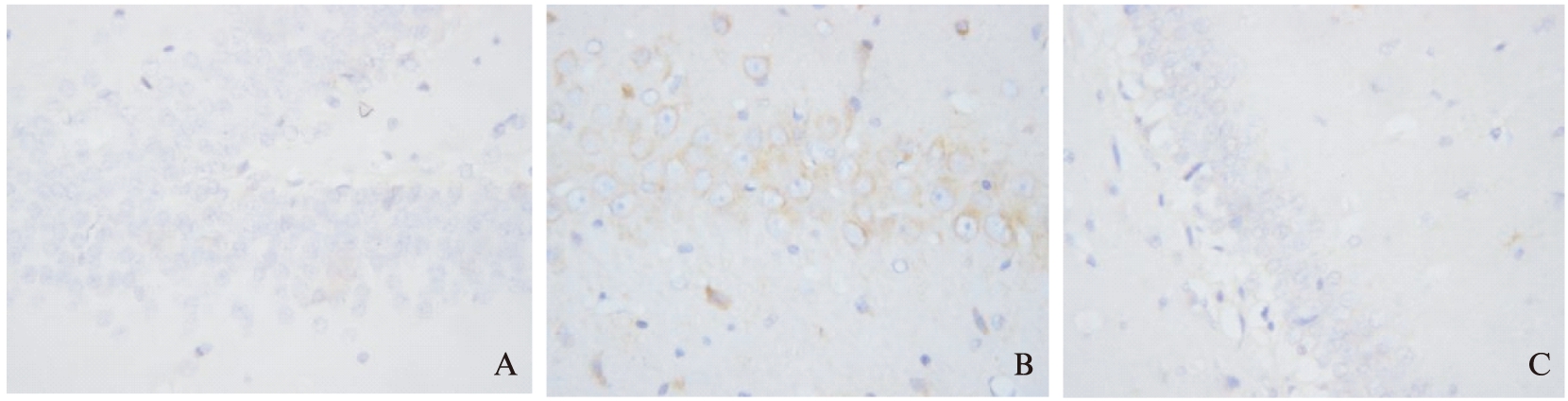
图1 脑I/R后海马caspase-3蛋白免疫组化结果(SP×400)
Fig.1 Expression of caspase-3 at hippocampus CA1 region after I/R(SP×400)
1A: Expression of caspase-3 in S 24h subgroup 1B: Expression of caspase-3 in IR 24h subgroup 1C: Expression of caspase-3 in M 24h subgroup
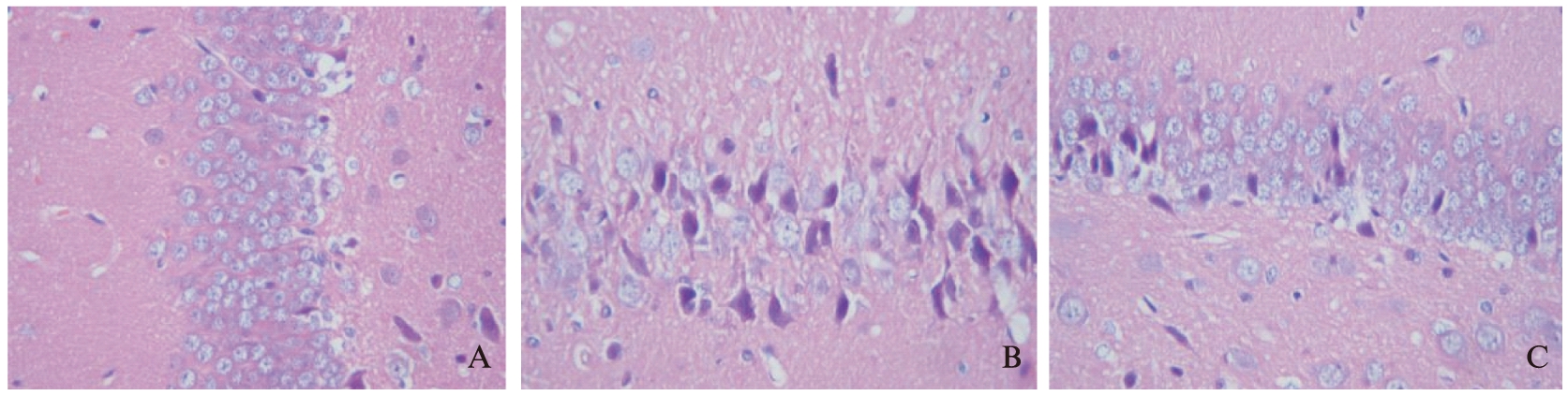
图2 脑I/R后24h海马CA1区光镜结果(H-E×400)
Fig.2 Cellular morphology at hippocampus CA1 region at 24 hours after I/R under the light microscope(H-E×400)
2A: S 24h subgroup 2B: IR 24h subgroup 2C: M 24h subgroup
2.3 透射电镜观察
S组海马CA1区的超微结构基本正常: 神经细胞核大小形态正常,呈椭圆形,核膜光滑,可见清晰的核仁,胞质内可见大量正常的线粒体,胞质密度均匀,内可见大量排列密杂的嵴和基质,见图3A。IR组: 神经细胞破坏严重,染色质聚集浓缩,核仁碎裂和边移,核膜破坏,完整性和连续性中断。胞质排列紊乱,密度不均,线粒体水肿明显,部分呈空泡样或烧瓶样改变,其内部基质嵴断裂和脱落,排列欠紧密。见图3B。M组: 较IR组受损明显减轻,细胞有一定程度皱缩或肿胀,细胞核内可见染色质点状凝集,细胞质密度较均匀,核膜较平滑,未见核固缩,碎裂和溶解;线粒体仍有一定程度的水肿,大多数嵴完整,排列较紧密,未见明显内部基质嵴断裂和脱落,见图3C。
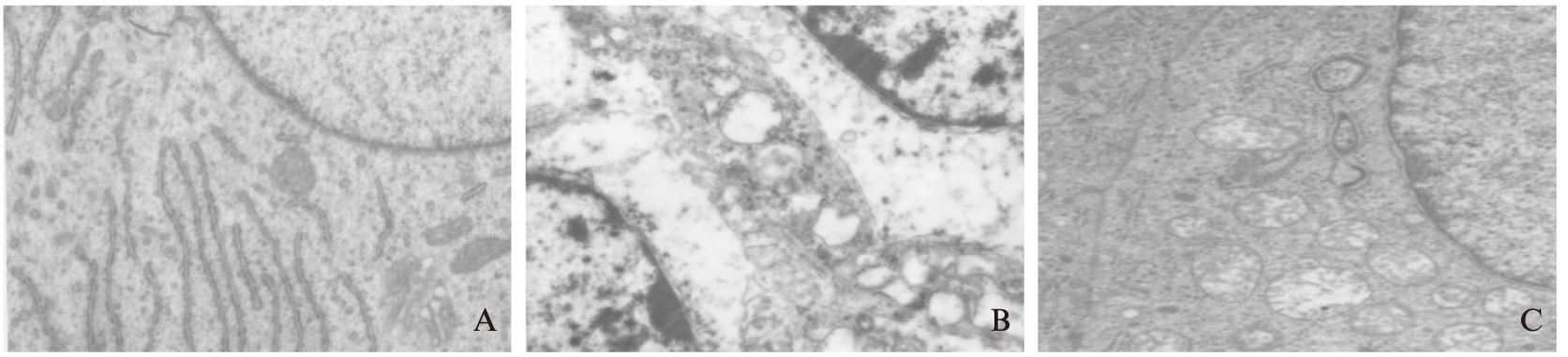
图3 脑I/R后24h海马CA1区透射电镜结果(×12000)(黑白)
Fig.3 Cellular morphology at hippocampus CA1 region at 24 hours after I/R under the electron microscope(×12000)
3A: S 24h subgroup 3B: IR 24h subgroup 3C: M 24h subgroup
近年来,大量实验研究发现,凋亡是脑I/R后神经元细胞死亡的重要方式之一。大量研究同时也证实,在脑I/R过程中,半胱氨酸蛋白酶-3(caspase-3)在caspase依赖的线粒体凋亡途径中起着十分重要的作用[3]。在细胞凋亡发生的各种通路中,天冬氨酸特异性半胱氨酸蛋白酶(caspase)被认为是细胞凋亡的中心环节,而caspase-3又在其中起着关键的作用[4]。近年来,研究发现caspase介导了脑I/R后神经元细胞的凋亡,且参与了迟发性神经细胞损伤的病理生理过程,在缺血性神经元死亡中起着十分重要的作用[5]。国内外的相关文献也已证实,Caspase可诱导细胞发生凋亡,caspase-3作为细胞凋亡的关键蛋白酶,切断凋亡细胞与周围细胞的联系,直接导致凋亡细胞酶解,同时关闭DNA的修复,裂解细胞结构蛋白,降解DNA,最后将细胞酶解并包裹形成多个凋亡小体。Jin等[6]发现全脑缺血再灌注5h后caspase-3开始表达,于24h达高峰。Martin等[7]发现caspase-3缺陷的大鼠缺血 2h 再灌注48h凋亡细胞减少36%,大脑皮质梗死体积减小55%,同样证明了caspase-3与缺血再灌注损伤的关系。caspase-3是细胞凋亡的执行者,它在多种生理和病理因素的刺激下,通过其家族成员的级联放大效应,实施细胞凋亡。
有学者研究发现,不论脑缺血前、缺血中或缺血后,早期开始亚低温治疗,尽早达到亚低温,能明显减轻缺血再灌注后脑组织病理形态的损害,同时能够促进患者大脑神经功能的恢复。亚低温对脑缺血再灌注有明显的保护作用[8-11]。研究去血清诱导体外神经细胞实验发现,亚低温能够保护去血清引起的神经细胞凋亡,其保护作用是通过降低caspase-3、caspase-8、caspase-9的活性,减少细胞色素C的释放;降低凋亡反应中凋亡执行蛋白和调节蛋白的活性而发挥作用。在之前的研究中也发现了类似的作用,bax引发细胞凋亡的机制不是与bcl-x和bcl-2的相互作用,而是通过与线粒体上的电压依赖性阴离子通道(VDAC)和核苷酸腺嘌呤易位子(ANT)形成异源二聚体,转位于线粒体,直接导致线粒体通透性转变孔复合体(PTPC)的构型发生改变,增加线粒体膜的通透性,从而引发线粒体释放Cyt-C,进一步激活caspase级联反应。
本实验结果显示,大鼠IR组caspase-3蛋白表达水平较假手术组显著增加,神经细胞病理形态和线粒体超微结构明显受损,脑I/R后海马CA1区caspase-3蛋白在再灌注12h即有显著表达,于再灌注24h达峰值,之后表达逐渐减少。研究结果提示caspase依赖的线粒体凋亡途径参与了脑I/R 后神经细胞凋亡的调控。给予亚低温治疗后,通过稳定线粒体膜,减少线粒体内部基质脱颗粒和嵴断裂,阻止部分线粒体内膜间隙cyt-C蛋白的激活和释放,进一步保护线粒体的形态和功能,从而减少细胞凋亡的发生,在线粒体水平上发挥脑保护作用。
总之,亚低温对caspase依赖的线粒体凋亡途径有调控作用,通过稳定线粒体膜,保护线粒体的形态和功能,抑制caspase-3的激活和释放,从而减少细胞凋亡的发生,发挥脑保护作用,这可能是其治疗脑I/R的部分作用机制。有关亚低温治疗脑I/R是否还存在其他具体分子机制和凋亡通路有待进一步的探索证实。
【参考文献】
[1] Li H, Wang D. Mild hypothermia improves ischemic brain function via attenuating neuronal apoptosis[J]. Brain Res, 2011,12(1368): 59-64.
[2] Ding L, Gao X, Yu S, et al. Effects of mild and moderate hypothemia therapy on expression of cerebral neuron apoptosis related proteins and glial fiber acidic protein after rat cardio-pulmonary resuscitation[J]. Cell Biochem Biophys, 2014,70(3): 1519-1525.
[3] Graham SH, Chen J. Programmed cell death in cerebral ischemia[J]. J Cereb Blood Flow Metab, 2001,21(2): 99-109.
[4] Zhao H, Yenari MA, Cheng D, et al. Biphasic cytochrome c release after transient global ischemia and its inhibition by hypothermia[J]. J Cereb Blood Flow Metab, 2005,25(9): 1-19.
[5] Zgavc T, De Geyter D, Ceulemans AG, et al. Mild hypothermia reduces activated caspase-3 up to 1 week after a focal cerebral ischemia induced by endothelin-1 in rats[J]. Brain Res, 2013,21(1501): 81-88.
[6] Jin K, Graham SH, Mao X, et al. Fas(CD95) may mediate delayed cell death in hippocampal CA1 sector after global cerebral ischemia[J]. J Cereb Blood flow Metab, 2001,21(12): 1411-1415.
[7] Martin VA, Herr I, Jeremias I, et al. CD95 ligand(Fasl/APO-1L) and tumor necrosis factor-related apoptosis-inducing ligand mediate Ischemia-induced apoptosis in neurons[J]. J Neurosci, 1999,19(10): 3809-3817.
[8] Luo C, Pan SY. The pathways by which mild hypothermia inhibits neuronal apoptosis following ischemia/reperfusion injury[J]. Neural Regen Res, 2015,10(1): 153-158.
[9] Jia F, Mao Q, Liang YM, et al. The effect of hypothermia on the expression of TIMP-3 after traumatic brain injury in rats[J]. J Neurotrauma, 2014,31(4): 387-394.
[10] Lu J, Shen Y, Qian HY, et al. Effects of mild hypothermia on the ROS and expression of caspase-3 mRNA and LC3 of hippocampus nerve cells in rats after cardiopulmonary resuscitation[J]. World J Emerg Med, 2014,5(4): 298-305.
[11] 陈胜,彭沪,庄育刚,等.盐酸法舒地尔对脑缺血再灌注损伤大鼠神经细胞凋亡和细胞色素C释放的影响[J].同济大学学报: 医学版,2012,33(6): 36-40.
doi: 10.16118/j.1008-0392.2016.06.007
Effects of subhypothermia on apoptosis and caspase-3 expression in neuronal cells after cerebral ischemia/reperfusion injury in rats
【Abstract】Objective To explore the effects and mechanism of subhypothermia on apoptosis and caspase-3 expression in neuronal cells after cerebral ischemia/reperfusion(IR) injury in rats. Methods Seventy two healthy male SD rats were randomly divided into three groups: group S(sham operation group), group IR(ischemia/ reperfusion) and group M(subhypothermia treated group), 24 rats in each group. The model of focal cerebral ischemia reperfusion injury was established by using Pulsinelli’s method. Rats in each group were further divided into 3 subgroups(n=8 in each), which were treated with 10min ischemia, then 12h, 24h or 48h cerebral reperfusion, respectively. The expression of caspase-3 in neuronal cells were examined by immunohistochemical SP method, the pathological changes and mitochondria ultrastructure of neuronal cells in hippocampus CA1 region were observed by light microscope and electron microscope at 24h after reperfusion. Results The expression of caspase-3 started to increase at 12h after reperfusion, reached the peak at 24h and remained high level at 48h. Compared with group S, the expression of caspase-3 in group IR and M were increased significantly(P<0.01). The pathological changes of nerve cells and mitochondria ultrastructure were exacerbated at 24h after reperfusion. Compared with IR group , the expression of caspase-3 in group M were decreased significantly(P<0.05 or P<0.01); and the pathological changes of nerve cells and mitochondria ultrastructure were attenuated at 24h after reperfusion. Conclusion Subhypothermia protects rat neuronal cells from ischemia/perfusion injury through stabilizing mitochondria membranes and inhibiting the caspase-3-dependent apoptosis.
【Key words】subhypothermia; cerebral ischemia/reperfusion injury; caspase-3
doi:10.16118/j.1008-0392.2016.06.004
收稿日期:2016-06-17
【中图分类号】R 743.3
【文献标志码】A
【文章编号】1008-0392(2016)06-0018-05