·临床研究·
【摘要】目的 探讨血浆25-羟维生素D[25(OH)D]在2型糖尿病(T2DM)患者动脉硬化损害中的作用。方法 回顾性分析160例T2DM患者的临床资料,根据动脉硬化(atherosclerosis, AS)检测结果,将T2DM组患者分为单纯T2DM组(69例)和T2DM+AS组(91例),另选取160例同期健康者作为对照组。检测各组血浆25(OH)D、RAAS改变,采用多因素logistic回归对AS的危险因素进行分析。结果 与对照组比较,T2DM+AS组、单纯T2DM组血糖和血脂相关指标、BMI、PRA、AngⅡ、ALD、25(OH)D等差异有统计学意义(P<0.05);与单纯T2DM组比较,T2DM+AS组年龄增大,FBG、HbAlc、PRA、AngⅡ、ALD升高,HDL-C、25(OH)D降低(P<0.05);血浆25(OH)D与PRA、AngⅡ、ALD均呈负相关(r=-0.611、-0.591、-0.639,P<0.05);多因素Logistic回归分析显示,年龄、HbAlc、PRA可能是T2DM患者AS的危险因素,HDL-C、25(OH)D则可能是保护因素(P<0.05)。结论 T2DM患者血浆25(OH)D降低,RAAS水平升高,25(OH)D缺乏可能通过对RAAS的负向调控而参与AS发生。
【关键词】2型糖尿病; 动脉硬化; 25-羟维生素D; 肾素-血管紧张素-醛固酮
糖尿病(diabetes mellitus, DM)心血管并发症现已成为DM患者致残和致死的主要原因,主要累及心、脑、外周大血管的动脉粥样硬化(atherosclerosis, AS)[1],其病理学基础是血管结构与功能的病变,颈动脉内中膜厚度(intima-media thickness, IMT)及斑块形成是检测血管硬化的早期亚临床指标,反映多种心血管危险因素对动脉壁损害的作用[2]。近年来,局部和全身肾素-血管紧张素醛固酮系统(renin-angiotensin-aldosterone system, RAAS)异常与DM心血管并发症的相关性愈发引人关注。研究[3-4]证实,维生素D缺乏或不足可能在DM动脉硬化损害中发挥着重要作用,但其作用机制尚不十分明确。本研究通过研究糖尿病患者血浆25-羟维生素D[25(OH)D]水平与DM早期动脉硬化指标、RAAS改变的相关性,探讨25(OH)D在其动脉硬化机制中的作用。
1.1 一般资料
收集2013年1月至2013年8月上海市徐汇区中心医院收治的2型糖尿病(T2DM)患者(T2DM组),共160例。入组标准: (1) 均符合1999年WHO制定的诊断标准[5];(2) 年龄45岁以上。排除标准: (1) 1型糖尿病、继发性糖尿病、过去3个月内有糖尿病急性代谢并发症、合并严重糖尿病慢性并发症;(2) 已服用维生素D及其类似物;(3) 伴有心源性休克、重度心力衰竭、严重室性心律失常;(4) 伴有其他严重疾病如恶性肿瘤、肝肾功能严重衰竭;(5) 精神疾病和严重感染的患者等。男82例,女78例;年龄45~78岁,平均(57.33±4.84)岁;病程0.5~10年,平均(5.2±2.1)年。同时收集同期健康体检者160例(对照组),男86例,女74例;年龄45~75岁,平均(55.45±5.17)岁。两组患者年龄、性别等一般临床资料比较,差异无统计学意义(P>0.05)。本研究方案经伦理委员会审议通过,患者或家属均签署知情同意书。
1.2 方法
1.2.1 临床资料收集 收集患者年龄、性别、T2DM病程、吸烟史(每天吸烟超过10支,连续吸烟超过5年)、身高、体质量、BMI、腹围、臀围、血压等。所有入选对象均在同一季节、户外运动基本相似的情况下进行测定。
1.2.2 标本采集 入选对象均抽取空腹静脉血6ml,其中2ml置于抗凝管中(充分混匀),离心半径10cm,3000r/min,离心10min,分离血清、血浆。
1.2.3 实验室指标测定相关生化指标 空腹血糖(fasting blood glucose, FBG)、餐后2h血糖(2-hour post-meal blood glucose, 2hPG)、总胆固醇(total cholesterol, TC)、三酰甘油(triglycerides, TG)、低密度脂蛋白(low-density lipoprotein C, LDL-C)、高密度脂蛋白(high-density lipoprotein C, HDL-C)、血钙(calcium, Ca)、血磷(phosphorus, P)采用SIEMENS ADVIA 2400全自动生化分析仪检测,试剂由西门子医学诊断产品(上海)有限公司提供。血浆肾素活性(plasma rema activity, PRA)、血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)、醛固酮(aldosterone, ALD)采用增强化学发光法测定,试剂盒由广东虹业抗体科技有限公司提供。
糖化血红蛋白(haemoglobin A1c, HbAlc)采用离子交换高效液相色谱法,D-10糖化血红蛋白A1c随机专用试剂盒(美国伯乐公司BIO-RAD D10TM);25-羟基维生素D(25-(OH)D)采用液相色谱-串联质谱法,25-羟基维生素D检测试剂盒(上海复星长征医学科学有限公司),API4000串联质谱仪(美国应用生物系统公司)。
1.2.4 颈动脉超声检查采用 ACUSON 128XP型彩色多普勒显像仪,探头频率为8~10MHz,检查左右颈总、颈内外动脉,记录IMT及斑块形成情况,颈动脉IMT增厚的判定标准是1.0mm≤IMT≤1.2mm,斑块判定标准为IMT局部增厚>1.2mm,局限性回声不均,其中IMT增厚和(或)斑块形成均可诊断为AS。超声检查均由指定的2名高年资主治医师完成。
1.3 统计学处理
数据采用SPSS 18.0进行处理,计数资料以例数或百分比表示,比较采用χ2检验,计量资料以![]() 表示,比较采用方差分析或t检验,25(OH)D与RAAS的关系采用Pearson检验,AS的危险因素分析采用logistic回归分析。P<0.05为差异有统计学意义。
表示,比较采用方差分析或t检验,25(OH)D与RAAS的关系采用Pearson检验,AS的危险因素分析采用logistic回归分析。P<0.05为差异有统计学意义。
2.1 各组患者的基本资料、糖代谢与25(OH)D指标的比较
与对照组比较,T2DM+AS组、单纯T2DM组BMI、血脂相关指标、Ca、P等差异均有统计学意义(P<0.05);与单纯T2DM组比较,T2DM+AS组年龄明显增大,HDL-C明显降低,差异有统计学意义(P<0.05)。其余指标两组之间比较差异均无统计学意义(P>0.05),见表1。
与对照组比较,T2DM+AS组、单纯T2DM组血糖相关指标、PRA、AngⅡ、ALD、25(OH)D差异均有统计学意义(P<0.05);与单纯T2DM组比较,T2DM+AS组FBG、HbAlc、PRA、AngⅡ、ALD明显升高,25(OH)D明显降低,差异有统计学意义(P<0.05),其余指标两组之间比较差异均无统计学意义(P>0.05),见表2。Pearson线性相关分析显示,25(OH)D与PRA、AngⅡ、ALD均呈明显负相关,相关系数r分别为-0.611、-0.591、-0.639(均P< 0.05)。
表1 各组患者的基本资料比较
Tab.1 Comparison of basic data among three groups
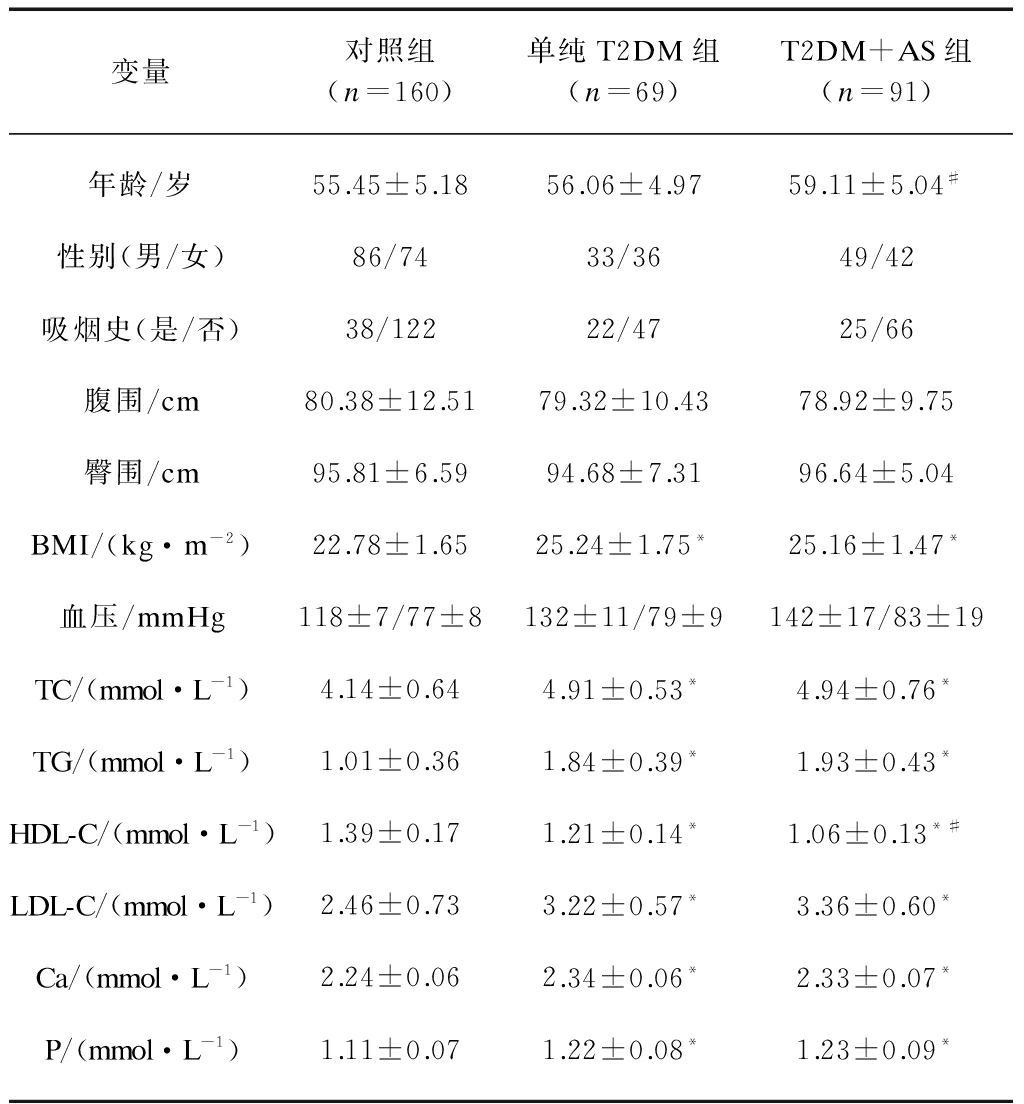
变量对照组(n=160)单纯T2DM组(n=69)T2DM+AS组(n=91)年龄/岁55.45±5.1856.06±4.9759.11±5.04#性别(男/女)86/7433/3649/42吸烟史(是/否)38/12222/4725/66腹围/cm80.38±12.5179.32±10.4378.92±9.75臀围/cm95.81±6.5994.68±7.3196.64±5.04BMI/(kg·m-2)22.78±1.6525.24±1.75*25.16±1.47*血压/mmHg118±7/77±8132±11/79±9142±17/83±19TC/(mmol·L-1)4.14±0.644.91±0.53*4.94±0.76*TG/(mmol·L-1)1.01±0.361.84±0.39*1.93±0.43*HDL-C/(mmol·L-1)1.39±0.171.21±0.14*1.06±0.13*#LDL-C/(mmol·L-1)2.46±0.733.22±0.57*3.36±0.60*Ca/(mmol·L-1)2.24±0.062.34±0.06*2.33±0.07*P/(mmol·L-1)1.11±0.071.22±0.08*1.23±0.09*
与对照组比较,*P<0.05;与T2DM组比较,#P<0.05
1mmHg=0.133kPa
表2 各组患者糖代谢与RASS和25(OH)D指标比较
Tab.2 Comparison of glycometabolism with RASS and 25(OH)D among three groups

变量对照组(n=160)单纯T2DM组(n=69)T2DM+AS组(n=91)FBG/(mmol·L-1)4.85±1.518.05±1.12*8.69±1.03*#2hPG/(mmol·L-1)8.87±3.1812.94±4.39*13.29±4.16*HbAlc/%5.03±2.407.02±2.34*7.79±2.03*#PRA/(ng·L-1)110.03±10.32123.04±12.20*138.04±11.14*#AngⅡ/(ng·L-1)67.04±8.7484.28±10.18*114.12±10.65*#ALD/(ng·L-1)103.28±8.32125.46±15.70*141.63±15.43*#25(OH)D26.22±5.7119.22±3.54*14.35±3.96*#
与对照组比较,*P<0.05;与T2DM组比较,#P<0.05
2.2 T2DM并发AS危险因素的多因素Logistic回归分析
以是否并发AS为因变量,将年龄、FBG、HbAlc、HDL-C、PRA、AngⅡ、ALD、25(OH)D 7个因素为自变量,引入多因素非条件logistic回归分析,结果显示,年龄、HbAlc、PRA是T2DM患者AS发病的危险因素,HDL-C、25(OH)D则是保护因素(P<0.05),见表3。
表3 T2DM患者AS发病危险因素的多因素logistic回归分析
Tab.3 Multivariate logistic analysis of risk factors of AS in T2DM patients
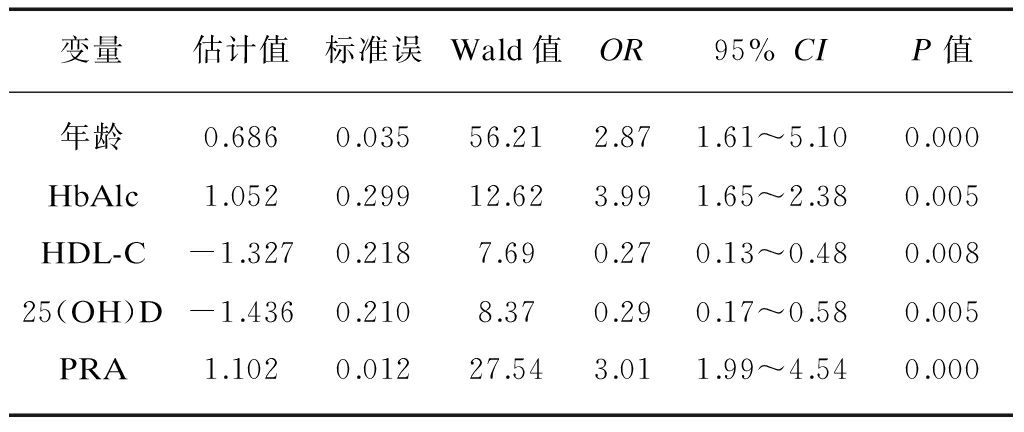
变量估计值标准误Wald值OR95%CIP值年龄0.6860.03556.212.871.61~5.100.000HbAlc1.0520.29912.623.991.65~2.380.005HDL-C-1.3270.2187.690.270.13~0.480.00825(OH)D-1.4360.2108.370.290.17~0.580.005PRA1.1020.01227.543.011.99~4.540.000
T2DM合并动脉硬化包括随年龄增长动脉僵硬度增加的生理性血管老化,以及在心血管危险因素的作用下加速血管硬化的病理性血管老化,后者可通过早期干预得到有效缓解甚至逆转。研究表明,25(OH)D对胰岛β细胞具有一定保护作用,有助于维持胰岛素的正常分泌,同时可缓解炎性反应,减少动脉内皮损伤,降低心血管疾病风险[6]。
本研究显示,T2DM患者25(OH)D水平显著低于健康人群,此外,T2DM合并动脉硬化患者25(OH)D亦明显低于单纯T2DM患者,该结论独立于公认的心血管疾病危险因素如年龄、吸烟、血糖和血脂相关指标等之外,与相关研究[7]的结果一致。Dong等[8]研究显示,与400IU/d维生素D的摄入量人群比较,2000IU维生素D人群C-FPWV明显降低(P<0.05),说明低水平的 25(OH)D 具有潜在增加大动脉硬化的作用。另有多项研究[9-10]发现,维生素D不足、补充维生素D与心血管疾病的转归密切相关,进一步提示维生素D可能在T2DM血管损害中发挥着重要作用,但其具体作用机制尚不清楚。RAAS由PRA、Ang、ALD等组成,通过控制外周阻力和血容量,调节血压、电解质间的平衡状态,从而保持内环境的稳定,其对糖尿病肾病、糖尿病视网膜病变的作用已有相关报道[11-12]。本研究分析发现,T2DM+AS组PRA、AngⅡ、ALD较单纯T2DM组明显升高(P<0.05),且均与25(OH)D表现为负相关。多因素分析显示,在控制了年龄、血糖及血脂等干扰因素后,发现PRA是T2DM患者AS发病的危险因素,25(OH)D则是保护因素(P<0.05),说明25(OH)D、RAAS均可作为T2DM患者AS的有效预测和评价指标,推测其可能的机制是维生素D通过下调RAAS活性,抑制炎症介导的AS,当维生素D缺乏时,该作用机制减弱导致AS的发生。动物实验研究[13]发现,缺乏维生素D受体(VDR)的小鼠,随着主动脉黏附因子和炎性因子的升高,肾素水平显著上调,表明缺乏VDR的表达会提升RAAS的活性。
综上所述,T2DM患者中普遍存在血浆 25(OH)D 水平降低,RAAS水平升高,推测25(OH)D 缺乏可能通过对RAAS的负向调控影响AS的发生。因此,临床上适当补充维生素D,通过抑制RAAS活性,对于预防和治疗T2DM患者大血管病变具有重要的临床意义和推广价值。
【参考文献】
[1] 张一峰,陈苏宁.2型糖尿病患者颈动脉病变的超声研究[J].同济大学学报: 医学版,2011,32(2): 66-68.
[2] 杨东伟,刘新叶,许富英,等.颈动脉内-中膜厚度与冠状动脉病变严重程度相关性研究[J].临床和实验医学杂志,2013,12(10): 745-746.
[3] Deleskoga A, Piksasovab O, Silveira A, et al. Serum 25-hydroxyvitamin D concentration, established and emerging cardiovascular risk factors and risk of myocardial infarction before the age of 60 years[J]. Atherosclerosis, 2013,223(1): 223-229.
[4] Wilkinson-Berka JL, Rana I, Armani R, et al. Reactive oxygen species, Nox and angiotensin Ⅱ in angiogenesis: implications for retinopathy[J]. Clin Sci(Lond), 2013,124(10): 597-615.
[5] Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus. provisional report of a WHO consultation[J]. Diabe Med, 1998,15(7): 539-553.
[6] 马金媛,郑世良,岳萍,等.老年2型糖尿病患者血清中25-羟维生素D水平与胰岛β细胞功能的关系[J].现代生物医学进展,2015,15(21): 4091-4093.
[7] Gunderson EP, Chiang V, Pletcher MJ, et al. History of gestational diabetes mellitus and future risk of atherosclerosis in mid-life: the Coronary Artery Risk Development in Young Adults study[J]. J Am Heart Assoc, 2014,3(2): e000490.
[8] Dong Y, Stallmann-Jorgensen IS, Pollock NK, et al. A 16-week randomized clinical trial of 2000 interna-tional units daily vitamin D3 supplementation in black youth: 25-hydroxyvitamin D, adiposity, and arterial stiffness[J]. J Clin Endocrinol Metab, 2010,95(7): 4584-4591.
[9] Wang L, Manson JE, Song Y, et al. Systematic review: vitamin D and calcium supplementation in prevention of cardiovascular events[J]. Ann Intern Med, 2010,152(8): 315-323.
[10] Dobnig H, Pilz S, Scharnagl H, et al. Independent association of low serum 25-hydroxyvitamin D and 1, 25-dihydroxyvitamin D levels with all-cause and cardio-vascular mortality[J]. Arch Intern Med, 2008,168(11): 1340-1349.
[11] 曹丹,郝丽荣.糖尿病肾病与肾素-血管紧张素-醛固酮系统的关系[J].医学综述,2012,18(9): 1386-1388.
[12] Fernández-Juárez G, Lu o J, Barrio V, et al. 25(OH) vitamin D levels and renal disease progression in patients with type 2 diabetic nephropathy and blockade of the renin-angiotensin system[J]. Clin J Am Soc Nephrol, 2013,8(11): 1870-1876.
o J, Barrio V, et al. 25(OH) vitamin D levels and renal disease progression in patients with type 2 diabetic nephropathy and blockade of the renin-angiotensin system[J]. Clin J Am Soc Nephrol, 2013,8(11): 1870-1876.
[13] Szeto FL, Reardon CA, Yoon D, et al. Vitamin Dreceptor signaling inhibits atherosclerosis in mice[J]. Mol Endocrinol, 2012,26(6): 1091-1101.
Association of plasma 25-hydroxy vitamin D with atherosclerosis in type 2 diabetic patients
【Abstract】Objective To investigate the association of plasma 25-hydroxyvitamin D and renin-angiotensin-aldosterone system(RAAS) with atherosclerosis(AS) in type 2 diabetes mellitus(T2DM). Methods Clinical data of 160 diabetic patients were retrospectively analyzed, including 69 cases of simplex T2DM and 91 cases of T2DM+AS; and 160 healthy subjects were included as control group. The plasma 25(OH) D levels and RAAS were detected in both groups, and risk factors of AS was analyzed by multivariate logistic analysis. Results There were significantly differences in blood glucose and lipid-related indicators, BMI, PRA, AngⅡ, ALD, 25(OH)D between T2DM group and control group(P<0.05). Compared with simplex T2DM group, the age was higher, the levels of FBG, HbAlc, PRA, AngⅡ, ALD in T2DM + AS group were increased, the levels of HDL-C and 25(OH)D were reduced(P<0.05). Plasma 25(OH)D was negatively correlated with PRA, AngⅡ, ALD(r=-0.611, -0.591, -0.639, P<0.05). Multivariate logistic regression analysis showed that HDL-C, 25(OH)D were protective factors, and age, HbAlc, PRA were risk factors for AS(P<0.05). Conclusion Plasma 25(OH)D level is decreased and RAAS is up-regulated in T2DM patients, and the deficit of 25(OH)D may promote pathogenesis of AS through negative regulation of RAAS.
【Key words】type 2 diabetes mellitus; atherosclerosis; 25-hydroxyvitamin D; renin-angiotensin-aldosterone system
doi:10.16118/j.1008-0392.2016.05.014
收稿日期:2016-02-18
基金项目:上海市卫生和计划生育委员会项目(20124276)
【中图分类号】R 781.6+4
【文献标志码】A
【文章编号】1008-0392(2016)05-0067-04