·基础研究·
【摘要】目的 探讨慢性低灌注时,水通道蛋白-4(aquaporin-4, AQP4)的表达与构型变化在血脑屏障(blood-brain barrier, BBB)通透性增高中的作用。方法 Wistar大鼠采用双侧颈总动脉结扎术(2-vessel occlusion, 2VO)建立慢性低灌注模型,测定2VO术后不同时间点脑组织伊文思蓝(evans blue, EB)含量,评价BBB通透性,RT-PCR和Western印迹法测定不同时间点AQP4 mRNA及蛋白水平表达,免疫荧光双标法观察AQP4的构型变化。结果 2VO术后早期,BBB通透性迅速升高,AQP4 mRNA和蛋白表达水平与BBB通透性变化趋势一致,均在术后3d时达到高峰,1、2周时仍显著升高(P<0.01),随着慢性缺血时间的延长,无论是BBB通透性还是AQP4 mRNA和蛋白表达水平均逐渐降低,至3个月时与假手术组相比,差异无统计学意义。而AQP4的功能构型OAPs与BBB通透性变化趋势呈负相关,2VO术后早期AQP4与GFAP共定位明显减少,随后逐渐增多,术后3个月时恢复至正常水平。结论 慢性低灌注状态可引起BBB通透性升高,AQP4的表达与构型改变与BBB通透性密切相关。
【关键词】慢性低灌注; 血脑屏障; 水通道蛋白-4; 大鼠
血脑屏障(blood-brain barrier, BBB)是维持中枢神经系统内环境稳定的基础,由内皮细胞,星形胶质细胞足突,基膜及其间的紧密连接组成,其结构的完整与功能的维持有赖于内皮细胞及星形胶质细胞表面水通道蛋白-4(aquaporin-4, AQP4)的表达及其活性形式OAPs(orthogonal arrays of particles)的形成[1-2]。目前,关于AQP4的研究主要集中在缺血再灌注损伤或胶质细胞瘤等方面,而慢性低灌注时AQP4是否参与了BBB的损伤、作用机制如何尚未见相关报道。本研究拟通过观察双侧颈总动脉结扎(2-vessel occlusion, 2VO)大鼠BBB通透性改变情况及其与AQP4表达、构型变化之间的关系,探讨AQP4在慢性低灌注时BBB损伤中的作用及其机制。
1.1 实验动物与分组
健康成年雄性Wistar大鼠,体质量220~250g,由上海斯莱克实验动物中心提供。120只Wistar大鼠随机分为假手术组和实验组,每组按不同时间点分为低灌注后3d,1、2周,1、3个月5个亚组,行2VO术建立慢性低灌注模型。实验组动物先结扎一侧颈总动脉,1周后结扎另一侧。假手术组只分离颈总动脉不结扎。分别于术后3d,1、2周,1、3个月取材,测定脑组织伊文思蓝(evans blue, EB)含量、AQP4 mRNA和蛋白表达水平及OAPs聚合情况。
1.2 仪器与设备
小鼠抗AQP4抗体购自英国Abcam公司;加辣根过氧化物酶标记的山羊抗兔Alexa Fluor 488二抗和Alexa Fluor 594山羊抗小鼠抗体购自美国Santa Cruz公司;兔抗GFAP抗体购自丹麦Dako公司;小鼠抗tubulin抗体购自美国Sigma公司;Quantity One软件购自美国Bio-Rad公司。
1.3 脑内EB含量测定评价BBB通透性
Wistar大鼠尾静脉注射2% EB,4ml/kg,在体循环2h后,腹腔注射戊巴比妥钠60mg/kg麻醉,经左心房灌注0.9%氯化钠溶液,直至左心耳流出的液体清亮,断头取脑称重。置入1ml的50%三氯乙酸溶液中,匀浆,离心半径13.5cm,10000r/min,离心20min。取上清液,用无水乙醇以1∶3的比例稀释后用酶标仪测浓度。绘制标准曲线,计算出大鼠脑内EB含量。
1.4 RT-PCR测定AQP4mRNA表达
Wistar大鼠戊巴比妥钠60mg/kg腹腔麻醉后,迅速断头取脑液氮保存。TRI法提取组织总RNA,反转录获取cDNA, cDNA作为分析AQP4表达的RT-PCR反应模板。引物设计由Primer 5.0引物设计软件完成,tubulin作为内参。引物序列如下。AQP4上游引物: 5′-TTGCTTTGGACTCAGCA-TTG-3′,下游引物: 5′-GGGAGGTGTGACCA-GGTAGA-3′。Tubulin上游引物: 5′-TGAGGCC-TCCTCTCACAAGT-3′,下游引物: 5′-CGCACG-ACATCTAGGACTGA-3′。引物由上海BioSune公司合成。SYBR Green荧光染料嵌合法,使用Bio-Rad CFX96 PCR扩增仪进行实时定量PCR反应。25μl 体系反应条件如下。预变性: 95℃ 5min,变性: 95℃ 20s,退火: 60℃ 20s,延伸: 72℃ 1min。共40个循环,扩增完毕进行溶解曲线分析,读取CT值,采用2-ΔΔCt法进行数据分析,用2-ΔΔCt表示其相对表达量。
1.5 Western印迹法观察AQP4蛋白表达
Wistar大鼠腹腔注射戊巴比妥钠60mg/kg麻醉后,迅速断头取脑液氮保存。取少量组织块加入组织裂解液(RIPA裂解液,1%蛋白酶抑制剂,1%磷酸酶抑制剂)匀浆,4℃,离心半径13.5cm,12000r/min,离心5min,抽提总蛋白。BCA法测定样本的蛋白浓度。根据测得的蛋白浓度用上样缓冲液调整样品蛋白至相同浓度。95℃金属浴10min,取蛋白样品30μg 加入10% SDS-聚丙烯酰胺凝胶,150V 恒压电泳,半干转法转至硝酸纤维膜上。10%脱脂牛奶封闭2h后洗膜,加小鼠抗AQP4抗体(1∶1000)4℃ 孵育过夜。TBST(Tris-HCl吐温缓冲液)漂洗,加辣根过氧化物酶标记的山羊抗兔二抗(1∶3000),室温孵育2h,TBST漂洗。LAS4000系统显影检测反应条带。其反应条带通过Quantity One软件进行定量分析。
1.6 免疫荧光双标观察OAPs构型
Wistar大鼠腹腔注射戊巴比妥钠60mg/kg麻醉后,经左心房灌注0.9%氯化钠溶液,直至左心耳流出的液体清亮为止,40%多聚甲醛溶液灌注直至大鼠全身抽搐,尾巴僵硬为止。断头取脑,置于40%多聚甲醛溶液中固定12h,分别移至10%、20%、30%蔗糖溶液中梯度脱水。冰冻冠状切片,片厚8μm,PBS溶液漂洗3次,加入抗原修复液,96℃修复10min,室温自然冷却,用免疫染色封闭液室温孵育后加入小鼠抗AQP4抗体(1∶100)和兔抗GFAP抗体(1∶200)孵育,4℃过夜。室温复温后,PBS溶液漂洗3次,加入荧光二抗(Alexa Fluor 488山羊抗兔和Alexa Fluor 594山羊抗小鼠抗体,1∶200),避光条件下,室温孵育2h。PBS溶液漂洗3次后滴加DAPI染液复染细胞核,避光孵育10min后PBS漂洗3次,双蒸水漂洗2次,用防猝灭封片剂封片,在激光共聚焦显微镜下拍片。
1.7 统计学处理
应用SPSS 20.0统计学软件。组间资料比较采用单因素方差分析,两组间的定量资料采用t检验。P<0.05为差异有统计学意义。
2.1 慢性低灌注不同时间点脑组织EB含量
渗出BBB的EB含量在2VO术后快速升高,术后3d达到高峰,术后1、2周仍显著高于假手术组(P<0.01),术后1个月仍高于假手术组(P<0.05)。2VO术后3个月EB含量与假手术相比,差异无统计学意义,见图1。

图1 2VO术后不同时间点脑组织EB含量
Fig.1 Effect of CCH on EB extravasations
1: 假手术组;2: 2VO术后3d组;3: 2VO术后1周组;4: 2VO 术后2周组;5: 2VO术后1个月组;6: 2VO术后3个月组;与假手术组比较,*P<0.05,**P<0.01
2.2 慢性低灌注不同时间点AQP4 mRNA表达
2VO术后,AQP4 mRNA表达快速升高,3d达到顶峰。与假手术组相比,术后3d,1、2周,AQP4 mRNA差异有统计学意义(P<0.01)。术后1、3个月,AQP4 mRNA表达较3d,1、2周有所下降,与假手术组相比,差异无统计学意义,见图2。

图2 2VO术后不同时间点各组AQP4 mRNA相对表达量
Fig.2 Quantification of AQP4 mRNA expression after 2VO
1: 假手术组;2: 2VO术后3d组;3: 2VO术后1周组;4: 2VO术后2周组;5: 2VO术后1个月组;6: 2VO术后3个月组;与假手术组比较,**P<0.01
2.3 慢性低灌注不同时间点AQP4蛋白表达
AQP4蛋白表达在2VO术后快速升高,3d达到顶峰,术后3d组、1周组与假手术组相比,差异有统计学意义(P<0.01),术后2周,AQP4蛋白表达仍有升高,与假手术组相比有统计学差异(P<0.05),术后1、3个月,AQP4蛋白表达与假手术组无明显差异,见图3。
2.4 慢性低灌注不同时间点OAPs形成情况
与假手术组相比,各组微血管周围的GFAP染色无明显差异,微血管周围AQP4的表达在术后 3d、1周表达较强,明显高于假手术组;术后2周、1个月,AQP4荧光信号开始出现不连续;术后3个月,AQP4荧光信号渐恢复,与假手术组相比,差异无统计学意义。2VO术后3d、1周,GFAP和AQP4共定位与假手术组相比明显减少;术后2周、1个月,GFAP和AQP4共定位与术后3d、1周相比有所增加,但较假手术组仍有减少;术后3个月,共定位情况与假手术组相比,差异无统计学意义,见图4。
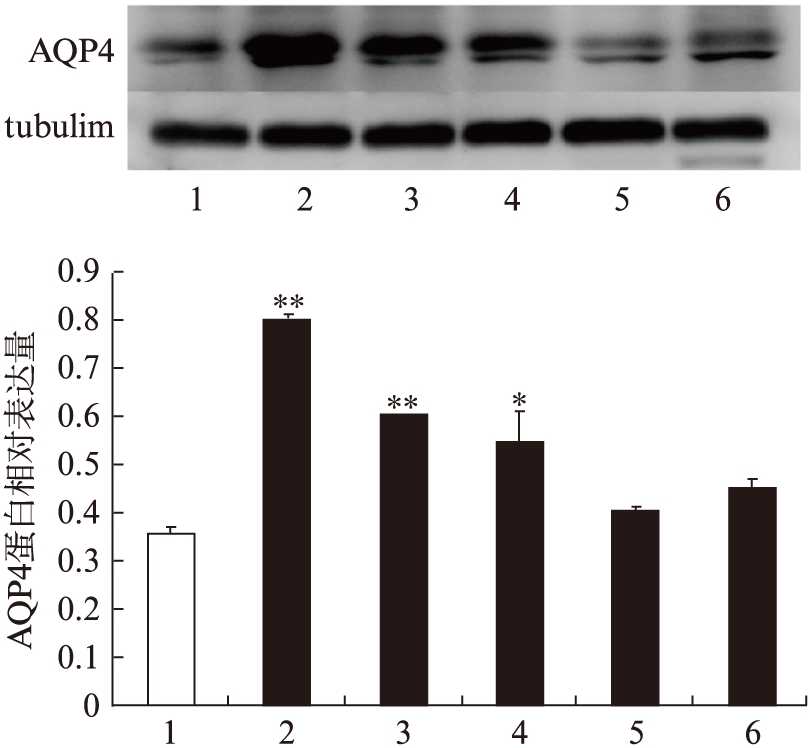
图3 2VO术后不同时间点各组AQP4蛋白相对表达量
Fig.3 Quantification of AQP4 protein expression after 2VO
1: 假手术组;2: 2VO术后3d组;3: 2VO术后1周组;4: 2VO术后2周组;5: 2VO术后1个月组;6: 2VO术后3个月组;与假手术组比较,*P<0.05,**P<0.01
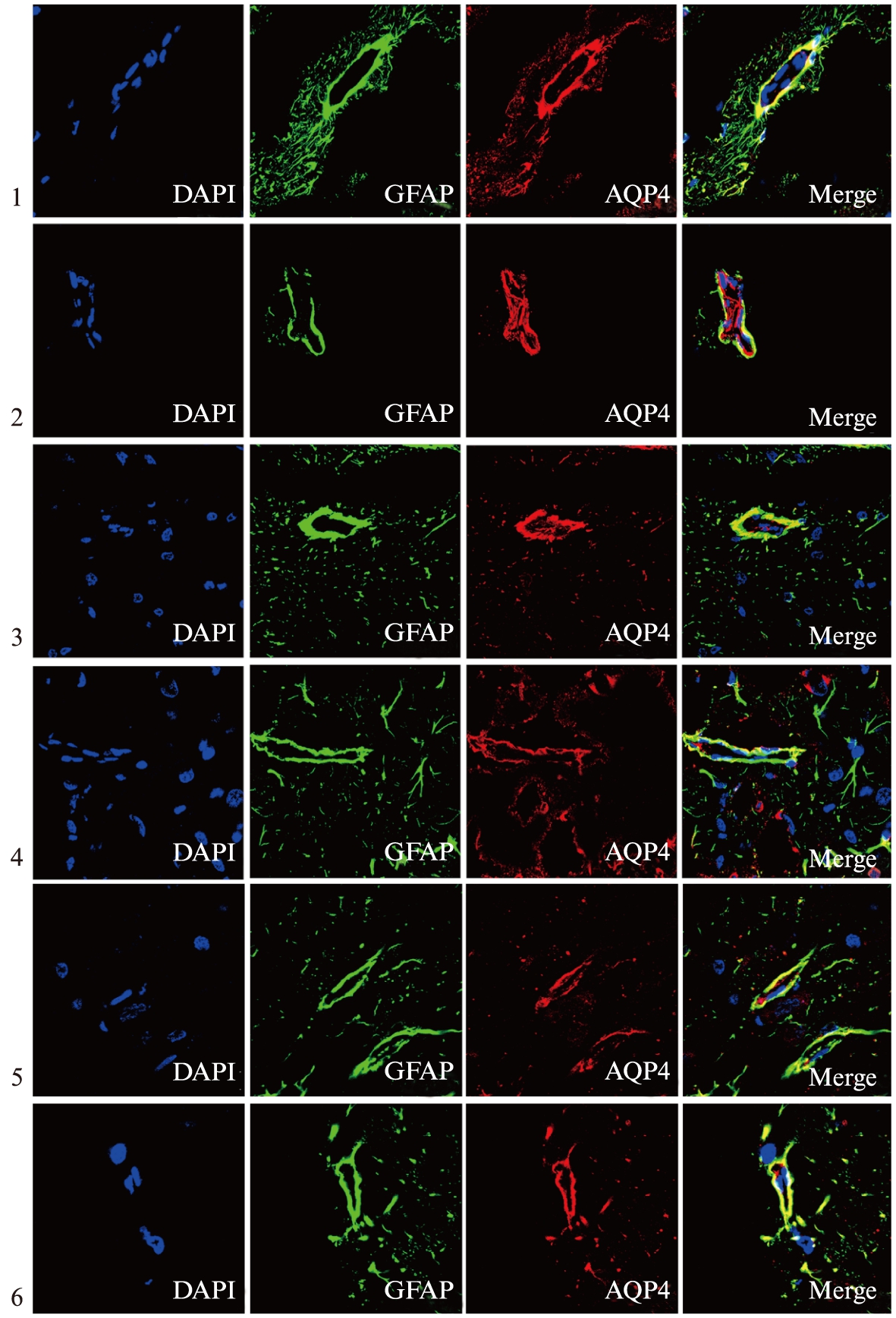
图4 2VO术后不同时间点各组GFAP和AQP4共定位情况
Fig.4 Immunofluorescence co-localization for GFAP and AQP4 in the brain after 2VO(×400)
1: 假手术组;2: 2VO术后3d组;3: 2VO术后1周组;4: 2VO术后2周组;5: 2VO术后1个月组;6: 2VO术后3个月组
慢性低灌注通常是指由动脉狭窄所致的脑组织血供长期低于生理阈值而出现慢性缺血性神经系统功能损害的病理状态,可能与脑白质疏松,血管性痴呆,短暂性脑缺血发作及动脉硬化性脑梗死等发病有关[3-6]。慢性低灌注状态可引起BBB通透性增高,BBB具有阻止有害物质进入脑内和将营养物质从外周血液转运至脑内的双重作用,其在控制血液和脑实质间的物质交换,稳定大脑微环境方面发挥了关键作用。传统观点认为导致BBB通透性升高的原因是其两侧静水压和渗透压平衡紊乱,随着分子生物学和蛋白质组学的发展,研究者们发现AQP4也参与调节BBB的发育与成熟,其表达水平的高低与BBB完整性密切相关[7-9]。
AQP4是一种对水分子有高度选择性的跨膜转运蛋白,在脑内分布广泛,主要存在于脑实质内的胶质细胞,微血管内皮细胞,室管膜上皮细胞及脉络丛上皮细胞,参与BBB对水分的转运以及脑脊液的分泌与吸收的调节,作为渗透压感受器参与全身代谢,另外在功能上也参与调节细胞外K+、水的代谢[10-12]。AQP4的功能状态是由4个亚基以非共价键连接形成的四聚体OAPs(orthogonal arrays of particles),称为颗粒的直角排列,正是由于星形胶质细胞膜表面OAPs的存在,使得星形胶质细胞有了极性,从而维持BBB的完整性[13]。
目前,评价BBB通透性的经典方法是对渗出至脑组织的EB含量做定量分析。EB是一种偶氮基荧光染料,易与血清蛋白结合,正常生理情况下,血管内的EB不能透过BBB进入脑组织,但在BBB受损时,部分EB就可以通过BBB的内皮细胞及胶质细胞足突等结构渗入脑组织,可以通过计算渗出血管外的EB含量来评价BBB的通透性。本研究结果显示,大鼠慢性低灌注后BBB通透性迅速升高,术后3d即达到最高峰,1、2周时仍有明显损伤,随后渐渐缓解,至3个月后BBB通透性恢复至正常。目前,有多项研究[14-17]表明,慢性低灌注可引起明显的BBB损伤,尤其在大鼠双侧颈总动脉结扎模型中,BBB通透性升高多出现在缺血早期即2周内,与本研究结果一致。在BBB中,内皮细胞和胶质细胞都表达AQP4,其中星形胶质细胞是AQP4的高表达细胞。本研究结果显示,AQP4的mRNA和蛋白表达水平变化趋势与BBB损伤变化呈正相关,在2VO术后早期即术后3d,1、2周急剧升高,随着慢性低灌注时间的延长,其表达逐渐减少,至术后3个月时BBB通透性,AQP4表达均恢复至正常水平。该结果表明AQP4表达水平的高低与BBB通透性密切相关。
AQP4的功能状态是其四聚体形式OAPs,这种特殊构型是维持BBB的稳定和功能正常所必需的。Wolberg等[18]发现,胶质细胞瘤患者BBB通透性显著升高,而其主要原因就是OAPs的减少。OAPs的正确形成与AQP4的数目及其在细胞膜上的位置排列密切相关。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP),是一种中间纤维蛋白,可特异性识别星形胶质细胞,GFAP和AQP4免疫荧光双标法观察二者共定位的荧光信号强度和连续性可以反映OAPs的形成情况。结果显示,在慢性低灌注早期,形成的OAPs明显减少,而后逐渐增多,至3个月时恢复至正常水平,OAPs的减少与BBB通透性升高的时间一致,表明除了AQP4表达多少与BBB通透性相关,AQP4是否能够定向锚定在星形胶质细胞伪足膜上也与BBB功能的维持密切相关。推测慢性脑缺血状态引起AQP4表达改变从而影响其在星形胶质细胞伪足膜表面的锚定,使其不能正确形成其功能结构OAPs,破坏了BBB的结构和功能的完整性。
目前,关于AQP4的研究多集中在急性缺血再灌注或胶质细胞瘤等病理状态下其在脑水肿形成和发展中的作用,而本研究显示慢性低灌注状态可引起BBB通透性增高,AQP4表达水平升高,其功能结构OAPs表达减少。表明AQP4不仅参与了脑组织中水分子的转运与调节,在一定病理条件下其表达水平和构型也与BBB完整性密切相关。至于AQP4使BBB通透性升高的具体分子机制则有待进一步的研究。BBB的完整性受损可引起大分子的渗漏,而大分子如免疫球蛋白和蛋白酶的外渗则可能是其他许多慢性脑缺血相关疾病如白质疏松的启动因素,期望本研究的结论能够为临床上与慢性低灌注相关的脑血管病及认知功能障碍等疾病的防治提供新的研究思路。
【参考文献】
[1] Li S, Hu X, Zhang M, et al. Remote ischemic post-conditioning improves neurological function by AQP4 down-regulation in astrocytes[J]. Behav Brain Res, 2015,289: 1-8.
[2] Jin BJ, Rossi A, Verkman AS. Model of aquaporin-4 supramolecular assembly in orthogonal arrays based on heterotetrameric association of M1-M23 isoforms [J]. Biophys J, 2011,100: 2936-2945.
[3] Narantuya D, Nagai A, Sheikh AM, et al. Microglia transplantation attenuates white matter injury in rat chronic ischemia model via matrix metalloproteinase-2 inhibition[J]. Brain Res, 2010, 1316: 145-152.
[4] Kwon KJ, Lee EJ, Kim MK, et al. Diabetes augments cognitive dysfunction in chronic cerebral hypoperfusion by increasing neuronal cell death: implication of cilostazol for diabetes mellitus-induced dementia[J]. Neurobiol Dis, 2015,73: 12-23.
[5] Hotter B, Ostwaldt AC, Levichev-Connolly A, et al. Natural course of total mismatch and predictors for tissue infarction[J]. Neurology, 2015,85(9): 770-775.
[6] Safouris A, Hambye AS, Sculier C, et al. Chronic brain hypoperfusion due to multi-vessel extracranial atherosclerotic disease: a potentially reversible cause of cognitive impairment[J]. J Alzheimers Dis, 2015,43(1): 23-27.
[7] Stavale LM, Soares ES, Mendonça MC, et al. Temporal relationship between aquaporin-4 and glial fibrillary acidic protein in cerebellum of neonate and adult rats administered a BBB disrupting spider venom[J]. Toxicon, 2013,66: 37-46.
[8] Wang X, Kang K, Wang S, et al. Focal cerebral ischemic tolerance and change in blood-brain barrier permeability after repetitive pure oxygen exposure preconditioning in a rodent model[J]. J Neurosurg, 2016,29: 1-10.
[9] Ji FT, Liang JJ, Miao LP, et al. Propofol post-conditioning protects the blood brain barrier by decreasing matrix metalloproteinase-9 and aquaporin-4 expression and improves the neurobehavioral outcome in a rat model of focal cerebral ischemia-reperfusion injury[J]. Mol Med Rep, 2015,12: 2049-2055.
[10] Saadoun S, Papadopoulos MC, Watanabe H, et al. Involvement of aquaporin-4 in astroglial cell migration and glial scar formation[J]. J Cell Sci, 2005,118: 5691-5698.
[11] Assentoft M, Larsen BR, MacAulay N. Regulation and function of AQP4 in the central nervous system[J]. Neurochem Res, 2015,40(12): 2615-2627.
[12] Yasui M. Roles of Aquaporins in Brain Disorders[J]. Brain Nerve, 2015,67(6): 733-738.
[13] Lu H, Lei XY, Hu H, et al. Relationship between AQP4 expression and structural damage to the blood-brain barrier at early stages of traumatic brain injury in rats[J]. Chin Med J (Engl), 2013,126(22): 4316-4321.
[14] Wang J, Fu X, Yu L, et al. Preconditioning with VEGF enhances angiogenic and neuroprotective effects of bone marrow mononuclear cell transplantation in a rat model of chronic cerebral hypoperfusion[J]. Mol Neurobiol, 2015.[Epub ahead of print].
[15] Choi JY, Cui Y, Kim BG. Interaction between hypertension and cerebral hypoperfusion in the development of cognitive dysfunction and white matter pathology in rats [J]. Neuroscience, 2015,303: 115-125.
[16] Yang Y, Rosenberg GA. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease [J]. Stroke, 2011,42(11): 3323-3328.
[17] Ueno M, Chiba Y, Murakami R, et al. Blood-brain barrier and blood-cerebrospinal fluid barrier in normal and pathological conditions[J]. Brain Tumor Pathol, 2016,33(2): 89-96.
[18] Wolburg H, Noell S, Fallier-Becker P, et al. The disturbed blood-brain barrier in human glioblastoma[J]. Mol Aspects Med, 2012,33: 579-589.
Effect of aquaporin- 4 on increased blood-brain barrier permeability during chronic hypoperfusion in rats
【Abstract】Objective To investigate the effect of the expression and configuration of aquaporin-4 (AQP4) on permeability increasing of blood-brain barrier (BBB) during chronic hypoperfusion in rats. Methods Rat models of chronic hypoperfusion were established by bilateral common carotid artery occlusion (2-vessel occlusion, 2VO). BBB permeability was verified by evans blue(EB) content, the mRNA and protein expression of AQP4 was evaluated. OAPs was assessed by visualising the distribution and expression of AQP4 on astrocyte end-feet membranes. Results At early phase of postoperation, the permeability of BBB significantly increased compared with that in sham group(P<0.01),and the changing trends of mRNA and protein expression of AQP4 were consistent with the EB concentration. They were significantly increased to reach its maximal value compared with the sham rats and then gradually decreased at 1 week, 2 weeks and 1 month after 2VO, and returned to the control levels after 3 months. Double labelling with GFAP and AQP4 demonstrated that AQP4 was correctly anchored on astrocyte end-feet membranes, and was redistributed on membranes in the 3-day, 1-week and 2-week groups, and the GFAP and AQP4 were co-localized on astrocyte end-feet membranes after 3 months. Conclusion The permeability of BBB was increased in hypoperfusion rats, the expression and configuration change of AQP4 are closely related to the BBB permeability.
【Key words】chronic cerebral hypoperfusion; blood-brain barrier; aquaporin-4; rat
doi:10.16118/j.1008-0392.2016.05.003
收稿日期:2016-03-29
基金项目:国家自然科学基金(81000492、81300771)
【中图分类号】R 743
【文献标志码】A
【文章编号】1008-0392(2016)05-0014-06