朱明飞
(上海市奉贤区中心医院急诊科,上海 201400)
【摘要】目的 观察高迁移率族蛋白B1(HMGB1),缺血修饰白蛋白(IMA),抗心磷脂抗体(ACA)和D-二聚体在慢性阻塞性肺疾病急性加重期(AECOPD)合并肺栓塞(PE)患者检测中的意义。方法 选择2013年1月至2015年6月AECOPD患者202例,根据是否合并PE将患者分为单纯AECOPD组(135例)和AECOPD合并PE组(67例)。AECOPD合并PE患者根据COPD分级分为Ⅱ级22例,Ⅲ级26例和Ⅳ级19例;根据PE严重程度分为低危组33例,中危组19例和高危组15例;根据患者的结局分为生存组48例和死亡组19例。结果 AECOPD合并PE组和单纯AECOPD组的血清HMGB-1, IMA, ACA和D-二聚体明显高于对照组(P<0.01),而AECOPD合并PE组明显高于单纯AECOPD组(P<0.01)。AECOPD合并PE患者随着COPD分级和PE危险程度的升高,机体的HMGB-1, IMA, ACA和D-二聚体水平出现明显升高(P<0.01)。治疗后AECOPD合并PE患者机体血清HMGB-1, IMA, ACA和D-二聚体水平较治疗前明显降低(P<0.01)。AECOPD合并PE患者存活组血清的HMGB-1, IMA ,ACA和D-二聚体水平明显高于死亡组(P<0.01)。结论 HMGB-1, IMA, ACA和D-二聚体参与AECOPD合并PE疾病的发生发展,联合检测对判断预后具有重要价值。
【关键词】高迁移率族蛋白B1; 缺血修饰白蛋白; 抗心磷脂抗体; 慢性阻塞性肺疾病; 肺栓塞
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者机体常常出现高凝状态,是发生肺栓塞(pulmonary embolism, PE)的独立危险因素[1]。临床上由于COPD与PE的症状较为相似,尤其COPD急性发作期(acute exacerbation COPD, AECOPD)往往与是否合并PE很难鉴别,临床正确诊断率较低。随着检测技术的应用于临床,寻找方便,可靠,具有特异性的鉴别指标成为研究的热点[2]。高迁移率族蛋白B1(high mobility group protein B1, HMGB1)是一种具有炎症递质功能的核蛋白,是炎症反应的内源性诱导剂,在AECOPD患者中血清呈高表达[3],而在AECOPD合并PE中的表达尚未见报道。缺血修饰白蛋白(ischemia-modified albumin, IMA)是诊断心肌缺血的敏感指标,由于PE患者也存在缺血,有学者运用与PE的诊断,取得了较好的效果[4],在鉴别AECOPD中是否合并PE尚不清楚。抗心磷脂抗体(anti-cardiolipin antibodie, ACA)是一种自身免疫性抗体,近年来ACA与血栓性疾病具有明显的相关性,在PE诊断中已经有了初步效果[5]。D-二聚体是一种纤维蛋白降解产物,其水平的增高反应体内凝血系统的增强,对PE的诊断具有较高的敏感性[6]。上述指标是否能够在AECOPD中鉴别出PE的报道较少,本组研究采用联合HMGB-1, IMA, ACA和D-二聚体指标检测AECOPD是否合并PE取得了较好效果,现报告如下。
1.1 临床资料
选择2013年1月至2015年6月在上海市奉贤区中心医院初诊为AECOPD的患者202例,所有的患者经肺部CT或者MRI检查,COPD分级为Ⅱ级以上。根据是否合并PE将患者分为单纯AECOPD组和AECOPD合并PE组。单纯AECOPD组为135例,男114例,女21例,年龄45~80岁,平均年龄(57.26±7.73)岁;AECOPD合并PE 67例,男57例,女10例,年龄45~80岁,平均年龄(56.97±6.72)岁,根据COPD分级分为Ⅱ级22例,Ⅲ级26例和Ⅳ级19例;根据PE严重程度分为低危组33例,中危组19例和高危组15例;根据患者在1个月内的最后结局分为生存组48例和死亡组19例。排除: 急性冠脉综合征,脑血管意外,急性心肌梗死,肠系膜缺血性疾病;心肝肾等重要脏器功能障碍和供血不足者;其他原因的继发性血栓形成。选择同期在我院健康体检者35例为对照组,其中男30例,女5例,年龄45~80岁,平均年龄(57.12±6.87)岁。三组在年龄、性别等一般资料差异无统计学意义,具有可比性。
1.2 方法
1.2.1 治疗方法 AECOPD合并PE组予以解痉,平喘,祛痰,止咳,抗凝,祛聚(肝素钙5000U皮下注射,舒血宁20ml静脉滴注)等治疗,每日1次,7d 为一疗程。
1.2.2 PE严重程度分级 根据肺栓塞严重指数评分和危险分级: 评分变量包括年龄、性别、既往史、生命体征、神智和血氧饱和度,将PE分为5级: Ⅰ级不超过65分,Ⅱ级为66~85分,Ⅲ级86~105分,Ⅳ级为106~125分,Ⅴ级不低于126分。将患者分成低危组(Ⅰ级或Ⅱ级),中危组(Ⅲ级和Ⅳ级),高危组(Ⅴ级)。
1.2.3 血液指标的检测 入院第1天各组和AECOPD合并PE患者治疗1周后抽取空腹血液 2~3ml,离心半径10cm,3000r/min,离心 20min,分离血清,并保存于-70℃的冰箱中待测。采用酶联免疫法测定HMGB-1、 IMA、 ACA和D-二聚体水平。采用Freedom Evolyzer 2150型全自动酶标仪,操作按照试剂盒(美国R&D公司)进行操作。
1.3 统计学处理
采用SPSS 15.0软件。计量资料以![]() 表示,多组间的比较采用方差分析,两两比较采用q检验,独立因素两组比较采用t检验,治疗前后的比较采用配对t检验。P<0.05为差异有统计学意义。
表示,多组间的比较采用方差分析,两两比较采用q检验,独立因素两组比较采用t检验,治疗前后的比较采用配对t检验。P<0.05为差异有统计学意义。
2.1 各组HMGB-1, IMA, ACA和D-二聚体水平的变化
AECOPD合并PE组和单纯AECOPD组的血清HMGB-1、 IMA、 ACA和D-二聚体明显高于对照组(P<0.01),而AECOPD合并PE组明显高于单纯AECOPD组(P<0.01),见表1。
2.2 不同COPD分级AECOPD合并PE患者的HMGB-1, IMA, ACA和D-二聚体水平变化
随着COPD分级的升高,AECOPD合并PE患者的HMGB-1, IMA, ACA和D-二聚体水平出现明显升高(P<0.01),见表2。
表1 各组HMGB-1, IMA, ACA和D-二聚体水平的变化
Tab.1 The levels of HMGB1, IMA, ACCA and D-dimer in different group![]()

与对照组比较,*P<0.01;与单纯AECOPD组比较,#P<0.01
表2 不同COPD分级AECOPD合并PE患者的HMGB-1, IMA, ACA和D-二聚体水平变化
Tab.2 The levels of HMGB1, IMA, ACCA and D-dimer in AECOPD patients with PE of different COPD grade![]()

与COPD Ⅱ级比较,*P<0.01;与COPD Ⅲ级比较,#P<0.01
2.3 不同PE危险程度AECOPD合并PE患者的HMGB-1, IMA, ACA和D-二聚体水平变化
随着PE危险程度的升高,AECOPD合并PE患者的血清HMGB-1, IMA, ACA和D-二聚体水平出现明显升高(P<0.01),见表3。
2.4 AECOPD合并PE患者治疗前后机体HMGB-1、 IMA、 ACA和D-二聚体水平的变化
治疗后AECOPD合并PE患者机体血清HMGB-1, IMA, ACA和D-二聚体水平较治疗前明显降低(P<0.01),见表4。
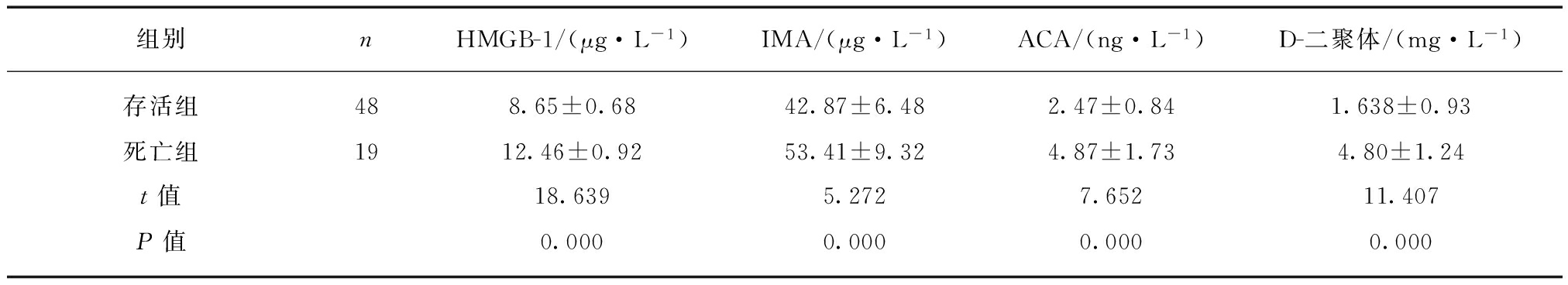
2.5 不同预后AECOPD合并PE患者血清的HMGB-1, IMA, ACA和D-二聚体水平的变化
存活组的AECOPD合并PE患者血清的HMGB-1, IMA, ACA和D-二聚体水平明显高于死亡组(P<0.01),见表5。
表3 不同PE危险程度AECOPD合并PE患者HMGB-1, IMA, ACA和D-二聚体水平变化
Tab.3 The levels of HMGB1, IMA, ACCA and D-dimer in AECOPD patients with PE of different risk degree![]()
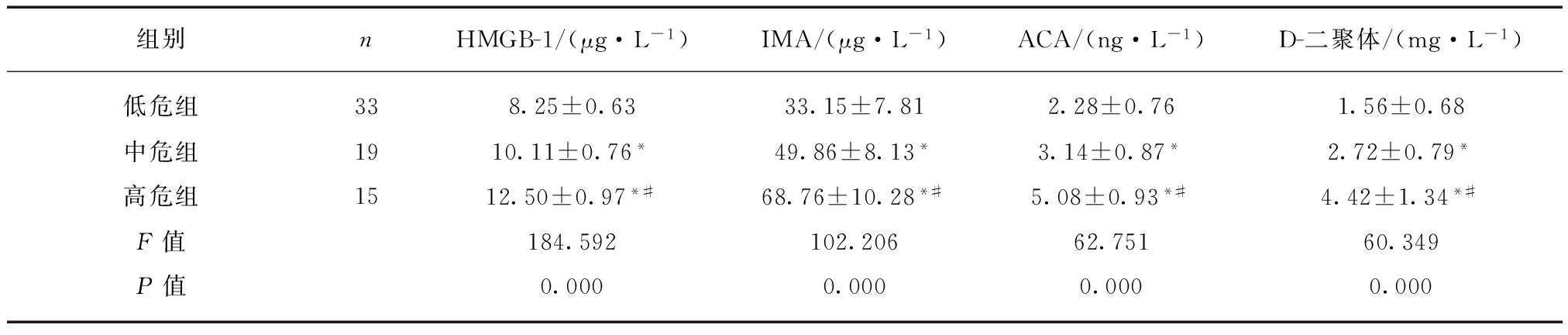
与低危组比较,*P<0.01;与中危组比较,#P<0.01
表4 AECOPD合并PE患者治疗前后机体HMGB-1, IMA, ACA和D-二聚体水平的变化
Tab.4 The levels of HMGB1, IMA, ACCA and D-dimer before and after treatment in AECOPD patients with PE![]()
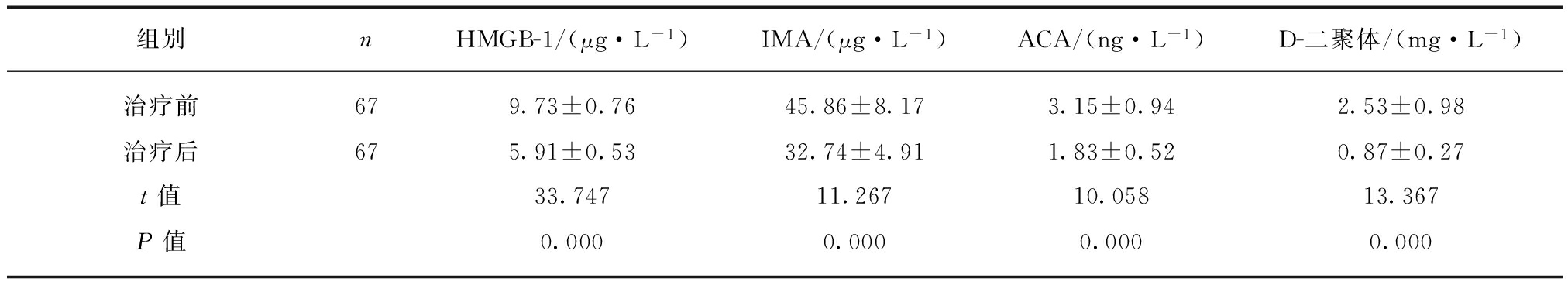
表5 不同预后AECOPD合并PE患者血清的HMGB-1, IMA, ACA和D-二聚体水平的变化
Tab.5 The levels of HMGB1, IMA, ACCA and D-dimer in survival and fetal groups in AECOPD patients with PE![]()
HMGB1是一种结合DNA的核蛋白,其主要在细胞核内发挥调节转录作用,同时作为多功能的细胞因子,主动和被动分泌到细胞外,引起炎症和免疫反应,参与炎症的病理生理过程[7]。本组研究表明AECOPD合并PE组的HMGB1水平明显高于单纯AECOPD组和对照组,并且随着COPD分级和PE严重程度升高而升高。说明AECOPD合并PE患者具有促进合成和分泌HMGB1的功能,与文献报道一致[8]。治疗后机体的HMGB1水平较治疗前明显降低,并且存活组的HMGB1水平明显低于死亡组。说明AECOPD合并PE患者由于感染和血栓等因素激活单核细胞,巨噬细胞和中性粒细胞促进细胞核内的HMGB1重新分布,释放入血,与其受体结合后,通过激活核转录因子,启动和维持参与瀑布式反应的中心分子(如IL-1β和肿瘤坏死因子等),促进炎症因子的大量释放,通过正反馈进一步分泌HMGB1增加,参与了疾病的发生发展过程[9-10]。而治疗后,由于炎症和血栓被控制,相应的细胞因子也明显降低,而机体的HMGB1水平明显降低。AECOPD合并PE患者机体HMGB1水平升高,而治疗后明显降低,其降低的具体机制尚不清楚,故抑制HMGB1可能成为治疗AECOPD合并PE的有效策略。
IMA在正常人中极微量。当机体受到损伤,如缺血在灌注损伤时,人血清白蛋白的氨基末端或者与铜离子结合,形成IMA,并且在数小时内迅速升高。本组研究表明AECOPD合并PE组机体的IMA水平明显高于AECOPD和对照组,且随着COPD分级和PE严重程度升高而升高;治疗后机体的IMA水平明显降低,而生存组明显低于死亡组,说明IMA水平与AECOPD形成PE有一定的联系,且对于预后的评估具有重要价值。AECOPD时肺部组织缺血缺氧,当合并PE后,引起肺动脉增高,引起右心负荷增加,心肌缺血缺氧和局部缺血再灌注损伤。组织局部氧自由基增加,机体的内环境出现紊乱,如酸中毒,细胞膜上各种离子能量代谢受到破坏,使白蛋白的氨基末端发生N-乙酰化,并且与金属结合能力增强,从而使机体的IMA水平明显增高[11]。IMA应用与早期诊断的指标期初运用于急性心肌缺血,2003年被美国FDA批准应用于临床诊断的生化标记物,后来被用于自身免疫性疾病,创伤,股骨肌缺血和胃肠道良性疾病的诊断。在血栓疾病的研究中,有研究表明急性肺栓塞血清IMA水平明显高于深静脉血栓和对照组,并认为对PE诊断具有一定的特异性[12]。结合本组研究说明IMA在AECOPD转变为PE的过程中具有重要的作用。
ACA和D-二聚体在早期PE早期的诊断和病情的监测中有重要作用,具有操作简单,无创和连续监测等优点,其价值越来越受到学者们的重视[13]。而在AECOPD合并PE的诊断,尚未见到有类似报道。D-二聚体是特异性交联纤维蛋白降解产物,是血管内最常见的血清标记物,对于肺栓塞的阴性预测接近100%[14];ACA是血管内膜带负电荷的心磷脂产生的自身抗体,参加了血栓的形成,与多种血栓形成具有重要意义。本组联合ACA和D-二聚体对AECOPD患者进行检测,并发现机体AECOPD合并PE水平明显增高,并能较好掌握机体内的纤溶状态,能够较好地掌握病情,有利于早期诊断和早期治疗,降低漏诊和误诊。
总之,HMGB-1, IMA, ACA和D-二聚体参与AECOPD合并PE疾病的发生发展,联合检测有助于鉴别AECOPD是否合并PE,对判断预后具有重要价值。
【参考文献】
[1] 徐鑫,曹卫军,倪健.住院结核患者合并静脉血栓栓塞症的危险因素分析[J].同济大学学报: 医学版,2015,36(05): 66-69.
[2] 徐薛芬,徐爱晖.COPD合并肺栓塞的危险因素及临床特征分析[J].临床肺科杂志,2013,18(6): 987-989.
[3] Pouwels SD, Nawijn MC, Bathoorn E, et al. Increased serum levels of LL37, HMGB1 and S100A9 during exacerbation in COPD patients[J]. Eur Respir J, 2015,45(5): 1482-1485.
[4] 李宾公,郑泽琪,王梦洪,等.缺血修饰白蛋白在急性肺栓塞诊断中的作用[J].临床心血管病杂志,2010,26(9): 670-672.
[5] 陈华宏.联合检测抗心磷脂抗体和D-二聚体在肺栓塞中的临床意义[J].现代诊断与治疗,2015,5: 1060- 1061.
[6] 杨勇,蔡明.高龄下肢骨折患者术后血栓预防中D-二聚体临界值的研究[J].同济大学学报: 医学版,2015,36(1): 83-86.
[7] Kanazawa H, Tochino Y, Asai K, et al. Validity of HMGB1 measurement in epithelial lining fluid in patients with COPD[J]. Eur J Clin Invest, 2012,42(4): 419-426.
[8] 赵晓梅,闫巧焕,刘玲玲.HMGB-1在慢性肺栓塞患者血清中的表达及其与IL-1β、TNF-α、D-二聚体的相关性研究[J].现代中西医结合杂志,2014(27): 2980-2982.
[9] Zhang Y, Li S, Wang G, et al. Changes of HMGB1 and sRAGE during the recovery of COPD exacerbation[J]. J Thorac Dis, 2014,6(6): 734-741.
[10] Pouwels SD, Nawijn MC, Bathoorn E, et al. Increased serum levels of LL37, HMGB1 and S100A9 during exacerbation in COPD patients[J]. Eur Respir J, 2015,45(5): 1482-1485.
[11] Turedi S, Karahan SC, Mentese A, et al. Investigation of relationship between the D-dimer and ischemia-modified albumin levels with the radiological imaging-based pulmonary embolism severity score in acute pulmonary embolism[J]. Anadolu Kardiyol Derg, 2010,10(4): 346-352.
[12] 鲁会田.肺栓塞患者血清缺血修饰白蛋白IMA及D- 二聚体表达水平及意义[J].延边医学,2014(35): 217-218.
[13] 杨海青,孙伟娜,梁梅菊.肺栓塞患者抗心磷脂抗体和D-二聚体的水平变化[J].检验医学与临床,2007,4(7): 672-673.
[14] 徐薛芬,徐爱晖.COPD合并肺栓塞的危险因素及临床特征分析[J].临床肺科杂志,2013,18(6): 987-989.
Serum HMGB-1, IMA, ACA and D-dimer levels in COPD patients complicated with pulmonary embolism
ZHU Ming-fei
(Dept. of Emergency, Central Hospital of Fengxian District, Shanghai 201400, China)
【Abstract】Objective To investigate serum levels of high mobility group protein B1(HMGB1), ischemia-modified albumin(IMA), anti-cardiolipin antibodies(ACA) and D-dimer in acute exacerbation of chronic obstructive pulmonary disease(AECOPD) patients complicated with pulmonary embolism(PE ). Methods Total 202 AECOPD patients admitted from January 2013 to June 2015 were divided into simple AECOPD group(135 cases) and AECOPD with PE group(67 cases). The AECOPD patients with PE were further divided into grade Ⅱ(22 cases), grade Ⅲ(26 cases) and grade Ⅳ(19 cases) according to COPD grads; into low-risk group(33 cases), intermediate risk group(19 cases) and high-risk groups(15 cases) according to the severity of PE; and into survival group(48 cases) and fetal group(19 cases). Results The serum levels of HMGB-1, IMA, ACA and D-dimer in AECOPD patients were significantly higher than those in control group(P<0.01), while the levels in AECOPD with PE group were significantly higher than those in simple AECOPD group(P< 0.01). The levels of HMGB-1, IMA, ACA and D-dimer significantly increased as the COPD grade and severity of PE elevated(P<0.01). After treatment, the levels of HMGB-1, IMA, ACA and D-dimer significantly decreased in AECOPD with PE group than those before treatment(P<0.01), and the levels of those in survival group were significantly higher than those in fetal group(P<0.01). Conclusion The levels of HMGB-1, IMA, ACA and D-dimer might be used as indicators for development of PE in AECOPD patients, and also may have prognostic value for patients.
【Key words】high mobility group protein B1; ischemia-modified albumin; anticardiolipin antibody; chronic obstructive pulmonary disease; pulmonary embolism
doi:10.16118/j.1008-0392.2016.04.021
收稿日期:2015-12-22
作者简介:朱明飞(1981—),男,主治医师,学士.E-mail: zhuifengtayue@163.com
【中图分类号】R 563.5
【文献标志码】A
【文章编号】1008-0392(2016)04-0104-05