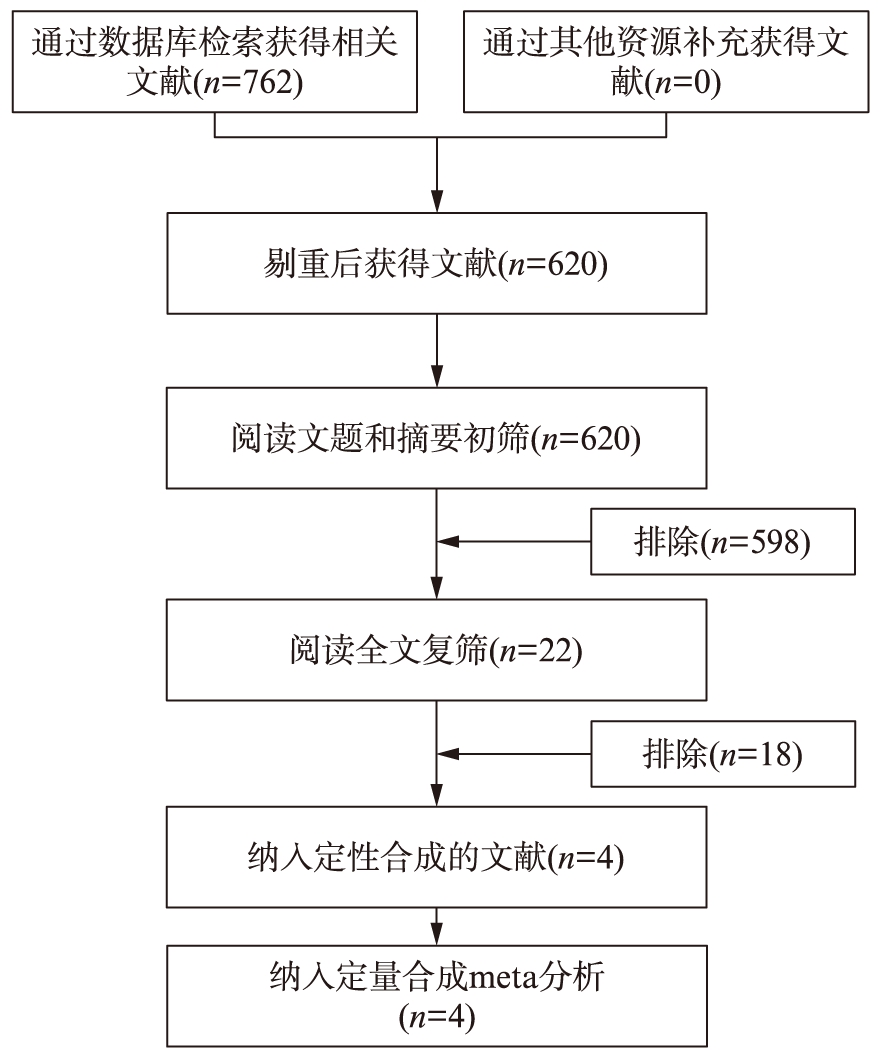
图1 文献筛选流程及结果和质量评价
Fig.1 Flow diagram: publications identified for study and exclusions
顾 俊1, 付强强2, 陆弘逾1, 张静芳1, 万悦竹2, 陈 梅1
(1. 同济大学附属杨浦医院血液科,上海 200090; 2. 同济大学附属杨浦医院科研管理部,上海 200090)
【摘要】目的 系统评价地西他滨对老年急性髓系白血病(acute myeloid leukemia, AML)治疗效果和相关不良反应。方法 计算机检索PubMed、Embase、Ovid、CochraneLibrary、CNKI、VIP、万方、和CBM等电子数据库,查找地西他滨对比其他方案治疗老年AML的随机对照试验(RCT),检索时限均从建库至2015年10月。对符合纳入标准的RCT,由两位评价员按Cochrane系统评价的方法,独立进行资料提取、质量评价并交叉核对后,采用RevMan 5.3进行meta分析。结果 共纳入4个RCT,628例老年AML患者,试验组采用地西他滨,对照组采用其他疗法。Meta分析结果显示,与其他疗法比较,地西他滨治疗老年AML患者的完全缓解率更高(OR=2.44,95% CI: 1.46~4.06,P=0.0006),部分缓解率差异无统计学意义(P>0.05);不良反应方面,地西他滨治疗组的Ⅲ/Ⅳ级粒细胞减少性发热发生率高于其他方案组(OR=1.77,95% CI: 1.20~2.61,P=0.004),而两组的Ⅲ/Ⅳ级中性粒细胞减少、Ⅲ/Ⅳ级血小板减少、Ⅲ/Ⅳ级贫血的发生率差异无统计学意义(P>0.05)。结论 现有研究证据显示,地西他滨治疗老年AML具有一定疗效,不良反应可耐受。
【关键词】地西他滨; 急性髓系白血病; 老年人; meta分析
急性髓系白血病(acute myeloid leukemia, AML)是最常见的成人急性白血病,其发病率随着年龄而增加[1]。近年来,包含蒽环类及阿糖胞苷的“3+7”方案已成为AML诱导治疗的标准方案。但是,该方案对于老年AML疗效欠佳[2],因此,亟需高效低毒的诱导治疗方案以改善老年AML的预后。临床上,采用CAG[3],HAG[4-5]等预激方案以及小剂量阿糖胞苷[6]治疗老年AML取得了一定疗效。而应用吉姆单抗奥佐米星(Gemtuzumab ozogamycin, GO),法尼基转移酶抑制剂(Tipifarnib),氯法拉滨(Clofarabine)等新药治疗老年AML的研究也在进行中,然而,更有效而安全的方案仍有待开发[2]。研究显示,DNA甲基化状态的改变,尤其是抑癌基因的过甲基化在AML的发生及发展中有着重要的影响,而随着对去甲基化药物研究的深入,应用去甲基化药物治疗老年AML也取得了一定的进展[7]。地西他滨(decitabine)作为一种去甲基化机制研究最为明确的药物,在国内外已广泛应用于骨髓增生异常综合征的治疗,但对于老年AML的治疗效果及安全性仍有争议。本研究对国内外地西他滨治疗老年AML的相关文献进行系统评价,比较临床有效性和不良反应情况,为指导临床安全合理用药提供参考。
1.1 研究对象
纳入公开发表的地西他滨治疗老年AML(≥60岁)的临床对照研究。
1.2 检索策略
参考Cochrane协作网制定的RCT检索策略,以“地西他滨、白血病、Decitabine、acute myeloid leukemia”为中、英文检索词,计算机检索PubMed、Cochrane Library、Embase、Ovid、CBM、VIP、CNKI和万方数据库,查找地西他滨对比其他方案治疗老年AML的有关RCT,检索时限从建库到2015年10月,并辅以追溯纳入文献的参考文献。
1.3 文献选择标准
1.3.1 文献纳入标准 原始文献为已公开发表的文献,统计方法恰当,数据完整可靠,评价指标明确。原始文献涉及诊断为AML的60岁及以上患者,试验组给予地西他滨治疗,对照组给予其他治疗。评价指标为: (1) 主要结局指标: 完全缓解率(complete remission, CR),部分缓解率(partial response, PR);(2) 次要结局指标: 粒细胞减少性发热(Ⅲ/Ⅳ级),中性粒细胞减少(Ⅲ/Ⅳ级),血小板减少(Ⅲ/Ⅳ级),贫血(Ⅲ/Ⅳ级)。
1.3.2 文献排除标准 (1) 重复发表文献;(2) 原始研究数据无法利用,联系作者也不能获得有用数据者;(3) 原始研究不包含主要或次要结局指标者;(4) 综述、个案报道等。
1.4 资料提取和文献质量评价
由2名研究者根据纳入和排除标准独立筛选文献、提取数据及评价纳入研究的方法学质量而后交叉核对,如遇分歧,通过讨论或交由第3位研究者确定。方法学质量评价参照Cochrane系统评价员手册质量评价标准,对随机分配方法、分配隐藏、盲法、数据缺失、选择性报告结果及其他偏倚进行评价。文献检索结果见图1。
1.5 统计学处理
由2名评价者独立录入数据,交叉核对,准确无误和意见统一后,使用Cochrane协作网提供的RevMan 5.3软件进行meta分析。计量资料采用均数差(MD)及其95% CI,计数资料则采用比值比(OR)及其95% CI表示。对各研究进行异质性检验,如不存在异质性或异质性较小(I2≤50%,P≥0.1),采用固定效应模型计算合并效应量;反之,若异质性较大(I2>50%,P<0.1),分析异质性产生的来源和原因,如仅有统计学异质性时,采用随机效应模型合并效应量,否则仅行描述性分析,P<0.05为差异有统计学意义。
2.1 纳入文献的基本特征
对数据库检索获得原始文献762篇,经筛选最终纳入文献4篇(英文3篇,中文1篇),文献筛选流程及结果见图1,纳入文献基本特征见表1。
2.2 纳入文献质量评价
对于4篇纳入文献的随机分配方法,分配隐藏,盲法,数据缺失,以及选择性报告结果及其他偏倚进行了质量评价,见图2、图3。

图1 文献筛选流程及结果和质量评价
Fig.1 Flow diagram: publications identified for study and exclusions
表1 纳入研究基本特征分析
Tab.1 Characteristics of included trials

HAG组中位年龄65岁,地西他滨组中位年龄68岁
(1): 完全缓解率;(2): 部分缓解率;(3): 粒细胞减少性发热(Ⅲ/Ⅳ级);(4): 中性粒细胞减少(Ⅲ/Ⅳ级);(5): 血小板减少(Ⅲ/Ⅳ级);(6): 贫血(Ⅲ/Ⅳ级)
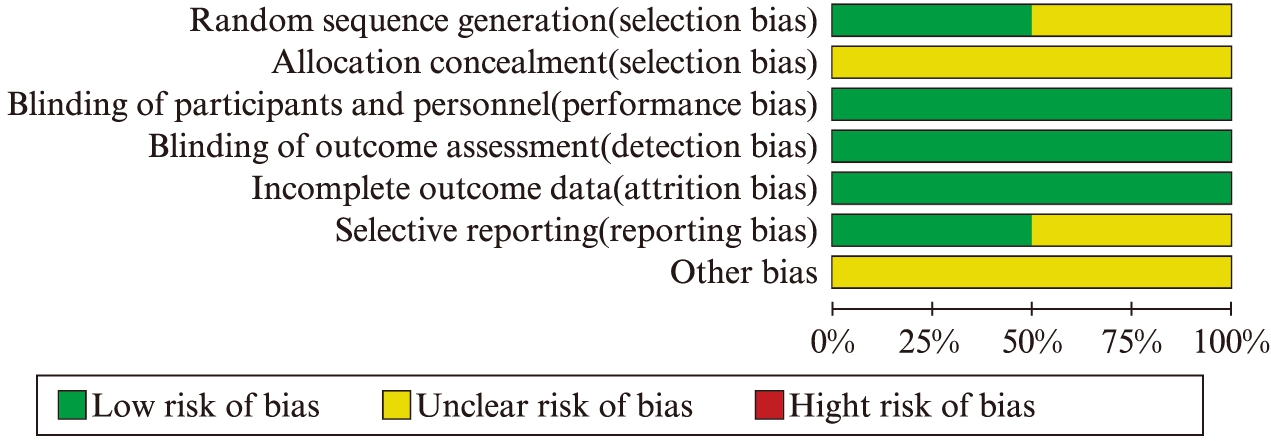
图2 总体文献质量评价
Fig.2 Total quality assessment of included publications
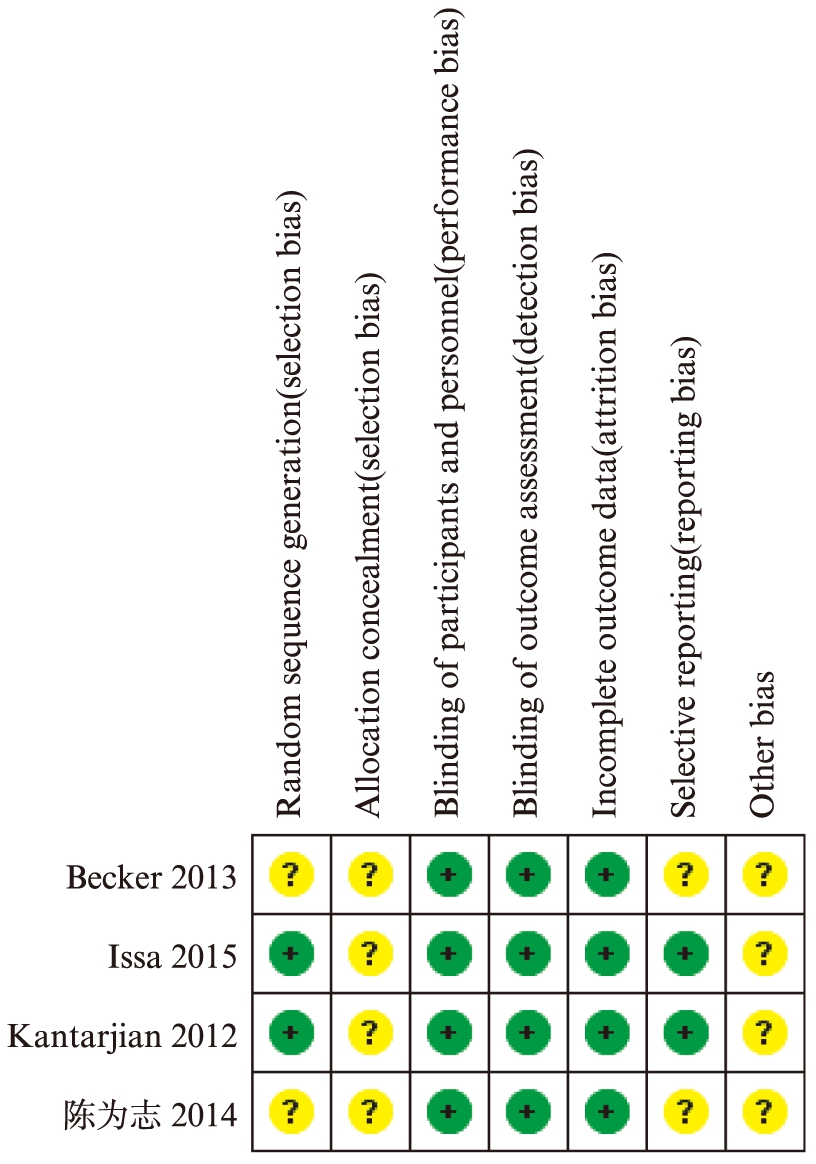
图3 单篇文献质量评价
Fig.3 Quality assessment of each publication
2.3 meta分析结果
4个研究[8-11]报告了完全缓解率(CR),各研究结果间无统计学异质性(P=0.34,I2=10%)采用固定效应模型。结果显示总体结果(OR=2.44,95% CI: 1.46~4.06,P=0.0006)差异有统计学意义,提示地西他滨组完全缓解率高于其他方案组,见图4。
3个研究[8-10]报告了部分缓解率(PR),各研究结果间无统计学异质性(P=0.35,I2=5%)采用固定效应模型。结果显示总体结果(OR=0.97,95% CI: 0.45~2.12,P=0.95)差异无统计学意义,提示地西他滨组部分缓解率与其他方案组相似,见图5。
3个研究[8-9,11]报告了粒细胞减少性发热(Ⅲ/Ⅳ级),各研究结果间无统计学异质性(P=0.35,I2=6%)采用固定效应模型。结果显示总体结果(OR=1.77,95% CI: 1.20~2.61,P=0.004)差异具有统计学意义,提示地西他滨组粒细胞减少性发热(Ⅲ/Ⅳ级)的发生率高于其他方案组,见图6。
2个研究[8,10]报告了中性粒细胞减少(Ⅲ/Ⅳ级),各研究结果间有统计学异质性(P=0.05,I2=74%)采用随机效应模型。结果显示总体结果(OR=0.91,95% CI: 0.10~8.30,P=0.94)差异无统计学意义,提示地西他滨组中性粒细胞减少(Ⅲ/Ⅳ级)的发生率与其他方案组相似,见图7。
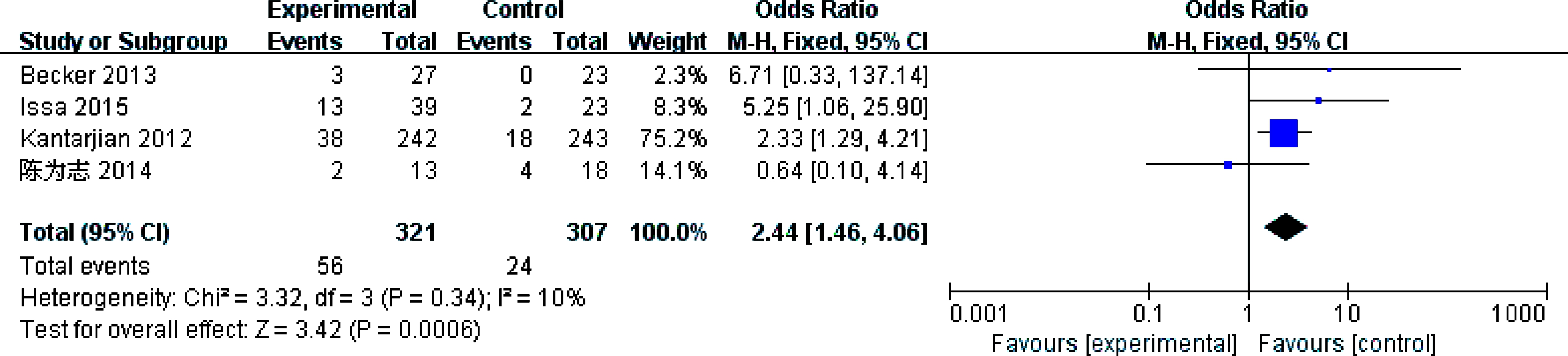
图4 完全缓解率比较的meta分析
Fig.4 Meta-analysis and forest plots of complete remission rates
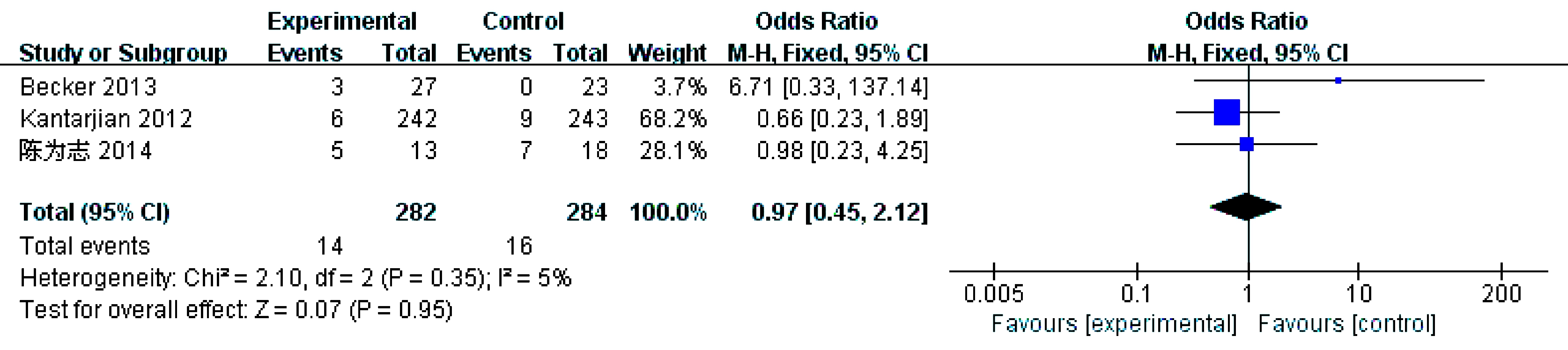
图5 部分缓解率比较的meta分析
Fig.5 Meta-analysis and forest plots of partial remission rates
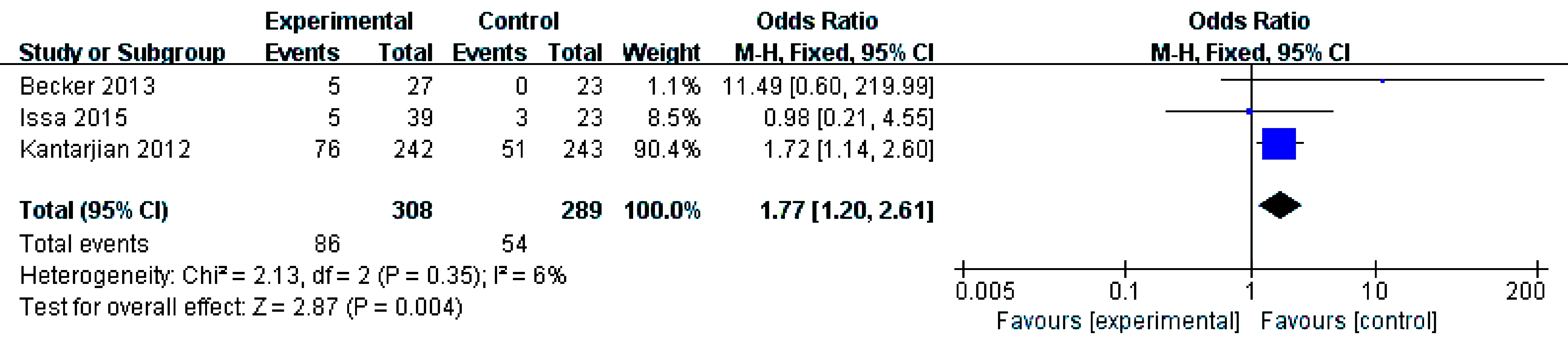
图6 粒细胞减少性发热(Ⅲ/Ⅳ级)发生率比较的meta分析
Fig.6 Meta-analysis and forest plots of the incidence of febrile neutropenia(grades Ⅲ or Ⅳ)

图7 中性粒细胞减少(Ⅲ/Ⅳ级)发生率比较的meta分析
Fig.7 Meta-analysis and forest plots of the incidence of neutropenia(grades Ⅲ or Ⅳ)
2个研究[8,10]报告了血小板减少(Ⅲ/Ⅳ级),各研究结果间无统计学异质性(P=0.26,I2=23%)采用固定效应模型。结果显示总体结果(OR=1.33,95% CI: 0.92~1.91,P=0.13)差异无统计学意义,提示地西他滨组血小板减少(Ⅲ/Ⅳ级)的发生率与其他方案组相似,见图8。
2个研究[8,10]报告了贫血(Ⅲ/Ⅳ级),各研究结果间无统计学异质性(P=0.17,I2=46%)采用固定效应模型。结果显示总体结果(OR=1.42,95% CI: 0.96~2.09,P=0.08)差异无统计学意义,提示地西他滨组贫血(Ⅲ/Ⅳ级)的发生率与其他方案组相似,见图9。
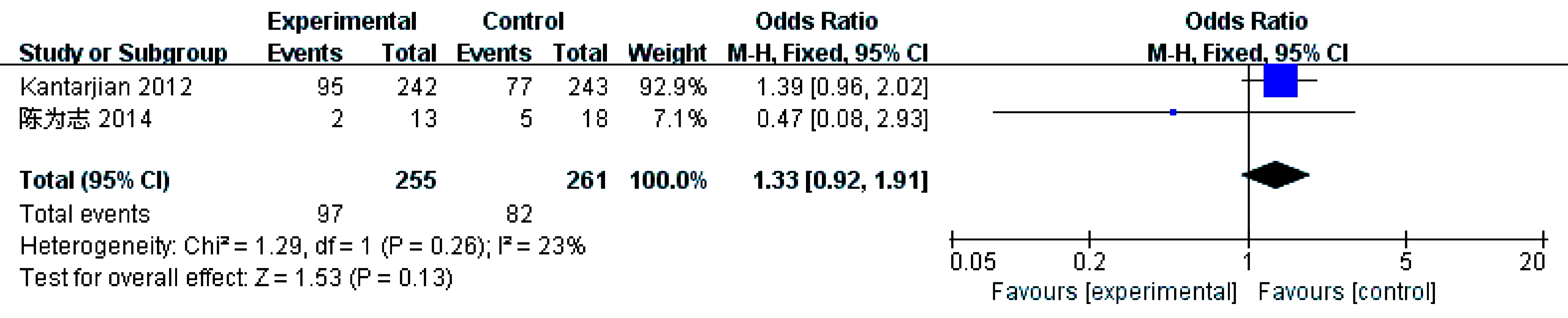
图8 血小板减少(Ⅲ/Ⅳ级)发生率比较的meta分析
Fig.8 Meta-analysis and forest plots of the incidence of thrombocytopenia(grades Ⅲ or Ⅳ)
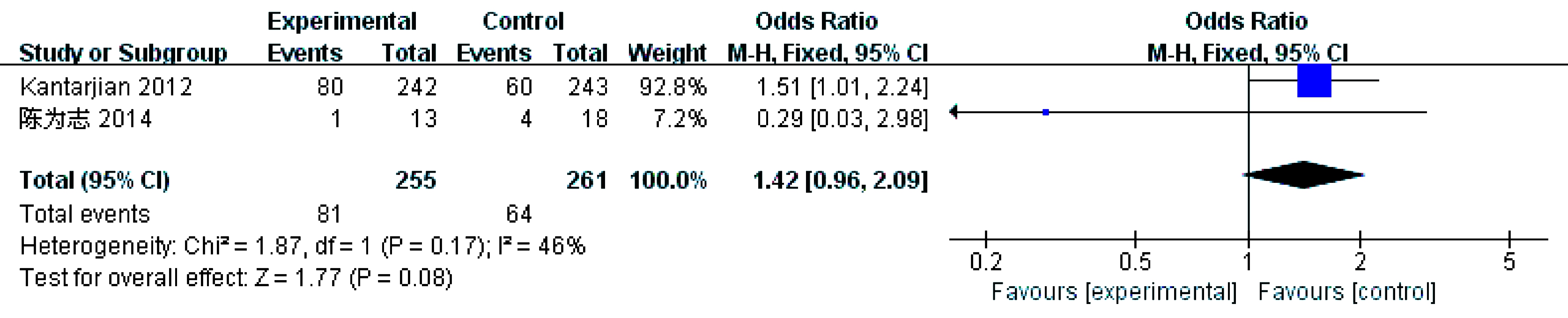
图9 贫血(Ⅲ/Ⅳ级)发生率比较的meta分析
Fig.9 Meta-analysis and forest plots of the incidence of anemia(grades Ⅲ or Ⅳ)
老年AML由于异常核型多见,继发性白血病较多见,多药耐药基因表达率高,合并症多,化疗耐受性差等原因,治疗缓解率低,不良反应多见[1]。目前,老年AML尚无统一化疗方案。国内治疗老年AML主要选择CAG方案或HAG方案。而欧美等国家在老年AML治疗推荐中提出可应用小剂量阿糖胞苷,地西他滨等[8]。小剂量阿糖胞苷除细胞毒作用外,可能还具有诱导细胞凋亡作用[6]。地西他滨作为特异性DNA甲基化转移酶抑制剂,通过磷酸化结合DNA后,能抑制DNA甲基化转移酶活性,使甲基不能转移到胞嘧啶上,并随着细胞的分裂逐渐降低DNA甲基化程度,诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡[7]。本研究对目前已经发表的比较地西他滨和其他方案治疗老年AML的RCT研究进行检索,拟对两者的治疗效果和不良反应的发生情况进行系统评价。本研究共纳入了4个相关RCT研究,包括3个国外研究和1个国内研究,异质性分析显示6个分析指标中,仅中性粒细胞减少(Ⅲ/Ⅳ级)研究结果间有统计学异质性,其余各指标均无统计学异质性,显示各研究之间异质性较小,提示研究文献质量较高。
Meta总体分析结果显示,地西他滨治疗老年AML取得的完全缓解率要高于其他方案组,结果存在显著的统计学差异,而部分缓解率两组相似,无统计学差异。地西他滨主要不良反应为血液学毒性,而本研究中两者在不良反应的发生率方面meta分析结果显示,除粒细胞减少性发热(Ⅲ/Ⅳ级)发生率地西他滨组要高于其他方案组外,中性粒细胞减少(Ⅲ/Ⅳ级)、血小板减少(Ⅲ/Ⅳ级)、贫血(Ⅲ/Ⅳ级)等血液学不良反应两组发生率无显著差别。本系统评价结果表明,地西他滨能有效提高老年AML患者完全缓解率,而血液学不良反应发生率并未高于其他方案,故不良反应可以耐受,从而为老年AML的有效治疗提供了循证依据。而地西他滨组粒细胞减少性发热(Ⅲ/Ⅳ级)发生率高于其他方案组,因此,在临床治疗过程中需注意预防,如口腔护理、肠道预防等。同时加强支持治疗,密切观察患者病情变化,及时进行相应处理,如中性粒细胞缺乏(≤0.5×109/L),给予重组人粒细胞集落刺激因子;出现发热等感染症状,给予相应的抗感染治疗,同时预防菌群失调引起的真菌感染等。
本系统评价有一定的局限性,部分研究未阐明随机方法以及是否采用分配隐藏和盲法,并且有些研究纳入样本量较少,影响了本研究的结果。对照组中有多种治疗方案,由于RCT少,未进行详细的亚组分析,不能明确有无差异。上述问题仍需更多RCT进行研究提供可靠的数据支持。
【参考文献】
[1] Walter RB, Estey EH. Management of older or unfit patients with acute myeloid leukemia[J]. Leukemia, 2015,29(4): 770-775.
[2] Nazha A, Ravandi F. Acute myeloid leukemia in the elderly: do we know who should be treated and how?[J]. Leuk Lymphoma, 2014,55(5): 979- 987.
[3] Wei G, Ni W, Chiao JW, et al. A meta-analysis of CAG(cytarabine, aclarubicin, G-CSF) regimen for the treatment of 1029 patients with acute myeloid leukemia and myelodysplastic syndrome[J]. J Hematol Oncol, 2011,4: 46.
[4] 张磊,苏定雷,苏爱玲,等.个体化小剂量HAG方案治疗老年急性髓细胞白血病的疗效观察[J].临床血液学杂志,2009,22(9): 502-503.
[5] 王剑利,何爱丽,张王刚,等.HAG预激化疗作为诱导缓解方案治疗老年人急性髓系白血病和骨髓增生异常综合征的临床观察[J].白血病·淋巴瘤,2011,20(3): 151-153.
[6] Burnett AK, Milligan D, Prentice AG, et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment[J]. Cancer, 2007,109(6): 1114-1124.
[7] 田慧,徐燕丽.甲基化转移酶抑制剂治疗急性髓系白血病的研究进展[J].国际输血及血液学杂志,2012,35(3): 215-218.
[8] Kantarjian HM, Thomas XG, Dmoszynska A, et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acutemyeloid leukemia[J]. J Clin Oncol, 2012,30(21): 2670-2677.
[9] Becker H, Suciu S, Ruter B, et al. Low-dose decitabine vs best supportive care in older patients with AML and low blast counts: Results of a subgroup analysis of the randomized phase III study 06011 of the eortc leukemia cooperative group and German MDS study group[J]. Blood, 2013,122(21): 1452.
[10] 陈为志.地西他滨治疗老年急性髓系白血病患者的效果及安全性评价[J].肿瘤研究与临床,2014,26(6): 415-417.
[11] Issa JP, Garcia-Manero G, Huang X, et al. Results of phase 2 randomized study of low-dose decitabine with or without valproic acid in patients with myelodysplastic syndrome and acute myelogenous leukemia[J]. Cancer, 2015,121(4): 556-561.
Efficacy and safety of decitabine for elderly patients with acute myeloid leukemia
GU Jun1, FU Qiang-qiang2, LU Hong-yu1, ZHANG Jing-fang1, WAN Yue-zhu2, CHEN Mei1
(1. Dept. of Hematology, Yangpu Hosptial, Tongji University, Shanghai 200090, China; 2. Dept. of Scientific Research Management, Yangpu Hospital, Tongji University, Shanghai 200090, China)
【Abstract】Objective To evaluate the effectiveness and safety of decitabine for older patients with acute myeloid leukemia. Methods Randomized controlled trials(RCTs) on decitabine in treatment of acute myeloid leukemia was searched from databases of PubMed, Embase, Ovid, Cochrane Library, CNKI, VIP, WanFang Data and CBM from inception to Oct, 2015. Two reviewers independently screened literature, extracted data, and assessed methodological quality. Then meta-analysis was conducted using RevMan 5.3 software. Results A total of 4 RCTs involving 628 patients were finally included. The trial arm was given decitabine while the control arm was given other therapies. The results of meta-analysis showed that for elderly patients with acute myeloid leukemia, decitabine produced a better complete remission(CR) rate than other therapies[OR=2.44,95% CI: 1.46~4.06,P=0.0006], while the partial remission(PR) rate had no statistically significant difference between two arms(P>0.05). In terms of adverse events, the incidence of grade Ⅲ or Ⅳ febrile neutropenia in decitabine arm was significantly higher than that in other therapies(OR=1.77,95% CI: 1.20~2.61,P=0.004). The incidences of grade Ⅲ or Ⅳneutropenia, grade Ⅲor Ⅳthrombocytopenia, and grade Ⅲ or Ⅳ anemia were not statistically different between two arms(P>0.05).Conclusion Current evidence suggests that decitabine achieved a higher CR rate, with comparable hematological side effects for elderly patients with AML.
【Key words】decitabine; acute myeloid leukemia; older patients; meta-analysis
doi:10.16118/j.1008-0392.2016.04.019
收稿日期:2016-01-20
基金项目:上海市卫生和计划生育委员会委级科研项目(20134443)
作者简介:顾 俊(1973—),男,主治医师,硕士研究生.E-mail: gujun004@hotmail.com
通信作者:陈 梅.E-mail: chenmei039@126.com
【中图分类号】R 733.7
【文献标志码】A
【文章编号】1008-0392(2016)04-0093-06