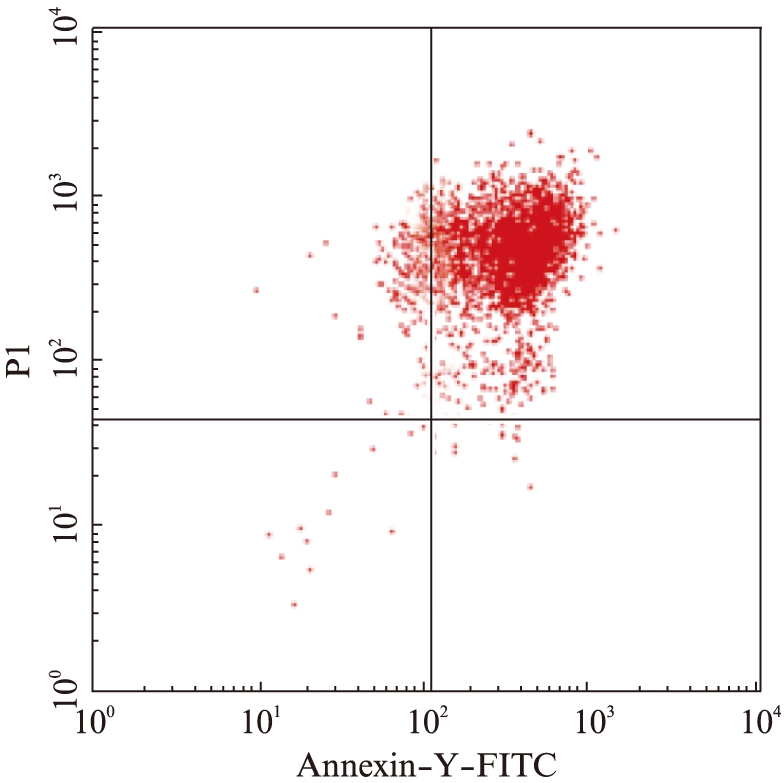
图1 24h后A549细胞凋亡流式图
Fig.1 Flow diagram of apoptosis in A549 cells after 24h
王凯玲, 任 涛
(同济大学附属东方医院呼吸科,上海 200123)
【摘要】目的 评估血浆游离DNA含量在非小细胞肺癌(non-small cell lung cancer, NSCLC)诊疗中的应用价值。方法 收集61例非小细胞肺癌患者和18例健康人的血浆,提取血浆游离DNA,荧光定量PCR方法检测DNA浓度。结果 健康人血浆游离DNA水平中位数为73.70(53.49~85.03)ng/ml,非小细胞肺癌患者血浆游离DNA水平为179.43(160.94~401.34)ng/ml,两者间差异有统计学意义(P<0.01)。血浆游离DNA含量与非小细胞肺癌患者的性别、年龄、吸烟状况及病理类型均无明显相关性,与有无转移存在相关性(P<0.01)。结论 非小细胞肺癌患者的血浆游离DNA是一种潜在有价值的生物学标志物,可作为临床上诊断肺癌、预测疾病进展、快速评估治疗疗效的工具。
【关键词】非小细胞肺肿瘤; 游离DNA; 液体活检
血液中循环的DNA,称为游离DNA(cell-free DNA, cfDNA)。检测肿瘤患者血浆或血清中的cfDNA,犹如做“液体活检”,不仅可以通过检测遗传学和表观遗传学的改变为诊断提供帮助,而且可以了解肿瘤负荷、评价治疗效果。因此,cfDNA被认为是很有潜力的肿瘤标记物。本研究以非小细胞肺癌(non-small cell lung cancer, NSCLC)患者为研究对象,通过分析非小细胞肺癌患者血浆中游离DNA水平,为游离DNA在肺癌诊治中的推广应用提供依据。
1.1 研究对象
2015年5月至2016年1月同济大学附属东方医院呼吸科和胸外科就诊的NSCLC患者61例,年龄41~83岁,中位年龄61岁;所有患者均有细胞病理学证据确诊。其中,Ⅰ期12例、Ⅱ期8例、Ⅲ期8例、Ⅳ期33例;鳞癌15例、腺癌46例;PS评分在0~3分;采血前均未接受手术、放疗及化疗等抗肿瘤治疗。同时收集健康人18例作为对照组,年龄36~64岁,中位年龄44.5岁,其性别、吸烟情况构成比与入组NSCLC患者相应构成比匹配。所有研究对象均排除肝炎、糖尿病、慢性炎症及免疫系统疾病,均知情同意。
1.2 血浆标本采集
分别抽取检测对象前臂静脉血5ml,放入EDTA抗凝管中,室温放置2h后20℃,离心半径15cm,4000r/min,离心5min,取上层血浆放入冻存管,置于-80℃冰箱保存备用。
1.3 血浆DNA提取
血浆游离DNA用QIAamp DNA Blood Mini Kit试剂盒(德国,Qiagen公司)提取。取待提取血浆样本600μl,分别调整蛋白酶、Buffer AL、乙醇(100%)剂量至60μl、600μl、600μl,最后加入 40μl的Buffer AE洗脱液。其余均严格按照说明书所述的方法。提取的血浆游离DNA置于-20℃冰箱保存备用。
1.4 血浆游离DNA浓度的检测
用二甲基亚砜(DMSO)凋亡A549细胞株,24h后取上清液,PI染色后行流式细胞仪检测,检测细胞凋亡、坏死水平。取上清液,用QIAamp DNA Blood Mini Kit试剂盒按上述方法提取游离DNA。紫外分光光度法测定提取的游离DNA浓度,梯度稀释获得DNA标准品。
血浆游离DNA浓度的检测应用LINE1,引物序列如下。上游引物: 5′-ACTTGGAACCAACCC-AAATG-3′;下游引物: 5′-CACCACAGTCCCCA-GAGTG-3′;扩增产物长度266bp。引物由上海生工生物工程技术服务有限公司合成。
将DNA标准品和提取的血浆游离DNA进行实时荧光定量PCR扩增。实时荧光定量PCR使用SYBR(TaKaRa公司)试剂盒,PCR总反应体系为20μl,包括SYBR® Premix Ex TaqTM II 10μl,Forward Primer 0.8μl,Reverse Primer 0.8μl,ROX Reference Dye II 0.4μl,DNA模板2μl,ddH2O 6μl。循环参数: 95℃预变性30s;95℃ 5s,60℃ 30s,共40个循环。
用已知浓度的DNA标准品得到的ct值绘制标准曲线。ct值与DNA含量的对数存在线性关系,用实时荧光定量PCR仪自带的分析软件根据样品中的ct值得到样品浓度。
1.5 统计学处理
应用SPSS 20.0软件统计数据。对实验数据进行分析,提示数据不符合正态分布,故结果采用中位数(四分位数)表示。两组样本间比较采用Mann-Whitney U秩和检验,以P<0.05为差异有统计学意义。
2.1 成功制备标准品
DMSO可诱导人肺癌细胞凋亡。将20%的DMSO加入A549细胞培养液中,24h后可使细胞凋亡和坏死达到90%以上,见图1。用QIAGEN试剂盒提取上清液中的游离DNA,以此cfDNA作为检测血浆游离DNA浓度的标准品原型。紫外分光光度法测定提取的游离DNA浓度为5.7×104ng/ml,梯度稀释获得浓度为5.7×103、5.7×102、5.7×101、5.7ng/ml的DNA标准品。
2.2 标准曲线的建立
成功构建标准品的扩增曲线,建立标准曲线(图2),ct值与模板起始浓度对数值之间具有较好的线性关系(R2=0.996)。目的基因熔解曲线无杂峰。

图1 24h后A549细胞凋亡流式图
Fig.1 Flow diagram of apoptosis in A549 cells after 24h
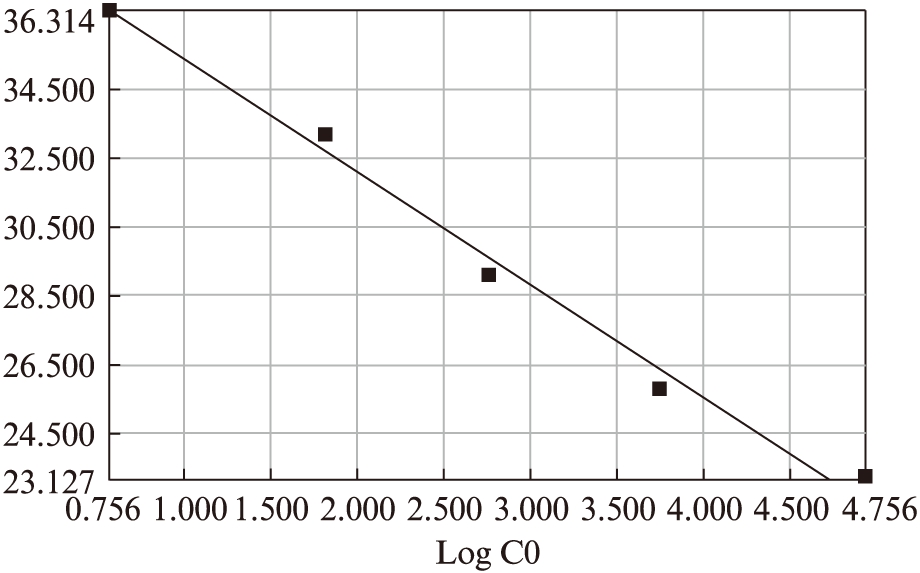
图2 以LINE1为引物的基因组DNA标准品荧光定量标准曲线
Fig.2 Fluorescence quantitative standard curve of the standard by LINE1
2.3 肺癌组及健康对照组血浆游离DNA水平比较
非小细胞肺癌组和健康对照组血浆游离DNA含量分别为179.43(160.94~401.34)、73.70(53.49~85.03)ng/ml。目的基因含量在非小细胞肺癌组和健康对照组间差异有统计学意义(P<0.01)。
2.4 NSCLC患者血浆游离DNA含量与临床病理参数的相关性
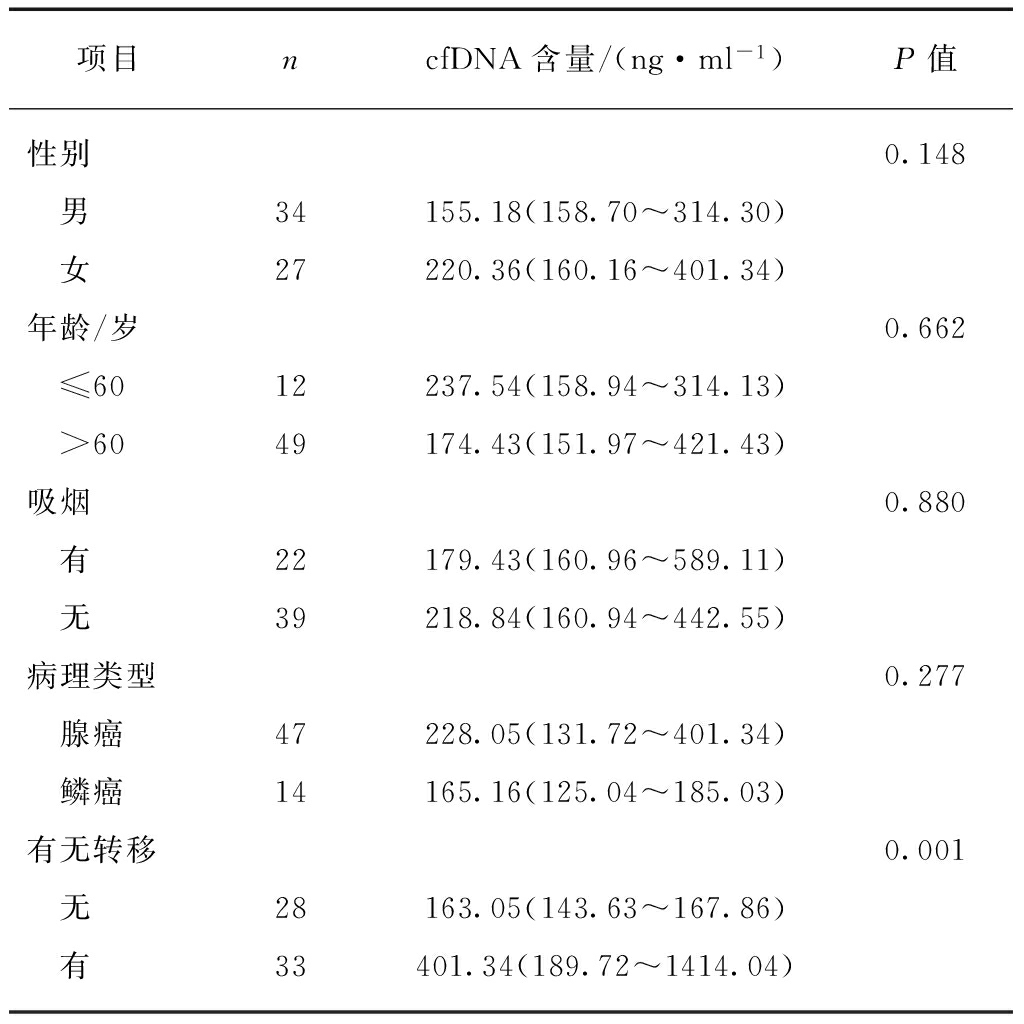
血浆游离DNA含量与NSCLC患者的性别、年龄、吸烟状况及病理类型均无明显相关性,与有无转移存在相关性(P<0.01),见表1。
表1 NSCLC患者血浆游离DNA含量与临床病理参数的相关性
Tab.1 Correlation of plasma cfDNA content and clinicopathological parameters in NSCLC patients
肺癌是人类最常见的恶性肿瘤之一,其发病率呈逐年上升趋势。2010年我国新发肺癌病例数高居恶性肿瘤榜首。尽管目前有影像学、肿瘤标记物等多种方法用于肺癌早期诊断,但仍存在敏感性不高、特异性不强、准确性差等缺点[1]。因此,希望能够建立一种灵敏度高、特异性好的,准确、简单、方便的检测方法,能够作为肺癌的一种生物标志物,用于诊断、预后评价和治疗监测。
Vasioukhin等[2]和Sorenson等[3]在急性髓性淋巴瘤、骨髓增生异常综合征和胰腺癌患者外周血中检测出突变的RAS基因片段,cfDNA才被认为是有潜力的肿瘤标记物,检测血浆或血清中的cfDNA犹如“液体活检”。为了确保得到较高质量的DNA定量,本研究采用SYBR进行实时荧光定量PCR检测,可提供精确的、可重复性良好的扩增DNA定量。由于白细胞在体外凝血、纤溶导致血清cfDNA含量明显高于血浆[4],故本研究选择肺癌患者血浆进行cfDNA检测。由于肿瘤患者的cfDNA主要来源于细胞的凋亡、坏死,故诱导肿瘤细胞凋亡坏死后制成的标准品可能较以往直接从细胞中提取DNA作为检测NSCLC患者血浆cfDNA的标准品,准确性更佳,此为本实验的创新点。研究结果显示,NSCLC患者血浆cfDNA水平明显高于健康人群(P<0.01),该趋势与Shapiro等[5]及Szpechcinski等[6]研究者的结果一致。其主要原因可能是在健康人血浆中,cfDNA来自于凋亡细胞;而肿瘤患者的细胞凋亡、坏死和分泌释放大量的cfDNA。提示血浆cfDNA含量在NSCLC患者中具有较高的区分度,可能成为NSCLC早期诊断的指标。然而各研究之间NSCLC患者血浆cfDNA含量与健康对照组之间的倍数关系却有区别。Lodovini等[7]证明76例肺癌患者血浆cfDNA水平[(60.0±99.8)ng/ml)]是66例对照组[(6.0±8.8)ng/ml)]的10倍;Sozzi等[8]报告84例NSCLC患者血浆cfDNA水平较43例健康对照组(分别为318ng/ml和18ng/ml)高17倍。该现象可能与cfDNA提取、定量的方法、标准品参考的多样性有关,同时又反映了肿瘤-宿主生物相互作用的复杂性和多样性。
本研究在cfDNA含量与临床病理参数相关性中,发现NSCLC患者与健康对照组的血浆cfDNA水平在年龄上差异无统计学意义。年龄对cfDNA的潜在影响在现有的文献报道中并不一致。Jylhävä等[9]的一项研究显示,老年妇女(>90岁)相对年轻的对照组(22~37岁)有较高的血浆cfDNA水平(P<0.05)。由于该数据集样本不大其可靠性仍不确定。Sozzi等[10]检测100例非小细胞肺癌患者和相等数量健康人的cfDNA浓度,发现年龄与cfDNA含量存在正相关(P=0.001)。Yoon等[11]观察到102例患者和105例对照组的血浆cfDNA浓度与年龄没有显著相关性。当要求的精度越高,可推断性要求越高时,要求样本量越大。因此,任何综合分析需要在一个相匹配的、样本量较大的群体中进行研究。
本研究证实血浆cfDNA含量与病理类型无明显相关性。Paci等[12]和Szpechcinski等[13]也指出血浆cfDNA水平在组织学上无显著差异,然而邓水秋等[14]和张弦等[15]报道腺癌患者血清游离cfDNA水平明显高于鳞癌患者。是否因为不同组织学类型的NSCLC存在基因组学或代谢组学上的差异,或是存在增殖动力学差异,有待进一步验证。
本研究提示,Ⅳ期NSCLC患者血浆cfDNA水平明显高于其他肺癌期患者,与有无转移存在相关性(P<0.01),与Madhavan等[16]研究结果相符。原因可能是Ⅳ期肺癌患者肿瘤负荷量较大,肿瘤细胞数量多,脱落、凋亡、坏死机会大。Diehl等[17]估计,一个重约100g的肿瘤,每天约有3×1010个细胞的DNA进入到血液循环中,循环系统中的肿瘤细胞和转移病灶也都能够释放cfDNA。提示血浆cfDNA水平过高可预示疾病的严重程度,说明肿瘤负荷高,可预测肺癌的进展。
综上所述,血浆游离DNA水平与NSCLC的发生、转移密切相关,是一种潜在的有价值的生物学标志物,其量化是临床上诊断肺癌、预测疾病严重程度的工具。然而,血浆中的cfDNA含量是否能够快速评估NCSLC患者的抗肿瘤治疗效果,是否能够对预后进行预测,这些问题都需要今后进一步研究。
【参考文献】
[1] 田德增.肺癌的早期诊断进展[J].同济大学学报: 医学版,2004,25(3): 251-253.
[2] Vasioukhin V, Anker P, Maurice P, et al. Point mutation of the N-ras gene in the blood plasma DNA of patients with myelodysplastic syndrome or acute myelogenous leukaemia[J]. Br J Haematol, 1994,86(4): 774-779.
[3] Sorenson GD, Pribish DM, Valone FH, et al. Soluble normal and mutated DNA sequences from single-copy genes in human blood[J]. Cancer Epidemiol Biomarkers Prev, 1994,3: 67-71.
[4] Jung K, Fleischhacker M, Rabien A. Cell-free DNA in the blood as a solid tumor biomarker—a critical appraisal of the literature[J]. Clin Chim Acta, 2010,411(21-22): 1611-1624.
[5] Shapiro B, Chakrabarty M, Clhn EM, et al.Determination of circulating DNA levels in patients with benign or malignant gastrointestinal disease[J]. Cancer, 1983,51(11),2116-2120.
[6] Szpechcinski A, Chorostowska-Wynimko J,Struniawski R,et al. Cell-free DNA levels in plasma of patients with non-small-cell lung cancer and inflammatory lung disease[J]. Br J Cancer, 2015,113(3): 476-483.
[7] Ludovini V, Pistola L,Gregorc V,et al. Plasma DNA, microsatellite alterations, and p53 tumor mutations are associated with disease-free survival in radically resected non-small cell lung cancer patients: a study of the perugia multidisciplinary team for thoracic oncology[J].J Thorac Oncol, 2008,3(4): 365-373.
[8] Sozzi G, Conte D,Mariani L,et al.Analysis of circulating tumor DNA in plasma at diagnosis and during follow-up of lung cancer patients[J].Cancer Res, 2001,61(12): 4675-4678.
[9] Jylhävä J, Kotipelto T,Raitala A,et al.Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+study[J].Mech Ageing Dev, 2011,132(1-2): 20-26.
[10] Sozzi G, Conte D,Leon M,et al.Quantification of free circulating DNA as a diagnostic marker in lung cancer[J].J Clin Oncol, 2003,21(21): 3902-3908.
[11] Yoon KA,Park S,Lee SH,et al. Comparison of circulating plasma DNA levels between lung cancer patients and healthy controls[J].J Mol Diagn, 2009,11(3): 182-185.
[12] Paci M,Maramotti S,Bellesia E,et al. Circulating plasma DNA as diagnostic biomarker in non-small cell lung cancer[J]. Lung Cancer, 2009,64(1): 92-97.
[13] Szpechcinski A, Chorostowska-Wynimko J, Struniawski R, et al. Cell-free DNA levels in plasma of patients with non-small-cell lung cancer and inflammatory lung disease[J]. Br J Cancer, 2015,113(3): 476-483.
[14] 邓水秋,欧阳学农,余宗阳,等.晚期非小细胞肺癌血清游离DNA水平变化及意义[J].山东医药,2013,53(30): 6-8.
[15] 张弦,唐立.非小细胞肺癌患者血中DNA片段的检测、定量及临床意义的研究[J].中国微生态学杂志,2007,19(6): 516-518.
[16] Madhavan, Wallwiener M, Bents Karin, et al.Plasma DNA integrity as a biomarker for primary and metastatic breast cancer and potential marker for early diagnosis[J].Breast Cancer Res Treat, 2014,146(1): 163-174.
[17] Diehl F,Meng L,Dressman D,et al.Detection and quantification of mutations in the plasma of patients with colorectal tumors[J]. Proc Natl Acad Sci U S A, 2005,102(45): 16368-16373.
Clinical significance of plasma cell free DNA detectionin in non-small cell lung cancer patients
WANG Kai-ling, REN Tao
(Dept. of Respiratory, East Hospital, Tongji University, Shanghai 200123, China)
【Abstract】Objective To evaluate the dection of plasma cell free DNA content in the diagnosis and treatment of non-small cell lung cancer (NSCLC). Methods The plasma samples were collected from 61 cases of NSCLC patients and 18 healthy subjects. The plasma cell free DNA was extracted using GIAGEN reagent. The concentration of cell free DNA was detected by fluorescence quantitative PCR method. Results The level of plasma cell free DNA was 73.70 (53.49-85.03)ng/ml in control group and 179.43(160.94-401.34)ng/ml in NSCLC group(P<0.01). Plasma cell free DNA was not correlated with gender, age, smoking and pathological type of NSCLC patients, but correlated with cancer metastasis(P<0.01).Conclusion The dection of plasma cell free DNA can be used as a biological marker for diagnose and prognosis for NSCLC patients.
【Key words】non-small cell lung cancer; cell free DNA
doi:10.16118/j.1008-0392.2016.04.009
收稿日期:2016-03-14
基金项目:国家自然科学基金(81372347)
作者简介:王凯玲(1979—),女,主治医师,硕士.E-mail: wangkailinger@163.com
通信作者:任 涛.E-mail: rentao305@163.com
【中图分类号】R 734.2
【文献标志码】A
【文章编号】1008-0392(2016)04-0046-05