雷公藤红素对β淀粉样蛋白诱导SH-SY5Y细胞Tau蛋白异常磷酸化影响的研究
曹帆帆1, 徐莉敏2, 王 莹1, 彭 彬1, 张 雪1, 张登海1
(1. 第二军医大学附属公利医院中法合作中心实验室,上海 200135; 2. 第二军医大学附属公利医院检验科,上海 200135)
【摘要】目的 观察雷公藤红素对β淀粉样蛋白1-42导致SH-SY5Y细胞Tau蛋白异常磷酸化的影响及其可能机制。方法 用 Aβ1-42刺激SH-SY5Y细胞,建立Tau蛋白异常磷酸化的细胞模型。加入雷公藤红素干预,Western印迹法检测Aβ1-42导致Tau蛋白异常磷酸化的变化,同时检测p-NF-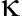 B表达情况;siRNA法下调TLR4表达,Western印迹法检测Aβ1-42导致的Tau蛋白异常磷酸化的变化情况;同时观察下调TLR4后,Aβ1-42刺激对p-NF-
B表达情况;siRNA法下调TLR4表达,Western印迹法检测Aβ1-42导致的Tau蛋白异常磷酸化的变化情况;同时观察下调TLR4后,Aβ1-42刺激对p-NF-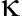 B表达的影响。结果 Aβ1-42刺激SH-SY5Y细胞,导致Tau蛋白Ser199/202、Ser396位点的磷酸化水平增加,而雷公藤红素能降低这两个位点磷酸化水平;Aβ1-42导致细胞p-NF-
B表达的影响。结果 Aβ1-42刺激SH-SY5Y细胞,导致Tau蛋白Ser199/202、Ser396位点的磷酸化水平增加,而雷公藤红素能降低这两个位点磷酸化水平;Aβ1-42导致细胞p-NF-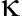 B表达增加,雷公藤红素干预后p-NF-
B表达增加,雷公藤红素干预后p-NF-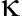 B表达下调,且NF-
B表达下调,且NF-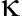 B抑制剂BAY11-7082同样能降低Aβ1-42导致的Tau蛋白异常磷酸化;下调TLR4表达,Aβ1-42导致的Tau蛋白异常磷酸化及p-NF-
B抑制剂BAY11-7082同样能降低Aβ1-42导致的Tau蛋白异常磷酸化;下调TLR4表达,Aβ1-42导致的Tau蛋白异常磷酸化及p-NF-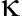 B表达下降。结论 雷公藤红素降低Aβ1-42导致的SH-SY5Y细胞Tau蛋白异常磷酸化可能与其抑制TLR4/NF-
B表达下降。结论 雷公藤红素降低Aβ1-42导致的SH-SY5Y细胞Tau蛋白异常磷酸化可能与其抑制TLR4/NF-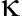 B通路活性有关。
B通路活性有关。
【关键词】雷公藤红素; β淀粉样蛋白; Tau蛋白; Toll样受体4; p-NF-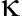 B
B
Tau蛋白主要功能是维持神经元微管系统稳定,Tau蛋白的功能受其磷酸化状态影响。Tau蛋白有数十个可被磷酸化位点。正常成熟脑中Tau蛋白分子含2~3个磷酸基。Tau蛋白与微管蛋白结合的结构域,存在可被磷酸化的位点,这些位点(以及结合结构域以外若干个位点)被异常磷酸化后,Tau蛋白与微管蛋白的结合力下降,Tau蛋白解离,丧失维持微管稳定的作用,神经元微管结构广泛破坏[1-2]。Tau蛋白异常磷酸化所引起的神经元退行性病,包括阿尔茨海默症等(Alzheimer’s disease, AD)[3],抑制Tau蛋白异常磷酸化,是神经元退行性病治疗领域重要研究方向之一。
研究[4]发现,天然化合物雷公藤红素能显著抑制小鼠脑神经元Tau蛋白异常磷酸化,但机制不明。雷公藤红素为核转录因子- B(nuclear transcription factor-
B(nuclear transcription factor- B, NF-
B, NF- B)活化抑制剂,能抑制Toll样受体4(Toll like receptor 4,TLR4)活性[5]。本研究用凝聚态Aβ1-42 作用于SH-SY5Y细胞,建立Tau蛋白异常磷酸化的细胞模型,观察雷公藤红素抑制Tau蛋白磷酸化是否通过阻断TLR4/NF-κB通路这一途径。
B)活化抑制剂,能抑制Toll样受体4(Toll like receptor 4,TLR4)活性[5]。本研究用凝聚态Aβ1-42 作用于SH-SY5Y细胞,建立Tau蛋白异常磷酸化的细胞模型,观察雷公藤红素抑制Tau蛋白磷酸化是否通过阻断TLR4/NF-κB通路这一途径。
1 材料与方法
1.1 试剂与仪器
DMEM/F-12培养基购自美国Gibco公司,胎牛血清购自美国Cambrex公司。β淀粉样蛋白多肽片段1-42(Aβ1-42)购自美国Sigma公司。雷公藤红素(Cel)购自美国Sigma公司(C0869),DMSO溶解,贮存浓度为100mmol/L,工作浓度为600nmol/L,用培养基临时配制。Tau磷酸化抗体Ser199/Ser202抗体(44768G)、Ser396抗体(44750G)均购美国Invitrogen公司。p-NF- B抗体(8242)、GAPDH抗体(2118)均购自美国Cell Signaling公司。TLR4转染试剂盒购自上海吉玛公司。NF-
B抗体(8242)、GAPDH抗体(2118)均购自美国Cell Signaling公司。TLR4转染试剂盒购自上海吉玛公司。NF- B抑制剂BAY11-7082、二喹啉甲酸(bicincho ninic, BCA)蛋白检测试剂盒及化学发光底物(enhanced chemiluminescent, ECL)试剂盒均购自江苏碧云天生物技术公司。辣根过氧化氢酶标记二抗购自美国eBioscience公司。化学成像发光系统购自英国Syngene公司。
B抑制剂BAY11-7082、二喹啉甲酸(bicincho ninic, BCA)蛋白检测试剂盒及化学发光底物(enhanced chemiluminescent, ECL)试剂盒均购自江苏碧云天生物技术公司。辣根过氧化氢酶标记二抗购自美国eBioscience公司。化学成像发光系统购自英国Syngene公司。
1.2 细胞培养
SH-SY5Y细胞购自中科院上海细胞库。DMEM/F-12培养基,分别加入10%胎牛血清(Cambrex公司),1%青霉素-链霉素,37℃,5% CO2培养。取对数生长期的细胞进行实验。
1.3 Tau蛋白异常磷酸化细胞模型建立
Aβ1-42用DMSO溶解,浓度为20mg/ml,溶解后加入PBS,浓度为1mg/ml。37℃孵育3d,使其成为凝集态。取贴壁生长良好的SH-SY5Y细胞,按1×106/ml种于24孔培养板中,每孔1ml。待细胞长满时,弃培养板中原有培养基,按所需浓度加入1ml Aβ1-42,继续培养6h。
1.4 细胞的药物处理
取贴壁生长良好的SH-SY5Y细胞,按1×106/ml种于24孔培养板中,每孔1ml。待细胞长满时,弃培养板中原有培养基,每孔加入1ml含雷公藤红素(终浓度为600nmol/L)或BAY11-7082(终浓度为20μmol/L)及Aβ1-42的完全培养基,对照组加入同浓度DMSO,处理6h。
1.5 siRNA转染
siRNA-TLR4及相应的control siRNA由上海吉玛公司设计合成;按Lipofecter脂质体转染试剂盒说明,将siRNA-TLR4或其相应的control siRNA转染至细胞中。
1.6 Western 印迹法检测Tau蛋白异常磷酸化
将处理好的细胞收集并用冷PBS洗1遍后,加入一定量蛋白裂解液裂解,提取蛋白,并按蛋白浓度测定试剂盒说明书进行蛋白浓度测定。取一定量蛋白按体积比5∶1,加入5×蛋白上样缓冲液于100℃煮3~5min。待样品冷却至室温后,上样至浓度为8%~10%的SDS-聚丙烯酰胺凝胶,进行电泳、转膜。膜经封闭液在室温下封闭1.5h后,与针对Tau不同磷酸化位点的抗体在4℃冰箱中孵育过夜,经洗涤液洗3次,每次10min后,将膜与相应的辣根过氧化物酶(HRP)标记的二抗在常温下孵育1.5h,再次洗涤3次后,按照ECL试剂盒说明书进行显色,并用化学成像发光系统对条带进行获取及分析。
1.7 统计学处理
应用SPSS 17.0统计软件对资料进行统计分析,每组实验重复3次,用组间t检验对结果进行统计分析,以P<0.05为差别有统计学意义。
2 结 果
2.1 不同浓度Aβ1-42刺激对Tau蛋白磷酸化表达的影响
与对照组相比,用终浓度为20μmol/L凝聚态Aβ1-42处理细胞6h后,Tau蛋白pSer199/202、pSer396表达明显增加(P<0.01)。终浓度为10μmol/L 的Aβ1-42处理细胞,Tau蛋白磷酸化位点表达无明显变化,见图1。
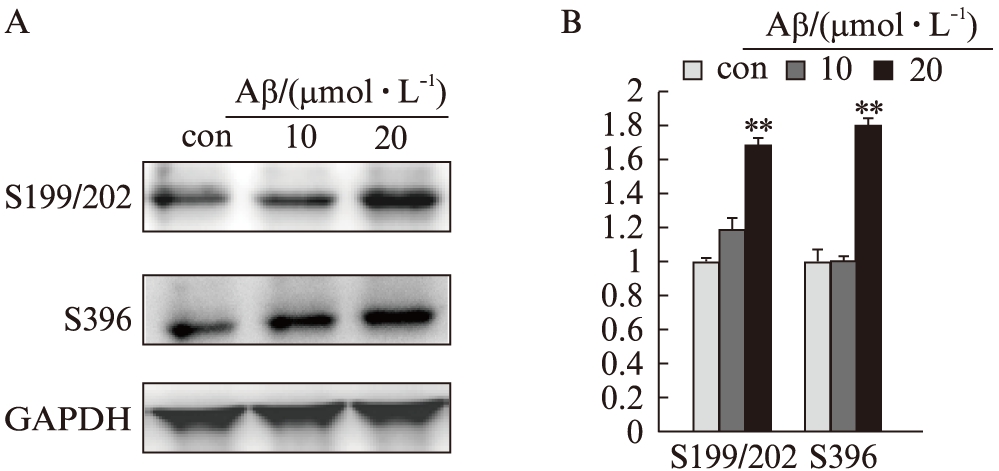
图1 不同浓度Aβ1-42处理后SH-SY5Y细胞Tau蛋白磷酸化位点的表达
Fig.1 Aβ 1-42 induced Tau hyperphosphorylation at different concentrations in SH-SY5Y cells
对照组(con)为DMSO组。A: Western 印迹法检测条带图;B: 统计图;与对照组相比,**P<0.01
2.2 雷公藤红素对Tau蛋白磷酸化表达的影响
Aβ1-42处理细胞后,Tau蛋白pSer199/202、pSer262表达均明显增加,而同时加入雷公藤红素(终浓度为600nmol/L)及Aβ1-42(终浓度为20μmol/L)时,pSer199/202表达明显下降(P<0.01)、pSer396表达同样下调(P<0.05),见图2。
图2 Aβ1-42刺激及用雷公藤红素干预后,SH-SY5Y细胞Tau蛋白磷酸化位点的表达
Fig.2 Effects of tripterine onAβ1-42 induced Tau hyper-phosphorylation in SH-SY5Y cells
A: Western 印迹法检测条带图;B: 统计图;与Aβ组比较,*P<0.05,**P<0.01
2.3 雷公藤红素对p-NF- B表达的影响
B表达的影响
Aβ1-42处理细胞后,p-NF- B表达明显增加(P<0.01),而同时加入雷公藤红素及Aβ1-42时,p-NF-
B表达明显增加(P<0.01),而同时加入雷公藤红素及Aβ1-42时,p-NF- B表达显著下降(P<0.01),见图3。
B表达显著下降(P<0.01),见图3。
2.4 NF- B抑制剂BAY11-7082对Tau蛋白磷酸化表达的影响
B抑制剂BAY11-7082对Tau蛋白磷酸化表达的影响
Aβ1-42处理细胞后,Tau蛋白pSer199/202、pSer396表达均明显增加,而加入BAY11-7082干预后,pSer199/202与pSer396表达均下调(P<0.05),见图4。
2.5 下调TLR4蛋白表达对Tau蛋白磷酸化的影响
下调TLR4蛋白表达后,用Aβ1-42处理细胞,Tau蛋白pSer199/202及pSer396表达均明显下降(P<0.05),见图5。
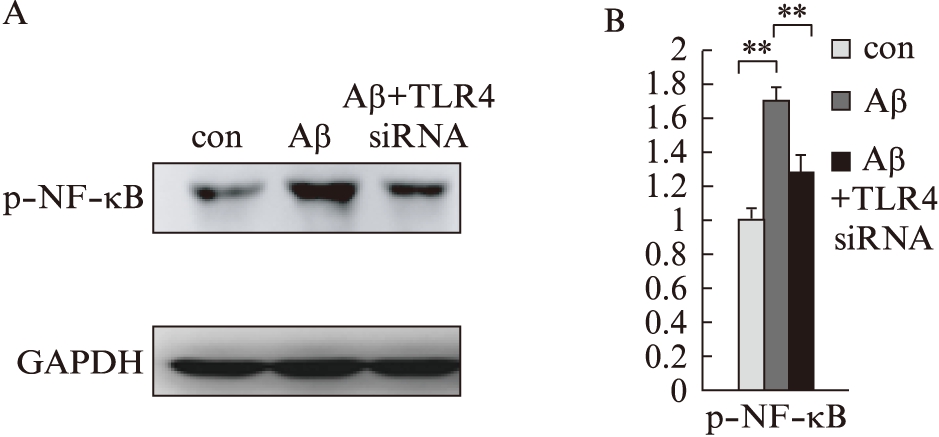
2.6 下调TLR4蛋白表达对p-NF- B表达的影响
B表达的影响
Aβ1-42处理细胞后,p-NF- B表达明显上升(P<0.01),而下调TLR4蛋白后,p-NF-
B表达明显上升(P<0.01),而下调TLR4蛋白后,p-NF- B表达下调(P<0.05),见图6。
B表达下调(P<0.05),见图6。

图4 Aβ1-42刺激及用BAY11-7082干预对SH-SY5Y细胞Tau蛋白磷酸化位点的影响
Fig.4 Effects of BAY11-7082 on Aβ1-42 induced Tau hyperphosphorylation in SH-SY5Y cells
A: Western印迹法检测条带图;B: 统计图;与Aβ组比较,*P<0.05
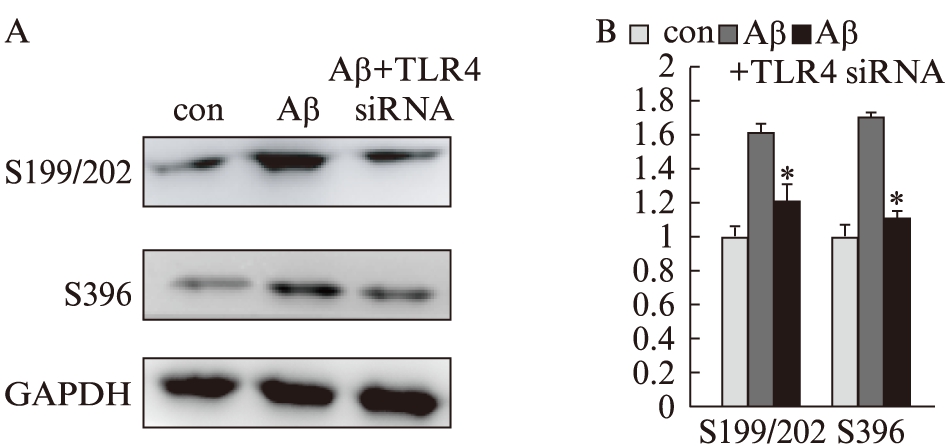
图5 下调TLR4蛋白对Aβ1-42处理SH-SY5Y细胞Tau蛋白各磷酸化位点的影响
Fig.5 Effects of knocking down TLR4 on Aβ1-42 induced Tau hyperphosphorylation in SH-SY5Y cells
Aβ组为用control siRNA后,加Aβ1-42处理。A: Western印迹法检测条带图;B: 统计图;与Aβ组比较,*P<0.05
3 讨 论
Tau蛋白异常磷酸化后,神经元微管结构被破坏,过度磷酸化的Tau蛋白自发聚集形成双股螺旋丝(paired helical filaments, PHF-tau),进一步发展为神经原纤维缠结(neurofibrillary tangles, NT)[6]。Tau蛋白Ser199/202、Ser396位点的过度磷酸化在AD发生、发展中的作用尤为重要。可溶性Aβ沉积后,聚集为AD脑中常见的淀粉样斑块,从而导致神经细胞毒性损伤及神经退行性变。Aβ在体内外能诱导Tau蛋白磷酸化,从而破坏微管的稳定性,损伤轴突转运,引起神经元死亡[7]。本研究用凝聚态Aβ1-42作用于SH-SY5Y细胞,建立Tau蛋白高度磷酸化模型。终浓度20μmol/L的Aβ1-42作用6h后,Tau蛋白磷酸化位点Ser199/202、Ser396表达均明显增加。
雷公藤红素是三萜类天然化合物,由我国科学家于20世纪30年代,首次从中药雷公藤中提取到。研究[4]发现,肝脏切除手术导致小鼠脑神经元Tau蛋白高度磷酸化,出现术后认知功能障碍,而雷公藤红素能显著抑制Tau磷酸化,改善术后认知功能。本研究结果表明,在Tau蛋白异常磷酸化的体外模型细胞中,雷公藤红素处理后,pSer199/202与pSer396表达明显下降。
TLR4是天然免疫系统识别病原微生物的主要受体,在AD、帕金森病(Parkinson disease,PD)和肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)等神经变性疾病的发生发展中发挥着重要作用[8]。目前研究表明,Aβ沉积诱导的炎性反应是导致AD发病的主要机制之一[9]。TLR4/NF- B信号通路是近年来发现与抗炎免疫机制紧密相关的信号传导通路。NF-
B信号通路是近年来发现与抗炎免疫机制紧密相关的信号传导通路。NF- B位于TLR4下游,通过信号传导,促使NF-
B位于TLR4下游,通过信号传导,促使NF- B从细胞质转位进入细胞核,最终导致炎症因子大量释放。本研究显示,雷公藤红素能抑制Aβ1-42导致的NF-
B从细胞质转位进入细胞核,最终导致炎症因子大量释放。本研究显示,雷公藤红素能抑制Aβ1-42导致的NF- B活化,且NF-
B活化,且NF- B抑制剂BAY11-7082干预可明显降低Aβ1-42导致的Tau蛋白异常磷酸化,表明雷公藤红素降低Aβ1-42导致的Tau蛋白异常磷酸化可能与其抑制NF-
B抑制剂BAY11-7082干预可明显降低Aβ1-42导致的Tau蛋白异常磷酸化,表明雷公藤红素降低Aβ1-42导致的Tau蛋白异常磷酸化可能与其抑制NF- B活化有关。Reed-Geaghan等[10]发现,Aβ活化NF-
B活化有关。Reed-Geaghan等[10]发现,Aβ活化NF- B通路需要TLR4参与。本研究发现,下调TLR4蛋白表达,NF-
B通路需要TLR4参与。本研究发现,下调TLR4蛋白表达,NF- B活化同样受到抑制,Tau蛋白pSer199/202及pSer396表达均明显下降。Lee等[5]研究显示,雷公藤红素通过阻止LPS与TLR4/MD2复合体的结合,从而降低TLR4活性[5]。这表明雷公藤红素可能通过降低TLR4活性,抑制TLR4/NF-
B活化同样受到抑制,Tau蛋白pSer199/202及pSer396表达均明显下降。Lee等[5]研究显示,雷公藤红素通过阻止LPS与TLR4/MD2复合体的结合,从而降低TLR4活性[5]。这表明雷公藤红素可能通过降低TLR4活性,抑制TLR4/NF- B信号通路,从而降低Aβ1-42导致的Tau蛋白异常磷酸化。
B信号通路,从而降低Aβ1-42导致的Tau蛋白异常磷酸化。
综上所述,雷公藤红素能明显抑制Aβ1-42导致的Tau蛋白异常磷酸化,其机制可能与其抑制TLR4/NF- B信号通路有关。
B信号通路有关。
【参考文献】
[1] Ballatore C, Lee VM, Trojanowski JQ. Tau-mediated neurodegeneration in Alzheimer’s disease and related disorders[J]. Nat Rev Neurosci, 2007,8(9): 663-672.
[2] Caccamo A, Magrì A, Medina DX, et al. mToR regulates tau phosphorylation and degradation: implications for alzheimer’s disease and other tauopa-thies[J]. Aging Cell, 2013,12(3): 370-380.
[3] Dickson DW. Neuropathology of non-Alzheimer degenerative disorders[J]. Int J Clin Exp Pathol, 2009,3(1): 1-23.
[4] Wan Y, Xu J, Meng F, et al. Cognitive decline following major surgery is associated with gliosis, beta-amyloid accumulation, and tau phosphorylation in old mice[J]. Crit Care Med, 2010,38(11): 2190-2198.
[5] Lee JY, Lee BH, Kim ND, et al. Celastrol blocks binding of lipopolysaccharides to a Toll-like receptor4/myeloid differentiation factor2 complex in a thiol-dependent manner[J]. J Ethnopharmacol, 2015,172: 254-260.
[6] Trotta T, Porro C, Calvello R, et al. Biological role of Toll-like receptor-4 in the brain [J]. J Neuroimmunol, 2014,268(1-2): 1-12.
[7] Stancu IC, Vasconcelos B, Terwel D, et al. Models of β-amyloid induced Tau-pathology: the long and “folded” road to understand the mechanism[J]. Mol Neurodegener, 2014,9(1): 1-14.
[8] Noelker C, Morel L, Lescot T, et al. Toll like receptor 4 mediates cell death in a mouse MPTP model of Parkinson disease[J]. Sci Rep, 2013,3(3): 1393-1411.
[9] Querfurth HW, LaFerla FM. Alzheimer’s disease[J]. N Engl J Med, 2010,362(4): 329-344.
[10] Reed-Geaghan EG, Savage JC, Hise AG, et al. CD14 and toll-like receptors 2 and 4 are required for fibrillar A{beta}-stimulated microglial activation[J]. J Neurochem, 2007,104(2): 524-533.
Effects of Tripterine on Tau hyperphosphorylation induced by β-amyloid peptides in cultured SH-SY5Y cells
CAO Fan-fan1, XU Li-min2, WANG Ying1, PENG Bin1, ZHANG Xue1, ZHANG Deng-hai1
(1. Sino-French Cooperative Central Lab, Shanghai Gongli Hospital, the Second Military Medical University, Shanghai 200135, China; 2. Clinical laboratory, Shanghai Gongli Hospital, the Second Military Medical University, Shanghai 200135, China)
【Abstract】Objective To investigate the effects and mechanisms of tripterine on Tau hyperphospho-rylation induced by β-amyloid in SH-SY5Y cells. Methods The effects of tripterine on the changes of Tau hyperphosphorylation and p-NF- B induced by β-amyloid in SH-SY5Y cells were measured by Western blotting after TLR4 knocking down by siRNA. Results Compared with the control group, the expressions of Tau pSer199/202 and pSer396 were markedly increased after the induction of Aβ1-42, while the hyperphosphorylation of Tau pSer199/202 and pSer396 induced by Aβ1-42 was decreased by tripterine. The increasing of p-NF-
B induced by β-amyloid in SH-SY5Y cells were measured by Western blotting after TLR4 knocking down by siRNA. Results Compared with the control group, the expressions of Tau pSer199/202 and pSer396 were markedly increased after the induction of Aβ1-42, while the hyperphosphorylation of Tau pSer199/202 and pSer396 induced by Aβ1-42 was decreased by tripterine. The increasing of p-NF- B expression induced by Aβ1-42 was decreased after the treatment of tripterine, and NF-
B expression induced by Aβ1-42 was decreased after the treatment of tripterine, and NF- B inhibitor BAY11-7082 also decreased the hyperphosphorylation of Tau pSer199/202 and pSer396 induced by Aβ1-42. The hyperphosphorylation of Tau pSer199/202 and pSer396 and p-NF-
B inhibitor BAY11-7082 also decreased the hyperphosphorylation of Tau pSer199/202 and pSer396 induced by Aβ1-42. The hyperphosphorylation of Tau pSer199/202 and pSer396 and p-NF- B expression induced by Aβ1-42 was decreased after knocking-down TLR4. Conclusion Decreasing of Tau hyperphosphorylation by Tripterine is partially via inhibiting the TLR4/NF-
B expression induced by Aβ1-42 was decreased after knocking-down TLR4. Conclusion Decreasing of Tau hyperphosphorylation by Tripterine is partially via inhibiting the TLR4/NF- B signaling pathway.
B signaling pathway.
【Key words】tripterine; β-amyloid; Tau; Toll like receptor 4; p-NF- B
B
doi:10.16118/j.1008-0392.2016.04.007
收稿日期:2016-04-18
基金项目:上海市浦东新区卫生系统优秀青年医学人才培养计划(PWRq2013-11);上海市青年科技英才扬帆计划(15YF1410800)
作者简介:曹帆帆(1983—),女,主管技师,硕士.E-mail: yffs.c@163.com
通信作者:张登海.E-mail: shanghai_zhang@hotmail.com
【中图分类号】R 741
【文献标志码】A
【文章编号】1008-0392(2016)04-0036-04
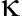 B表达情况;siRNA法下调TLR4表达,Western印迹法检测Aβ1-42导致的Tau蛋白异常磷酸化的变化情况;同时观察下调TLR4后,Aβ1-42刺激对p-NF-
B表达情况;siRNA法下调TLR4表达,Western印迹法检测Aβ1-42导致的Tau蛋白异常磷酸化的变化情况;同时观察下调TLR4后,Aβ1-42刺激对p-NF-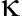 B表达的影响。结果 Aβ1-42刺激SH-SY5Y细胞,导致Tau蛋白Ser199/202、Ser396位点的磷酸化水平增加,而雷公藤红素能降低这两个位点磷酸化水平;Aβ1-42导致细胞p-NF-
B表达的影响。结果 Aβ1-42刺激SH-SY5Y细胞,导致Tau蛋白Ser199/202、Ser396位点的磷酸化水平增加,而雷公藤红素能降低这两个位点磷酸化水平;Aβ1-42导致细胞p-NF-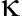 B表达增加,雷公藤红素干预后p-NF-
B表达增加,雷公藤红素干预后p-NF-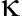 B表达下调,且NF-
B表达下调,且NF- B抑制剂BAY11-7082同样能降低Aβ1-42导致的Tau蛋白异常磷酸化;下调TLR4表达,Aβ1-42导致的Tau蛋白异常磷酸化及p-NF-
B抑制剂BAY11-7082同样能降低Aβ1-42导致的Tau蛋白异常磷酸化;下调TLR4表达,Aβ1-42导致的Tau蛋白异常磷酸化及p-NF- B表达下降。结论 雷公藤红素降低Aβ1-42导致的SH-SY5Y细胞Tau蛋白异常磷酸化可能与其抑制TLR4/NF-
B表达下降。结论 雷公藤红素降低Aβ1-42导致的SH-SY5Y细胞Tau蛋白异常磷酸化可能与其抑制TLR4/NF- B通路活性有关。
B通路活性有关。 B(nuclear transcription factor-
B(nuclear transcription factor-