房星星, 路臻豪, 汤建平, 冯 润, 杨邵英, 龚邦东
(同济大学附属同济医院风湿免疫科,上海 200065)
【摘要】目的 体外探讨人脐带间充质干细胞(mesenchymal stem cells, MSCs)对原发性干燥综合征(primary Sjögren syndrome, pSS)患者外周血活化CD4+ T细胞的免疫抑制效应,分析MSCs促分泌的转化生长因子-β1(transforming growth factor-β1, TGF-β1)、IL-6及IL-10在免疫抑制效应中的作用。方法 原代分离脐带MSCs,并经流式细胞术鉴定。分选成年健康者和pSS患者外周血CD4+T细胞,分为对照组活化CD4+T细胞(CD3、CD28抗体共刺激72h)、MSCs共培养组(活化CD4+T细胞与MSCs共培养72h)和干扰素-γ(IFN-γ)预刺激后MSCs共培养组(活化CD4+T细胞与IFN-γ预刺激后的MSCs共培养72h),活化CD4+T细胞组为对照。ELISA法检测培养上清液中TGF-β1、IL-6、IL-10因子水平。结果 相对于活化CD4+T细胞组,MSCs共培养组培养上清中TGF-β1、IL-6、IL-10浓度均显著升高(P≤0.01),并且活化的CD4+T细胞增殖受到抑制。结论 MSCs通过促分泌TGF-β1、IL-6、IL-10抑制活化的CD4+T细胞增殖,起到免疫抑制作用。
【关键词】干燥综合征; 脐带间充质干细胞; TGF-β1; IL-6; IL-10; 免疫抑制效应
原发性干燥综合征(primary Sjögren syndrome,pSS)是一种以泪腺和唾液腺等外分泌腺高度淋巴细胞浸润为特征的弥漫性结缔组织病,病理机制不明,唾液腺上皮功能紊乱与自身反应性T细胞活化是其重要机制[1]。临床表现复杂,最常见的症状是口、眼干燥,且常伴有内脏损害而出现多种临床表现,部分患者可向恶性淋巴瘤发展。免疫功能紊乱为其发病及病变延续的主要基础,确切病因仍不十分清楚,目前尚无根治的方法。有研究[2]提示,间充质干细胞(mesenchymal stem cells, MSCs)的缺陷参与了pSS的疾病发生,MSCs作为一种有效的治疗pSS的新方法正日益受到关注[2]。
MSCs具有广泛的免疫调节功能,能调节先天性和获得性免疫[3-4],将MSCs加入体外的活化T细胞培养体系中,可抑制T细胞活化与增殖,减少炎性细胞因子干扰素-γ(interferon-γ,IFN-γ)、TNF-α、IL-6和IL-17等的产生,同时增加抗炎因子IL-4、IL-10等的水平[4]。在MSCs抑制CD4+T细胞方面,活化的CD4+T细胞可分泌IFN-γ,后者单独或联合TNF-α、IL-1α、IL-1β等作用于MSCs,使MSC抑制作用增强;虽然MSCs可以通过与靶细胞直接接触,在免疫抑制中发挥一定作用,但其免疫抑制作用主要是通过分泌一些可溶性因子来实现,如转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肝细胞生长因子(hepatocyte growth factor,HGF)、吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)、前列腺素E2(prostaglandin E2,PGE2)、IL-6和IL-10等,从而抑制CD4+T细胞活性。本研究探讨人脐带MSCs促分泌的TGF-β1、IL-6和IL-10在pSS中的免疫抑制效应。
1.1 实验对象
脐带标本取自同济大学附属同济医院足月剖宫产新生儿,经医院伦理委员会批准,并经父母签署知情同意,选取近胎儿段脐带作为MSCs来源。新鲜抗凝外周血标本取自同济大学附属同济医院输血科,经医院伦理委员会批准,并经献血者本人签署知情同意,选取健康者1例,女性24岁,pSS患者1例,女性46岁,主要表现为口眼干伴双手雷诺现象10年,2年前明确诊断为pSS。
1.2 主要试剂和仪器
改良Eagle培养基(DMEM/F12,1∶1)、胎牛血清(fetal calf serum,FBS)、0.25%胰蛋白酶购自美国Gibco公司;Human MSC Analysis Kit购自美国BD公司;Lymphoprep购自挪威Axis-shield公司;台盼蓝染色细胞存活率检测试剂盒购自上海碧云天公司;FITC anti-human CD4、Purified anti-human CD3、Purified anti-human CD28购自美国BioLegend公司;重组人干扰素γ购自美国PeproTech公司;人TGF-β1 ELISA试剂盒、人IL-6 ELISA试剂盒、人IL-10 ELISA试剂盒为上海西唐公司产品。
流式细胞仪BD FACSAria Ⅱ型购自美国BD公司; DENLEY DRAGON Wellscan MK3酶标仪、Multiskan Ascent分析软件购自芬兰Thermo公司。
1.3 实验方法
1.3.1 MSCs的分离、鉴定 无菌条件下取近胎儿段脐带,分别用胶原酶Ⅱ、胰蛋白酶消化,过滤,过滤后的细胞用含10%FBS、10ng/ml表皮细胞生长因子(epidermal growth factor, EGF)、100U/ml青霉素和100U/ml链霉素的DMEM/F12培养基重悬,接种于25cm2培养瓶中,细胞覆盖率达到80%~90%时传代。至第3代FCM鉴定细胞表面抗原CDl9、CD34、CD45、CDl1b、HLA-DR、CD73、CD90、CDl05。
1.3.2 CD4+ T细胞的分离 按以下步骤分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。 将新鲜抗凝外周血用PBS 1∶1稀释;将稀释外周血沿倾斜的离心管壁缓慢加于淋巴细胞分离液上面;22℃,离心半径5cm,2000r/min,离心20min,no brake刹车关闭);吸取白膜层细胞即PBMC,重悬于2~5倍洗涤液中;1500r/min,离心10min),弃上清液;洗涤(1500r/min,15min;1000r/min,10min;800r/min,10min;800r/min,5min);加入10μl FITC-CD4抗体,冰上20~30min;流式细胞仪分选CD4+T细胞。
1.3.3 MSCs与CD4+T细胞体外共培养 分选成年健康者和pSS患者外周血CD4+T细胞,各分为3组: 对照组(活化CD4+T细胞与CD3、CD28抗体共刺激72h)、MSCs共培养组(活化CD4+T细胞与MSCs共培养72h)、IFN-γ预刺激后MSCs共培养组(活化CD4+T细胞与IFN-γ预刺激后的MSCs共培养72h)。共培养前48h在10cm培养皿中接种MSCs,接种细胞量为2×105/皿,用DMEM/F12完全培养基将终体积调整为10ml,共培养前24h在IFN-γ预刺激后MSCs共培养组中加入rhIFN-γ(100ng/ml),接种CD4+T细胞前全换液1次,用DMEM/F12完全培养基将所有培养皿的培养液体积调整为9ml;收集分选出的CD4+T细胞,调整细胞密度为2×106/ml,将细胞接种于上述含有MSCs的培养皿,每个培养皿1ml,即2×106/皿,同时加入CD3抗体(1μg/ml)及CD28抗体(1μg/ml),置37℃恒温CO2培养箱培养72h。
1.3.4 CD4+T细胞计数及细胞活率检测 应用台酚蓝染色细胞存活率检测试剂盒,从各组细胞悬液中吸取100μl转移至相应1.5ml EP管,加入100μl 台酚蓝染色液(2×),轻轻混匀,染色3min,吸取10μl经过染色的细胞,用血细胞计数板计数。
1.3.5 共培养上清液中可溶性因子检测 将共培养上清液平衡至室温,按以下步骤操作。(1) 加样: 每孔各加入标准品或待测样品100μl,将反应板充分混匀后置37℃ 40min;(2) 洗板: 用洗涤液将反应板充分洗涤4~6次,向滤纸上印干;(3) 每孔加入蒸馏水和第一抗体工作液各50μl(空白除外);将反应板充分混匀后置37℃ 20min;(4) 洗 板: 同前;(5) 每孔加酶标抗体工作液100μl;将反应板置37℃ 10min;(6) 洗板: 同前;(7) 每孔加入底物工作液100μl,置37℃暗处反应15min;(8) 每孔加入100μl终止液混匀;(9) 30min内用酶标仪在450nm处测吸光值(D450),检测上清液中TGF-β1、IL-6、IL-10的浓度。
1.4 统计学处理
所有实验数据采用SPSS 17.0统计学软件进行统计学分析,以![]() 表示,多组间均数比较采用单因素方差分析,多重比较采用LSD法,以P<0.05为差异有统计学意义。
表示,多组间均数比较采用单因素方差分析,多重比较采用LSD法,以P<0.05为差异有统计学意义。
2.1 MSCs的鉴定
MSCs呈长梭形、纤维状贴壁生长。经流式细胞仪检测MSCs阳性率为97.5%,流式鉴定结果: FITC-CD90(+),PerCP-CyTM 5.5 CD105(+),APC-CD73(+),而PE-CD45, CD34, CD11b, CD19,HLA-DR均(-),见图1。
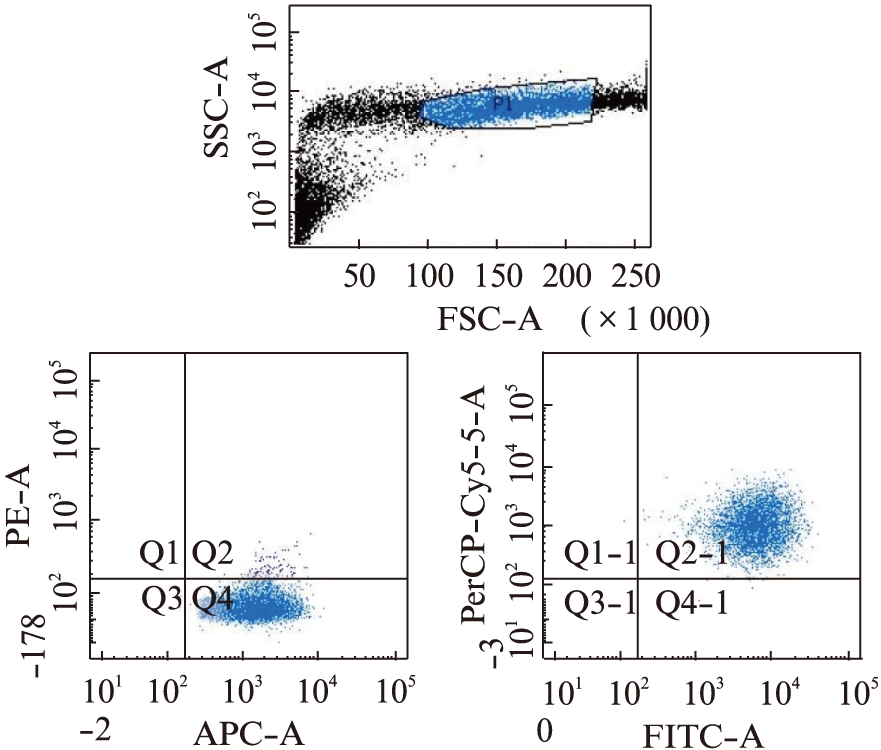
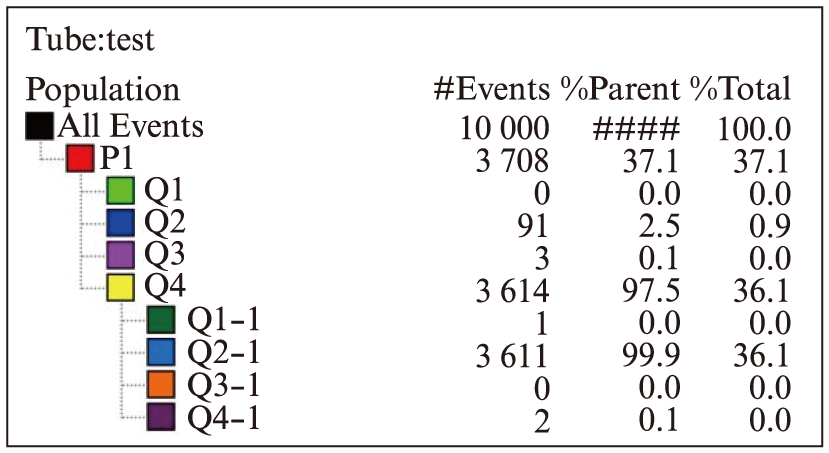
图1 人脐带来源MSCs流式鉴定结果
Fig.1 Human umbilical cord derived MSCs flow type identification results
2.2 FACS分选外周血CD4+T细胞
分离获得的PBMC经FACS分选CD4+T细胞,其中健康者PBMC中CD4+T细胞阳性率为17.8%,pSS患者PBMC中CD4+T细胞阳性率为23.2%。
2.3 MSCs抑制CD4+T细胞增殖
CD4+T细胞接种量为2×106/皿,在加入CD3、CD28抗体共刺激后CD4+T细胞增殖至2.5×106,MSCs共培养组CD4+T细胞数减少至1.8×106,提示MSCs能抑制活化的CD4+T细胞增殖,尤其在用IFN-γ预刺激MSCs后,CD4+T细胞数减少至1.14×106。
2.4 培养上清液中的可溶性因子水平
与活化CD4+T细胞组相比,健康者MSCs共培养组和IFN-γ预刺激后MSCs共培养组TGF-β1水平均有升高(P<0.01和P=0.01);IL-6水平升高(P<0.01),IL-10水平有升高(均P<0.01)。与活化CD4+T细胞组相比,pSS患者MSCs共培养组和IFN-γ预刺激后MSCs共培养组TGF-β1水平均有升高(P<0.01),IL-6水平均升高(均P<0.01),IL-10水平均升高(P<0.01),见表1。
表1 健康者和pSS患者培养上清液中的TGF-β1、IL-6、IL-10浓度比较
Tab.1 Concentrations of TGF-β 1, IL-6 and IL-10 in the culture supernatant of healthy subjects and pSS patients (pg/ml)

与活化CD4+T细胞组比较,*P<0.01
本研究结果证实,相对于活化CD4+T细胞单独培养组,当培养体系中存在MSCs时TGF-β1、IL-6、IL-10浓度均显著升高(P≤0.01),而活化的CD4+T细胞增殖受到抑制,故推测MSCs可能通过促进自身细胞或CD4+T细胞分泌TGF-β1、IL-6、IL-10抑制活化的CD4+T细胞增殖。本实验以活化CD4+T细胞组为对照,故未设MSCs单独治疗组,究竟是MSCs还是CD4+T细胞在其中占主导作用尚有待进一步研究。在体外培养环境中,本研究采用CD3抗体和CD28抗体刺激T细胞增殖,尽管不能完全反映体内的真实免疫情况,但是通过这种模型证实了MSCs在体外可以显著抑制T淋巴细胞增殖;MSCs通过促分泌免疫抑制性细胞因子如TGF-β1、IL-6、IL-10等途径构建局部免疫微环境,发挥免疫抑制作用。
MSCs在体外实验中可以抑制活化的CD4+T细胞增殖,有文献[5]报道其免疫抑制作用呈剂量依赖性,因此本研究中控制MSCs与T细胞比例为1∶10,共培养后通过细胞计数可以观察到显著的抑制效果,用IFN-γ预刺激MSCs可以增强其免疫抑制作用,进一步抑制T细胞增殖,与以往的报道一致,证实了MSCs在体外对活化CD4+T细胞的免疫抑制效应。而且,这种免疫抑制作用没有MHC限制性,实验中与效应T细胞HLA不合的第三方MSCs仍可抑制其增殖。
在MSCs抑制CD4+T细胞方面,体外研究排除了MSCs诱导T细胞凋亡的可能性,指出MSCs与T淋巴细胞间的直接接触和MSCs分泌的可溶性因子对T细胞的间接抑制作用是MSCs的免疫调节机制之一。DiNicola等[6]采用Transwell小室用聚碳酸酯膜将MSC与T细胞分开培养,MSC仍然可以抑制T细胞增殖,故推断MSC对T细胞增殖的抑制作用并不严格依赖于细胞之间的直接接触,MSC分泌的可溶性因子也参与其中。本研究证实,相对于活化CD4+T细胞单独培养组,当培养体系中存在MSCs时TGF-β1、IL-6、IL-10浓度均显著升高(P≤0.01),这些因子可能主要由MSCs分泌,在MSCs发挥免疫抑制效应中起重要作用。
目前,在MSCs诱导的免疫调节机制的相关研究中,还提出其他各种假说,包括吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)介导[7],抑制T细胞有丝分裂[8]从而将活化T细胞阻抑在G0/G1期[3],抑制单核细胞分化为树突状细胞(dendritic cells,DCs)以减少抗原提呈[9]以及诱导调节性T细胞[10]等。结合本研究考虑,MSCs可能通过促分泌TGF-β1、IL-6、IL-10等可溶性因子诱导以上免疫抑制效应,而且这可能与免疫应答调节的启动有关。
此外,微小核糖核酸(microribonucleic acid,miRNA)在细胞因子表达调控中的作用日益受到关注,在细胞因子调节的多个环节都有miRNA直接或间接的调控,而且miRNA调节不同于“开/关”调节,表现为定量基因调节,能精细调节细胞响应外界影响。近年来,研究发现miRNAs可通过调控信号转导、细胞因子的产生、基因的活化与转录等影响T细胞的活化与增殖[11],而TGF-β、IL-10等细胞因子能以不同机制改变细胞miRNAs表达,进而影响细胞功能[12-13],而这些细胞因子均能由MSCs促分泌并发挥免疫抑制效应,故有必要进一步阐明MSCs是否可通过促分泌上述可溶性因子来调控pSS的CD4+T细胞内异常miRNAs,改变活化CD4+T细胞部分miRNAs的表达,从而抑制CD4+T细胞活化、增殖。
总之,MSCs的细胞疗法为pSS患者提供了一种值得尝试的治疗方法。TGF-β1、IL-6、IL-10等可溶性因子甚至相关的miRNAs均可能成为新的免疫调节靶标,调节患者的CD4+T细胞以达到免疫抑制效应。能人为地调节患者的CD4+T细胞以优化pSS诊断和治疗。但是,鉴于pSS中信号通路网的复杂性,目前仍不清楚MSCs促分泌的可溶性因子影响T细胞发育、分化、活化及功能效应的确切机制,尚需要更为深入的研究。
【参考文献】
[1] Fox PC, Speight PM. Current concepts of autoimmune exocrinopathy: immunologic mechanisms in the salivary pathology of Sjögren’s syndrome[J]. Crit Rev Oral Biol Med, 1996,7(2): 144-158.
[2] 路臻豪,汤建平.间充质干细胞在干燥综合征发病机制中的作用与治疗前景[J].中华风湿病学杂志,2013,17: 492-494.
[3] Tran SD,Pillemer SR,Dutra A,et al. Differentiation of human bone marrow-derived cells into buccal epithelial cells in vivo: a molecular analytical study[J]. Lancet, 2003,361: 1084-1088.
[4] Tran SD,Sumita Y,Khalili S. Bone marrow-derived cells: A potential approach for the treatment of xerostomia[J]. Int J Biochem Cell Bio, 2011,43(1): 5-9.
[5] Le Blanc K, Ringdén O. Immunomodulation by mesenchymal stem cells and clinical experience[J]. J Intern Med, 2007,262: 509-525.
[6] Di Nicola M, Carlo-Stella C, Magni M, et al. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J]. Blood, 2002, 99: 3838-3843.
[7] Meisel R, Zibert A, Laryea M, et al. Human bone marrow stromal cells inhibit allogeneic T-cell responses by indoleamine 2,3-dioxygenase-mediated tryptophan degradation[J]. Blood, 2004,103: 4619-4621.
[8] Glennie S, Soeiro I, Dyson PJ, et al. Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells[J]. Blood, 2005,105: 2821-2827.
[9] Jiang XX, Zhang Y, Liu B, et al. Human mesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells[J]. Blood, 2005, 105: 4120-4126.
[10] Djouad F, Plence P, Bony C, et al. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals[J]. Blood, 2003,102: 3837-3844.
[11] 秦安东,徐林.MicroRNAs与T细胞关系的研究进展[J].免疫学杂志,2012,28: 69-72.
[12] Davis BN, Hilyard AC, Lagna G, et al. SMAD proteins control DROSHA-mediated microRNA maturation[J]. Nature, 2008,454: 56-61.
[13] McCoy CE, Sheedy FJ, Qualls JE, et al. IL-10 inhibits miR-155 induction by toll-like receptors[J]. J Biol Chem, 2010,285: 20492-20498.
Mesenchymal stem cells inhibit activation and proliferation of CD4+ cells in Sjögren syndrome by promoting TGF-β1, IL-6 and IL-10 secretion
FANG Xing-xing, LU Zhen-hao, TANG Jian-ping, FENG Run, YANG Shao-ying, GONG Bang-dong
(Dept. of Rheumatology and Immunology,Tongji University,Shanghai 200065, China)
【Abstract】Objective To investigate the immune suppression effect of human umbilical cord mesenchymal stem cells (MSCs) on the activation of peripheral blood CD4+ T cells in primary Sjögren syndrome (pSS) in vitro, and analyze the immunosuppressive effects of transforming growth factor-β1 (TGF-β1 ), IL-6 and IL-10 promoted by MSCs. Methods Primary cultured umbilical cord MSCs were identified by flow cytometry (FCM),and peripheral blood CD4+T cells were sorted both in healthy adults and in pSS patient. CD4+T cells were cultured with CD3, CD28 antibody for 72h to be activated (control group); the activated CD4+T cells were co-cultured with MSCs for 72h (MSCs group)or MSC were pre-stimulated with interferon-γ (IFN-γ), then the activated CD4+T cells were co-cultured with pre-stimulated MSCs for 72h (pre-stimulated group). TGF-β1, IL-6 and IL-10 in the supernatants were detected by ELISA.Results Compared with control group, levels of TGF-β1, IL-6 and IL-10 were significantly increased in MSCs group and pre-stimulated MSCs group(P≤0.01), and CD4+T cell activation was inhibited. Conclusion MSCs may have an immunosuppressive effect,which can inhibit the proliferation of activated CD4+T cells by promoting the secretion of TGF-β1, IL-6 and IL-10.
【Key words】Sjögren syndrome; umbilical cord mesenchymal stem cells; TGF-β1; IL-6; IL-10; immunosuppressive effects
doi:10.16118/j.1008-0392.2016.04.006
收稿日期:2016-02-06
基金项目:国家自然科学基金(81273295);教育部留学回国人员基金(20101174);上海市卫生局基金(2011276)
作者简介:房星星(1983—),女,住院医师,硕士.E-mail: xingxing_fang@126.com
通信作者:汤建平.E-mail: tangjp6512@126.com
【中图分类号】R 817.5
【文献标志码】A
【文章编号】1008-0392(2016)04-0031-05