表1 Real-Time PCR引物序列
Tab.1 Primer sequence of Real-Time PCR
董晓燕1, 张 荣1, 陈信良2
(1. 克拉玛依市中心医院妇产科,新疆 克拉玛依 834000; 2. 上海交通大学医学院附属国际和平妇幼保健院妇科,上海 200030)
【摘要】目的 探讨人阴道壁成纤维细胞中赖氨酸氧化酶(lysine oxidase, LOX)的表达在盆腔器官脱垂发生中的可能机制。方法 选取绝经前、后无症状对照组的阴道前壁组织,用酶消化+组织块培养法分离培养成纤维细胞,细胞免疫荧光法对细胞进行鉴定。针对LOX基因,设计并构建4个慢病毒干扰载体(LOX-RNAi-LV),分别转染HEK-293T细胞,Real-Time PCR检测LOX的表达情况,筛选出其中1个干扰效率最高的LOX-RNAi-LV,将其包装成慢病毒并测定效价,将慢病毒感染人阴道壁细胞,Real-Time PCR检测细胞中弹性蛋白和基质金属蛋白酶-2(MMP-2)的mRNA表达水平。结果 培养出绝经前、后无症状对照组的阴道前壁成纤维细胞各4例,成功筛选出了具有较高干扰效率的LOX-RNAi-LV并成功包装入慢病毒,感染慢病毒的人阴道前壁成纤维细胞,弹性蛋白表达均降低,MMP-2表达均增高,差异有统计学意义。结论 LOX-RNAi-LV慢病毒感染后的人成纤维细胞弹性蛋白表达降低,MMP-2表达增高,因此推测LOX对弹性蛋白和基质金属蛋白酶2的表达有调节作用。
【关键词】赖氨酰氧化酶; 盆腔器官脱垂; RNAi; 慢病毒; 弹性蛋白; 基质金属蛋白酶-2
盆腔脏器脱垂(pelvic organ prolapse, POP)是中老年妇女的常见病,发病机制复杂。近年来研究发现,赖氨酸氧化酶(lysyl oxidase, LOX)的表达异常与盆腔脏器脱垂的发生密切相关,但LOX的作用机制尚不清楚[1]。本研究通过体外细胞培养和构建LOX慢病毒干扰载体(LOX-RNAi-LV)抑制人阴道壁成纤维细胞中LOX基因表达,检测相关因子弹性蛋白(elastin, ELN)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)的表达变化,探讨LOX在盆腔脏器脱垂发生中的作用机制,为POP的预防和治疗提供新的思路和理论依据。
1.1 研究对象
选取2013年2月至2013年6月于同济大学附属同济医院妇科因妇科良性疾病而无POP和(或)SUI行全子宫切除术患者阴道组织10例。本研究经同济大学附属同济医院伦理委员会通过。标本采集经患者和家属同意。
1.2 主要材料
大肠杆菌TOP1O、DH5oL菌株由复旦大学生物医学研究院提供;HEK-293T细胞株购自中国科学院上海细胞生物学研究所;Real-Time PCR试剂盒、限制性内切酶、T4DNA连接酶等购自日本TaKaRa公司,质粒DNA抽提试剂盒购自Omega公司;LipofectAMIN 2000购自美国Invitrogen公司;病毒包装系统Lenti-Easy Packaging Mix为中国Genechem公司产品;鼠抗人Vimentin(E-5)单克隆抗体(sc-373717)一抗、GFP抗体购自美国Santa Cruz公司,FITC荧光标记的山羊抗小鼠IgG二抗购自中杉金桥公司;DMEM高糖培养基、Opti-MEM及胎牛血清购自美国Gibco公司。
1.3 体外成纤维细胞培养及鉴定
手术室无菌条件下,取手术所得阴道前壁组织约0.5cm3于冰生理盐水中冲洗掉血液,以手术刀仔细修剪、剔除黏膜、脂肪等非结缔组织,将标本移入盛有含双抗(100U/ml青霉素、100mg/ml链霉素)的PBS溶液,置于冰上,迅速转移至实验室细胞台。采用胰酶消化+组织块法培养: 阴道壁组织标本先用含双抗的PBS液清洗血迹3~5次,用显微外科剪将韧带剪成大小约1mm3的碎块置于15ml 离心管内,加入组织量2~3倍的0.2% Ⅰ 型胶原酶消化液,混匀,37℃ 5%CO2孵箱内消化60min。消化结束后,离心半径10cm,1000r/min,离心5min,弃去上清液。组织块用PBS清洗,离心半径10cm,1000r/min,离心5min,共重复3次,弃去上清液。消化后的组织块均匀放入25cm2细胞培养瓶内,置于37℃、5% CO2、饱和湿度的培养箱中静置8h,培养瓶侧壁小心加入20% FBS-DMEM高糖培养液,使组织块浸没在培养液中,继续培养。6d后首次更换培养液。在倒置显微镜下观察细胞生长状况及形态变化并拍照。原代细胞生长至80%融合时进行细胞传代,能顺利传代视为培养成功。
取P3代细胞制备细胞爬片,并对该细胞进行波形蛋白(Vimentin)的细胞免疫化学染色: 待细胞生长至约70%融合。用PBS洗5min×2次,4.0%多聚甲醛溶液室温固定15min。用PBS洗5min×3次。0.5% Triton透化2min,PBS漂洗5min×2次。10%血清室温孵育封闭30min后,弃封闭液。加人1∶100稀释的小鼠抗波形蛋白单克隆抗体(一抗),用BSA作阴性对照,置入湿盒,4℃过夜。PBS洗5min×3次,分别用1∶50稀释的FITC荧光标记的山羊抗小鼠IgG(二抗),37℃避光孵育1h,PBS洗5min×3次,对照组中一抗二抗均为PBS。避光处,待爬片晾干,加DAPI,室温孵育4min,PBS洗3次,用手晃动洗涤。避光处,待爬片晾干,用抗荧光淬灭封片剂,4℃避光保存。在共聚焦显微镜下观察、摄像。
1.4 LOX慢病毒干扰载体的构建和病毒包装
1.4.1 设计并构建4个慢病毒干扰载体(LOX-RNAi-LV),转染并进行筛选 根据Genbank公布的人LOX基因序列(NM_001178102),使用Oligo Designer3.0设计针对LOX的4个干扰片段和1个阴性对照,靶序列如下。LOX1: 5′-CGACAACCC-TTATTACAACTA-3′,LOX2: 5′-CCAAGGGACA-TCAGATTTCTT-3′,LOX3: 5′-CTGCACAATTTCA-CCGTATTA-3′,LOX4: 5′-CCTGGCTGTTATGAT-ACCTAT-3′。将合成的序列退火(95℃ 5min,85℃ 5min,75℃ 5min,70℃ 5min),形成双链DNA与酶切后的hU6-MCS-CMV-EGFP载体相连,见图1。转化进入E.coli.TOP10感受态细胞,在50μg/ml Ampicillin LB平板上进行阳性克隆的筛选,阳性菌液进行测序鉴定,测序引物序列: 5′-CCATGATT-CCTTCATATTTGC-3′,提取质粒。
为了筛选出干扰效率最高的1个LOX-RNAi-LV,将5个干扰载体(LOX1、2、3、4、NC)分别转染HEK-293T细胞,命名为LOX1组、LOX2组、LOX3组、LOX4组,LOX-NC组为阴性对照组,不做转染的细胞作为空白对照组。HEK-293T细胞消化接种于6孔板,密度为3×105/ml,37℃、5%CO2培养箱中培养过夜后,每孔加入4μg 重组质粒,转染过程按LipofectAMINE 2000说明书进行。转染48h后收集细胞,提取RNA,并进行反转录,体系为: 5×primer script buffer 4μl,Random6 mers 1μl,PrimeScript RT Enzyme mix 1μl,Oligo dT Primer 1μl,RNA 1μg,用RNAse-Free的水补足至20μl。反转录条件为37℃ 15min,85℃ 5s,所得cDNA用于PCR扩增。以18s-RNA作为内参照,用Primer Primer 5.0设计引物,通过BLAST验证引物的特异性,引物均跨越两个相邻的外显子。所采用的引物序列引物序列如下。18s-RNA上游引物: 5′-TACTCAACACCAACATCGATGGGC-3′,下游引物: 5′-GCTTTCCTCAACACCACATGAGCA-3′;LOX上游引物: 5′-GCTCAGATTTCCCCAAAGAGTGA-3′,下游引物: 5′-TGGCATCAAGCAGGTCATAGTG-3′。引物均由上海生物工程公司合成。基于使用SYBR Green荧光染料对PCR扩增反应中每一个循环产物荧光信号进行实时检测以得到对起始模板的定量分析。
1.4.2 将最高效率LOX-RNAi-LV进行病毒包装并测定效价 筛选出的干扰效率最高的LOX-RNAi-LV,测序正确后进行慢病毒包装和测定病毒效价。包装成的慢病毒命名为LOX-SR。取细胞状态良好,处于对数生长期的HEK-293T细胞,细胞计数后,按照每个10cm的细胞培养皿5×106个细胞接种于细胞培养皿中,37℃,5% CO2的培养箱中培养过夜,转染前2h将细胞培养基更换为Opti-MEM 5ml,将25μl Lent-Easy Packaging Mix和3g慢病毒干扰载体按操作说明书共转染HEK-293T细胞。转染试剂用LipofectAMIN 2000,6h后,将培养基更换为5ml含50μl丁酸钠(110mg/ml)的完全培养基(10%FBS+DMEM+1%P/S),再过6h后,将培养基更换为10ml正常完全培养基(10%FBS+DMEM+1%P/S),48h后收集病毒上清液,离心去除细胞残余,用滤器过滤分装,保存于-80℃冰箱中。用倍比稀释法感染HEK-293T细胞测定病毒效价,在荧光显微镜下观察荧光细胞数量,病毒效价为表达荧光的细胞数乘以相应倍数。
1.5 LOX降表达成纤维细胞中弹性蛋白、MMP-2的表达的测定
1.5.1 LOX降表达模型的建立 人阴道壁成纤维细胞用添加10%胎牛血清、100U/ml青霉素、100mg/ml 链霉素的DMEM高糖培养基培养,置于37℃、5%CO2培养箱中培养,感染前1d将生长状态良好的人阴道壁成纤维细胞以4×104/ml,体积为2ml的密度接种于六孔板中,使第2天细胞密度达到30%~40%。实验分组共分3组。空白对照组: 成纤维细胞中不加入慢病毒;LOX降表达组: 细胞加入200μl(1×108 TU/ml)LOX-RNAi-LV病毒液+3μl polybrene;阴性对照组: 细胞加入200μl(1×108 TU/ml)LOX-NC病毒液+3μl polybrene。感染24h后更换为新鲜完全培养基,继续培养72h,荧光显微镜下观察GFP绿色荧光蛋白的表达情况,计算转染效率。流式细胞仪分选慢病毒感染后带绿色荧光的人阴道壁成纤维细胞,显微镜下观察GFP绿色荧光蛋白的表达情况,计算转染效率。传代感染后的成纤维细胞,收集部分细胞,从mRNA水平检测LOX的表达情况。
1.5.2 Real-Time PCR检测细胞中弹性蛋白和MMP-2的mRNA表达 将流式分选后传代培养的部分细胞收集,加入TRIzol裂解细胞,抽提RNA,反转录成cDNA,Real-Time PCR检测绝经前后样本培养的LOX降表达成纤维细胞中弹性蛋白、基质金属蛋白酶-2的mRNA表达水平,引物序列见表1。
表1 Real-Time PCR引物序列
Tab.1 Primer sequence of Real-Time PCR

1.6 统计学处理
所得所有数据均采用SPSS 13.0统计软件处理。数据以![]() 表示,各组绝经前、后各指标比较采用独立样本的非参数检验,P<0.05为差异有统计学意义。
表示,各组绝经前、后各指标比较采用独立样本的非参数检验,P<0.05为差异有统计学意义。
2.1 人阴道壁成纤维细胞培养及鉴定
成功培养出8例无POP患者阴道壁成纤维细胞,其中绝经前、后各4例。细胞生长情况见图1。
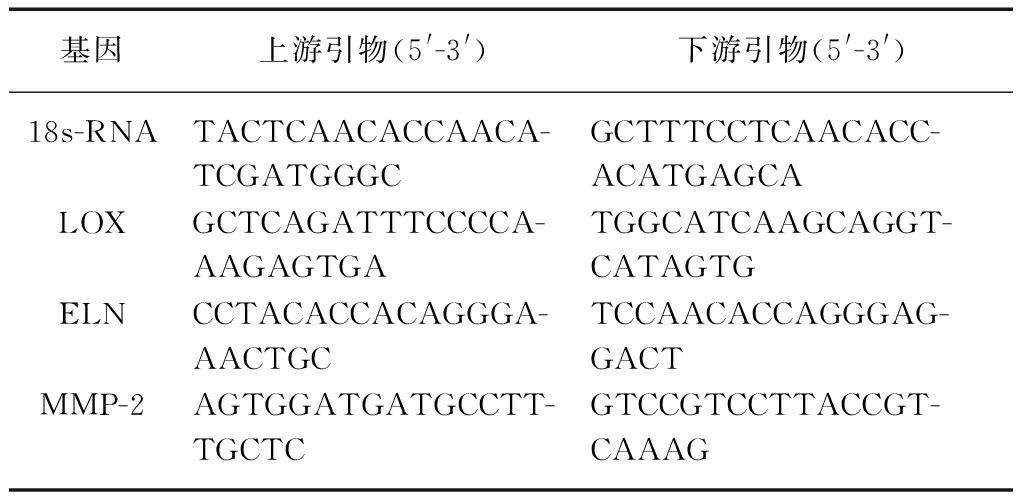
第4代成纤维细胞进行细胞免疫荧光化学染色,所有培养细胞的成纤维细胞的标志物Vimentin为阳性,见图2。胶原消化+组织块培养法能获得高纯度的成纤维细胞,可用于后续试验。

图1 阴道壁成纤维细胞形态
Fig.1 Vaginal wall fibroblasts(×100)
A: 刚迁出原代细胞,生长瘦小;B: 传代细胞,生长呈梭形,少数呈多角形;C细胞呈鱼群样或涡流状生长
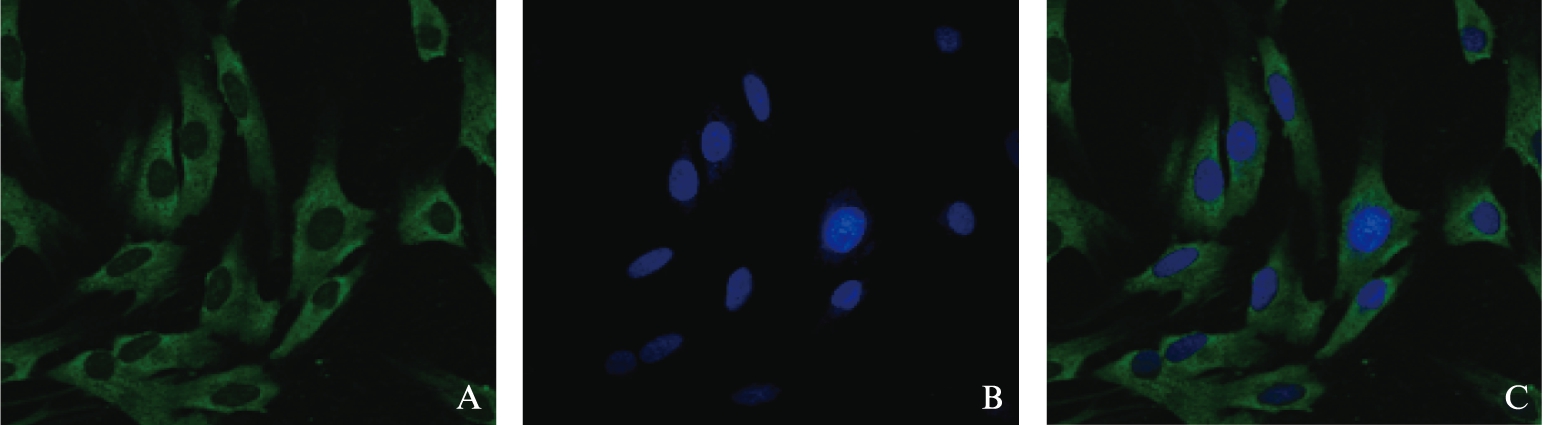
图2 共聚焦显微镜下观察细胞荧光显色
Fig.2 Views of confocal fluorescence microscopy(×600)
A: 细胞Vimentin阳性显示为绿色荧光,B: 细胞核DAPI染色结果,C: 荧光显色合成效果
2.2 最有效的LOX-RNAi-LV的筛选
将转染后48h的细胞进行裂解获取RNA,反转录成cDNA,通过Real-Time PCR,结果显示,LOX-3抑制效率最高,其抑制率>75%, Real-Time PCR分析LOX相对表达量,未转染空白组与LOX-NC的LOX表达效率几乎一致,其他组均明显下降,LOX-3组LOX表达量最低,见图3。
2.3 慢病毒病毒包装效果和效价测定
使用LOX-RNAi-LV和Packaging Mix转染HEK-293T细胞24h后,在荧光显微镜下同一视野的荧光和明场照片,转染了LOX重组质粒的HEK-293T细胞中可见较多的荧光着色细胞,对照组未转染质粒的HEK-293T细胞未见荧光着色细胞,可见慢病毒载体被成功转染,见图4。
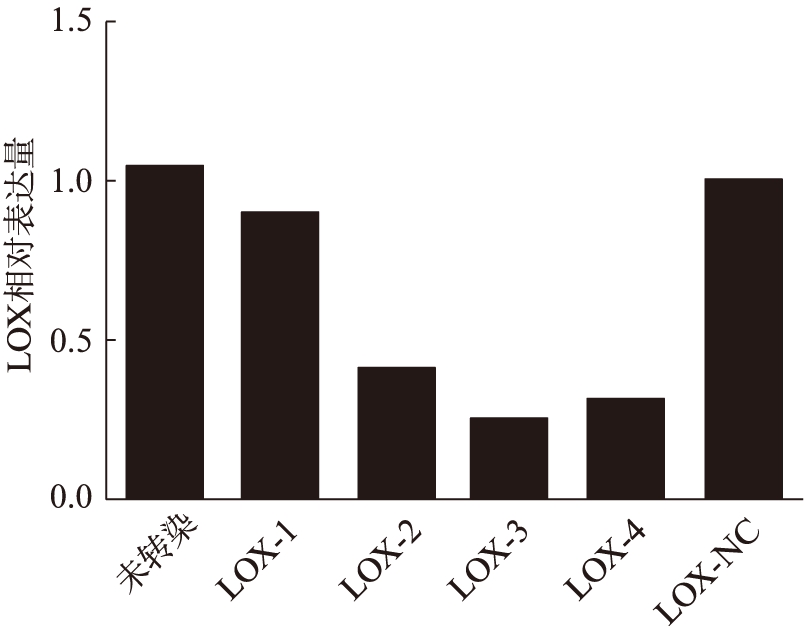
图3 LOX-RNAi-LV筛选与干扰效率比较
Fig.3 Screening of constructed LOX-RNAi-LV vectors
LOX-RNAi-LV慢病毒感染293T细胞72h后,荧光显微镜下观察到较高比例的绿色荧光蛋白,倍比稀释法测定慢病毒效价为: (18+22)/2×10-6=2×107TU/μl=2×1010TU/ml。
2.4 LOX-RNAi-LV慢病毒干扰人阴道壁成纤维细胞LOX的表达
慢病毒感染人阴道壁成纤维细胞LOX降表达
成功样本共8例,绝经前4例,绝经后4例。慢病毒感染人阴道壁成纤维细胞96h,在荧光显微镜下观察,可见较高绿色荧光蛋白的表达,流式细胞仪分选后,各样本中成纤维细胞荧光蛋白表达率>90%,且传代后细胞可稳定表达绿色荧光蛋白,见图5。
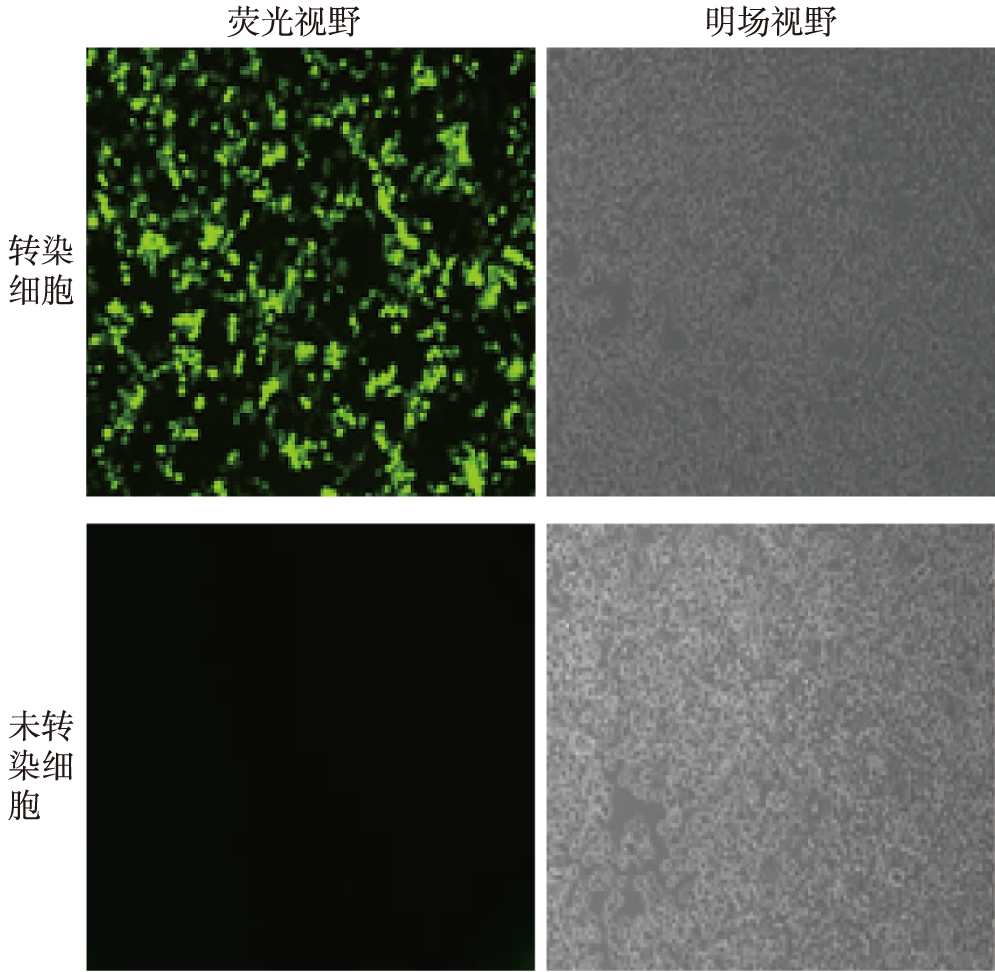
图4 LOX-RNAi-LV转染HEK-293T细胞的明场及荧光照片
Fig.4 LOX-RNAi-LV HEK293T cells transfected with bright-field and fluorescence photo(×40)
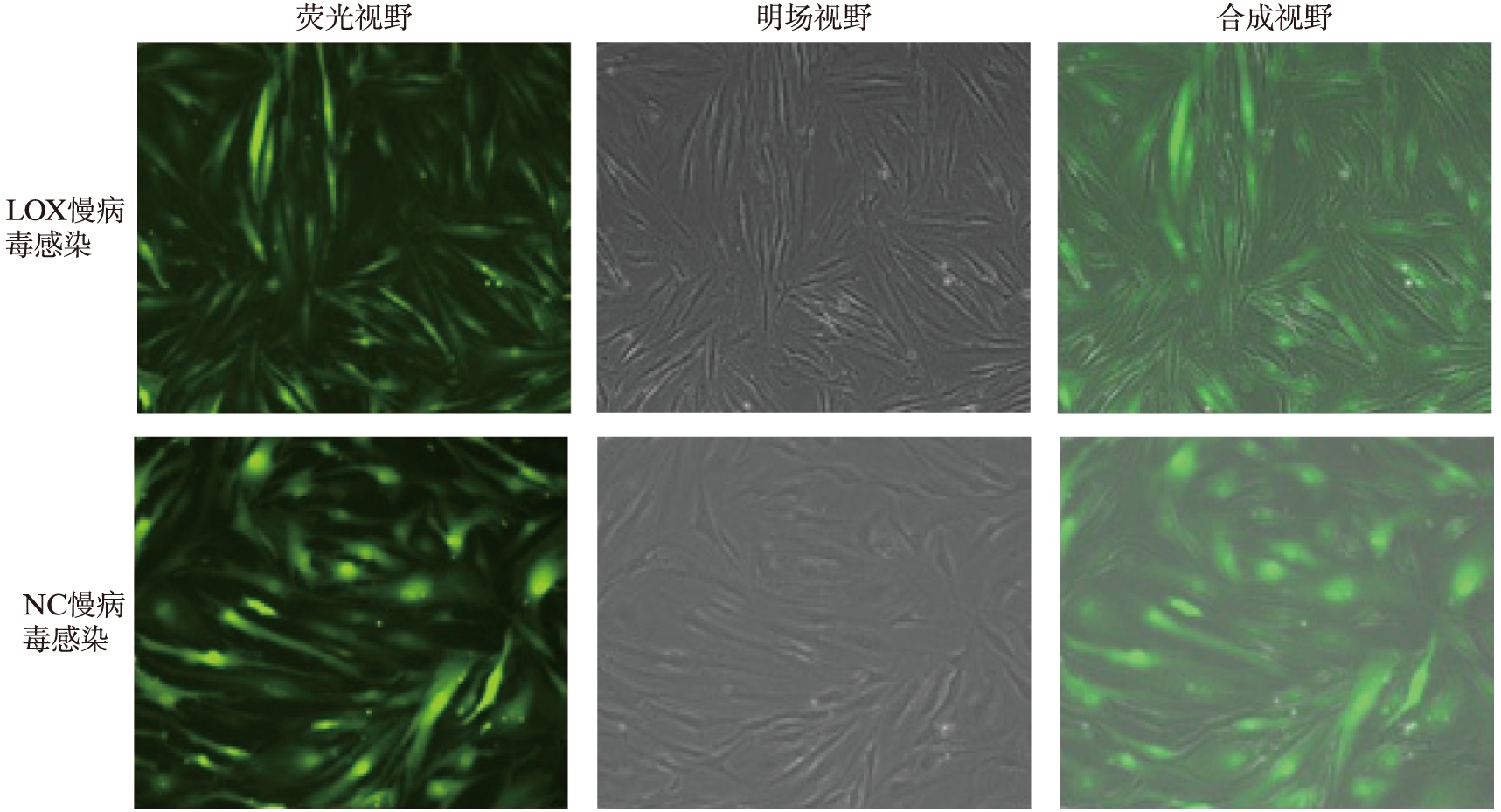
图5 流式荧光细胞分选后绿色荧光蛋白表达情况
Fig.5 GFP expression after flow fluorescence cell sorting(×100)
Real-Time PCR检测成纤维细胞LOX基因mRNA的表达水平,LOX降表达组细胞中LOX基因mRNA的表达水平较空白对照组显著下降(P<0.05),而阴性对照组与空白对照组细胞中LOX基因mRNA的表达水平差异无统计学意义(P>0.05),与预期值相符,见图5。
LOX降表达组细胞中LOX基因mRNA的表达水平较空白对照组下降83.36%,而阴性对照组与空白对照组细胞中LOX基因mRNA的表达水平差异无统计学意义,与预期值相符。空白对照组和阴性对照组LOX、ELN、MMP-2 mRNA表达水平差异无统计学意义,LOX降表达组ELN mRNA表达较空白组和阴性对照组分别降低80.99%和81.31%(P<0.05),而LOX降表达组MMP-2的mRNA表达与空白组和阴性对照组比较,分别升高7.67倍与7.53倍,差异有统计学意义(P<0.05)。
盆腔脏器主要由韧带、肌肉和骨盆所支持,而盆底结缔组织起到连接韧带、肌肉和骨盆的作用。POP的发生与盆底支持组织中结缔组织的弹性、韧性、功能的改变密切相关[1]。结缔组织的主要组成细胞是成纤维细胞,成纤维细胞在维持结缔组织弹性和韧性中起着重要作用。LOX是一种铜依赖的单胺氧化酶,由促纤维化细胞表达和分泌,能催化细胞外基质中胶原和弹性纤维中赖氨酸残基的交联,以维持ECM的正常结构和功能,在ECM中发挥基本的生物学功效[2]。
POP组阴道前壁组织中LOX表达量较无症状对照组明显减少,提示LOX的表达减少与POP的发生有密切关系[3-4]。Klutke等[5]对8名POP妇女和8名无POP妇女的宫骶韧带组织中LOX基因启动子区域进行研究,POP组共发现66个甲基化CpG位点,非POP组只发现1个甲基化CpG位点,提示LOX基因的启动子区域甲基化可能会抑制LOX基因的表达,但目前无相关实验证实启动子区域甲基化与LOX的降表达及POP的发生之间的关系。
LOXL-1表达下降或缺失,可使弹性纤维的交联受阻,形成不稳定的弹性纤维,易于断裂分解,导致盆底支持组织薄弱,最终导致POP。Alperin等[6]研究表明,LOXL1基因敲除小鼠其阴道支持组织的生物学行为发生改变。Liu等[7]研究发现,LOXL1基因敲除小鼠分娩后出现POP的发病率比野生型小鼠高,组织学检查发现尿道旁结缔组织中弹性纤维数目减少,排列不规则,免疫染色显示尿道平滑肌层细胞数目下降,排列紊乱。Liu等[8]发现LOXL1基因缺陷的大鼠无法形成弹性蛋白聚合物。本研究发现,LOX降表达成功的成纤维细胞胞体变小、生长缓慢、细胞贴壁性降低,推测可能与LOX降表达后成纤维细胞生物学行为发生改变有关。LOX降表达成功的阴道壁成纤维细胞与降表达前相比,弹性蛋白的mRNA表达水平明显下降,由此从基因水平推测,LOX可能对弹性蛋白的表达有调节作用。
MMPs能影响局部组织中多种类型胶原蛋白的代谢功能,是细胞外基质降解过程中的重要酶。目前研究表明,盆腔结缔组织中MMP-l、MMP-2、MMP-9与盆底功能障碍性疾病的关系较密切[9-12]。MMP-1主要降解Ⅰ、Ⅱ、Ⅲ型胶原。MMP-2参与Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ型胶原以及弹性蛋白的降解,同时,还能降解胶原酶的降解产物。Gabriel等[9]研究发现POP女性子宫骶韧带中MMP-2表达明显增加。本研究发现,LOX降表达后的成纤维细胞MMP-2mRNA表达较降表达前明显增加,提示LOX降表达后可引起细胞外ECM成分发生改变。
LOX表达降低可能使阴道前壁等盆腔器官支持组织中的胶原和弹性纤维交联异常,机械强度降低,易于断裂分解,或是对蛋白水解酶作用的敏感性增加,导致其功能异常,从而参与POP的发生。因此,通过干扰LOX表达,例如通过上调LOX内源性表达或应用外源性LOX替代,产妇分娩后补充LOX从而加强胶原与弹性纤维交联、增强盆底支持结构的稳定性,有望成为预防和治疗POP的有效方法。
【参考文献】
[1] De Landsheere L, Munaut C, Nusgens B, et al. Histology of the vaginal wall in women with pelvic organ prolapse: a literature review[J]. Int Urogynecol J, 2013,240(12): 2011-2020.
[2] Kagan HM, Li W. Lysyl oxidase: properties, specificity, and biological roles inside and outside of the cell[J]. J Cell Biochem, 2003,88(4): 660-672.
[3] Alarab M, Bortolini MA, Drutz H, et al. LOX family enzymes expression in vaginal tissue of premenopausal women with severe pelvic organ prolapse[J]. Int Urogynecol J, 2010,21(11): 1397-1404.
[4] Zhang SQ, Zhang LL, Yu H. Expression of elastin, lysyl oxidase and elafin in the cardinal ligament of women with pelvic organ prolapse [J]. Zhonghua Fu Chan Ke Za Zhi, 2008,43(9): 675-679.
[5] Klutke J, Stanczyk FZ, Ji Q, et al. Suppression of lysyl oxidase gene expression by methylation in pelvic organ prolapse[J]. Int Urogynecol J, 2010,21(7): 869-872.
[6] Alperin M, Debes K, Abramowitch S, et al. LOXL1 deficiency negatively impacts the biomechanical properties of the mouse vagina and supportive tissues[J]. Int Urogynecol J Pelvic Floor Dysfunct, 2008,19(7): 977-986.
[7] Liu G, Daneshgari F, Li M, et al. Bladder and urethral function in pelvic organ prolapsed lysyl oxidase like-1 knockout mice[J]. BJU Int, 2007,100(2): 414-418.
[8] Liu X, Zhao Y, Pawlyk B, et al. Failure of elastic fiber homeostasis leads to pelvic floor disorders[J]. Am J Pathol, 2006,168(2): 519-528.
[9] Gabriel B, Watermann D, Hancke K, et al. Increased expression of matrix metalloproteinase 2 in uterosacral ligaments is associated with pelvic organ prolapse[J]. Int Urogynecol J Pelvic Floor Dysfunct, 2006,17(5): 478-482.
[10] Usta A, Guzin K, Kanter M, et al. Expression of matrix metalloproteinase-1 in round ligament and uterosacral ligament tissue from women with pelvic organ prolapse[J]. J Mol Histol, 2014,45(3): 275-281.
[11] Wu JM, Visco AG, Grass EA, et al. Matrix metalloproteinase-9 genetic polymorphisms and the risk for advanced pelvic organ prolapse[J]. Obstet Gynecol, 2012, 120(3): 587-593.
[12] 周慧娟,李怀芳.胶原代谢与盆腔脏器脱垂的相关性研究进展[J].同济大学学报: 医学版,2011,32(5),109-113.
Effect of lentivirus-mediated LOX RNA interference on expression of elastin and matrix metalloproteinase-2 in human vaginal wall fibroblasts
DONG Xiao-yan1, ZHANG Rong1, CHEN Xin-liang2
(1. Dept.of Obstetrics and Gynecology, Karamay Central Hospital, Karamay 834000, Xinjiang Uygur Autonomous Region, China; 2. Dept.of Gynecology, the International Peace Maternity and Child Health Hospital,Shanghai Jiaotong University School of Medicine, Shanghai 200030, China)
【Abstract】Objective To investigate the effect of lentivirus-mediated lysine oxidase (LOX) RNA interference on expression of elastic protein and matrix metalloproteinase-2 (MMP-2) in human vaginal wall fibroblasts. Methods Anterior vaginal tissue samples were collected from healthy women before and after menopause, the fibroblasts were isolated from vagina tissue by enzymes digestion. The cultured cells were identified using immunofluorescence method. Four lentivirus RNAi vectors of LOX (LOX-RNAi-LV) were constructed and transfected to HEK-293T cells to screening the most efficient LOX-RNAi-LV. The screened LOX-RNAi-LV was transfected to human vaginal tissue-derived fibroblasts cells. The mRNA expression of elastin and MMP-2 was detected by RT-PCR. Results The LOX-RNAi-LV with high efficiency was successfully constructed and transfected to fibroblasts isolated from anterior vaginal wall. The mRNA expression of elastin was decreased and MMP-2 was increased, compared to those before transfection. Conclusion Results indicate that LOX may have a regulatory effect on the expression of elastin and matrix metalloproteinase 2 in fibroblasts of vagina tissue, and may be involved in pelvic organ prolapse.
【Key words】lysyl oxidase; pelvic organ prolapse; RNAi; Lentiviral vector; elastin; matrix metalloproteinase 2
doi:10.16118/j.1008-0392.2016.04.004
收稿日期:2016-01-16
基金项目:国家自然科学基金面上项目( 81571419)
作者简介:董晓燕(1967—),女,副主任医师,学士.E-mail: klmydong@qq.com
通信作者:陈信良.E-mail: superstarcxl@126.com
【中图分类号】R 711.2
【文献标志码】A
【文章编号】1008-0392(2016)04-0019-06