
图1 裸鼠肺原位瘤模型
Fig.1 The orthotopic lung tumor model in nude mice
A: 裸鼠右肺癌病灶;B: 病灶的局部解剖;C: 肺癌组织光镜像(H-E,×100)
周 薇, 陈 晓, 王 龙, 何文娟, 赵培林
(同济大学医学院组织学与胚胎学教研室,上海 200092)
【摘要】目的 探讨OVA基因修饰的树突状细胞疫苗(DC-OVA)在肿瘤模拟抗原OVA(ovabumin)的裸鼠肺癌模型体内抗肺肿瘤的效应。方法 裸鼠右肺原位接种携带OVA的Lewis肺癌细胞(Lewis lung cancer cell-OVA, LLC-OVA)悬液,建立裸鼠肺癌模型。获取DC,经基因转导制备DC-OVA疫苗。Western 印迹法检测OVA蛋白的表达。获取T细胞,进而制备DC疫苗系统(DC-OVA/T)。CCK8试剂检测DC-OVA刺激后T细胞的增殖。模型建立2周后,尾静脉注射DC-OVA/T。Micro-CT扫描荷瘤裸鼠的胸部,观察肺部影像。H-E染色观察肺部及肿瘤组织形态结构。IHC方法观察脾、淋巴结、肿瘤组织中CD8的表达;观察肿瘤组织中SOX2、BMI1的表达。ELISA法检测血清中IL-12水平。结果 Western印迹法在样本中检测出清晰的OVA条带。DC-OVA强有效地刺激了T细胞的增殖(P<0.05)。DC-OVA/T治疗4周,疫苗组裸鼠肺micro-CT未见明显肿瘤阴影;取材,裸眼可见疫苗组病灶减小,H-E染色显示疫苗组的肿瘤组织较少,肺组织形态较完整。疫苗组裸鼠的脾、淋巴结、肿瘤组织内CD8阳性表达均明显高于对照组(P<0.05,P<0.05,P<0.01),肿瘤组织中的SOX2、BMI1阳性表达明显低于对照组(P<0.05,P<0.05);血清中的IL-12含量较对照组明显升高(P<0.001)。结论 基因修饰的DC疫苗在裸鼠体内具有强大的抗肺癌效应,为临床治疗肺癌提供了新的实验依据。
【关键词】树突状细胞疫苗; 肺肿瘤; 肿瘤干细胞; 肿瘤免疫治疗; 裸鼠
肺癌是我国最常见的恶性肿瘤之一。在过去的10年里,肺癌的5年生存率仍保持在15%左右[1]。目前,临床针对肺癌治疗除了传统的三大治疗方法,免疫治疗也越来越受关注。随着免疫学及分子生物学研究方法的迅速发展,抗原特异性肿瘤疫苗等肿瘤免疫治疗研究陆续展开[2]。树突状细胞作为机体内专职的抗原提呈细胞,在激活免疫T细胞、诱导细胞免疫抗肿瘤的过程中起到关键作用。本研究通过建立裸鼠肺癌模型,构建基因修饰的靶向树突状细胞肿瘤疫苗,使其能特异性识别肿瘤细胞,并刺激特异性T细胞活化为细胞毒性T细胞(cytotoxic T lymphocyte, CTL),观察该疫苗在体内的抗肿瘤效应,并探讨相关机制。
1.1 实验动物
雄性裸鼠35只,6~8周龄,体质量18~22g,由上海斯莱克实验动物有限公司提供,饲养于同济大学实验动物中心。其中15只用于肺癌模型的建立,其余用于实验分组。雄性BALB/c小鼠12只,6~ 8周龄,体质量18~20g,由上海必凯实验动物有限公司提供,用于DC疫苗系统的制备。
1.2 细胞与质粒
携带OVA的Lewis肺癌细胞(Lewis lung cancer cell-OVA, LLC-OVA)由本实验室构建并保存;pHR-CMV-EGFP-OVA为基因转移质粒,由本实验室构建并保存;pLTR-VSVG为包膜质粒、pHIV包装质粒,均由美国路易斯安那州立大学王国顺教授惠赠,本实验室扩增、保存。
1.3 试剂
Matrigel购自上海翊圣生物科技公司;转染试剂购自北京天根生化科技公司;细胞因子mGM-CSF、mIL-4、mIL-2购自英国PeproTech公司;培养基、胎牛血清购自美国Gibco公司;兔抗小鼠CD8、SOX2抗体购自武汉博士德生物公司,兔抗小鼠BMI1抗体购自上海泽众生物有限公司,兔抗鸡OVA抗体购自美国Abcam公司;ECL对比剂购自美国Signalway公司;CCK8试剂盒购自碧云天生物技术研究所;IL-12 ELISA试剂盒购自上海威奥生物有限公司。小动物活体Micro-CT系统型号为Explore Locus,购自美国通用公司。
1.4 裸鼠肺癌模型的建立
1.4.1 细胞准备 LLC-OVA复苏后种于含10%FBS、1%双抗的高糖DMEM培养液中,细胞培养箱孵育,培养至对数生长期,计数7×106/160μl,与Matrigel以2∶1体积比置于冰上混合、冰浴,待接种。
1.4.2 接种 裸鼠共15只(每组5只,分别于注射肿瘤细胞2、3、4周后取材),摆直立体位,头颈固定。1ml注射器吸取细胞混合液(240μl)静置约2min,于裸鼠右肺第五、六肋间垂直穿刺,进针约7mm,匀速缓慢注入。
1.5 DC疫苗制备
1.5.1 DC细胞分离培养及疫苗制备 提取分离3只BALB/c小鼠的股骨与胫骨,冲洗出骨髓腔内骨髓,裂解红细胞,离心半径16.5cm,1500r/min,离心10min,细胞种于含有25ng/ml GM-CSF和4ng/ml IL-4的RPMI-1640培养液,置于细胞培养箱孵育。3d后半量换液。于第6天收集细胞,转移到离心管中,加入浓缩的慢病毒颗粒,离心半径16.5cm,3000r/min,室温离心4h。重悬细胞后转移至培养皿中继续培养,72h后显微镜下观察,详见文献[3]。
1.5.2 Western印迹法检测OVA蛋白的表达 分别裂解DC-OVA、LLC-OVA细胞制备蛋白样品,测定蛋白浓度,聚丙烯酰胺凝胶电泳,湿转法转膜,BSA封闭,一抗(OVA浓度1∶1000;GAPDH浓度1∶2000)4℃ 孵育过夜,HRP标记羊抗兔二抗(1∶2000)和HRP标记羊抗小鼠二抗(1∶2000)室温孵育2h,最后经ECL显影,化学发光成像仪观察、摄片。
1.6 尼龙毛柱法提取T细胞
尼龙毛柱高压蒸汽灭菌,研磨小鼠脾脏用红细胞裂解,过滤、离心后置于尼龙毛柱上,37℃孵育45min,收集滤液。细胞经离心洗并计数后,细胞培养箱孵育,详见文献[3]。
1.7 CCK8检测经DC-OVA刺激后T细胞增殖
T细胞与DC-OVA细胞分别计数1×104/ml,96孔板中各加入100μl细胞悬液,另设3行分别加入200μl 培养液、200μl DC-OVA细胞悬液、200μl T细胞悬液,均设置4个复孔,置细胞培养箱共培养。分别于6、24、48、72h加入等量的CCK8试剂,暗室中静置90min后,用酶标仪在450mm波长处测定各孔的D450值。比较两组细胞增殖指数的差异。增殖指数SI=[DC-OVA/T组D450值-DC-OVA组D450值/T组D450值-空白对照组D450值][4]。
1.8 实验分组
建立稳定模型后,将动物分为对照组、治疗1次组、治疗2次组,共计20只裸鼠。治疗1次组4只裸鼠,于肿瘤细胞接种2周后尾静脉注射8×106/200μl DC-OVA/T,同期有4只裸鼠注射PBS作为对照,肿瘤细胞接种后第4周取材;治疗2次组共4只裸鼠,肿瘤细胞接种后第2周和第3周,分别尾静脉注射上述剂量的DC-OVA/T,治疗1次组共4只鼠,肿瘤细胞接种后第3周尾静脉注射上述剂量的DC-OVA/T,4只裸鼠在同时间注射PBS作为对照。
1.9 Micro-CT扫描
肿瘤细胞接种后第6周进行Micro-CT扫描。将受试裸鼠腹腔注射戊巴比妥钠(浓度1%、30mg/kg)麻醉后,仰卧平放于CT扫描床上,小鼠胸部用绷带固定。Micro-CT机的扫描软件以Fluro方式选择胸部区域进行扫描,具体扫描参数如下,电压: 50kVp,电流: 450μA,曝光时间: 300ms,扫描技术: 360度,探测器bin模式: 4×4,平均帧数: 2,扫描时间: 16min。扫描完成后将生成的原始图像经标准的体模校正后重建至精度为0.092mm的高分辨率,拍片。
1.10 脾、淋巴结、肿瘤等组织的病理学检测
1.10.1 H-E染色 受试裸鼠常规取材,经石蜡切片,二甲苯、梯度乙醇脱蜡,苏木精染胞核、伊红染胞质,中性树胶封片,显微镜下观察。
1.10.2 IHC法观察 受试裸鼠常规取材,行石蜡切片。IHC观察脾、腋窝淋巴结、肿瘤组织中CD8的表达以及肿瘤组织中肿瘤干细胞标志物SOX2、BMI1的阳性分布、强弱变化。二甲苯、梯度乙醇脱蜡,3%H2O2浸15min,5%山羊血清封闭30min,一抗4℃孵育过夜。二抗孵育1h,DAB显色,苏木素滴染、脱水,中性树胶封片,显微镜下观察。
1.11 ELISA法检测裸鼠血清IL-12水平
将各浓度标准品取100μl依次加入一排7孔中,1孔只加样品稀释液作为零孔。小鼠血清用样品稀释液稀释后每孔加100μl,室温孵育90min;生物素抗小鼠IL-12抗体工作液按每孔加入100μl,室温孵育60min,ABC工作液按每孔加入100μl,室温反应30min。每孔依次加入TMB显色液,室温避光反应25min。每孔加入TMB终止液。用酶标仪在450nm测定D450值。
1.12 统计学处理
相关实验数据用Prism5、SPSS 19.0统计学软件进行绘制和分析,组间比较用独立t检验分析,P<0.05为差异有统计学意义。
2.1 裸鼠肺癌模型的建立
受试裸鼠肺部接种肿瘤细胞后分时段取材。第2周取材,大体标本观察,可见其右上肺叶体积约 0.5cm3 大小的瘤块;第3周取材,可见裸鼠均稳定荷瘤,右侧肺叶的中、上肺叶长有界限分明的瘤体;第4周取材,可见右肺几乎完全已被肿瘤组织所占据,正常肺组织仅存少量,左侧肺部亦见累及,裸鼠出现恶病质,甚至死亡(图1A、图1B,箭头所示为肿瘤)。H-E染色显微镜下可见典型肿瘤组织特征,低倍镜下肿瘤区域呈较强的嗜碱性,高倍镜下有较多的核分裂相(图1C)。

图1 裸鼠肺原位瘤模型
Fig.1 The orthotopic lung tumor model in nude mice
A: 裸鼠右肺癌病灶;B: 病灶的局部解剖;C: 肺癌组织光镜像(H-E,×100)
2.2 DC疫苗的鉴定
三质粒系统包装,产生慢病毒颗粒,经浓缩后,转导DC,72h后显微镜下观察可见细胞内荧光,见图2。
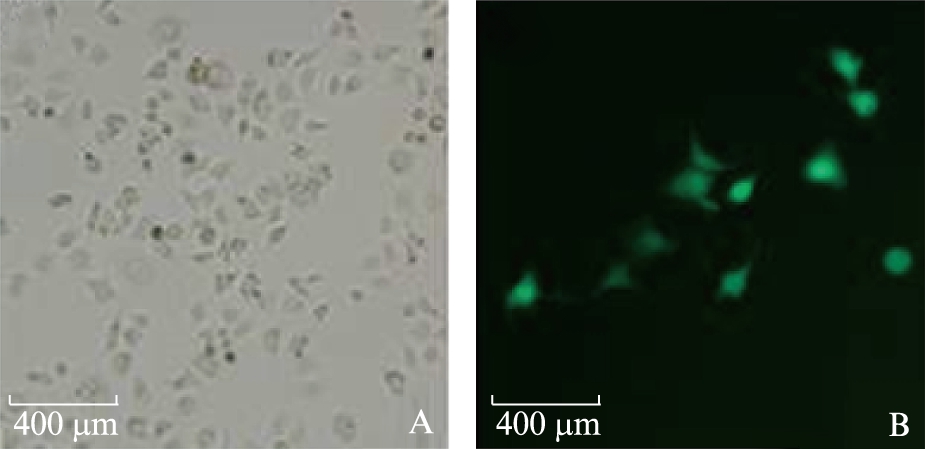
图2 DC疫苗检测
Fig.2 Detection of DCs by fluorescence microscopy
A: 常规显微镜观察DC-OVA;B: 荧光显微镜观察DC-OVA
2.3 OVA蛋白的鉴定
Western印迹法检测OVA蛋白在DC-OVA中的表达,结果可见相对分子质量约35000的蛋白条带,表明OVA蛋白成功在DC中表达,见图3。
2.4 T细胞经DC-OVA疫苗刺激后的增殖曲线
CCK8试剂盒检测结果显示,DC-OVA刺激T淋巴细胞增殖的能力明显优于无疫苗刺激的T细胞的增殖能力(P<0.05),表明疫苗刺激后T细胞增殖分化的能力进一步提高,见图4。

图3 Western印迹法结果
Fig.3 Western Blotting analysis
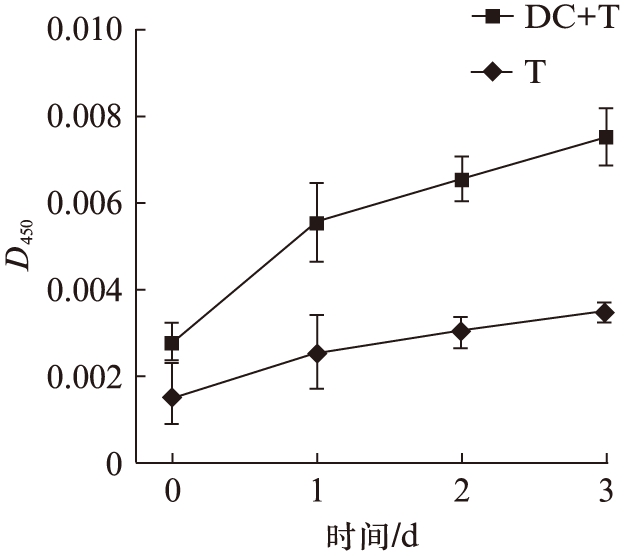
图4 T细胞增殖曲线
Fig.4 Proliferation of T cells
2.5 DC-OVA对裸鼠肺原位肿瘤的治疗作用
对6周组受试裸鼠进行Micro-CT活体扫描,选取冠状位图片进行比较,结果显示,治疗组肺叶轮廓清晰,未见明显肿瘤阴影(图5A);对照组右侧肺部见异于正常组织的阴影,左侧则多发感染(图5B)。6周组裸鼠行病理解剖,裸眼观察治疗组裸鼠病灶体积明显小于对照组,H-E病理组织染色显示,治疗组肿瘤细胞坏死,边缘有淋巴细胞浸润(图5C);对照组肿瘤细胞排列无序、大小不一,核多分裂相(图5D)。
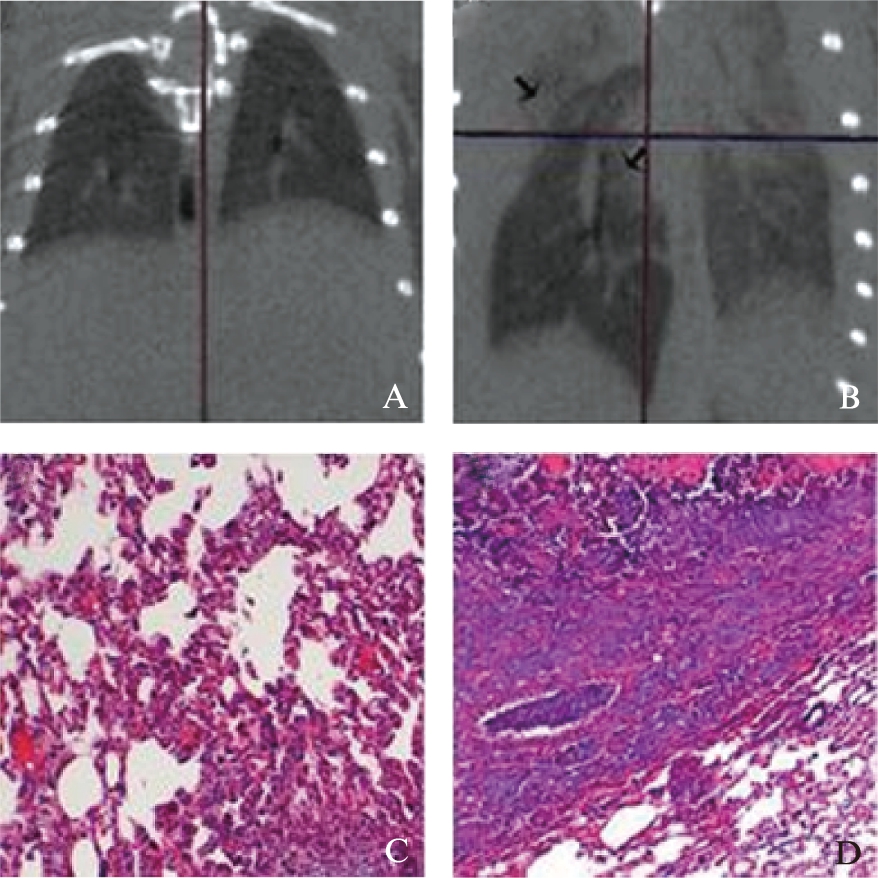
图5 DC-OVA对裸鼠肺癌的治疗作用
Fig.5 The anti-lung tumor effects of DC-OVA in nude mice
A: 正常裸鼠CT扫描;B: 携有肿瘤的裸鼠CT扫描;C: 正常肺组织光镜像(H-E,×100);D: 肺癌组织光镜像(H-E,×100)
2.6 裸鼠组织IHC检测结果
裸鼠的脾脏、淋巴结、肿瘤组织经常规石蜡切片后,IHC方法检测CD8在DC-OVA疫苗组脾脏、淋巴结、肿瘤组织中的表达,显微镜下可见CD8多分布于细胞质,呈棕黄色或黄褐色,见图6、表1。6周后取材病理检测,SOX2多定位于细胞核中,呈黄褐色,见图7。BMI1阳性表达较强,在胞质中呈棕黄色,多分布于肿瘤的边缘处,见图8。对照组裸鼠肿瘤组织中SOX2、BMI阳性表达较DC-OVA疫苗组高(t=22.94,P=0.001<0.05;t=2.81,P=0.03<0.05),差异有统计学意义。
表1 CD8在各组织中阳性表达的IOD值
Tab.1 IOD of CD8 expression in tissues![]()
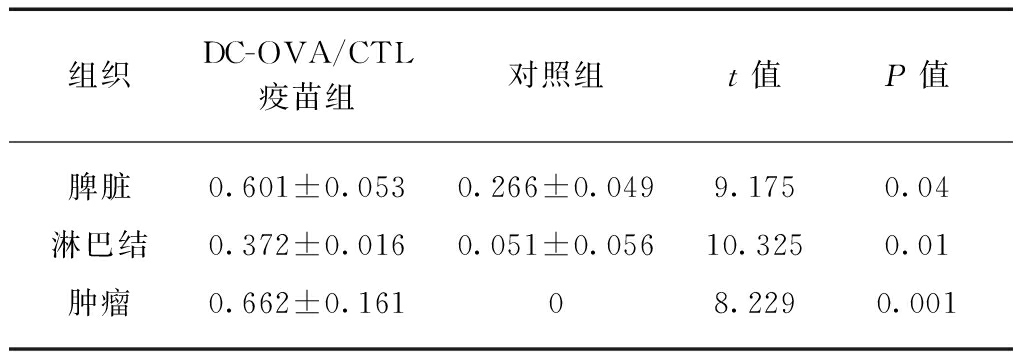

图6 CD8在脾脏、淋巴结、肿瘤组织中的表达
Fig.6 Expressions of CD8 in spleen, lymph nodes and tumor tissue(IHC,×400)
2.7 血清中IL-12的分泌水平检测
ELISA检测表明,DC-OVA/CTL疫苗系统4周组血清中IL-12的含量显著高于PBS对照组(t=5.872,P=0.02<0.05),6周组血清中IL-12含量也显著高于对照组(F=121.54,P<0.001),其中治疗2次组的IL-12含量比治疗1次组的IL-12高(图9)。这表明,DC-OVA疫苗不仅在数量上促进T淋巴细胞的增殖,而且在功能上促进T淋巴细胞分化成CTL,增强其杀伤肿瘤细胞的活性。
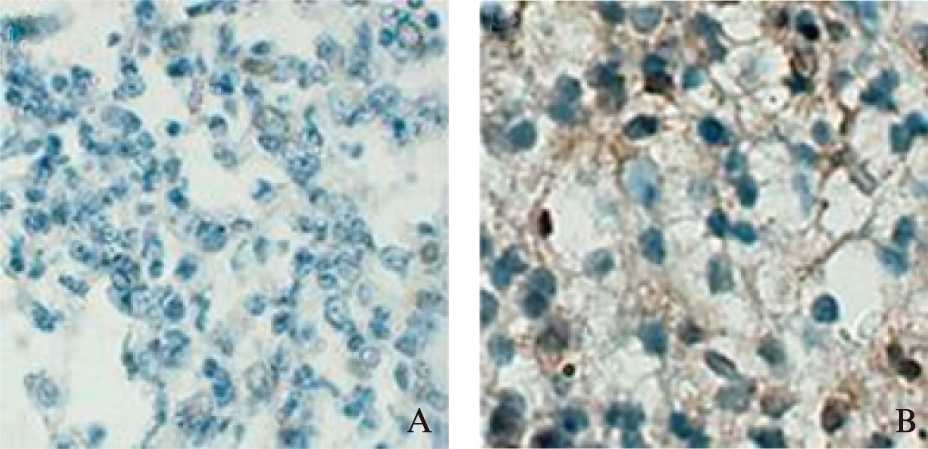
图7 SOX2在肿瘤组织中的表达
Fig.7 Expression of SOX2 in tumor tissues(IHC,×400)
A: DC-OVA疫苗组;B: PBS对照组
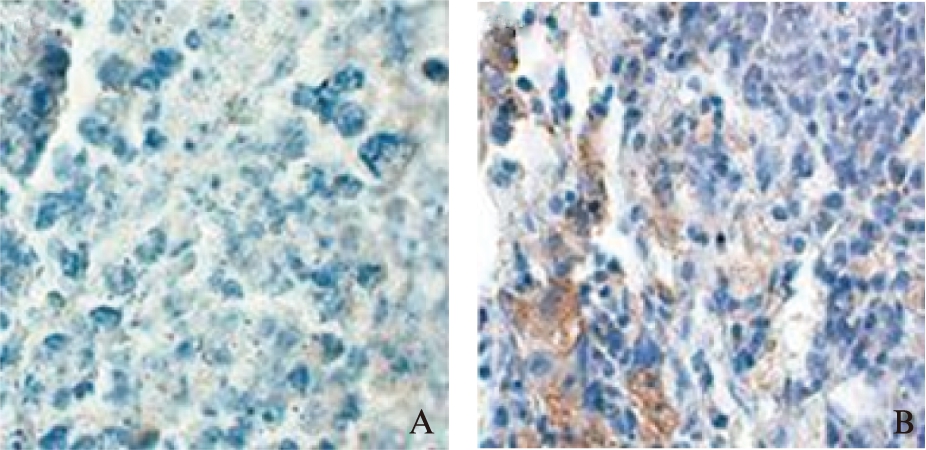
图8 BMI1在肿瘤组织中的表达
Fig.8 Expression of BMI1 in tumor tissues(IHC,×400)
A: DC-OVA疫苗组;B: PBS对照组
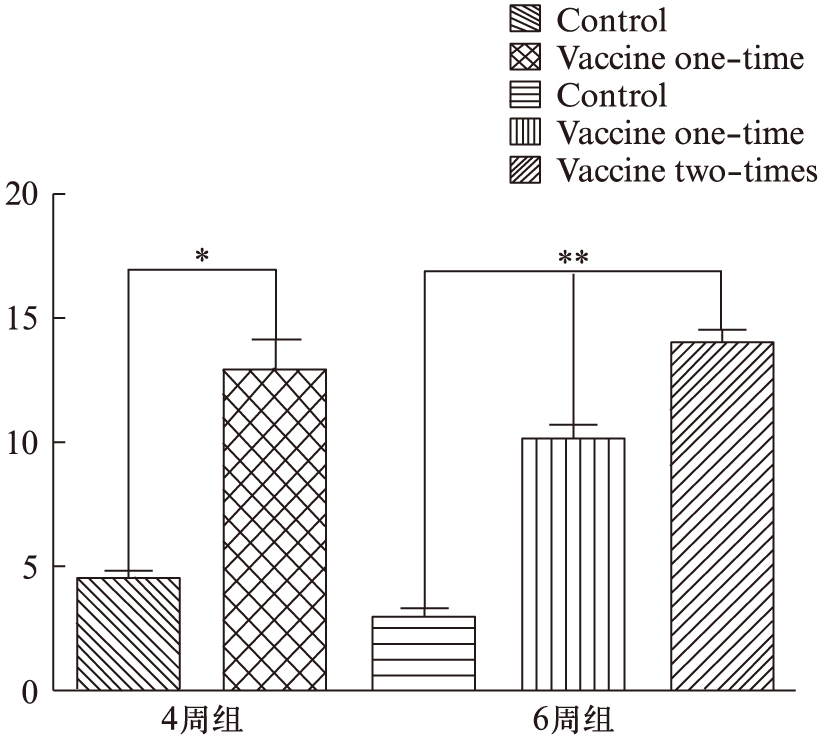
图9 肿瘤治疗过程中血清IL-12的含量差异
Fig.9 Differences of content of IL-12 in Serum during tumor therapy
*P<0.05,**P<0.001
鼠肺癌模型是与机体肺癌发生发展及其肿瘤微环境最为相近的一种模型,建立稳定有效的鼠肺癌模型是研究肺癌体内治疗效应的基础[5]。目前,小鼠肺癌模型的建立主要包括以下几种: (1) 化学致癌物质通过吸入或口服的方式让小鼠患癌,但该方式患癌周期比较长,且在给予小鼠致癌物质时,实验人员也同样暴露在致癌环境中,常此以往会对身体产生不良后果[6]。(2) 通过给小鼠腹腔麻醉,行气管切开术,向其注入肿瘤细胞悬液,该方法易引起小鼠感染,术后并发症、死亡率较高;且肺癌的部位、大小都不太好确定[7]。本实验室采取细胞悬液与Matrigel混合,行肺原位穿刺直接注入肿瘤细胞,建立鼠肺原位瘤模型。Matrigel是一种从富含胞外基质蛋白的EHS小鼠肿瘤中提取出来的可溶性基底膜制备物,其主要成分有层粘连蛋白,Ⅳ型胶原等,可模拟体内细胞基底膜的结构和功能[8]。Matrigel的特性能使接种的肿瘤细胞固定在注射部位,使肿瘤形成单一病灶。该方法感染率低、成瘤率高,操作简单,可重复性强,大幅度地提升了肺癌原位模型的成功率。较前几种方法,更适合裸鼠等免疫缺陷类小鼠为实验对象的体内相关实验研究。
DC作为抗原提呈细胞,能有效激活T细胞分化。现阶段制备DC疫苗多采用肿瘤细胞的裂解产物负载DC、重组肿瘤相关抗原致敏DC、肿瘤细胞的mRNA转导DC。上述抗原都是取自肿瘤细胞,并不能确保只针对肿瘤组织表达,而对机体的正常组织无不良影响。本实验选用鸡卵清蛋白(ovabumin, OVA)作为模拟抗原,其作为一种疫苗佐剂本身不具备抗原性,DC负载OVA蛋白,能够靶向识别肿瘤细胞LLC-OVA,有效激活疫苗组裸鼠体内共回输的T淋巴细胞,促进了T细胞活化并促进其进一步分化成CTL,有效杀伤肿瘤细胞。
肿瘤干细胞是指一类具有自我更新能力和多向分化潜能的细胞群体。目前尚缺乏医学界高度认可的肺肿瘤干细胞的标志物。BMI1是多梳基因(polycomb of genes, PcP) 家族的一员,作为原癌基因,BMI1在多种恶性肿瘤组织中都有过表达且与肿瘤预后相关[9]。本研究显示,BMI1在DC-OVA/CTL疫苗组的表达明显低于对照组。研究[10]表明,SOX2在肺癌组织中有较高的表达,且该表达同肿瘤体积呈正相关。SOX2可能是参与肺癌发生发展的重要因素,有望成为肺癌新的标志物及治疗靶点。本研究结果显示,SOX2抗体表达定位于细胞核,呈深棕黄色,其在DC-OVA/CTL疫苗组的表达也低于对照组。IL-12又称为细胞毒淋巴细胞成熟因子(cytotoxic lymphocyte maturation factor, CLMF),是由DC、巨噬细胞等抗原提呈类细胞分泌产生,刺激T细胞增殖分化生成CTL细胞,发挥杀伤肿瘤细胞的作用。本实验结果表明,疫苗组裸鼠血清中的IL-12含量高于对照组,发挥了其免疫调节功能,提高疫苗组小鼠T细胞的免疫杀伤能力。
DC-OVA/CTL疫苗不仅能够杀伤肿瘤细胞,也能够杀伤部分肿瘤干细胞。其疗效与肿瘤抗原的选择、肿瘤抗原的负载方式、DC疫苗数量、DC注射方式及次数等多种因素有关。
【参考文献】
[1] Jemal A,Bray F,Center MM,et al. Global cancer statistics [J]. CA Cancer J Clin,2011,61(2): 69-90.
[2] 马美丽,钟华,钱嘉琳,等.肺癌的免疫治疗进展[J].医药专论,2015,36(5): 1-6.
[3] 陈晓,周薇,王方策,等.DC-OVA疫苗在裸鼠体内的抗肿瘤效应[J].同济大学学报: 医学版,2015,36(4): 1-6.
[4] 崔晶,林阿丽,刘群,等.负载hGM-CSF基因的慢病毒载体介导的宫颈癌DC疫苗抗肿瘤活性的初步研究[J].现代妇产科进展,2010,19(6): 445-449.
[5] 刘馨,伍治平,左曙光,等.小鼠Lewis肺癌原位模型的构建[J].中国肺癌杂志,2010,13(1): 42-47.
[6] Tago Y, Yamano S, Wei M, et al. Novel medium-term carcinogene-sis model for lung squamous cell carcinoma induced by N-nitroso-tris-chloroethylurea in mice[J]. Cancer Sci, 2013,104(12): 1560-1566.
[7] Zou Y, Fu H, Ghosh S, et al. Antitumor activity of hydrophilic paclitaxel copolymer prodrug using locoregional delivery in human orthotopic non-small cell lung cancer xenograft models[J]. Clin Cancer Res, 2004,10(21): 7382-7391.
[8] 胥孜,刘菲,邹纯朴,等.小鼠肺癌原位模型的建立[J].中国医药导报,2015,12(1): 1-5.
[9] 黄梅,李苏宜.Bmi-1基因及其在恶性肿瘤表达的临床意义[J].实用肿瘤杂志,2010,25(4): 494-497.
[10] 许伟,位云艳,谭瑶曦,等.干细胞转录因子Sox2在肺癌中的表达和意义[J].中国肺癌杂志,2013,16(11): 591-596.
Anti-lung cancer effect of dendritic cell vaccine modified with OVA gene in nude mice
ZHOU Wei, CHEN Xiao, WANG Long, HE Wen-juan, ZHAO Pei-lin
(Dept. of Histology & Embryology, School of Medicine, Tongji University, Shanghai 200092, China)
【Abstract】Objective To investigate the anti-tumor effect of dendritic cell vaccine with OVA gene in nude mice. Methods The lung cancer model was induced by injection of Lewis lung cancer (LLC) cells with OVA suspension in the right lung of nude mice. The OVA gene was transducted into DC to prepare the DC vaccine (DC-OVA). Expression of OVA protein in DC-OVA was detected by Western blotting. The T cells were gained to construct DC-OVA/T vaccine system. T cell proliferation stimulated by DC-OVA vaccines was detected by Cell Counting Kit-8. Two weeks after the model was established, the mice were injected with DC-OVA/CTL through tail vein. The chest of mice was scanned by micro-CT to observe lung images. The lung specimens were stained by H-E Staining for pathological examination. The expressions of CD8 in spleen, lymph nodes and tumor tissue were detected by immunohistochemistry (IHC); the expressions of SOX2, BMI in tumor tissue were also detected by IHC; serum IL-12 was detected by ELISA kit. Results OVA stripes were observed clearly detected by Western blotting. The proliferation of T cell stimulated by DC-OVA was increased significantly (P<0.05). Micro-CT did not show the image of lung cancer after 4 weeks DC vaccine treatment. Macro and micro morphological examination showed attenuated lesions of lung cancer in DC-OVA group. The expressions of CD8 in spleen, lymph nodes, and tumor tissues of nude mice in DC vaccine group were higher than those in control group (P<0.05, P<0.05, P<0.01). The expressions of SOX2, BMI1 in tumor tissue were lower in DC vaccine group than in control group (P<0.05, P<0.05). The serum levels of IL-12 was higher in DC vaccine group than that in control group (P<0.001).Conclusion DC vaccines modified by OVA can target lung cancer in nude mice to elicit anti-cancer effect.
【Key words】DC vaccine; lung cancer; tumor stem cell; tumor immunotherapy; nude mice
doi:10.16118/j.1008-0392.2016.04.003
收稿日期:2016-03-04
基金项目:上海市教委科研创新重点项目( 08ZZ19)
作者简介:周 薇(1990—),女,硕士研究生.E-mail: zhouweiyang1991@163.com
通信作者:赵培林.E-mail: plzhao@yahoo.com
【中图分类号】R 73
【文献标志码】A
【文章编号】1008-0392(2016)04-0012-07