·基础研究·
唐伦先1, 许明正1, 张 颖1, 刘显东1, 张 华2
(1. 同济大学附属东方医院急诊内科,上海 200120; 2. 同济大学附属东方医院老年医学科,上海 200120)
【摘要】目的 观察线粒体通透性转换孔(mitochondrial permeablity transition pore, MPTP)在慢性心力衰竭模型中的作用,并初步探讨n-3PUFA的干预作用及其可能机制。方法 采用阿霉素腹腔注射Wistar大鼠建立心力衰竭模型。正常对照组10只,青年和老年心力衰竭组各20只(安慰剂组和n-3PUFA组各10只)。进行超声心动图心功能检测和心肌病理组织学检查;ELISA法检测各组大鼠血清中BNP的表达;提取心肌线粒体,检测膜电位和MPTP孔活性;TUNEL法检测心肌细胞凋亡指数;免疫组化法检测各组大鼠左心室心肌细胞Cleaved-Caspase3的表达。结果 n-3PUFA治疗组与安慰剂组相比,各项心功能指标均明显改善,LVEDD和LVESD明显降低,LVEF及LVFS明显升高(P<0.05),而且心肌损害明显减轻,血清BNP明显降低(P<0.05)。心力衰竭组与对照组相比,心肌线粒体膜电位降低,MPTP孔活性增加,通透性增强,心肌细胞凋亡指数增加,心肌Cleaved-Caspase3蛋白表达升高(P<0.05)。n-3PUFA治疗组与安慰剂组相比,心肌线粒体膜电位增加,MPTP孔活性降低,通透性降低,心肌细胞凋亡指数降低,心肌Cleaved-Caspase3表达下调(P<0.05)。结论 n-3PUFA可能通过抑制心肌线粒体MPTP孔活性,抑制心肌细胞凋亡,有效改善年心力衰竭模型的心功能。
【关键词】线粒体通透性转换孔; 慢性心力衰竭; n-3多不饱和脂肪酸; Caspase-3蛋白; 大鼠
线粒体在心肌细胞存亡过程中起着非常重要的作用,线粒体通透性转换孔(mitochondrial permea-bility transition pore, MPTP)的开放导致线粒体肿胀、膜电位的崩解、呼吸链的脱耦联、细胞色素C(cytochrome C)及其他致凋亡因子的释放,最终导致细胞凋亡或坏死[1]。研究提示MPTP可能在慢性心力衰竭,特别是老年慢性心力衰竭的发生发展中起着非常重要的作用。n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acid, n-3PUFA)可通过改善线粒体功能和增加ATP的合成而发挥心血管的保护作用[2],但目前尚未有n-3PUFA作用于心力衰竭心肌MPTP的报道。既往研究提示,与青年大鼠相比,MPTP孔在老年大鼠慢性心力衰竭模型中可能起了重要作用,本研究拟通过建立慢性心力衰竭大鼠模型,评价和比较MPTP在青年和老年慢性心力衰竭模型的作用及n-3PUFA的可能保护机制。
1.1 实验动物
雄性Wistar大鼠各15只(合格证号: SYXK 2013-1-0003),健康月龄分别为3个月(青年,体质量200~250g)与12个月(老年,体质量450~500g),清洁级,由上海交通大学医学院实验动物中心提供。
1.2 主要实验仪器和试剂
注射用盐酸多柔米星(阿霉素)购自浙江海正药业股份有限公司,批号33021980;n-3PUFA购自美国Sigma-Aldrich公司;原位凋亡检测试剂盒(POD法)购自Roche公司(货号11684817910);线粒体膜电位检测试剂盒(JC-1,产品编号C2006)、纯化线粒体膜通道孔(MPTP)荧光检测试剂盒(产品编号GMS10095.2)购自碧云天生物技术研究所。大鼠BNP ELISA试剂盒购自北京达科为生物技术有限公司。荧光分光光度计为日立公司产品,光学显微镜和图像处理系统为尼康公司产品,荧光显微镜为奥林巴斯产品。
1.3 方法
1.3.1 造模方法 CHF组参照文献[3]建模,即腹腔注射盐酸阿霉素(2mg/kg),每周1次,连续8周。8周后行心脏超声检查以及血流动力学监测,以心腔扩张,射血分数(ejection fraction,EF)<60%为标准,入选心力衰竭组。各组均正常饮食喂养,观察大鼠的活动量、饮食量、尿量变化和精神状态。
1.3.2 动物分组及给药 青年组和老年组各15只。每组又分为正常对照组(n=5)、安慰剂组(n=5)和n-3PUFA组(n=5)。均统一饲养,黑夜、白昼各12h。参照文献[3]的方法,n-3PUFA组从注射盐酸阿霉素起,每日喂养n-3PUFA 8周,剂量为1mg/kg体质量,安慰剂组则每日经胃管喂养相同剂量生理盐水。
1.3.3 心功能测定 苯巴比妥钠20mg/kg腹腔注射,轻度镇静大鼠,使用13MHz线阵探头于n-3PUFA治疗6~8周后分别采集大鼠胸骨旁左心室长轴切面、短轴乳头肌切面二维动态图像,并于短轴切面获得M型超声心动图。调节帧频至224~483帧/s,图像深度1cm,采集左室多普勒组织速度图像。测量左心室舒张末期内径(left ventricular end diastolic diameter, LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter, LVESD)、左室射血分数(left ventricular ejection fraction, LVEF)和左室短轴缩短率(left ventricular fraction shortening, LVFS)。
1.3.4 心肌病理学观察 取心尖部组织,用10%甲醛常规固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片厚度4μm,H-E染色,显微镜下观察。
1.3.5 ELISA法测定BNP的表达 处死大鼠,心脏直接取血,离心半径14cm,3000r/min,离心5min,上清液冻存于-80℃冰箱,ELISA法分别测定BNP的表达。
1.3.6 心肌细胞凋亡检测 处死大鼠,取不同组左心室组织约200g,以4%甲醛固定隔夜,乙醇梯度脱水,石蜡包埋并切片,标本行TUNEL染色,棕色为TUNEL染色阳性的凋亡细胞,蓝色为被苏木精染色的细胞核。应用Image-Pro Plus6.0软件分析照片时,每组内每张切片随机挑选至少3个200倍视野进行拍照。拍照时让组织充满整个视野,对每张照片进行分析得出每张照片阳性细胞的比率。凋亡指数(apoptotic index, AI)=阳性细胞数/总细胞数。
1.3.7 心肌线粒体的分离 处死大鼠,取不同组左心室组织约100mg,按照组织线粒体分离试剂盒说明书分离心肌线粒体,加入40μl线粒体储存液,重悬线粒体。
1.3.8 心肌线粒体膜电位和膜通透性检测 将20μg总蛋白的线粒体加入JC-1工作液中,荧光分光光度计测定相应的荧光值,以红光/绿光的比值表示膜电位,比值降低,表明线粒体通透性增加;20μg总蛋白的线粒体按GENMED MPTP荧光检测试剂盒说明书测定线粒体MPTP,使用分光光度计检测540nm处线粒体吸光度值(D540)。
1.3.9 免疫组化检测Cleaved-Caspase3的表达 严格按照免疫组化试剂盒说明书步骤操作,抗体工作浓度为1∶50。Cleaved-Caspase3蛋白阳性产物为分布于细胞质的棕黄色颗粒。用Image-Pro Plus6.0图像分析系统选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张切片进行分析,得出Cleaved-Caspase3蛋白阳性的累积光密度值(IOD)。
1.4 统计学处理
数据均以![]() 表示,使用GraphPad Prism 5数据统计软件进行作图和分析。非配对student t检验用以比较两组间的差别,多组间差别使用one-way AVONA Tukey检验进行分析,P<0.05为差异具有统计学意义。
表示,使用GraphPad Prism 5数据统计软件进行作图和分析。非配对student t检验用以比较两组间的差别,多组间差别使用one-way AVONA Tukey检验进行分析,P<0.05为差异具有统计学意义。
2.1 超声心动图心功能检测和血浆BNP水平比较
青年和老年大鼠心力衰竭模型组LVEDD、LVESD均明显高于对照组,而LVEF及LVFS则明显降低(P<0.05);n-3PUFA治疗组大鼠与心力衰竭安慰剂组相比,各项心功能指标均明显改善,LVEDD和LVESD明显降低,LVEF及LVFS明显升高(P值均<0.05)。
无论青年还是老年组,心力衰竭大鼠血浆BNP水平均显著高于正常对照组,n-3PUFA治疗组与心力衰竭模型安慰剂组相比,BNP水平明显降低,差异有统计学意义(P<0.05),见表1。
表1 各组心功能检测指标及BNP的变化
Tab.1 Changes of cardiac function and levels of BNP in each group![]()
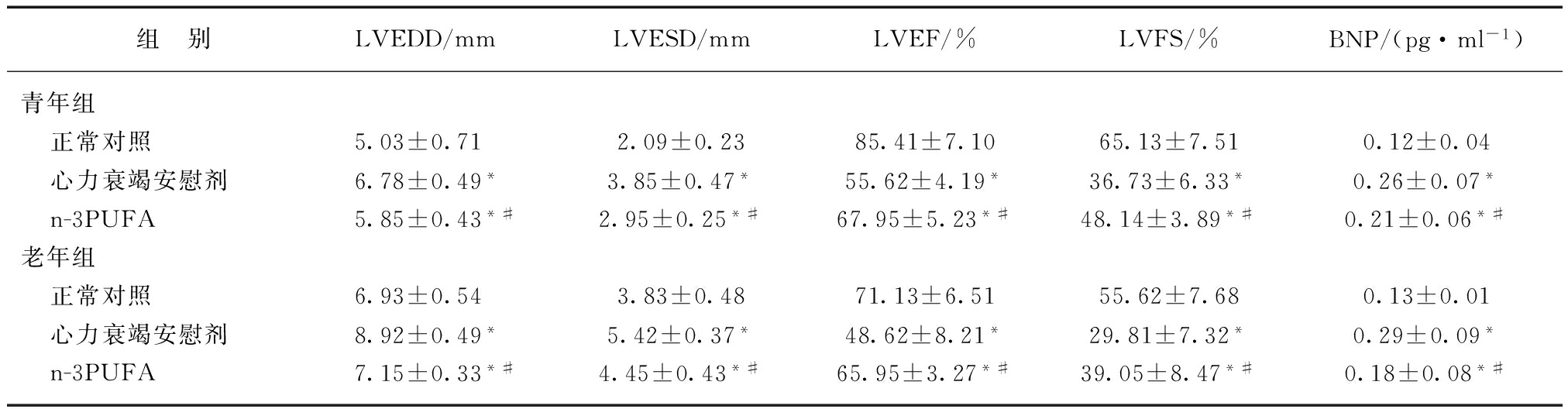
与对照组相比,*P<0.05;与心力衰竭安慰剂组相比,#P<0.05
2.2 大鼠心肌组织H-E染色观察
病理学观察显示,青年和老年对照组大鼠心肌细胞排列整齐,胞核清晰,可见横纹,无心肌纤维的破坏,细胞间隙正常,细胞大小均一;心力衰竭模型组细胞则见心肌纤维排列紊乱,胞质疏松,细胞肿胀,肌原纤维溶解断裂明显,并且在心肌纤维间可见结缔组织增生。n-3PUFA组虽也有心肌纤维的轻度变形等损害,但与模型组相比心肌损害明显减轻,见图1。
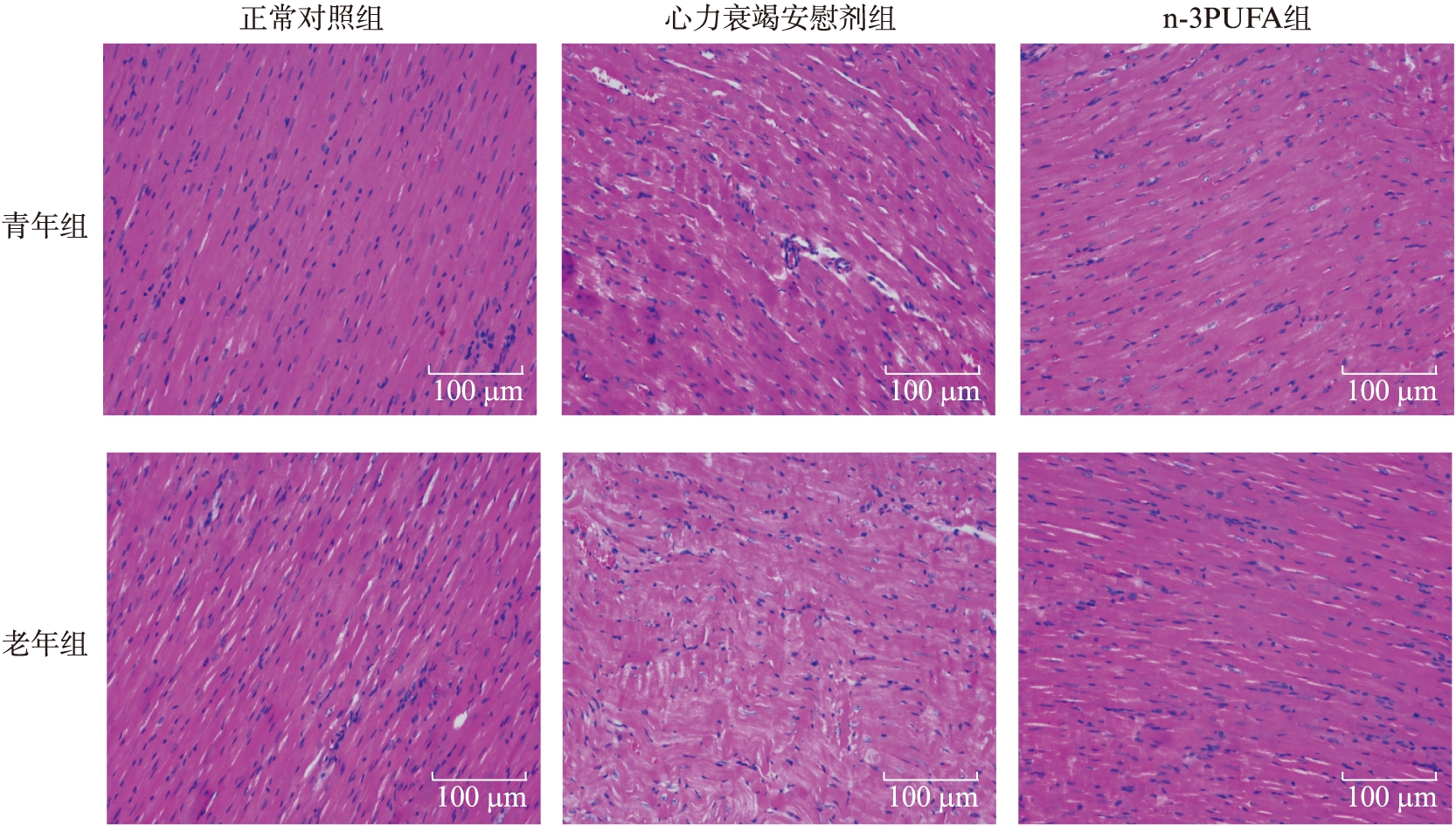
图1 光镜下大鼠心肌组织H-E染色图片
Fig.1 Histopathological changes of myocardial tissue in heart failure rats(H-E staining,×100)
2.3 心肌线粒体膜电位和MPTP活性
青年和老年心力衰竭组大鼠心肌线粒体膜电位明显低于正常对照组,MPTP孔活性增加,差异具有统计学意义(P<0.05);与心力衰竭模型组相比,n-3PUFA治疗组大鼠明显增加线粒体膜电位,降低MPTP孔活性(P<0.05)。老年组正常大鼠MPTP孔活性低于青年组大鼠,但差异无统计学意义,见表2。
表2 心肌组织线粒体膜电位和MPTP孔活性
Tab.2 The membrane potential and MPTP activity of mitochondria in myocardial tissue of each group![]()
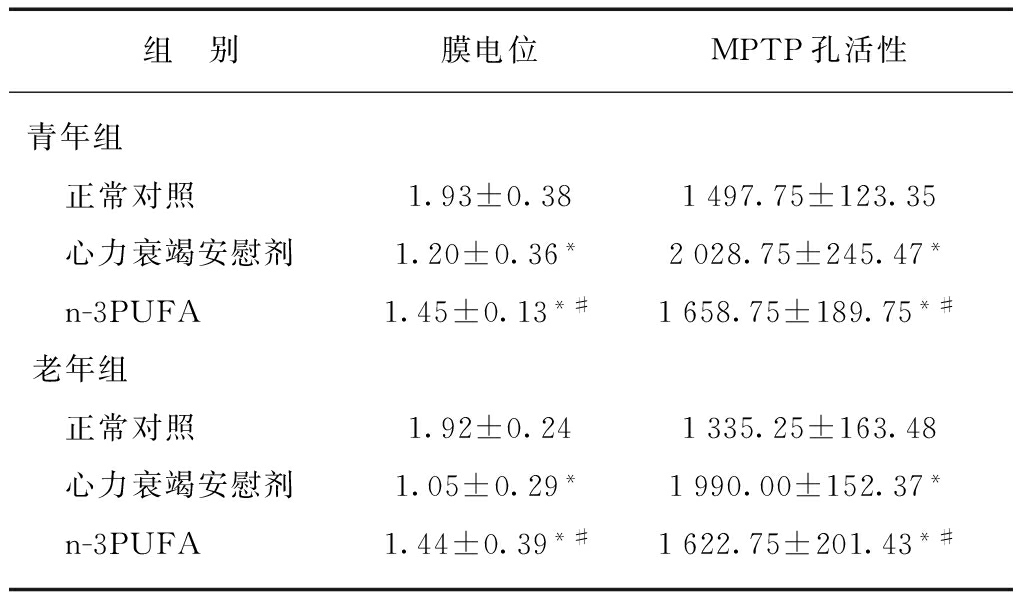
与对照组相比,*P<0.05;与心力衰竭安慰剂组相比,#P<0.05
2.4 TUNEL法检测各组大鼠心肌细胞凋亡指数
青年和老年对照组仅有少量凋亡细胞,心力衰竭模型和n-3PUFA组均较对照组凋亡细胞增多(P<0.05);与安慰剂心力衰竭组相比,n-3PUFA治疗组大鼠心肌凋亡细胞减少,差异具有统计学意义,见表3、图2。
表3 各组大鼠心肌细胞凋亡指数、Cleaved-Caspase3蛋白的表达
Tab.3 The apoptotic index and cleaved-caspase3 protein in myocardial tissue of each group![]()
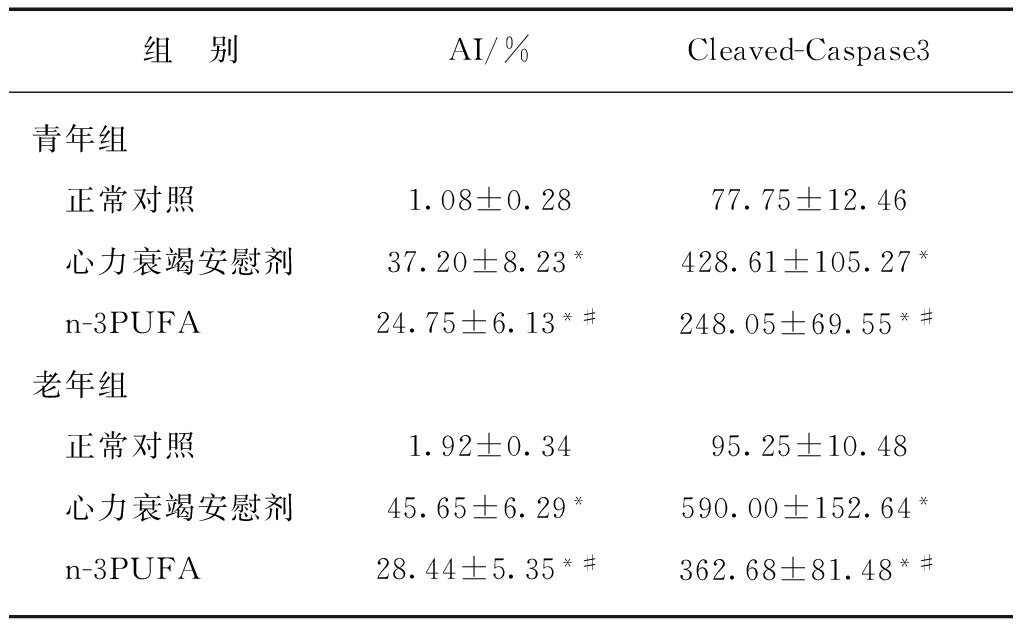
与对照相比,*P<0.05;与心力衰竭安慰剂组相比,#P<0.05
2.5 大鼠心肌组织Cleaved-Caspase3蛋白的表达
青年和老年各组大鼠心肌组织Cleaved-Caspase3蛋白的阳性表达为分布于细胞质中的棕黄色颗粒。正常对照组仅见少许Cleaved-Caspase3蛋白表达,而心力衰竭安慰剂组和n-3PUFA组大鼠心肌细胞中Cleaved-Caspase3蛋白的表达均明显增多,颜色明显加深;与心力衰竭安慰剂组相比,n-3PUFA治疗组大鼠心肌细胞Cleaved-Caspase3蛋白的表达明显降低,差异具有统计学意义(P<0.05),见表3、图3。
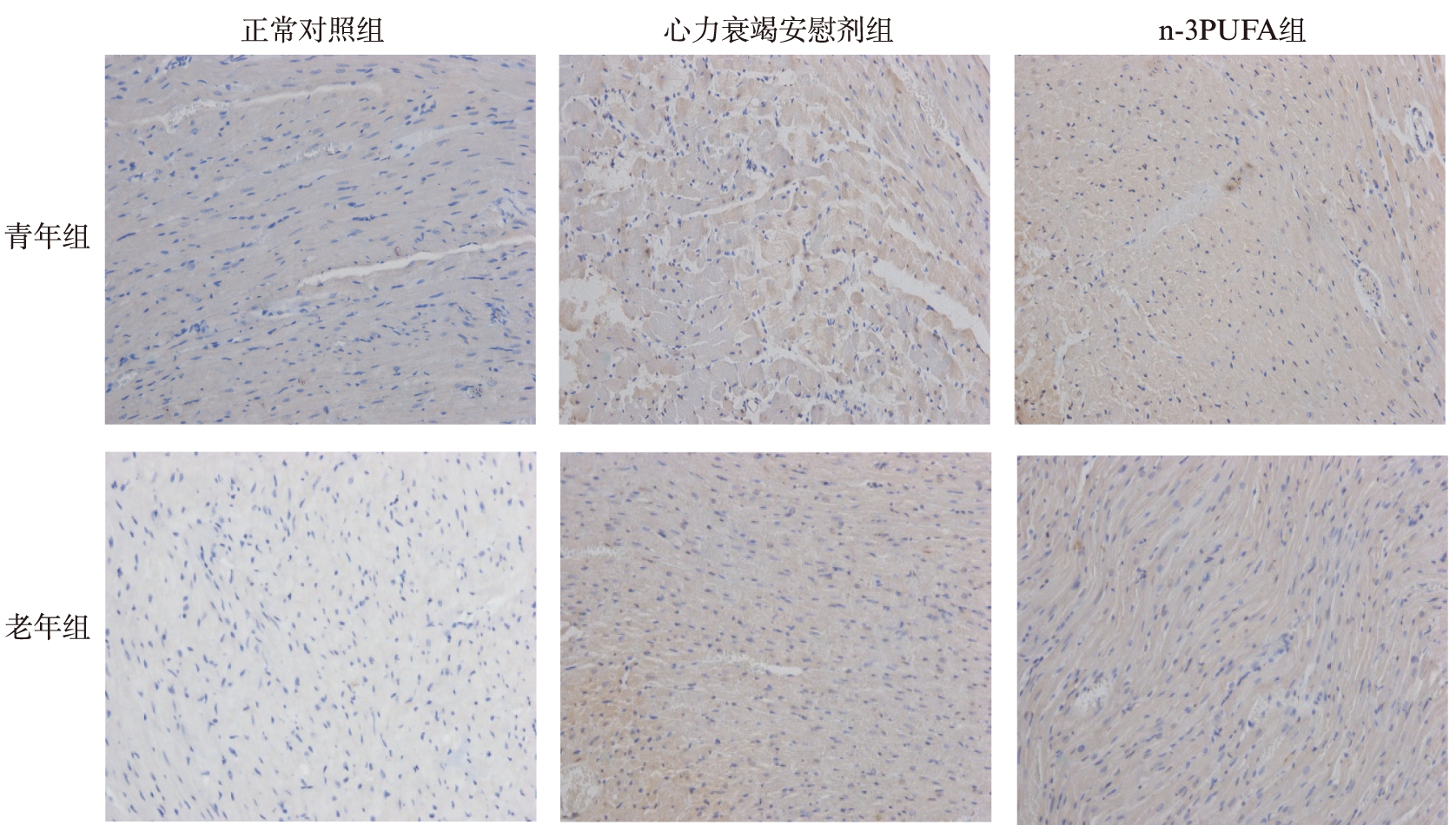
图2 TUNEL法检测各组大鼠心肌细胞凋亡
Fig.2 The measurement of apoptosis in myocardial tissue by TUNEL(×200)
细胞核棕褐色的为凋亡细胞
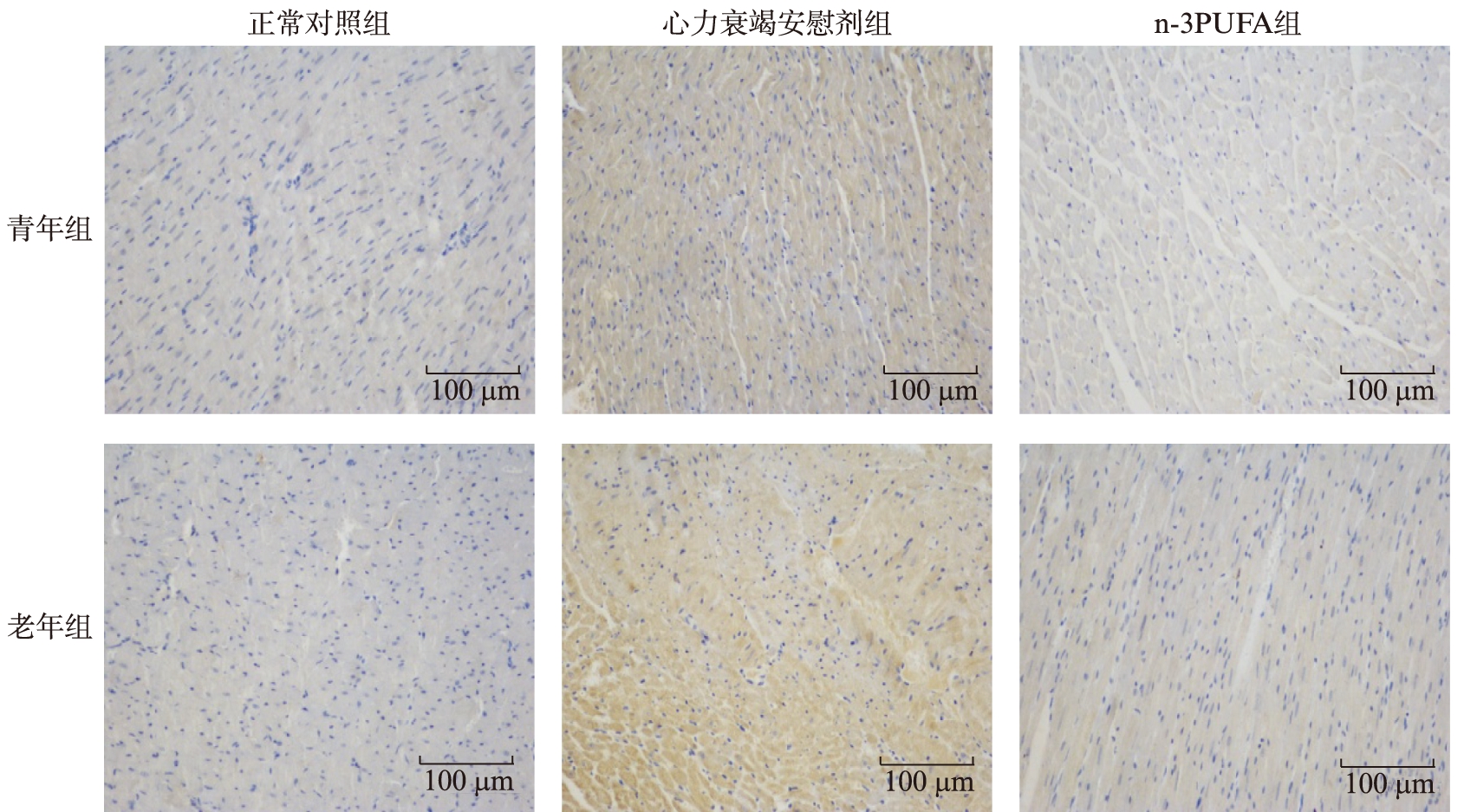
图3 免疫组化法检测各组大鼠心肌组织Cleaved-Caspase3蛋白的表达
Fig.3 Immunohistochemical staining of Cleaved-Caspase3 in myocardial tissue in rats of each group(×200)
棕黄色颗粒为Cleaved-Caspase3蛋白的阳性表达产物
研究表明,无论血流动力学异常、神经体液激素过度激活还是瓣膜异常引起的慢性心力衰竭,均伴有线粒体结构和功能的变化,因此线粒体的变化可能在心力衰竭的发生及发展过程中起着关键的调节作用[4]。
MPTP是位于线粒体内、外膜上由多个蛋白组成的非选择性、高导电性复合通道,主要由基质的亲环蛋白D(cyclophilin D, CyP-D)、内膜的腺苷酸转移酶(adenine nucleotide translocator, ANT)以及内膜的线粒体磷酸转载体(phosphatecarrier, PiC)三个基本亚基组成[5],在心肌细胞凋亡、心肌缺血/再灌注损伤中具有重要作用。心脏衰老使心脏对心肌缺血、收缩压升高等病理状况更为敏感。既往研究提示,随年龄增长,大鼠心肌线粒体PT孔开放增加,线粒体膜电位降低、线粒体呼吸功能抑制、心功能出现明显衰退[6]。本研究通过阿霉素诱导建立青年和老年大鼠慢性心力衰竭模型,结果发现与正常对照组相比,心力衰竭大鼠线粒体膜电位明显降低,MPTP孔活性增加,这与既往研究一致。
心肌细胞凋亡在心力衰竭心肌重构的过程中起着重要作用,线粒体途径是非常重要的通路系统,起着中心调控的作用。Caspase-3蛋白是各种凋亡反应的关键因子,在线粒体途径诱导的凋亡中也起着非常重要的作用[7]。研究表明,在凋亡刺激因素的作用下,MPTP孔径明显增加,外膜破坏,进而导致细胞色素C从线粒体释放进入胞质,与Caspase-9前体、d-ATP和凋亡蛋白酶活化因子1(Apaf-1)组成凋亡复合体,活化Caspase-9并激活下游的Caspase-3蛋白,导致细胞DNA修复功能障碍,激活细胞核内切酶,使DNA片段化,最终导致细胞凋亡[8]。本研究证明,无论老年还是青年心力衰竭大鼠心肌凋亡细胞明显增多,并伴随Cleaved-Caspase3蛋白水平增加。
n-3 PUFA是一类人体必需脂肪酸,它主要包括EPA(二十碳五烯酸)、DHA(二十二碳六烯酸)、ALA(十八碳三烯酸)等[9]。研究发现,n-3 PUFA可以阻止心力衰竭的进展[10]。MPTP的开放受线粒体膜上的磷脂成分所影响,尤其是花生四烯酸和心磷脂(cardiolipin, CL)[11]。CL起着维持正常线粒体的呼吸功能的作用,心力衰竭时CL水平下降[12]。Karen等[13]通过冠状动脉结扎建立心肌梗死模型,结果发现膳食补充n-3PUFA延迟假手术组大鼠Ca2+诱导的心肌线粒体MPTP开放,而这种效应在添加环孢素A后得到增强,并且不伴随线粒体呼吸功能、耦联功能改善和CyP-D蛋白的增加。Ramzi等[14]通过腹主动脉缩窄法建立心肌肥厚模型,结果发现膳食补充EPA+DHA延迟正常和心肌肥厚大鼠Ca2+诱导的心肌线粒体MPTP开放。
目前对线粒体保护在心力衰竭的研究还较少,还没有明确的体内试验证实抑制MPTP对心力衰竭尤其是老年心力衰竭的疗效,环孢霉素A虽然是公认的MPTP抑制剂,但由于其巨大的副作用限制了临床的推广应用。本研究发现n-3PUFA能够抑制MPTP孔开放,降低膜电位,改善线粒体功能,减少心肌细胞凋亡,降低活化Caspase-3的表达,为针对MPTP靶点防治老年心力衰竭提供了一个新的方向,但其详细机制还有待进一步探讨。
【参考文献】
[1] Gustafsson AB, Gottlieb RA. Heart mitochondria: gates of life and death [J]. Cardiovasc Res, 2008,77: 334-343.
[2] Pepe S, McLennan PL. (n-3) Long chain PUFA dose-dependently increase oxygen utilization efficiency and inhibit arrhythmias after saturated fat feeding in rats[J]. J Nutr, 2007,137: 2377-2383.
[3] Teng LL, Shao L, Zhao YT,et al. The beneficial effect of n-3 polyunsaturated fatty acids on doxorubicin-induced chronic heart failure in rats [J]. J Int Med Res, 2010,38: 940-948.
[4] 赵兰,郑霞,方强.线粒体在脓毒症导致心力衰竭中的作用[J].国际心血管病杂志,2013,40: 9-11.
[5] Leung AW, Varanyuwatana P, Halestrap AP. The mitochondrial phosphate carrier interacts with cyclophilin D and may play a key role in the permeability transition[J]. J Biol Chem, 2008,283: 26312-26323.
[6] 赵淑琴,孙蒙,陈慧颖,等.衰老大鼠心肌线粒体PT孔开放对线粒体呼吸功能的影响[J].中国老年学杂志,2015,35: 404-406.
[7] 杨泽栋,李永东.细胞色素C评价心肌细胞凋亡的研究进展[J].医学综述,2012,18: 341-343.
[8] Lang F, Hoffmann EK. Role of ion transport in control of apoptotic cell death [J]. Compr Physiol, 2012,2(3): 2037-2061.
[9] Glück T, Alter P. Marine omega-3 highly unsaturated fatty acids: from mechanisms to clinical implications in heart failure and arrhythmias [J]. Vascul Pharmacol, 2016, 82: 11-19.
[10] Marchioli R, Levantesi G. n-3 PUFAs and heart failure [J]. Int J Cardiol, 2013,170: S28-32.
[11] Dolinsky VW, Cole LK, Sparagna GC, et al. Cardiac mitochondrial energy metabolism in heart failure: Role of cardiolipin and sirtuins[J]. Biochim Biophys Acta, 2016. pii: S1388-1981: 30060-30069.
[12] Chicco AJ, Sparagna GC. Role of cardiolipin alterations in mitochondrial dysfunction and disease[J].Am J Physiol Cell Physiol, 2007,292: C33-C44.
[13] O’Sheaa KM, Khairallah RJ, Sparagna GC, et al. Dietary ω-3 fatty acids alter cardiac mitochondrial phospholipid composition and delay Ca2+-induced permeability transition[J]. J Mol Cell Cardiol, 2009,47(6): 819-827.
[14] Khairallah RJ, O’shea KM, Brown BH, et al. Treatment with docosahexaenoic acid, but not eicosapentaenoic acid, delays Ca2+- induced mitochondria permeability transition in normal and hypertrophied myocardium[J]. J Pharma Col Exp Ther, 2010,335(1): 155-162.
The role of mitochondrial permeability transition pore in chronic heart failure rats and potential protective effects of n-3 polyunsaturated fatty acid
TANG Lun-xian1 , XU Ming-zheng1, ZHANG Yin1, LIU Xian-dong1, ZHANG Hua2
(1. Dept. of Emergency Internal Medicine,East Hospital, Tongji University, Shanghai 200120, China;2. Dept. of Geriatric, East Hospital, Tongji University, Shanghai 200120, China)
【Abstract】Objective To investigate the role of mitochondrial permeability transition pore in chronic heart failure rats and potential protective effects of n-3 polyunsaturated fatty acid. Methods Thirty Wistar rats were divided into 3groups: the control group(n=10); heart failure(HF)+placebo group(n=10); heart failure(HF)+n-3PUFA group(n=10). HF groups received intraperitoneal injection of doxorubicin 2mg/kg every week. The n-3PUFA group was treated with n-3PUFA by gavage daily for 8 weeks. Echocardiography and histological examination were performed in 3 groups. The concentration of BNP in the serum was measured by ELISA. The mitochondrial membrane potential and MPTP activity were measured by relevant kits. Apoptotic index (AI) was detected by TUNEL assay. The expression of Cleaved-Caspase3 was evaluated by immunohistochemistry. Results Compared with the HF placebo group, the echocardiography parameters and histological damage of n-3PUFA group were attenuated. Compared with the control group, BNP in the serum of HF group were elevated (P<0.05). The mitochondrial membrane potential in the HF+placebo group was significantly lower than the control groups, while the MPTP activity was significantly elevated(P<0.05).Compared with the HF+placebo group, the mitochondrial membrane potential was significantly increased, the MPTP activity was significantly decreased, the apoptotic index and the expression of Cleaved-Caspase3 were significantly reduced in N-3 PUFA group(all P<0.05). Conclusion n-3PUFA can decrease the MPTP activity, inhibit the myocardial apoptosis in chronic heart failure rats, which might be the potential mechanism of protective effects.
【Key words】MPTP; chronic heart failure; n-3 polyunsaturated fatty acid; Caspase-3; rat
doi:10.16118/j.1008-0392.2016.04.001
收稿日期:2015-12-02
基金项目:上海市浦东新区科技发展创新基金(PKJ2012-Y09; PKJ2012-Y64);上海市浦东新区卫计委优秀学科带头人附带课题(PWRd2014-08)
作者简介:唐伦先(1977—),女,副主任医师,博士.E-mail: 456tlx@163.com
通信作者:张 华.E-mail: zhanghuazh@medmail.com.cn
【中图分类号】R 541
【文献标志码】A
【文章编号】1008-0392(2016)04-0001-06