表1 43例老年AML患者临床资料
Tab.1 Clinic data of 43 AML patients
·临床研究·
陆惠娜, 丁 懿, 修 冰, 吴 昊, 陈毓华, 梁爱斌
(同济大学附属同济医院血液科,上海 200065)
【摘要】目的 比较地西他滨联合CAG方案与标准IA方案治疗老年急性髓系白血病患者的临床疗效及安全性。方法 回顾性分析20例接受地西他滨联合CAG方案、23例接受IA方案治疗的初发老年AML患者的临床资料,分别比较两组患者的总反应率(ORR)、总生存率(OS)及不良反应发生率。结果 43例患者的ORR为58.14%,地西他滨联合CAG组及IA组的ORR分别为65%、52.2%,两组比较差异无统计学意义(P>0.05)。截至2015年8月31日,16例存活,25例死亡,2例失访,中位随访时间10(1~34)个月,2年OS率为11.63%,两组1年OS率分别为50%、39.13%,差异无统计学意义(P>0.05)。39例患者出现感染,25例有出血,两组患者在感染发生率、出血发生率差异无统计学意义。两组的红细胞输注量分别为5.35U、8.30U,单采血小板输注量分别为1.85U、3.48U,差异有统计学意义(P<0.05)。结论 地西他滨联合CAG方案和IA方案治疗老年AML患者均有较好的疗效,地西他滨联合CAG方案CR率及OR率相对较高。两组治疗副反应相当,但地西他滨联合CAG组骨髓造血恢复较快。
【关键词】地西他滨; CAG方案; 老年急性髓系白血病
由于现代社会人口老龄化和环境的污染,老年白血病的发病率逐年上升,急性髓系白血病(acute myeloid leukemia, AML)占老年白血病的80%左右。由于老年人伴有的基础疾病较多,机体储备能力较弱,耐受性较差,临床上常常无法进行造血干细胞移植,主要采用以化疗为主的治疗方法,但因其对标准化疗药物的原发耐药和(或)高强度化疗后并发的各种脏器功能衰竭及感染,早期病死率较高,预后较差[1]。近年来,随着遗传学的发展,人们发现DNA甲基化在急性髓系白血病的发生和发展中起着重要的作用[2]。有研究发现,对老年AML患者实施地西他滨联合CAG方案(阿克拉霉素+阿糖胞苷+粒细胞集落刺激因子)效果显著[3]。本研究对地西他滨联合CAG方案与IA方案(去甲氧柔红霉素+阿糖胞苷)治疗老年AML的临床疗效和不良反应进行了初步的对比观察,现将结果报告如下。
1.1 一般资料
回顾性总结分析2012年1月至2015年8月我院收治的43例接受化疗的初发老年AML患者,均经骨髓穿刺MICM分型检查确诊[4],临床排除合并严重肝肾功能不全、心肺疾病及其他不能耐受化疗的因素。其中男27例,女16例;年龄60~80岁,中位年龄65岁。初发时骨髓见病态造血怀疑MDS转化的有12例;分型中M0 1例,M1 6例,M2 10例,M4 21例,M5 5例。43例患者临床资料及分组,见表1。
表1 43例老年AML患者临床资料
Tab.1 Clinic data of 43 AML patients

1.2 方法
43例患者均经知情同意后进行化疗,化疗前进行肝肾、心肺功能全面评估。根据治疗方案分为2组。地西他滨联合GAG方案组: 地西他滨15mg/m2,连续3d;阿克拉霉素20mg,连续3d;阿糖胞苷10mg,q12h,d1-14;来格司亭100μg,d1-14。IA方案: 去甲氧柔红霉素5mg/m2,d1-3,阿糖胞苷100mg/m2,d1-7。
化疗过程中积极予以对症支持治疗,如常规应用止吐、保肝药物,采取包括漱口在内的各种预防感染措施。若血红蛋白<60g/L或有明显贫血症状时申请输注去白红悬液;血小板<20×109/L时或有明显出血倾向时申请输注单采血小板、皮下注射促血小板生成素、加用止血药物等治疗;出现感染征象时根据指南及时经验性应用抗生素,完善病原菌培养并根据药敏结果指导进一步抗生素用药。
1.3 疗效判断
疗效标准参照张之南等血液学诊断及疗效标准。在化疗结束后血常规回升后进行骨髓穿刺检查评估疗效。CR定义为白血病的症状和体征消失,外周血中性粒细胞绝对值≥1.5×109/L,血小板≥100×109/L,白细胞分类中无白血病细胞,骨髓原粒细胞(原单+幼单核细胞)≤5%,红细胞及巨核细胞系正常,无髓外白血病。PR定义为骨髓原始细胞在5%~20%,或临床、血象中有2项中有1项未达CR者。ORR为CR与PR的总和。总生存(OS)时间为从确诊AML至患者死亡的时间。
1.4 不良反应
观察2组患者治疗前后临床体征变化情况,记录治疗中以及治疗后不良反应的发生情况,按照WHO急性和亚急性药物不良反应分级标准评定不良反应。治疗期间定期检测肝肾功能(每周一次)和血常规(每日)。
1.5 统计学分析
采用统计学软件SPSS 17.0对本研究数据进行分析,组间计数资料比较采用χ2检验,P<0.05表示差异有统计学意义。Kapla Meier 法估计OS时间,组间OS率比较采用Log-rank检验。
2.1 随访情况
通过电话、医院门诊随访等方式对所有患者进行随访。截至2015年8月31日,43例随访患者中,16例存活,25例死亡,2例失访。16例存活患者中,1例完全缓解并巩固强化治疗后进一步行造血干细胞移植治疗,15例定期巩固化疗,中位OS时间13(1~34)个月。25例死亡患者,中位OS时间10(1~30)个月。
2.2 疗效和生存情况
43例老年AML患者完全缓解(CR)18例,部分缓解(PR)7例,总CR率为41.86%,总反应率(ORR)为58.14%,中位OS时间为10个月,平均11.7个月,1年OS率为44.17%,2年OS率为11.63%。地西他滨联合CAG组20例,缓解率为50%,ORR为65%,10例存活,1例失访,中位OS时间11.5(2~34)个月。IA组23例,缓解率为34.78%,ORR为52.2%,6例存活,1例失访,中位OS时间9(1~29)个月(表2)。两组的生存时间见图1。
表2 两组老年AML患者的疗效和生存情况
Tab.2 Comparison of therapeutic effect and survival condition in AML patients between 2 groups

CR: 完全缓解;PR: 部分缓解;ORR: 总反应率;OS: 总生存。a两组CR比较,P=0.313>0.05,b两组ORR比较,P=0.395>0.05
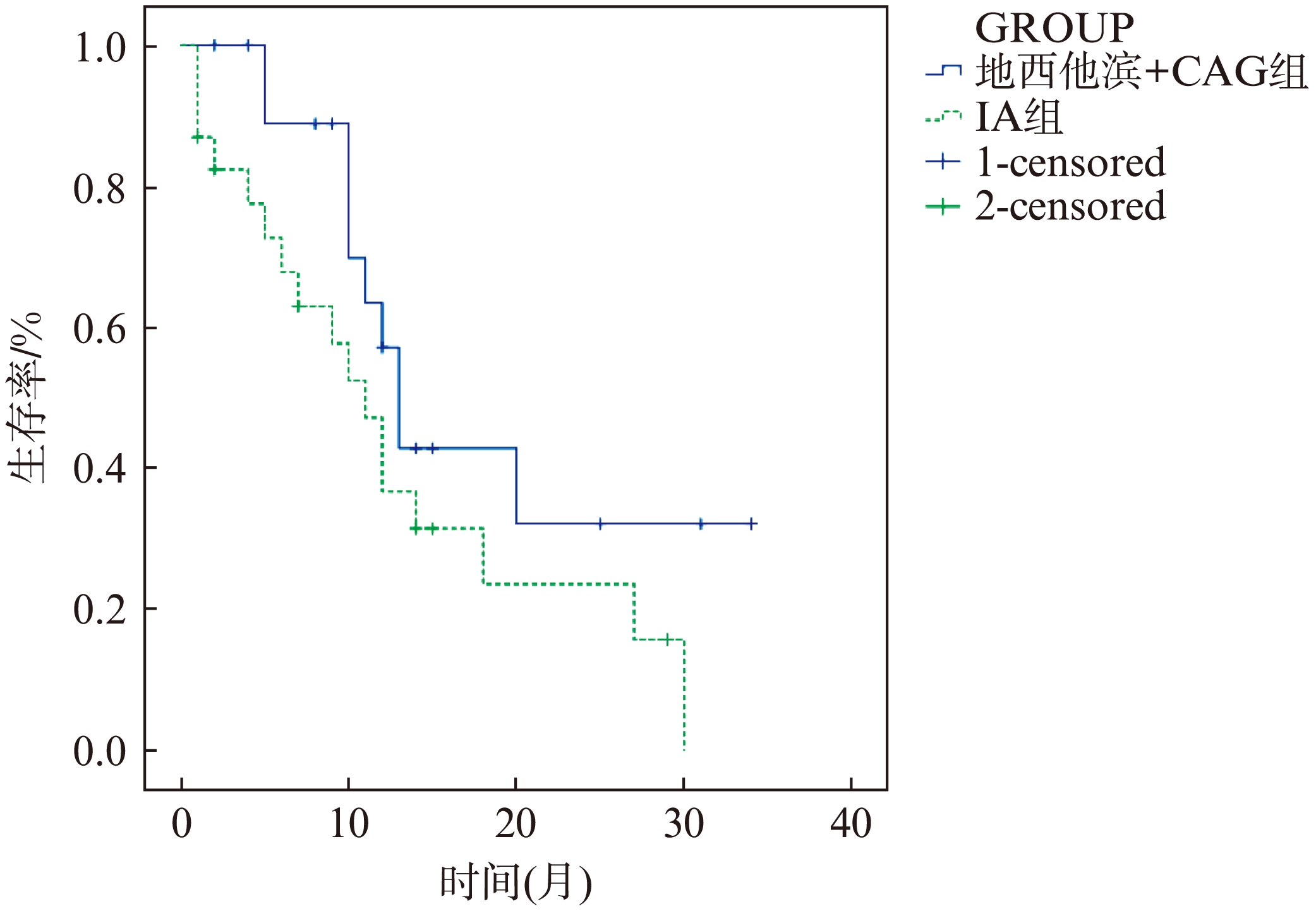
图1 两组患者生存曲线
Fig.1 Survival curves of two groups
2.3 不良反应观察
主要不良反应为骨髓抑制所致的感染和出血,其中39例患者出现感染,3~4级感染11例,(地西他滨联合CAG组4/20,IA组7/23);1~2级感染28例(地西他滨联合CAG组14/20,IA组14/23);主要为肺部感染(36/43,83.72%),其次为胃肠道感染和皮肤软组织感染。另有2例出现3~4级出血,1例为肺出血(IA组),1例为脑出血(地西他滨+CAG组);23例出现1~2级出血(地西他滨联合CAG组10/20,IA组13/23),主要表现为皮肤瘀斑瘀点。红细胞和单采血小板平均输注量分别为6.93U和2.72U。两组的红细胞输注量分别为5.35U和8.30U,单采血小板输注量分别为1.85U和3.48U。予以抗感染、皮下注射G-CSF、止血药物、输注红悬液及单采血小板支持治疗后,37例患者安全度过骨髓抑制期,2例严重出血患者及4例严重感染的患者死亡。两组患者的不良反应发生情况及支持治疗见表3。
表3 两组老年AML患者不良反应发生情况及支持治疗比较
Tab.3 Adverse reactions of two groups of elderly patients with AML and their support for treatment![]()

目前,多数临床研究中采用≥60岁作为老年白血病的年龄界限,老年白血病有其特有的生物学特性,比如起源于更早期的造血祖细胞、可累及多个细胞系、骨髓增生异常综合征(MDS)转化和三系发育异常频率高、不良核型频率高、白血病细胞不良表型特征高表达、FLT3阳性比例高、正常组细胞对生长因子的敏感性低等[5]。同时老年患者常合并较多的基础疾病,对化疗药物毒性的耐受力减低,感染的风险亦有增加,细胞因子的支持治疗效果差,老年白血病的治疗缓解率低,缓解持续时间短,临床积极探索出新的有效的治疗方案治疗老年AML成为当前研究的重点与热点。
1995年日本学者Yamada等首先设计了CAG方案治疗难治、复发性AML,获得了83%的CR率,给老年白血病患者带来了一个全新的治疗方案。近几年,研究表明,AML患者中也存在ER、HIC-1、p15等多种基因的甲基化[7],那么如果能恢复这些抑癌基因的正常甲基化状态,是否就有可能进一步提高白血病的疗效?考虑到地西他滨通过表观遗传学调控治疗白血病的潜在作用,许多研究中心将地西他滨联合CAG方案治疗中高危的MDS及难治复发的白血病,得到了不错的疗效[7-9]。地西他滨是一种脱氧核苷类似物,在体内体外均能与DNA甲基转移酶1(DNMT1)相结合,不可逆地抑制DNMT1活性。低浓度时具有去甲基化作用,可重新激活由于DNA过度甲基化而失活的基因,从而诱导肿瘤细胞分化和凋亡,高浓度时具有细胞毒作用[10]。阿糖胞苷为一种细胞周期特异的细胞毒性化疗药物,地西他滨在去甲基化的同时也能够增强阿糖胞苷的细胞毒性[11]。而方案中G-CSF的作用在于: (1) 能促进白血病细胞的增殖,增加其对细胞周期特异性药物的敏感性;(2) 可使Ara-C的活性产物三磷酸阿糖胞苷水平增高,又增强了Ara-C对白血病细胞的细胞毒性;(3) 可促进粒细胞成熟并释放至外周血,缩短了骨髓抑制时间。
本研究发现,地西他滨联合CAG方案治疗老年AML完全缓解率及总反应率高于传统IA方案组,但差异均无统计学意义。陈丽等[9]报道地西他滨联合CAG方案治疗老年AML的总反应率达76.1%,明显高于单独CAG方案组的53.3%,差异有统计学意义。这可能与样本量较小,而且均只统计了1次诱导化疗后的疗效有关,尚需增加病例数进一步观察。
43例患者中确诊时发现病态造血,高度怀疑MDS转急性白血病的有12例,其中6例CR,缓解率50%,略高于总体CR率,但差异无统计学意义。MDS作为AML相关的一个独立预后不良因素,治疗相关病死率高,疗效差[11],临床上属于难治性白血病。但本研究中其CR率不低,考虑可能因为大部分怀疑MDS转AML的患者(10/12)入组了地西他滨联合CAG方案组,有了地西他滨的去甲基化作用,增加了治疗有效率。
43例患者的中位OS时间为10个月,平均11.7个月。地西他滨联合CAG组中位OS时间11.5(2~34)个月,高于IA组,但差异无统计学意义(P=0.098>0.05),两个组的生存时间见图1。
本研究两组治疗方案的主要不良反应为Ⅲ~Ⅳ级的骨髓抑制及感染和出血,恶心、呕吐及肝功能损害等其他不良反应均可对症处理进行控制和恢复。我们的研究结果显示两组患者中IA组患者感染发生率及出血发生率均高于地西他滨联合CAG组,但差异无统计学意义。在化疗后骨髓抑制期红细胞及单采血小板的输注量上,IA组输注量均较大,差异有统计学意义,提示在化疗后的骨髓造血的恢复上,地西他滨联合CAG较IA组更快。体外和动物实验研究发现地西他滨可促进巨核细胞成熟和加速血小板从骨髓向外周血释放,治疗起效一般首先观察到血小板计数的上升,这一点在临床实践中也得到了认证。
对比两组治疗方案,其完全缓解率及总反应率虽无统计学意义,但地西他滨联合CAG均高于IA组;老年患者化疗后感染的发生率都很高,两组在感染及出血发生率差异无统计学意义,但IA组较高;在化疗后骨髓恢复期,地西他滨联合CAG组的血红蛋白及血小板恢复快,并且有统计学差异。由于地西他滨价格昂贵,国内许多患者因经济条件限制难以承受多个疗程甚至一个疗程的治疗,对于MDS转化而来的老年AML,推荐使用地西他滨联合CAG方案,而对于其他普通的老年AML患者,使用地西他滨联合CAG方案可减少骨髓抑制期的时间,加快造血的恢复与重建,IA方案的疗效的关键在于感染及出血的防控措施以及更强大的后期支持治疗。
【参考文献】
[1] 樊文娟,姜中兴.老年急性髓系白血病的治疗现状[J].河南医学研究,2014,23(1): 149-152.
[2] Pievani A, Borleri G, Pende D, et al.Dual-functional capability of CD3+ CD56+ CIK cells, a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity [J]. Blood, 2011,118: 3301-3310.
[3] Kantarjian HM, Thomas XG, Dmoszynska A, et al. Multicenter, randomized, open-label, phase Ⅲ trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia [J]. J Clin Oncol, 2012,30(21): 2670-2677.
[4] 中华医学会血液学分会.成人急性髓系白血病(非急性早幼粒细胞白血病).中国诊疗指南(2011年版)[p].中华血液学杂志,2011,32(11): 804-807.
[5] 赵邢力,刘凯奇.老年急性髓系白血病染色体核型和基因突变特征分析[J].中国实验血液学杂志,2015,12 (2): 300-305.
[6] Jiang D, Hong Q, Shen Y, et al. The diagnostic value of DNAmethylation in leukemia: a systematic review and meta-analysis [J]. PLoS One, 2014,9: e96822.
[7] 陈丽,郝云良.低西他滨联合CAG方案治疗老年急性髓系白血病的疗效观察[J].临床血液学杂志,2015,28 (3): 233-236.
[8] Li J, Chen Y, Zhu Y, et al. Efficacy and safety of decitabine in combination with G-CSF, low-dose cytarabine and aclarubicin in newly diagnosed elderly patients with acute myeloid leukemia [J]. Oncotarget,2015,6(8): 6448-6458.
[9] Zhu CY, Liu SY. Clinical research of decitabine combined with modified CAG regimen for treatment of relapsed or refractory acute myeloid leukemia [J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi,2015,23(1): 88-93.
[10] Solomon PR, Munirajan AK, Tsuhida N, et al. Promoter hypermethylation analysis in myelodysplastic syndrome: diagnostic & prognostic implication [J]. Indian J Med Res, 2008; 127: 52-57.
[11] 郝杰,程澍,等.地西他滨联合预激方案和传统治疗方案治疗老年MDS/MPD转化的急性髓系白血病的疗效和安全性的比较研究[J].临床血液学杂志,2014,27 (1): 15-18.
Decitabine combined with chemotherapy CAG regime versus IA regime for elderly patients with acute myeloid leukemia
LU Hui-na, DING Yi, XIU Bing, WU Hao, CHEN Yu-hua, LIANG Ai-bin
(Dept. of Hematology, Tongji Hospital, Tongji University, Shanghai 200065, China)
【Abstract】Objective To compare the clinical safety and efficacy of decitabine combined with chemotherapy CAG regime to IA regime in treatment of elderly patients with acute myeloid leukemia (AML). Methods Forty three elderly AML patients were treated with combination of decitabine (15mg/m2×3d) and CAG chemotherapy (CAG group, n=20) (Acla 20mg×3d, Ara-C 10mg q12h d1-14, G-CSF 100μg/d d1-14) or IA chemotherapy (IA group, n=23) (Idarubicin 5mg/m2 d1-3, Ara-C 100mg/m2 d1-7). The complete remission (CR) rate, overall response rate (ORR) and overall survival (OS) of the two groups were documented. The factors related to decitabine efficacy and the prognosis was analyzed. Results ORR in CAG and IA groups were 65% and 52.2%, respectively (P>0.05). The 2-year cumulative survival rate was 11.63%. The 1-year survival rate of two groups were 50% and 39.1%, respectively (P>0.05). Infection occurred in 39 patients and bleeding events occurred in 25 patients; there were no significant difference in rate of infection and bleeding events between two groups (P>0.05). The mean MAP transfusion platelet transfusion in CGA group were lower than those in IA group (5.35U vs 8.30U and 1.85U vs 3.48U, P<0.05). Conclusion Decitabine combination with CAG and IA chemotherapy produced high efficacy and low adverse effects for elderly AML patients. In decitabine combination with CAG regime the ORR and CR are relatively higher, and the hemopoiesic function is recovered earlier.
【Key words】decitabine; CAG regimen; elderly acute myeloid leukemia
doi:10.16118/j.1008-0392.2016.03.014
收稿日期:2015-12-08
基金项目:上海市卫生系统新百人计划(XRB2013077)
作者简介:陆惠娜(1985—), 女,住院医师,硕士.E-mail: nana850305@126.com
通信作者:梁爱斌.E-mail: lab7182@tongji.edu.cn
【中图分类号】R 733.7
【文献标志码】A
【文章编号】1008-0392(2016)03-0071-05