·基础研究·
魏梦丹, 陆 英, 曹月誉, 徐增光
(同济大学附属东方医院科研部,上海 200120)
【摘要】目的 研究真核翻译起始因子4γ1(eukaryotic translation initiation factor 4γ1,EIF4G1)对非小细胞肺癌细胞株A549细胞凋亡的抑制作用。方法 使用RNAi技术下调A549细胞内EIF4G1的表达后,通过MTS法检测细胞生长增殖,采用流式细胞术(FCM)检测细胞凋亡,采用蛋白质印记(Western blot)技术检测下调EIF4G1后对A549细胞中与细胞凋亡相关的蛋白表达影响。 结果 下调A549细胞内EIF4G1的表达后,细胞生长受到明显抑制,细胞凋亡率也明显增加(P<0.05),且凋亡相关蛋白和对照组相比,FAS,P21和TRAF2的表达量明显增高(P<0.05)。 结论 EIF4G1在A549细胞中表达降低后,凋亡相关蛋白FAS,P21和TRAF2的表达量升高,促进A549细胞凋亡。
【关键词】真核翻译起始因子4γ1; 非小细胞肺肿瘤; 细胞凋亡
肺癌一直是世界范围内高死亡率的恶性肿瘤, 在我国居恶性肿瘤死因之首。肺癌可分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)两大类,其中NSCLC占所有肺癌病例的85% 以上[1]。只有15%~25%的NSCLC有手术治疗的机会,即使接受根治性手术治疗,仍然有50%的NSCLC患者会复发。肿瘤的发生发展过程中受到多种调节因子的作用。近年研究发现,真核翻译起始因子4G1(eukaryotic translation initiation factor 4 gamma 1,EIF4G1)在NSCLC中过量表达[2]。该分子最早发现是作为转录起始因子复合物EIF4F的组成蛋白之一,最近研究表明,EIF4G1除了促进蛋白翻译外,也与肿瘤的发生、进展密切相关[3-5]。
本研究将通过RNAi技术下调非小细胞肺癌细胞株A549 中EIF4G1的表达后,观察其对肺癌细胞的生长以及凋亡的影响,为明确EIF4G1在NSCLC发生发展中作用机制提供理论依据。
1.1 主要试剂
人NSCLC A549由同济大学附属东方医院中心实验室和转化医学平台俞作仁教授课题组惠赠;培养基及主要试剂1640、含EDTA胰酶、胎牛血清、Opti-MEM培养液均为Gibco公司产品;CellTiter-96® Aqueous One Solution Cell Proliferation Assay检测试剂盒购自Promega公司;Annexin-V-FITC/PI细胞凋亡检测试剂盒购自凯基生物科技发展有限公司;转染试剂Lipofectamine® RNAiMAX购自Invitrogen公司;所有siRNA均购自美国Invitrogen公司,分别根据说明书,取部分siRNA稀释至 10μmol,分装待用;Western-blot使用抗人EIF4G1、P21抗体购自abcam公司,抗人β-actin、Fas、TRAF2抗体购自Santa-Cruz公司;其他相关试剂购自威奥公司。
1.2 实验方法
1.2.1 细胞培养 A549细胞培养于含10%胎牛血清、青霉素100IU/ml、链霉素100μg/ml的RPMI1640培养液中, 37℃,5%CO2培养箱培养。细胞均贴壁生长,0.25%胰蛋白酶消化传代,选择对数生长期的细胞进行试验。
1.2.2 细胞SiRNA转染 将处于对数生长期的细胞接种六孔板,60%~80%左右融合后进行转染。用PBS冲洗2~3次后,加入Opti-MEM 培养液 1.7ml,分别于150μl Opti-MEM中加入9μl Lipofectamine® RNAiMAX配成A液,150μl Opti-MEM中加入3μl siRNA配成B液,按照1∶1比例混合A液和B液,充分混匀,室温静置5min。每孔加入300μl混合液,摇匀,置于37℃,5%CO2培养箱培养24h。分为3组: 实验组siRNA-EIF4G1,对照组siRNA-control,空白对照组Blank,每组设3个复孔。
1.2.3 Annexin-V-FITC/PI双染法检测细胞凋亡 实验前24h进行细胞转染,设立空白组、处理组及阴性对照组,后用不含EDTA胰酶消化细胞,分别收集各组细胞以及培液上清,离心半径15cm,1000r/min,离心 5min 弃上清液。1xPBS洗细胞两遍,弃上清液每管加 400μl Binding Buffer,5μl Annexin-V-FITC和5μl PI,混匀,避光孵育15min,上流式细胞仪检测细胞凋亡率。采用Cellquest软件分析,FSC/SSC设门,结果以散点图表示。
1.2.4 Western-blot法检测细胞蛋白表达 细胞转染24h后弃去培养液,用1xPBS轻轻洗两次,加入适量2x细胞裂解液,充分裂解后,用细胞刮至1.5ml EP管,加热至100℃10min,然后4℃离心机离心半径15cm,10000r/min,离心5min,取上清液,用微量紫外分光光度计进行蛋白定量后保存于-80℃冰箱备用。根据所需目的蛋白分子量大小分别配置不同浓度的分离胶,电泳后转至PVDF膜,5%奶粉配制的封闭液室温封闭2h,再用稀释好的一抗(β-actin、EIF4G1、P21抗体1∶1000,Fas、TRAF2抗体1∶500)4℃孵育过夜。TBST洗三次每次10min。二抗室温避光孵育1h,TBST洗三次,每次10min。最后于ODYSSEY红外成像系统上扫描。Image J软件采集条带灰度值,取目的条带与内参条带的灰度比值为相对表达量。
1.3 统计学分析
采用SPSS 20.0软件进行处理。实验重复3遍,结果用![]() 表示。采用t检验,检验水准: P<0.05为具有统计学差异。P<0.01为具有显著差异。
表示。采用t检验,检验水准: P<0.05为具有统计学差异。P<0.01为具有显著差异。
2.1 光学显微镜下细胞形态学变化
将各组细胞转染24h后置于倒置显微镜下观察: SiRNA-control组细胞贴壁生长且轮廓清楚,细胞间的结构清晰,折光性强且胞质清亮,SiRNA-EIF4G1组贴壁细胞可见明显减少,镜下还可见周围碎片明显增多,漂浮细胞明显增多,见图1。

图1 未转染及转染SiRNA-EIF4G1后肺癌细胞A549细胞图
Fig.1 Microscopic diagraph of untransfected and transfected A549 cells
转染组细胞可见明显减少,死细胞增多
2.2 MTS实验检测转染SiRNA-EIF4G1后对A549细胞生长的抑制作用
细胞转染 24h 后将 10μl CellTiter-96® Aqueous单溶液试剂直接加入到培养孔中,孵育2~4h,然后在96孔板读板仪上记录490nm的吸光度D。在490nm测量的吸光度值与培养孔中活细胞的数量成正比,根据D统计细胞增殖情况,每组设五个复孔,见图2。
如图2所示,SiRNA-EIF4G1转染后细胞生长状况与Blank组和SiRNA-NC组相比细胞增殖明显减慢,有统计学意义(P<0.05)。而Blank组和SiRNA-NC组相比较,细胞增殖情况变化不明显(P>0.05)。
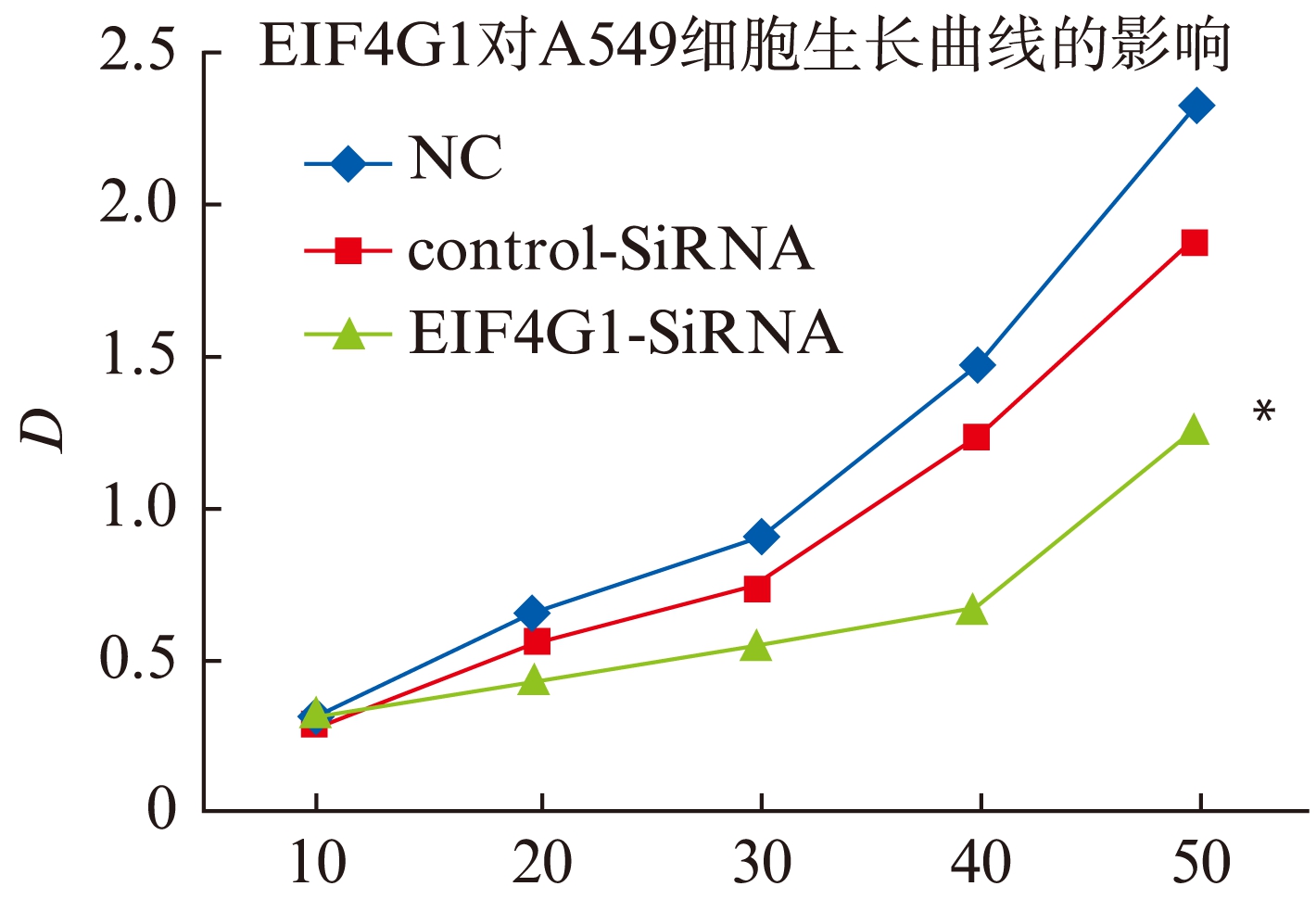
图2 MTS检测不同处理组A549细胞生长曲线,Si-EIF4G1组与另外两组相比生长明显抑制(P<0.05)
Fig.2 Proliferation of A549 cells in different groups detected by MTS: cell growth was inhibited significantly in Si-EIF4G1 group, as compared with other groups(P<0.05)
2.3 Annexin-V-FITC/PI双染法检测A549细胞凋亡
在双变量流式细胞仪的散点图上,左下象限(FITC-/PI-)显示活细胞,右下象限(FITC+/PI-)显示早期凋亡细胞,而右上象限(FITC+/PI+)是坏死细胞或晚期凋亡细胞,检测结果以百分比表示。Blank组, SiRNA-EIF4G1组,SiRNA-NC组早期凋亡率分别为(1.26±2.60)%,(4.65±6.12)%,(3.88±3.52)%,Si-EIF4G1组与对照组相比,细胞凋亡率明显增高(P<0.05)(图3)。
2.4 Western-blot检测下调EIF4G1在A549中的表达后对凋亡相关蛋白的影响
用SiRNA下调肺癌细胞A549中真核翻译起始因子4γ1(EIF4G1)的表达,细胞转染24h后(图4),EIF4G1在细胞内的相对表达经灰度分析发现: 对照组1.21±0.47,SiRNA-EIF4G1组0.76±0.30,Si-对照组1.11±0.49。SiRNA-EIF4G1组细胞内EIF4G1蛋白表达明显下降,差异有统计学意义(P<0.05),见表1。下调EIF4G1的A549细胞内凋亡相关蛋白FAS,P21和肿瘤坏死因子受体相关因子2(TRAF-2)的表达和对照组相比均明显升高,见表2、图5,且差异具有统计学意义(P<0.05)。
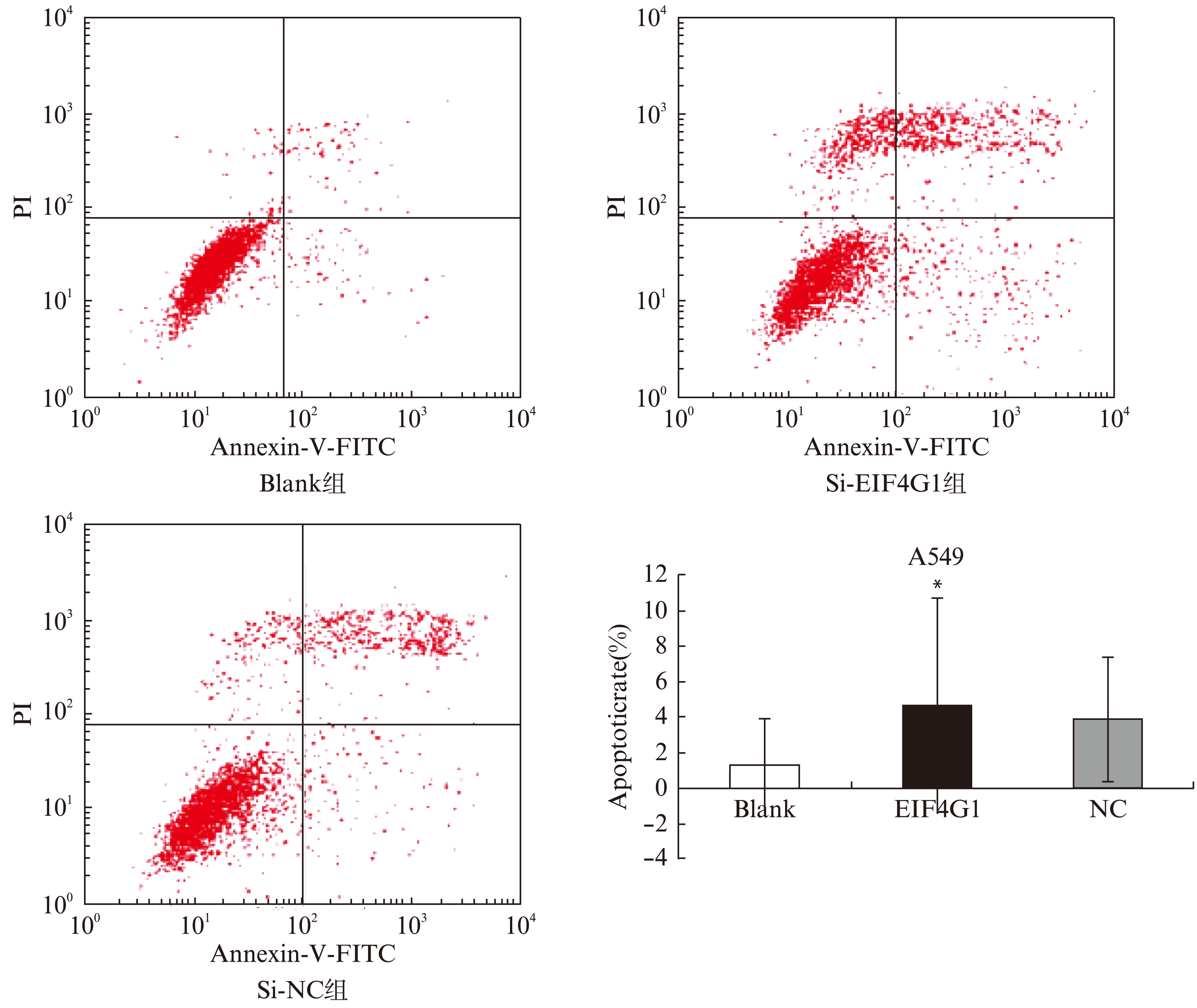
图3 流式细胞仪检测A549细胞凋亡率
Fig.3 Apoptosis rate of A549 cells in different groups detected by flow cytometry
右下象限代表早期凋亡细胞群,右上象限为死亡细胞群或晚期凋亡细胞群,Si-EIF4G1组与对照组相比,凋亡率明显增高(P<0.05)

图4 Western-blot检测A549细胞中EIF4G1的蛋白表达量
Fig.4 Western-blotting detection of EIF4G1 protein expression in A549 cells
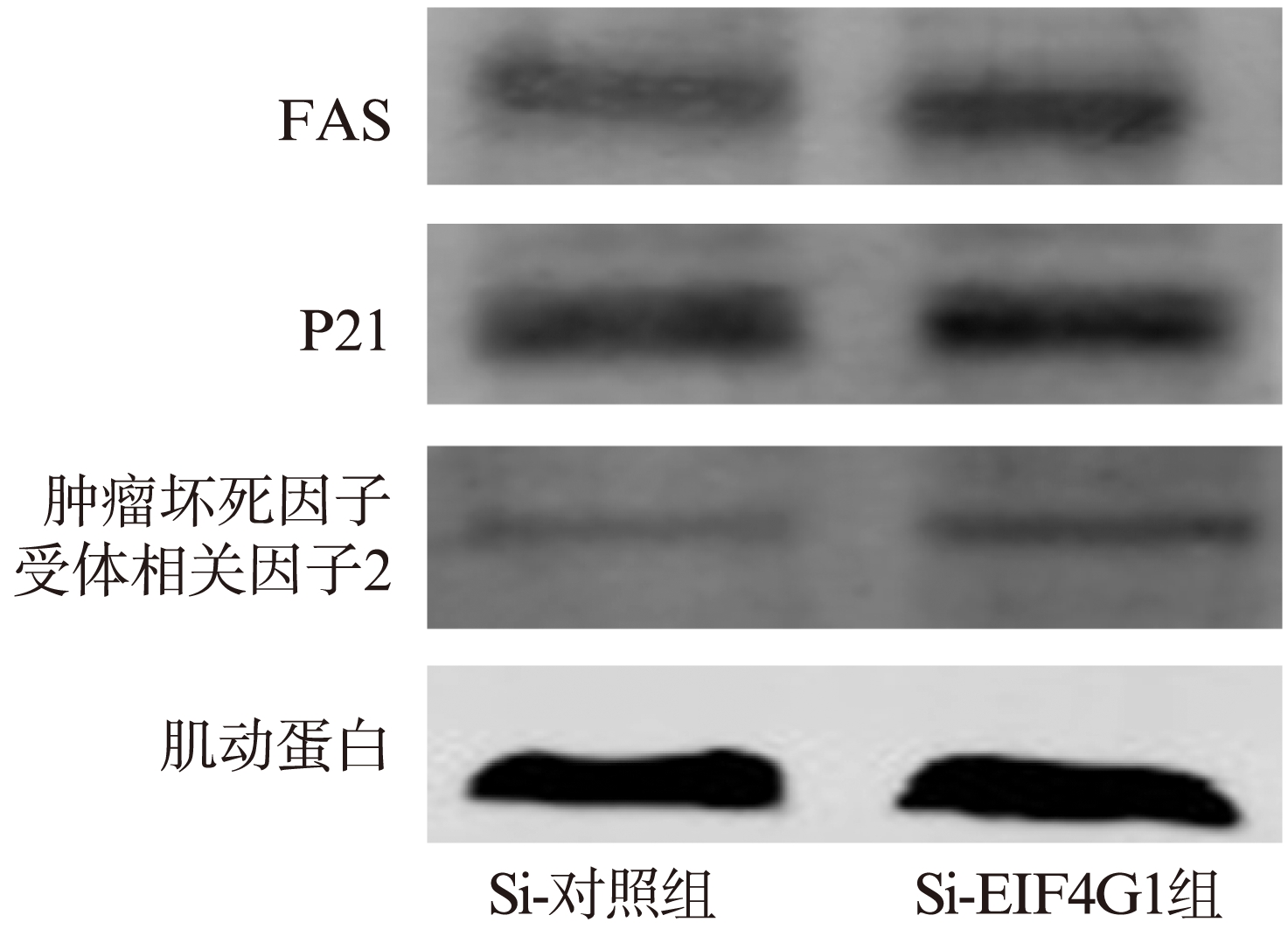
图5 Western-blot检测不同处理组A549细胞中FAS,P21和TRAF-2蛋白表达
Fig.5 Western-blotting detection of FAS, P21 and TRAF-2 protein expression in A549 cells
表1 不同处理组中真核翻译起始因子4γ1(EIF4G1)蛋白表达量
Tab.1 EIF4G1 protein expression in different groups of A549![]()

注: *与对照组比较, P<0.05
表2 Si-EIF4G1对A549细胞内FAS,P21和TRAF2蛋白表达影响
Tab.2 FAS,P21 and TRAF2 protein expression in different groups of A549
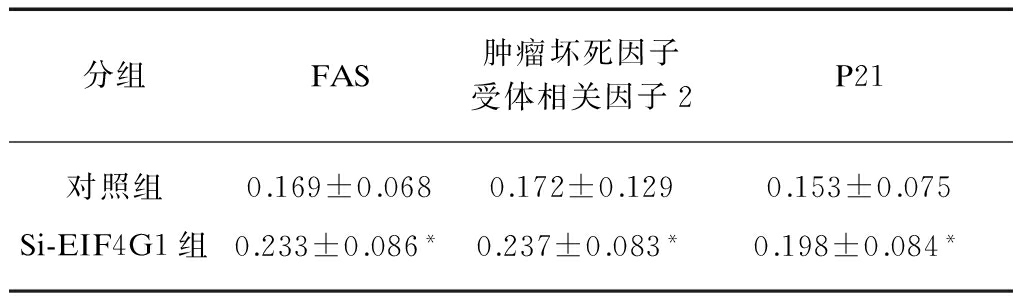
注: 与对照组相比,*P<0.05
肺癌的发生和侵袭转移是一个多阶段、多因子参与的复杂而又连续的过程,其中涉及了一些关键的癌基因和抑癌基因。近几年,针对这些关键分子的靶向性药物开始应用于临床,如EGFR、KRAS、VEGF、BRAF、HER-2等[6-8]。对于EGFR敏感突变的特定人群,酪氨酸蛋白激酶抑制剂吉非替尼和厄洛替尼能明显延长晚期NSCLC患者的无复发生存期,但是最终会出现耐药现象,因此需要寻找更有效的分子标记物。
研究发现EIF4G1在鼻咽癌、喉癌、肺癌、乳腺癌中表达都有明显增高,促进了肿瘤细胞蛋白翻译、肿瘤血管生成、细胞恶性转化等。EIF4G1作为一种支架蛋白,可能是NSCLC的潜在分子标记物。但是至今为止,NSCLC中过量表达的EIF4G1与NSCLC发生发展的关系、NSCLC细胞侵袭及转移的确切作用机制尚未明确。本研究通过RNAi技术下调EIF4G1在NSCLC细胞株A549中的表达水平后,癌细胞生长缓慢,并出现了明显的凋亡现象,提示EIF4G1在肺癌中可以作为一个潜在的治疗靶点,通过抑制肺癌细胞中EIF4G1的基因表达有可能抑制肿瘤的发展。
目前关于NSCLC中凋亡相关蛋白Fas/FasL的表达及其介导的凋亡、免疫逃逸在肺癌发生发展、转移及预后中的作用机制研究一直在不断进展中,在子宫内膜癌、肝癌等癌症细胞检测中都发现有Fas/FasL系统的表达失衡[9]。一些药物研究也发现用药后的癌细胞凋亡也伴随着上调Fas/FasL通路的蛋白表达,检测FAS可以为检测肺癌发生发展及转移提供依据[10]。有研究表明P21可能参与了TGFβ(transforming growth factorβ)信号系统调节细胞增殖、凋亡的功能,其基因产物是一种细胞周期蛋白依赖性激酶的抑制蛋白可以促进细胞增殖、抑制凋亡[11]。上调和下调P21的表达已证实在肺癌的细胞凋亡及浸润和转移中有抑制和促进作用[12]。肿瘤坏死因子受体相关因子(TRAFs,Tumor necrosis factor receptor associated factors)是一类重要的胞浆衔接蛋白,参与调节NF-κB、JNK等多种信号传导通路,调节细胞增殖、存活与凋亡[13],其中TRAF2是TRAF家族的核心成员,在肿瘤中起了很重要的作用[14]。有研究已证实在肺癌细胞中TRAF2的表达下降,而增加TRAF2在癌细胞中的蛋白表达后可以促进癌细胞的凋亡[15-16]。在本研究中,在下调A549中 EIF4G1的表达后,FAS,P21和TRAF2表达明显升高,说明EIF4G1抑制细胞凋亡的作用机制与这些分子所在的信号通路有关: 当下调EIF4G1的表达后,促凋亡蛋白FAS和TRAF2表达增高,肿瘤细胞凋亡增多;P21表达增高,发挥细胞周期抑制作用,癌细胞增殖减慢。然而其具体的调控机制还有待进一步的深入研究。
本研究结果显示,下调NSCLC细胞中EIF4G1的表达后,癌细胞生长明显缓慢,凋亡细胞明显增多,通过western-blot实验证实在EIF4G1表达明显低于对照组的情况下,siENA-EIF4G1组中促凋亡蛋白FAS,P21和TRAF2表达明显升高,说明下调EIF4G1在肺癌中的表达可起到促进癌细胞凋亡的作用。
综上所述,EIF4G1在A549细胞的生长过程中起了重要的作用,今后将进一步深入研究EIF4G1与非小细胞肺癌发生发展的关系及分子作用机制,为非小细胞肺癌的治疗提供新的思路。
【参考文献】
[1] Antonelli G, Libra M, Panebianco V,et al. Molecular-targeted therapy for elderly patients with advanced non-small cell lung cancer[J]. Oncol Lett, 2016,11(1): 3-8.
[2] Bauer C, Brass N,Diesinger I,et al. Over-expression of the eukaryotic translation initiation factor 4G(EIF4G1)in squamous cell lung carcinoma[J]. Int J Cancer, 2002,98(2): 181-185.
[3] Attar-Schneider O, Drucker L, Zismanov V, et al., Targeting eIF4GI translation initiation factor affords an attractive therapeutic strategy in multiple myeloma[J]. Cellular Signaling, 2014,26(9): 1878-1887.
[4] Tu LX, Liu Z, He XF, et al. Over-expression of eukaryotic translation initiation factor 4 gamma 1 correlates with tumor progression and poor prognosis in nasopharyngeal carcinoma[J]. Mol Cancerg, 2010,9: 78.
[5] Silvera D, Arju R, Darvishian F, et al. Essential role for eIF4GI overexpression in the pathogenesis of inflammatory breast cancer[J]. Nat Cell Biol, 2009,11(7): 903-908.
[6] Villalva C, Duranton-Tanneur V, Guilloteau K, et al. EGFR, KRAS, BRAF and HER-2 molecular status in brain metastases from 77 NSCLC patients[J]. Cancer Med, 2013,2(3): 296-304.
[7] Karachalion N, Mayo C, Costa C, et al. KRAS mutations in lung cancer[J]. Clin Lung Cancer, 2013,14(3): 205-214.
[8] Emma S, Thomas H, George R, et al. Molecular pathways and therapeutic targets in lung cancer[J]. Oncotarget, 2014,5(6): 1392-1433.
[9] Xiao Z, Shan J, Li C. Mechanisms of cyclosporine induced renal cell apoptosis: a systematic review[J]. Am J Nephrol, 2012,37(1): 30-40.
[10] Gordon N, Kleinerman ES. The role of Fas/FasL in the metastatic potential of osteosarcoma and targeting this pathway for the treatment of osteosarcoma lung metastases[J]. Cancer Treat Res, 2009,152: 497-508.
[11] Suzuki A, Ito T, Kawano H, et al. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death[J]. Oncogene, 2000, 19(10): 1346-1353.
[12] 周崧雯,周彩存,李爱斌,等.多基因表达对非小细胞肺癌术后预后的评价[J].同济大学学报: 医学版,2006,27(1): 73-75.
[13] Yang XD, Sun SC. Targeting signaling factors for degradation, an emerging mechanism for TRAF functions[J]. Immunol Rev, 2015,266(1): 56-71.
[14] Hildebrandt MA, Roth JA, Vaporciyan AA, et al. Genetic variation in the TNF/TRAF2/ASK1/p38 kinase signaling pathway as markers for postoperative pulmonary complications in lung cancer patients[J]. Sci Rep, 2015,5: 12068.
[15] Kim J, Moon SH, Kim BT, et al. A novel aminothiazole KY-05009 with potential to inhibit Traf2- and Nck-interacting kinase (TNIK) attenuates TGF-β1-mediated epithelial-to-mesenchymal transition in human lung adenocarcinoma A549 cells[J]. PLoS One, 2014,9(10): e110180.
[16] Wang W, Yan H, Dou C, et al. Human leptin triggers proliferation of A549 cells via blocking endoplasmic reticulum stress-related apoptosis[J]. Biochemistry Mosc, 2013,78(12): 1333-1341.
Effect of EIF4G1 on apoptosis of non-small cell lung cancer cells
WEI Meng-dan, LU Ying, Cao Yue-yu, XU Zeng-guang
(Dept. of Research, East Hospital, Tongji University, Shanghai 200120, China)
【Abstract】Objective To investigate the effects of eukaryotic translation initiation factor 4γ1 (EIF4G1) on apoptosis of human non-small cell lung cancer (NSCLC) cells. Methods EIF4G1 expression in NSCLC cells was knocked down by RNAi technology. Human NSCLC A549 cells were divided into three groups: blank control group, Si-EIF4G1 group and Si-NC group. The proliferation of the A549 cell was analyzed by MTS and the apoptosis rates were detected by flow cytometry. EIF4G1 protein and apoptosis-related proteins in A549 cells were detected by Western blot. Results The proliferation of A549 cells in Si-EIF4G1 group were decreased compared with Si-NC group. Flow cytometry showed that cell apoptosis in Si-EIF4G1 group was increased(4.65%±6.12%)compared to NC(1.26%±2.60%)and Si-NC groups(3.88%±3.52%). Western-blot showed that the expressions of apoptosis-related proteins FAS, P21 and TRAF2 were increased (P<0.05).Conclusion EIF4G1 can inhibit apoptosis of A549 by regulating the expression levels of FAS, P21 and TRAF2.
【Key words】EIF4G1; non-small cell lung cancer; apoptosis
doi:10.16118/j.1008-0392.2016.03.010
收稿日期:2016-01-20
基金项目:上海市浦东新区科委创新基金(PKJ2015-Y16);上海市浦东新区卫生系统领先人才培养计划(PWRL2014-01)
作者简介:魏梦丹(1987—),女,硕士研究生.E-mail: wmd052050@sina.com
通信作者:徐增光.E-mail: xuzg1998@163.com
【中图分类号】R 734.2
【文献标志码】A
【文章编号】1008-0392(2016)03-0050-06