·基础研究·
沈爱群, 初 磊, 李 莉, 梁俊华, 童晓文, 李怀芳
(同济大学附属同济医院妇产科,上海 200065)
【摘要】目的 研究子宫内膜异位症患者在位内膜热休克蛋白70的表达及其对内膜细胞上皮间质化过程的影响。方法 (1) 采用Real-time PCR法测定子宫内膜异位症患者在位及异位内膜组织,以及非子宫内膜异位症患者在位内膜组织中HSP70 mRNA表达量;(2) 采用半定量法分析上述三种组织HSP70蛋白含量;(3) 将HSP70与子宫内膜细胞共培养后使用免疫荧光法测定上皮间质化标志物E-cadherin和α-SMA蛋白表达量的变化,使用Real-time PCR法测定E-cadherin和α-SMA蛋白mRNA表达变化。结果 (1) 内异症患者及非内异症患者分泌期内膜组织内HSP70 mRNA表达量和蛋白含量均高于增生期内膜组织(P<0.05)。(2) 分泌期内异症患者在位和异位内膜组织内HSP70 mRNA表达量及蛋白含量高于非内异症患者(P<0.05)。(3) 子宫内膜细胞与HSP70共培养后E-cadherin表达降低,α-SMA蛋白表达增加。结论 HSP70蛋白能够促进子宫内膜细胞上皮间质化,帮助异位内膜细胞种植转移。
【关键词】热休克蛋白70; 子宫内膜异位症; 上皮间质转化
子宫内膜异位症(endometriosis, EMS)是指子宫内膜腺体及间质在子宫外生长。子宫内膜异位症具有转移和播散生长的特征,可以造成慢性疼痛和不孕,严重影响女性生活质量,据估计,全球约有1亿7千6百万女性患病[1-2]。热休克蛋白(heat-shock protein, HSP)是一类普遍存在于原核和真核细胞内高度保守的多肽类蛋白质分子家族。HSP70是HSP家族中在细胞内最丰富也最保守的一类,具有抗凋亡、免疫逃避及促进上皮间质化过程等作用。本实验探讨和分析HSP70在子宫内膜异位病灶上皮间质化中的作用。
1.1 一般资料
收集我医院2015年1月至2015年12月经手术切除且病理确诊的卵巢子宫内膜异位症病例22例,年龄(26.9±5.1)岁,取患者子宫内膜异位病灶组织及子宫内膜组织,其中子宫内膜处于增生期10例,分泌期12例。收集我院同期因子宫肌瘤或者卵巢畸胎瘤、输卵管系膜囊肿行手术治疗患者内膜共20例,年龄(26.2±3.0)岁,其中增生期10例,分泌期10例。
1.2 不同组织HSP70 mRNA转录水平检测
取各组子宫内膜组织各30mg,提取基因组DNA,再取1μg DNA样本,对DNA样本浓度检测,将样本稀释至工作浓度30~50ng。使用Triz01一步法提取总RNA,应用Real-time PCR技术检测上述标本中HSP70 mRNA的表达,定量分析HSP70 mRNA在EMS患者在位内膜、异位内膜以及非EMS患者增生期和分泌期组织中的表达水平。
1.3 不同组织HSP70蛋白表达检测
将EMS患者在位及异位子宫内膜标本制成病理学检查的蜡块,4μm厚度连续切片,并行脱蜡、水化,对切片进行磷酸盐缓冲液(PBS)冲洗并加聚合物增强剂和兔抗人HSP70多克隆抗体等试剂,室温孵化,最后加入二氨基联苯胺(DAB)显色液,用苏木精染,并用中性树脂封片。同法对20例对照组患者内膜组织制片。兔抗人HSP70多克隆抗体、免疫织化学S-P试剂盒,苏木素复染试剂,DAB显色试剂盒均购自深圳华大基因有限公司。封片完毕后将切片放置显微镜下观察HSP70在内膜组织中的表达。以黄色和棕黄色为阳性信号。根据染色强度和显色细胞比例的综合评分。(1) 按内膜组织中显色有无及深浅评分: 无显色为0分,浅黄色或黄色为1分,棕黄色为2分,棕褐色为3分;(2) 膜组织的显色比例评分: <25%为0分,25%~50%为1分,50%~75%为2分,>75%为3分。每例标本的评分为[(1)+(2)]/2。
1.4 细胞外HSP70对子宫内膜细胞间质化的作用
1.4.1 子宫内膜细胞的分离培养 参考董喆[3]的方法培养在位子宫内膜细胞。取EMS患者分泌期子宫内膜组织,将内膜组织倒入无菌培养皿中,以PBS液冲洗3遍,去除血块等杂质。无菌剪刀将内膜组织剪成1mm×1mm×1mm大小的碎片,加入组织体积2倍的Ⅰ型胶原酶(0.5g/ml),37℃恒温水浴箱内消化20min,每5min取出拍打助消化,20min后取出加入等量的细胞培养基终止消化,离心半径10cm,1000r/min,离心5min,弃上清液。以细胞培养基悬浮,悬浮液经150目不锈钢滤网过滤、研磨,PBS冲洗,滤液经200目不锈钢滤网过滤,PBS冲洗,将滤液转入离心管中,离心半径10cm,1000r/min,离心5min,弃上清液,细胞培养基悬浮计数,以5×105~6×105个ml密度接种于培养瓶中,加入细胞培养基,37℃、相对体积分数5%CO2细胞培养箱中培养24h,细胞贴壁后换液,去除红细胞、未贴壁细胞及其他杂质。原代细胞分离培养后,间隔2~3d换液,每日倒置显微镜下观察细胞的生长状况,待细胞铺满培养瓶90%以上即需传代。弃细胞上清液,PBS清洗一次,吸净余留PBS洗液,加入含0.02%EDTA 0.15%胰蛋白酶消化约2min,倒置显微镜下观察,待基质细胞收缩变圆,将要脱离瓶壁而部分腺细胞及成纤维细胞尚未脱离时,加入细胞培养基终止消化,以吸管反复吹打,1000r/min,离心5min,弃上清液,以细胞培养基悬浮1∶3传代。取第三代细胞进行实验。
1.4.2 细胞外HSP70构建 GST-HSP70融合蛋白购自Sigma公司,采用Blachere等[4]的方法进行抗原肽和GST-HSP70体外结合。反应体系含1mmol/L ADP、1mmol/L MgCl 2、75μg/ml抗原肽、250μg/ml GST-HSP70, 37℃水浴2h。
1.4.3 E-cadherin、α-SMA蛋白表达的检测 将传代的内膜细胞分为HSP70干预组和对照组,其中干预组与HSP70共培养,按分子克隆方法提取细胞总蛋白,经Bradford法测定蛋白浓度;各组取总蛋白进行100g/L SDS聚丙烯酰胺凝胶电泳,半干法转膜,丽春红染色标记,100g/L脱脂奶粉于室温封闭 2h,50g/L脱脂奶粉稀释Ⅰ抗,4℃孵育过夜。TBST室温摇洗3次,10~15min;50ml/L脱脂奶粉稀释HRP标记的Ⅱ抗,于室温孵育2h,TBST摇洗3次,每次10~15min;ECL显色,测定各条带积分吸光度(A)值,定量分析。
1.4.4 E-cadherin、α-SMA mRNA表达的检测 将传代的内膜细胞分为HSP70干预组和对照组,其中干预组与HSP70共培养,按说明书提取各组细胞总RNA,测定RNA浓度和纯度并根据总RNA浓度按说明书逆转合成cDNA,共20μl。引物序列由北京鼎国生物工程有限公司设计并合成,E-cadherin正向引物5′-CCGCCATCGCTTACA-3′,反向引物5′-GGCACCTGACCCTTGTA-3′;α-SMA正向引物5′-CGGGACATCAAGGAGAAACT-3′;反向引物5′-CCATCAGGCAACTCGTAACTCT-3′。反应条件:两步法,第1步: 95℃ 3min;第2步: 95℃ 10s,60℃ 30s,共40个循环。熔解曲线分析: 以0.5℃/s 变化速度从65℃到95℃每隔5s计算1次荧光值。采用相对定量法,测定目的基因、校对基因及GAPDH的PCR产物的Ct值,代入公式2-ΔΔCt×100%。
1.5 统计学处理
采用SPSS 16.0统计软件,数据用![]() 表示,进行方差分析,以P<0.05为差异有统计学意义。
表示,进行方差分析,以P<0.05为差异有统计学意义。
2.1 EMS患者子宫内膜中HSP70的表达及随月经周期的变化
使用Real-time PCR法测量EMS患者在位及异位内膜以及非EMS患者在位内膜内HSP70 mRNA含量,发现无论EMS患者还是非EMS患者,分泌期内膜组织内HSP70含量均明显高于增生期内膜组织。而分泌期EMS患者在位和异位内膜组织内HSP70 mRNA含量高于非EMS患者,差异有统计学意义(表1、图1)。
表1 HSP70 mRNA在EMS患者及对照组增生期与分泌期内膜组织中的表达
Tab.1 Expression of HSP70 in endometrium of EMS patients and changes following menstrual cycle
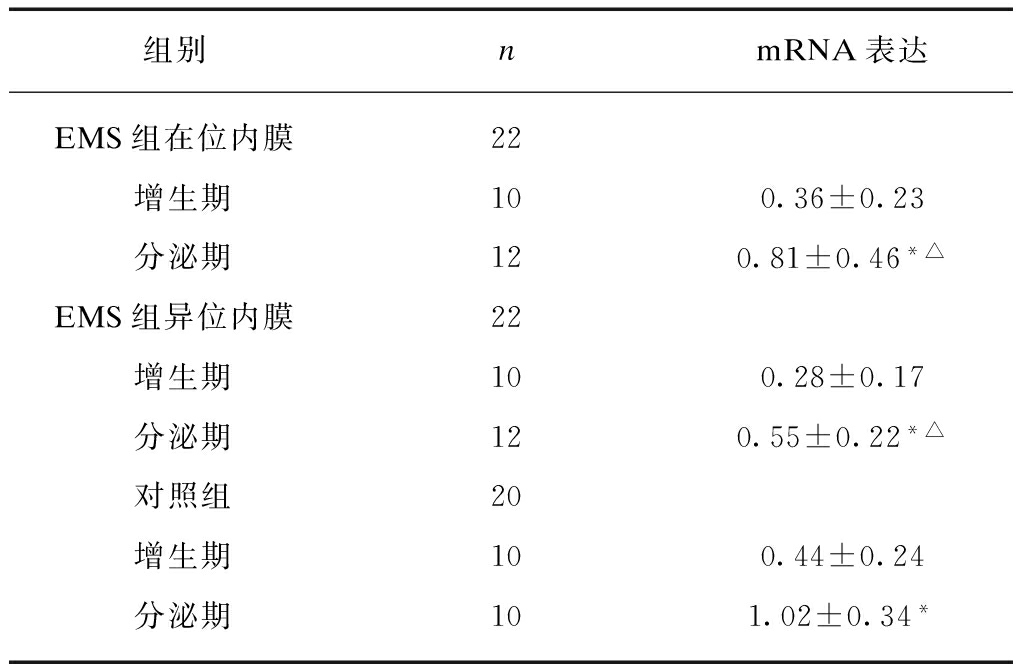
*表示与同组增生期对比,P<0.05,△表示与对照组分泌期对比,P<0.05
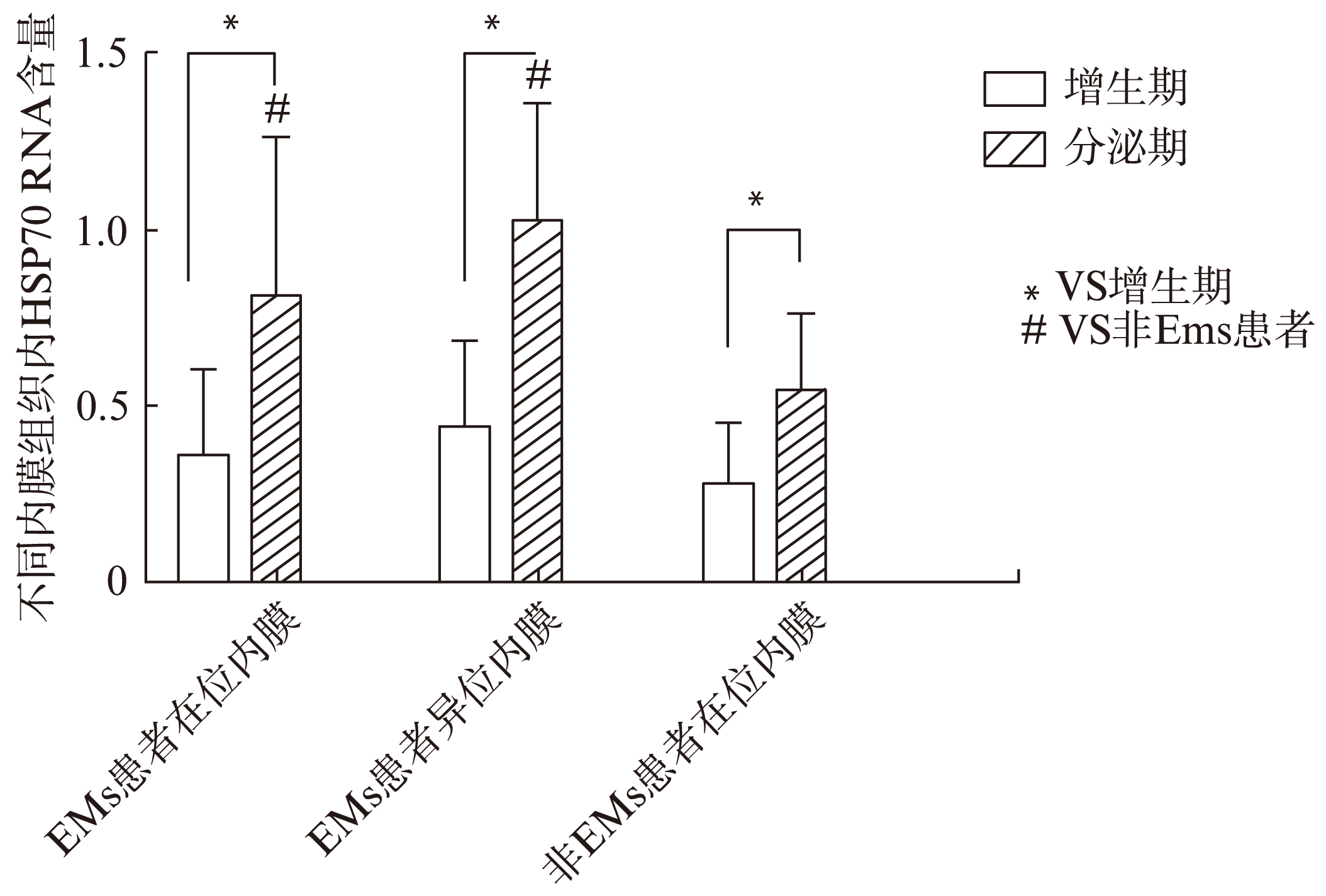
图1 不同内膜组织内HSP70 mRNA含量
Fig.1 HSP70 mRNA in different endometrial tissues
使用免疫组化法对EMS患者在位及异位内膜以及非EMS患者在位内膜HSP含量进行半定量评分,发现无论EMS患者还是非EMS患者,分泌期内膜组织内HSP70含量均明显高于增生期内膜组织。而分泌期EMS患者在位和异位内膜组织内HSP70含量高于非EMS患者,差异有统计学意义(表2、图2)。
表2 HSP 70在EMS患者及对照组增生期与分泌期内膜组织中的表达
Tab.2 HSP 70 pression in endometrium of EMS patients and changes following menstrual cycle
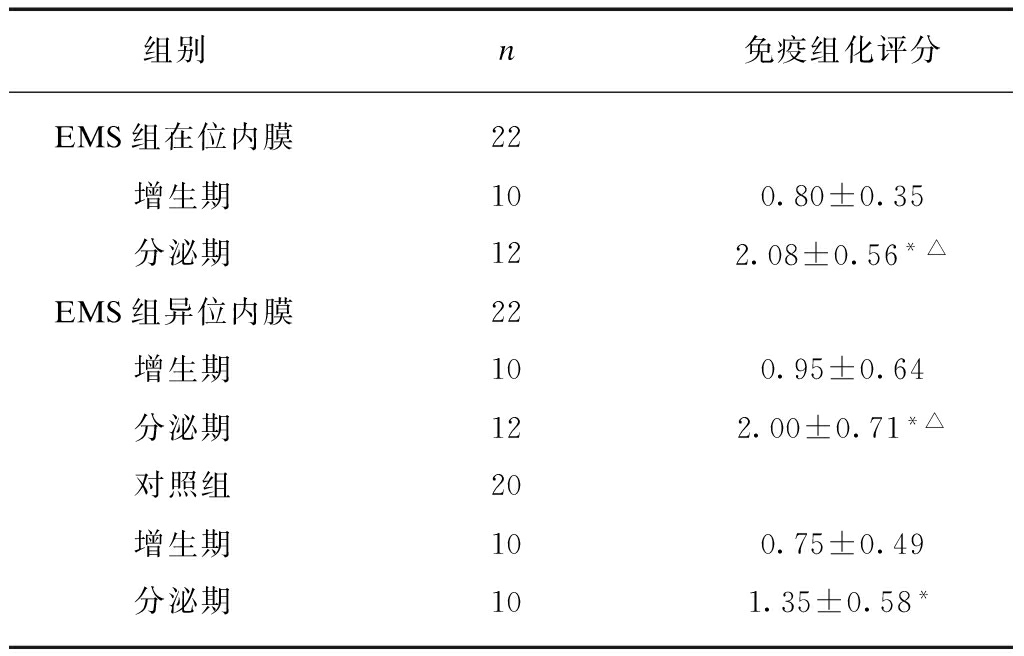
*表示与同组增生期对比,P<0.05,△表示与对照组分泌期对比,P<0.05
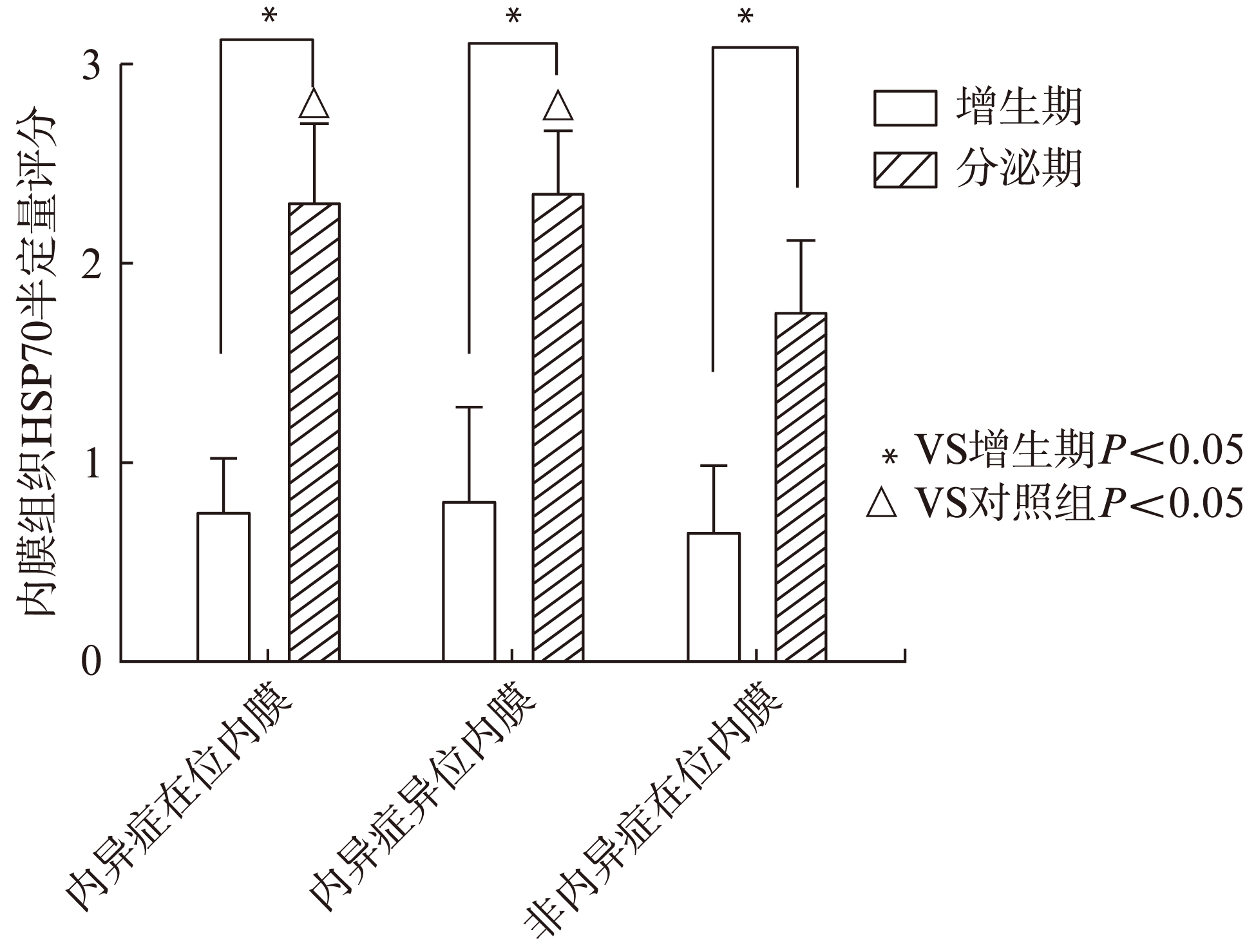
图2 不同内膜组织内HSP70半定量评分
Fig.2 HSP70 in different endometrial tissues
2.2 细胞外HSP70促进在位子宫内膜细胞EMT转化
Real-time PCR结果显示,HSP70干预组内膜细胞E-cadherin mRNA的表达显著下降,而间充质细胞标志物α-SMA mRNA的表达显著升高,见图3。同样,Western blotting结果显示,HSP70干预组细胞中上皮标志物E-cadherin蛋白的表达显著降低,而α-SMA蛋白的表达显著升高,见图4。
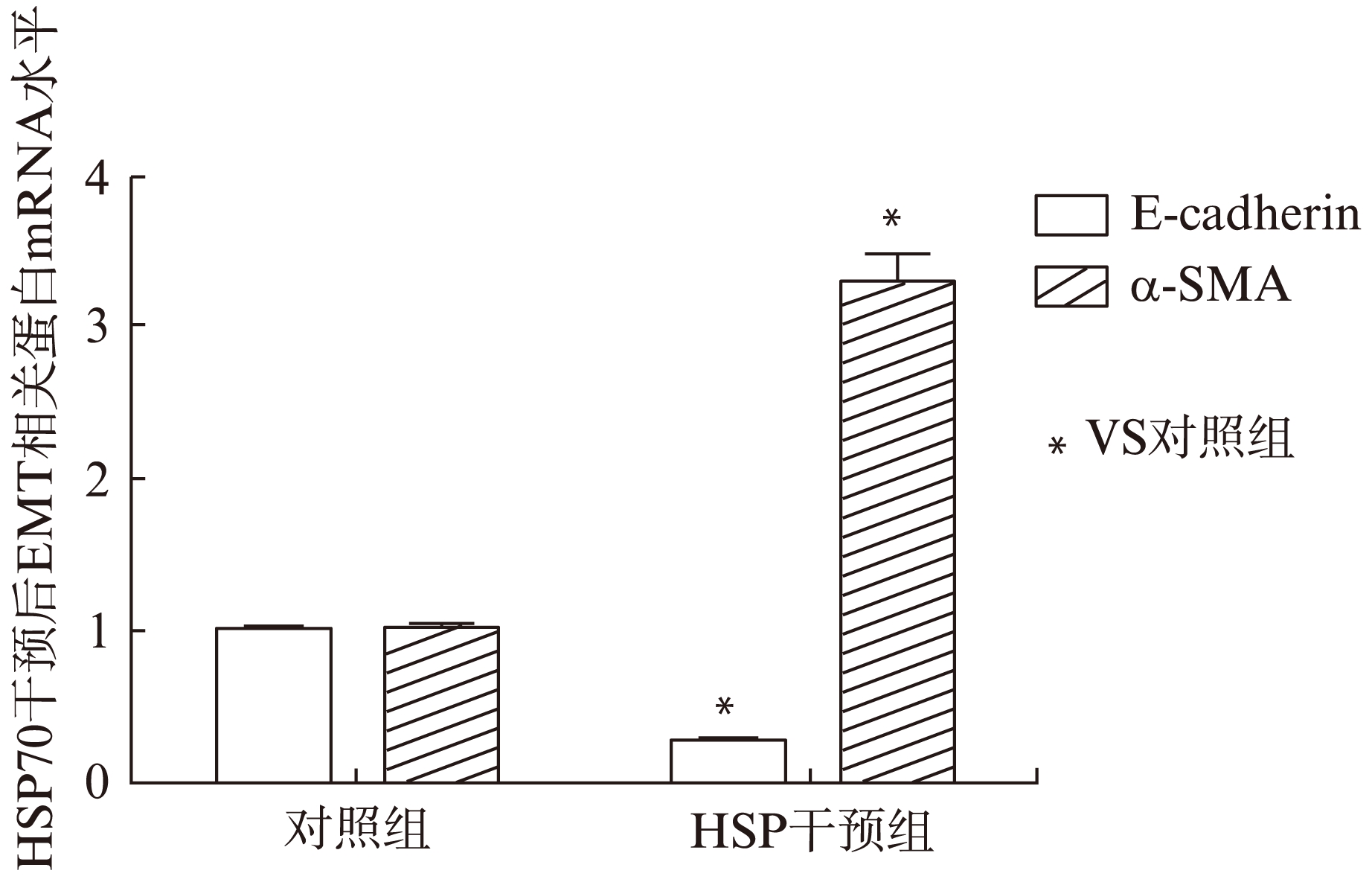
图3 HSP70干预后子宫内膜细胞E-cadherin及α-SMA mRNA含量变化
Fig.3 Expression of E-cadherin and α-SMA mRNA in endometrial cell treated with HSP70
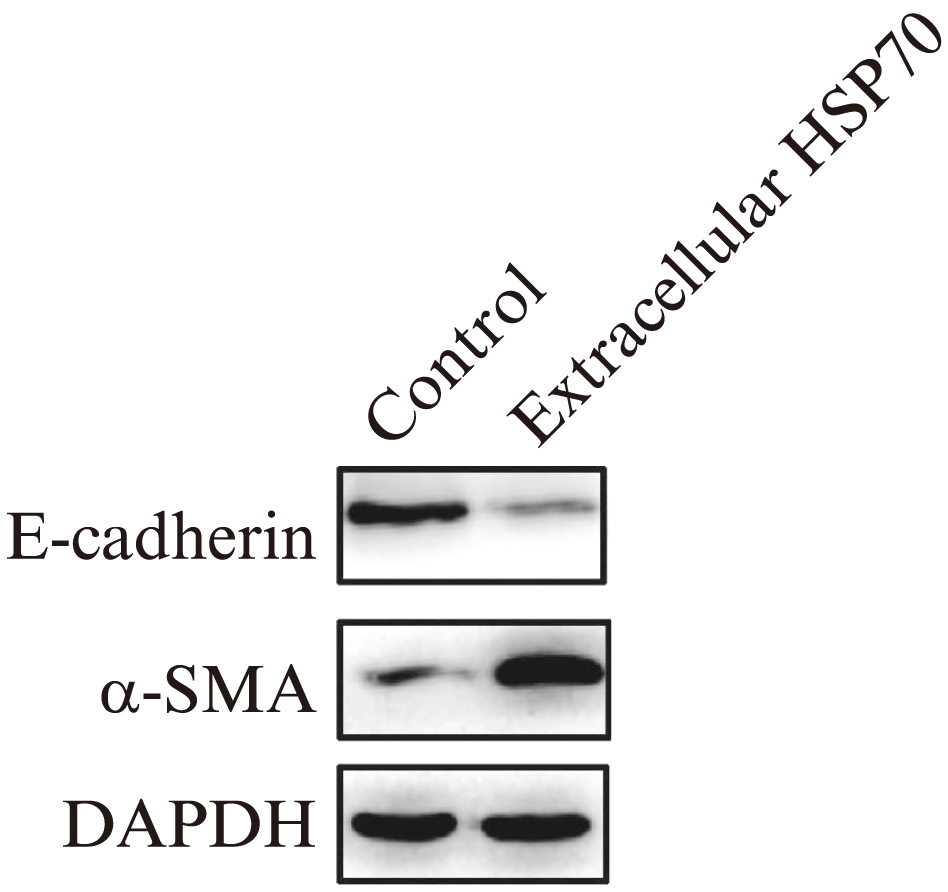
图4 HSP70干预后子宫内膜细胞E-cadherin及α-SMA 蛋白变化
Fig.4 Expression of E-cadherin and α-SMA protien in endometrial cell treated with HSP70
子宫内膜异位症是育龄妇女常见的良性疾病,但其具有侵袭和转移的恶性特征。Sampson经典的经血逆流学说是EMS发病学说的主导理论,解释了内膜转移的路径,即内膜组织经输卵管逆流播散到盆腹腔组织。但后续研究发现,经血逆流见于90%的育龄妇女,而EMS的发生率却只有10%~15%,许多学者尝试用新的理论解释这一现象。郎景提出的在位内膜决定论认为,EMS患者子宫内膜存在基因表达的异常,使得其具有更强的侵袭和生长能力,因此这些人的内膜细胞在盆腹腔内存活,导致了内异症的发生[5]。在位内膜决定论为研究EMS发生的相关性提供了新的思路。
HSP是一类古老的蛋白质家族,在细胞中执行最基本的生理功能,在应激的不利条件下,提高细胞的抵抗力,起到应激保护作用。近年,发现HSP70可以通过胞吐、分泌等形式释放到细胞外发挥作用[6]。Sims等[7]研究表明,细胞外存在的HSP70参与肿瘤的侵袭转移。先前的研究已经发现EMS患者子宫内膜组织中HSP70含量高于正常人[7],研究再次证实了这一点。研究中发现,无论是否患有EMS,分泌期子宫内膜组织内HSP70蛋白含量均高于增生期(P<0.05),而分泌期EMS患者在位以及异位内膜组织内HSP70含量相比较,差异无统计学意义,但均高于非EMS患者(P<0.05)。为进一步验证,本研究组使用Real-time PCR法研究不同组织间HSP70 mRNA表达水平,结果同样发现,分泌期内膜组织HSP70 mRNA水平高于增生期(P<0.05),而EMS患者HSP70 mRNA水平高于非EMS患者。
HSP70有多种重要的生理功能,主要包括抗凋亡和免疫逃避,以在应激的不利条件下提高细胞的抵抗能力。先前对HSP70在EMS发病中的作用机制研究主要集中在抗凋亡方面,发现HSP70升高能使脱落的内膜细胞保持更长时间的活力,并且抵抗腹腔液中各种促凋亡因子的作用。Khan则发现,HSP70可以通过TLR4受体影响腹腔液中巨噬细胞的功能,从而达到免疫逃避[8-10]。脱落的子宫内膜细胞种植在盆腹腔组织上必然伴随着上皮间质化过程。探讨HSP70是否在脱落内膜细胞上皮间质化中发挥作用。Liu发现,HSP70通过阻断Smad3通路从而影响腹膜间皮细胞的上皮间质化[11]。在研究中,将外源性的HSP70加入到传代培养的子宫内膜细胞中共培养后,上皮细胞标志物E-cadherin的mRNA及蛋白表达量均明显减少(P<0.05),而间皮细胞标志物α-SMA的mRNA及蛋白表达量均显著升高(P<0.05),说明细胞外高水平的HSP70确实能够影响脱落的子宫内膜细胞上皮间质化过程。在后续研究中将进一步探讨HSP70影响子宫内膜细胞上皮间质化的具体信号通路,以及导致EMS患者HSP70水平升高的原因。
【参考文献】
[1] Giudice LC, Clinical practice. Endometriosis[J]. N Engl J Med,2010,362(25): 2389-2398.
[2] Johnson NP, Hummelshoj L. World endometriosis society montpellier consortium, consensus on current management of endometriosis[J]. Hum Reprod,2013,28(6): 1552-1568.
[3] 董喆.子宫内膜异位症体外细胞共培养模型的建立及细胞迁移和侵袭的研究[D].中国协和医科大学,2010.
[4] Blachere NE, Li Z, Chandawarkar RY, et al. Heat shock protein-peptide complexes, reconstituted in vitro, elicitpeptide-specific cytotoxic T lymphocyte response and tumor immunity[J]. J Exp Med,1997,186(8): 1315-1322.
[5] 郎景和.子宫内膜异位症的研究与设想[J].中华妇产科杂志,2003,8: 33-35.
[6] Nirdé P, Derocq D, Maynadier M, et al.Heat shock cognate 70 protein secretion as a new growth arrest signal for cancercells[J].Oncogene,2010,29(1): 117-127.
[7] 于月成,辛晓燕,王滨,等.热休克蛋白在子宫内膜异位症中的表达及意义[J].细胞与分子免疫学杂志,2002,6: 571-574.
[8] Khan KN, Kitajima M, Inoue T,et al.Additive effects of inflammation and stress reaction on Toll-like receptor 4-mediated growth of endometriotic stromal cells[J]. Hum Reprod,2013,28(10): 2794-2803.
[9] Khan KN, Kitajima M, Imamura T,et al. Toll-like receptor 4-mediated growth of endometriosis by human heat-shock protein 70[J]. HumReprod, 2008,23(10): 2210-2219.
[10] Imamura T, Khan KN,Fujishita A, et al.Effect of GnRH agonist therapy on the expression of human heat shock protein 70 in eutopic and ectopic endometria of women with endometriosis[J]. Eur J Obstet Gynecol Reprod Biol,2014,180: 16-23.
[11] Liu J, Bao J, Hao J,et al.HSP70 inhibits high glucose-induced Smad3 activation and attenuates epithelial-to-mesenchymal transition of peritoneal mesothelial cells[J]. Mol Med Rep,2014,10(2): 1089-1095.
Expression of HSP70 in ectopic uterine endometrium and its relation to epithelial-mesenchymal transition
SHEN Ai-qun, CHU Lei, LI Li, LIANG Jun-hua, TONG Xiao-wen, LI Huai-fang
(Dept. of Gynecology and Obstetrics, Tongji Hospital, Tongji University, Shanghai 200065, China)
【Abstract】Objective To investigate the expression of heat shock protein 70 (HSP70) in endometriosis (EMs) and its relation to epithelial-mesenchymal transition.Methods The expression of HSP70 mRNA and protein in ectopic and eutopic endometrium in patients with EMs and eutopic endometrium in women without EMs was detected by RT-PCR and immunohistochemistry, respectively. The expression of E-cadherin and α-SMA was detected in uterine endometrial cells by RT-PCR and Western blotting after treated with extracellular HSP70 in vitro. Results The expression of HSP70 mRNA and protein in secretory phase endometrium in EMs patients and women without EMs was higher than that in proliferative phase(P<0.05). The expression of E-cadherin HSP70 mRNA and protein in secretory phase ectopic and eutopic endometrium in EMs patients was higher than that in women without EMs(P<0.05). The expression of E-cadherin decreased and the expression of α-SMA increased in uterine endometrial cell after treated with extracellular HSP70. Conclusion HSP70 expression can promote the epithelial-mesenchymal transition in ectopic uterine endometrial cells.
【Key words】HSP70 heat-shock proteins; endometriosis; epithelial-mesenchymal transition
doi:10.16118/j.1008-0392.2016.03.009
收稿日期:2016-04-08
基金项目:上海市科委医学引导项目(09411963700)
作者简介:沈爱群(1975—),女,主治医师,硕士.E-mail: saqtongji@yeah.net
通信作者:李怀芳.E-mail: huaifangli@126.com
【中图分类号】R 711.71
【文献标志码】A
【文章编号】1008-0392(2016)03-0045-05