·基础研究·
张佑俊, 曲新凯
(上海交通大学附属胸科医院心内科,上海 200030)
【摘要】目的 通过建立大鼠心肌缺血再灌注(ischemia/ reperfusion, I/R)模型,探索药物烟酰胺腺嘌呤二核苷酸(NAD+)在大鼠心肌缺血再灌注损伤中的保护作用。方法 采用手术结扎前降支建立大鼠心肌I/R模型,20只Sprague-Dawley ( SD)大鼠随机分入I/R+NAD+组(n=10)和I/R+NS组(n=10),通过血清肌钙蛋白(cTn-I),TTC染色检测心肌损伤程度, TUNEL染色用于检测缺血区域凋亡信号。结果 成功建立大鼠I/R模型,I/R+NAD+组大鼠血清cTn-I水平显著低于I/R+NS组[(10.01±3.26) ng/ml vs. (57.17±14.83) ng/ml, P<0.01]。TTC染色结果显示: I/R+NAD+组大鼠心脏梗死体积显著低于I/R+NS组[(68.06±16.04) mm3vs. (11.42±9.65) mm3, p=0.02]。TUNEL染色结果显示: I/R+NAD+组大鼠心脏梗死区域凋亡信号显著低于I/R+NS组。结论 NAD+在大鼠心肌缺血再灌注损伤具有显著保护作用,而其具体保护机制需进一步研究。
【关键词】缺血再灌注损伤; NAD+; 心肌梗死; 大鼠
冠心病是严重威胁人类健康和生命的重大疾病之一,其发病率、死亡率逐年升高,其中急性心肌梗死是冠心病中致死及致残率最高的一类疾病[1]。尽管介入治疗的广泛开展,治疗缺血及再灌注(ischemia/ reperfusion, I/R)损伤的心肌仍是尚未解决的难题,大量患者在急诊介入治疗后一周内出现急性心衰,恶性心律失常,甚至死亡[2]。此外,冠脉搭桥、心脏移植、心脏骤停心肺复苏后、体外循环心脏手术后等均存在I/R问题[3-4]。
烟酰胺腺嘌呤二核苷酸(NAD+)是天然的细胞内参与能量代谢的重要辅酶。近年来,研究发现NAD+更是作为代谢底物和细胞内信号分子参与并调节细胞内代谢及基因表达[5]。细胞内NAD+耗竭导致细胞代谢障碍甚至细胞凋亡。 Alano和Liu等的心肌细胞模型研究发现,I/R损伤伴随显著的细胞内NAD+水平的下降,外源性补充NAD+具有显著的保护作用[6-7]。然而,目前研究NAD+的心肌保护作用仍局限于细胞水平,本研究通过建立大鼠心肌I/R模型研究NAD+在心肌I/R损伤的作用,发现静脉注射NAD+显著保护大鼠心肌I/R损伤,有望进一步为NAD+在大动物疾病模型研究甚至临床应用提供重要依据。
1.1 实验动物和主要试剂
健康雄性Sprague-Dawley (SD)大鼠20只,体质量250~350g,购买于上海斯莱克医用实验动物中心。分笼饲养于恒温(20~22)℃、12h明/暗循环、无特殊病原体条件下,饮用水和标准饲料均经灭菌后供动物自由取用。实验所有的操作流程均符合上海交通大学医学院实验室动物保护和使用守则。NAD+及2,3,5-氯化三苯基四氮唑(TTC)分别购买于美国sigma公司,转移酶介导的三磷酸脱氧鸟苷-生物素刻痕末端标记(TUNEL)试剂盒购买于默克密理博公司。
1.2 大鼠心肌I/R动物模型建立
用3%戊巴比妥钠麻醉大鼠(30mg/kg, ip),气管插管,连接小动物呼吸机 (通气频率60次/min)。开胸,以5-0丝线在距冠状动脉前降支根部1~2mm 系一个拌,其间穿过一塑料管,拉紧拌,观察结扎线以下心肌组织颜色变暗的情况。60min松开结扎袢,使冠状动脉血流再通,再灌时局部组织充血[8]。实验分为I/R+NAD+组和I/R+生理盐水(NS)组,每组大鼠10只。分别在再灌注6h和24h先从下腔静脉取血,再取出心脏进行后续检测。I/R+NAD+组在前降支结扎后即刻尾静脉给NAD+ 20mg/kg,I/R+NS组则给等量(100μl)的NS。再灌注24h后,牺牲大鼠,取大鼠心脏用于 TTC染色,再灌注6h后牺牲大鼠,血清用于血清肌钙蛋白(cTn-I)检测,心脏冰冻切片后进行TUNEL染色。
1.3 TTC染色
将大鼠心脏手术结扎缺血1h再灌注 24h 后死亡大鼠,取下心脏,在切片模具下沿垂直心脏长轴方向将其横切为8~9片,每片厚约为1mm。展平后置于磷酸缓冲盐溶液(PBS)溶解的1% TTC溶液中,37℃避光孵育20min,分别于染色后在数码相机下拍照,采用Image pro plus 6.0图像处理软件计算每片梗死面积[9]。每片梗死体积=每片梗死面积×每片的厚度。
1.4 血清cTn-I检测
心肌梗死血清标志物cTn-I是临床上诊断心肌损伤的金标准,本实验中采用血清cTn-I浓度评价大鼠心肌梗死程度。3%的戊巴比妥钠腹腔麻醉大鼠,固定四肢,在下腔静脉取血,用促凝管收集 4ml 静脉血,待血液自然凝固后,离心半径 12cm,以3000r/min,15min离心后取上层血清,在Access® Immunoassay System系统下检测血清cTn-I浓度[10]。
1.5 TUNEL凋亡信号检测
3%的戊巴比妥钠腹腔麻醉大鼠,固定四肢,快速取出大鼠心脏,洗净血液,保存于液氮中,后转移至-80℃保存,冰冻切片,根据试剂盒说明书进行TUNEL染色,后在400倍光镜下观察摄片。
1.6 统计分析
采用SPSS 20.0统计学软件进行统计分析,所有计量资料均用![]() 表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2.1 NAD+显著减少大鼠I/R损伤后心肌梗死体积
两组大鼠心脏TTC染色结果见图1所示,I/R+NAD+组心肌梗死体积(11.42±9.65)mm3,明显小于R+NS组(68.06±16.04)mm3(P=0.02)。
2.2 NAD+显著降低cTn-I水平
两组大鼠血清cTn-I结果如图2所示,I/R+NAD+组cTn-I (10.01±3.26ng/ml)显著小于I/R+NS组(57.17±14.83ng/ml)(P<0.01)。
2.3 NAD+显著降低TUNEL凋亡信号
两组大鼠TUNEL染色结果如图3所示,I/R+NAD+组凋亡信号明显少于I/R+NS组。

图1 两组大鼠心肌梗死体积比较
Fig.1 the myocardial infarct volume of rats in two groups
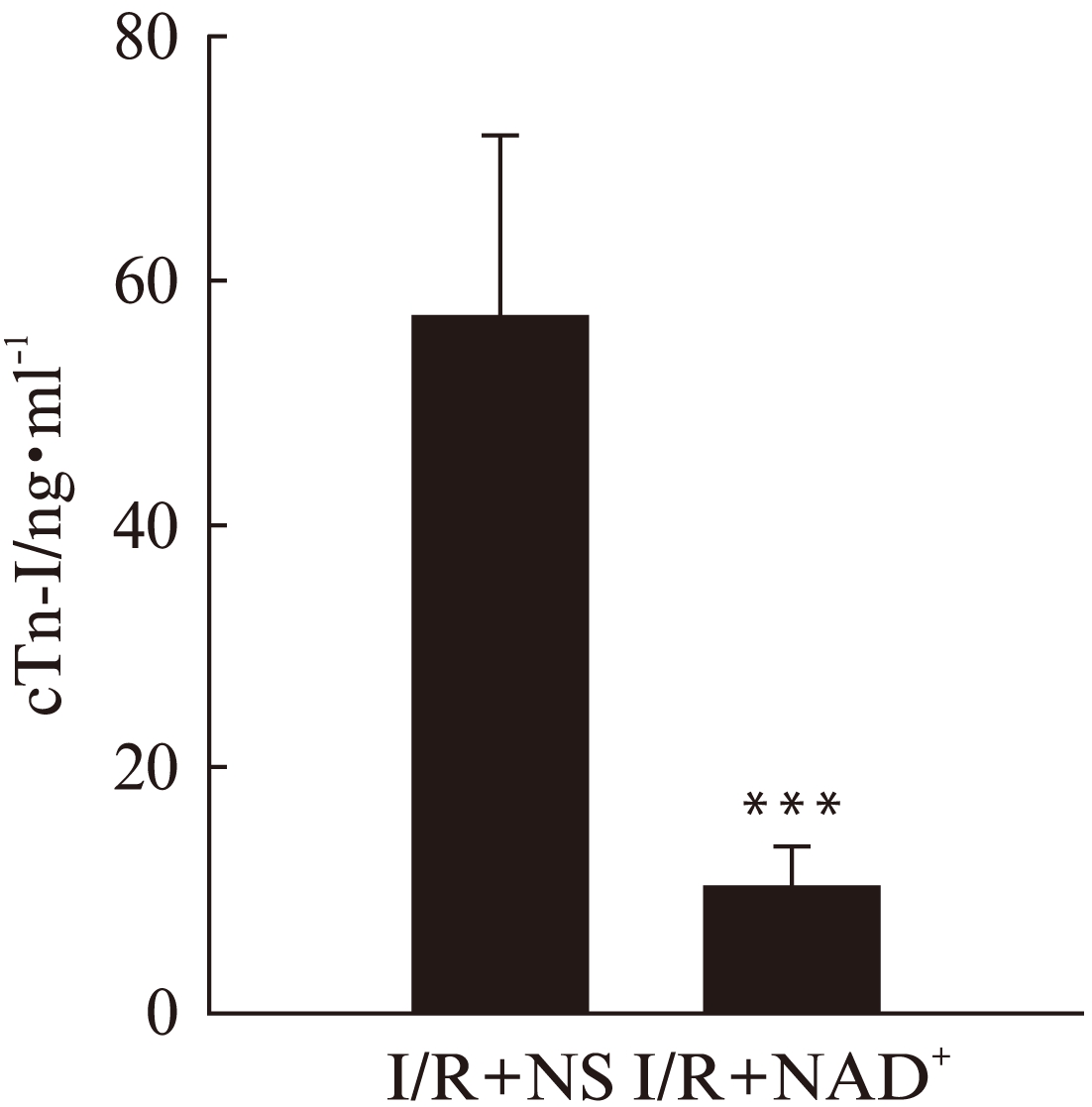
图2 两组大鼠再灌注6h 血清cTn-I水平
Fig.2 the cTn-I level of rats after 6h reperfusion in two groups
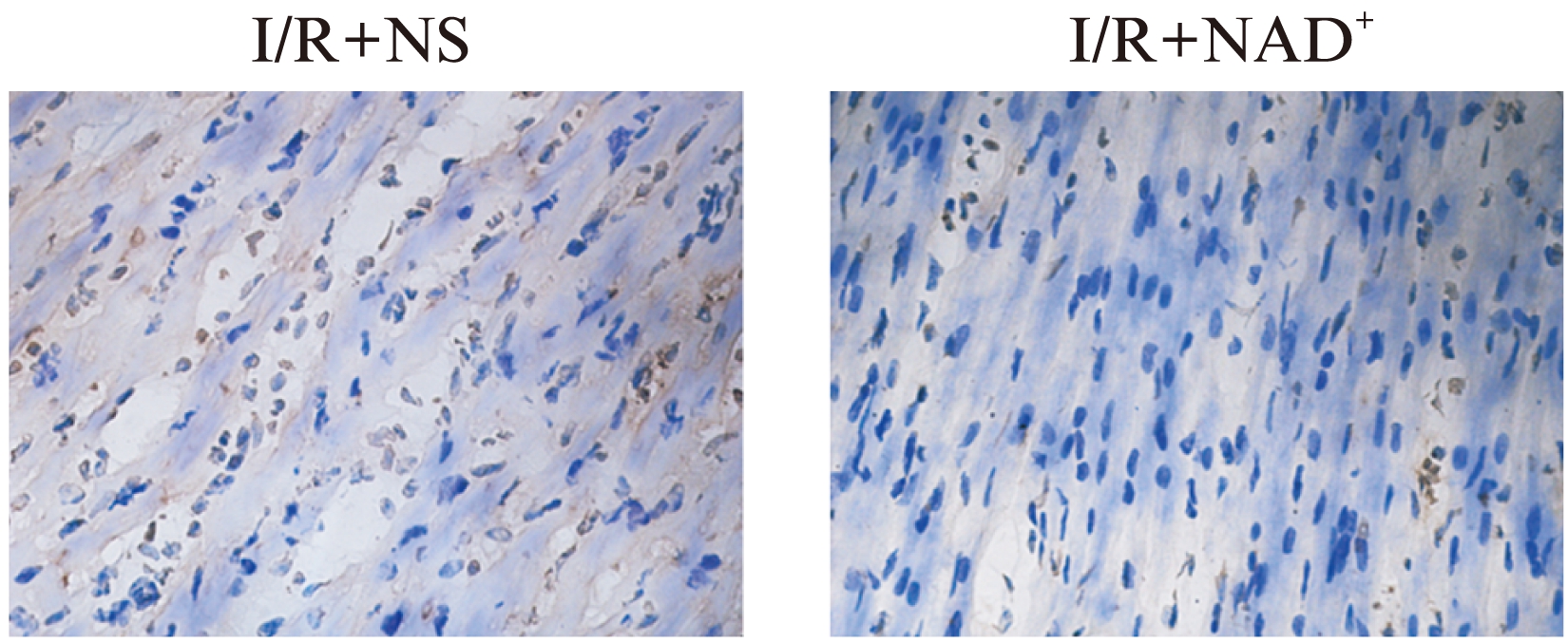
图3 两组大鼠缺血区域心肌细胞凋亡信号比较
Fig.3 the apoptosis rate in ischemical area of neats in two groups
大量实验研究发现多种药物被证明具有保护心肌I/R损伤的作用,但至今仍无FDA批准的用于治疗I/R损伤的临床药物[11]。临床上仍缺乏针对I/R损伤的有效药物。
本研究中,成功实现大鼠心肌I/R模型的建立,通过静脉注射NAD+可显著减少I/R导致的心肌梗死体积,相应的再灌注6h后cTn-I水平在NAD+给药组亦显著降低,进一步研究发现,静脉给药NAD+可显著减少I/R损伤后的心肌细胞凋亡。在现象上,NAD+可显著保护I/R损伤的心肌。
NAD+最初被发现作为一个重要辅酶在细胞糖代谢以及线粒体电子传递链起着重要作用。但是近年来研究发现,NAD+对于氧化性细胞损伤和缺血性脑损伤有着显著的保护作用[6, 12]。进一步的,关于NAD+依赖性酶的研究发现,NAD+及NAD+依赖性酶在细胞内氧化应激、细胞代谢、能量平衡中起着重要作用[13-15]。
Ying等的研究发现,应激条件下,细胞内NAD+的显著下降是引起细胞凋亡的主要原因,外源性补充NAD+可维持应激条件下细胞的稳态。在进一步的大鼠脑I/R模型中,NAD+显著保护脑I/R损伤[12]。另外,研究表明,在一定范围内,NAD+与NAD+依赖的细胞内组蛋白去乙酰化酶(Sirtuins)乙酰化作用呈明显的量效关系[13]。目前Sirtuins的去乙酰化作用成为近年研究的热点并取得积极效果[16]。Hsu等在小鼠心肌I/R模型中发现Sirtuins 1通过去乙酰化靶蛋白显著增强了心肌抗氧化抗凋亡的能力[17]。Pais及peek等研究则提示Sirtuins 2,3分别在炎症和能量代谢中发挥重要作用[13, 18]。
I/R损伤是一个多因素参与的病理过程。在细胞水平研究发现,NAD+减少缺氧复氧导致的心肌细胞凋亡,首次通过大鼠I/R模型研究发现,NAD+显著减少I/R损伤导致的心肌梗死体积及心肌细胞凋亡,进一步证明了NAD+具有显著保护心肌I/R损伤的作用,为NAD+在大动物疾病模型甚至临床应用中提供依据。另一方面,NAD+在I/R损伤过程中可能从多个通路保护心肌,NAD+的保护心肌的确切机制有待于研究。
【参考文献】
[1] Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statistics-2016 update: a report from the American heart association[J]. Circulation,2016,133(4): 38.
[2] Hausenloy DJ, Yellon DM. Targeting myocardial reperfusion injury—the search continues[J]. N Engl J Med, 2015,373(11): 1073-1075.
[3] Tomaselli GF, Barth AS. Sudden cardio arrest: oxidative stress irritates the heart[J]. Nat Med, 2010,16(6): 648-649.
[4] Hausenloy DJ, Candilio L, Evans R, et al. Remote ischemic preconditioning and outcomes of cardiac surgery[J]. N Engl J Med, 2015,373(15): 1408-1417.
[5] Canto C, Menzies KJ, Auwerx J. NAD(+) metabolism and the control of energy homeostasis: a balancing act between mitochondria and the nucleus[J]. Cell Metab, 2015,22(1): 31-53.
[6] Alano CC, Garnier P, Ying W, et al. NAD+ depletion is necessary and sufficient forPoly(ADP-Ribose) polymerase-1-mediated neuronal death[J]. J Neurosci, 2010,30(8): 2967-2978.
[7] Liu L, Wang P, Liu X, et al. Exogenous NAD+supplementation protects H9c2 cardiac myoblasts against hypoxia/reoxygenation injury via sirt1-p53 pathway[J]. Fundam Clin Pharmacol, 2014,28(2): 180-189.
[8] 张治国,叶亮,曹浩.大鼠急性心肌梗死模型的建立[J]. 同济大学学报: 医学版,2011,32(2): 44-46.
[9] Tseliou E, Kanazawa H, Dawkins J, et al. Widespread myocardial delivery of heart-derived stem cells by nonocclusive triple-vessel intracoronary infusion in porcine ischemic cardiomyopathy: superior attenuation of adverse remodeling documented by magnetic resonance imaging and histology[J]. PLoS One, 2016,11(1): e0144523.
[10] Reagan WJ, York M, Berridge B, et al. Comparison of cardiac troponin i and t, including the evaluation of an ultrasensitive assay, as indicators of doxorubicin-induced cardiotoxicity[J]. Toxicol Pathol, 2013,41(8): 1146-1158.
[11] Zhang J, Karcz MK, Nadtochiy SM, et al. High-throughput screening reveals the mitochondrial complex i inhibitor nornicotine is cardioprotective in ischemia-reperfusion injury when delivered at reperfusion[J]. Circ Res, 2015,117(Suppl 1): A404.
[12] Ying W, Wei G, Wang D, et al. Intranasal administration with NAD+ profoundly decreases brain injury in a rat model of transient focal ischemia[J]. Front Biosci, 2007,12: 2728-2734.
[13] Peek CB, Affinati AH, Ramsey KM, et al. Circadian clock NAD+ cycle drives mitochondrial oxidative metabolism in mice[J]. Science, 2013,342(6158): 1243417.
[14] Wu MF, Yin JH, Huang CS, et al. NAD attenuates oxidative DNA damages induced by amyloid beta-peptide in primary rat cortical neurons[J]. Free Radic Res, 2014,48(7): 794-805.
[15] Verdin E. NAD+ in aging, metabolism, and neurodegeneration[J]. Science, 2015,350(6265): 1208-1213.
[16] Winnik S, Auwerx J, Sinclair DA, et al. Protective effects of sirtuins in cardiovascular diseases: from bench to bedside[J]. Eur Heart J, 2015,36(48): 3404-3412.
[17] Hsu CP, Zhai P, Yamamoto T, et al. Silent information regulator 1 protects the heart from ischemia/reperfusion[J]. Circulation, 2010,122(21): 2170-2182.
[18] Pais TF, Szego EM, Marques O, et al. The NAD-dependent deacetylase sirtuin 2 is a suppressor of microglial activation and brain inflammation[J]. EMBO J, 2013,32(19): 2603-2616.
Protective effect of NAD+ in heart ischemia/reperfusion injury
ZHANG You-jun, QU Xin-kai
(Dept. of Cardiology, Shanghai Chest Hospital, Shanghai Jiaotong University, Shanghai 200030, China)
【Abstract】Objective To investigate the effect of nicotinamide adenine dinucleotide (NAD+) in protection of myocardium from ischemia/reperfusion injury. Methods The ischemic/reperfusion model was induced with surgical ligation of left anterior descending (LAD) in 20 SD rats. NAD+ 20mg/kg or same volume of NS were given i.v. immediately after LAD ligation to rats in I/R+ NAD+ group (n=10) or I/R +NS group (n=10). Serum cTn-I was measured; TTC staining and TUNEL assay were performed. Results Serum cTn-I level was significantly higher in I/R+NS group than that in I/R+NAD+ group [(57.17±14.83) ng/ml vs. (10.01±3.26) ng/ml, P<0.01]. TTC staining showed that the infarct volume in I/R+NS group was higher than that in I/R+NAD+ group [(68.06±16.04) mm3vs. (11.42±9.65) mm3, P=0.02]. TUNEL assay showed that high apoptosis signal induced by I/R injury was significantly reduced by NAD+ administration. Conclusion NAD+ can significantly protect the heart from I/R injury.
【Key words】ischemia/reperfusion injury; NAD+; myocardial infarction; ret
doi:10.16118/j.1008-0392.2016.03.006
收稿日期:2016-01-31
基金项目:上海交通大学医工交叉研究基金(YG2014MS74);上海市胸科医院科技发展基金(2014YZDH20300)
作者简介:张佑俊(1989—),男,住院医师,硕士.E-mail: zyjheart@126.com
通信作者:曲新凯.E-mail: qxkchest@126.com
【中图分类号】R 54
【文献标志码】A
【文章编号】1008-0392(2016)03-0032-04