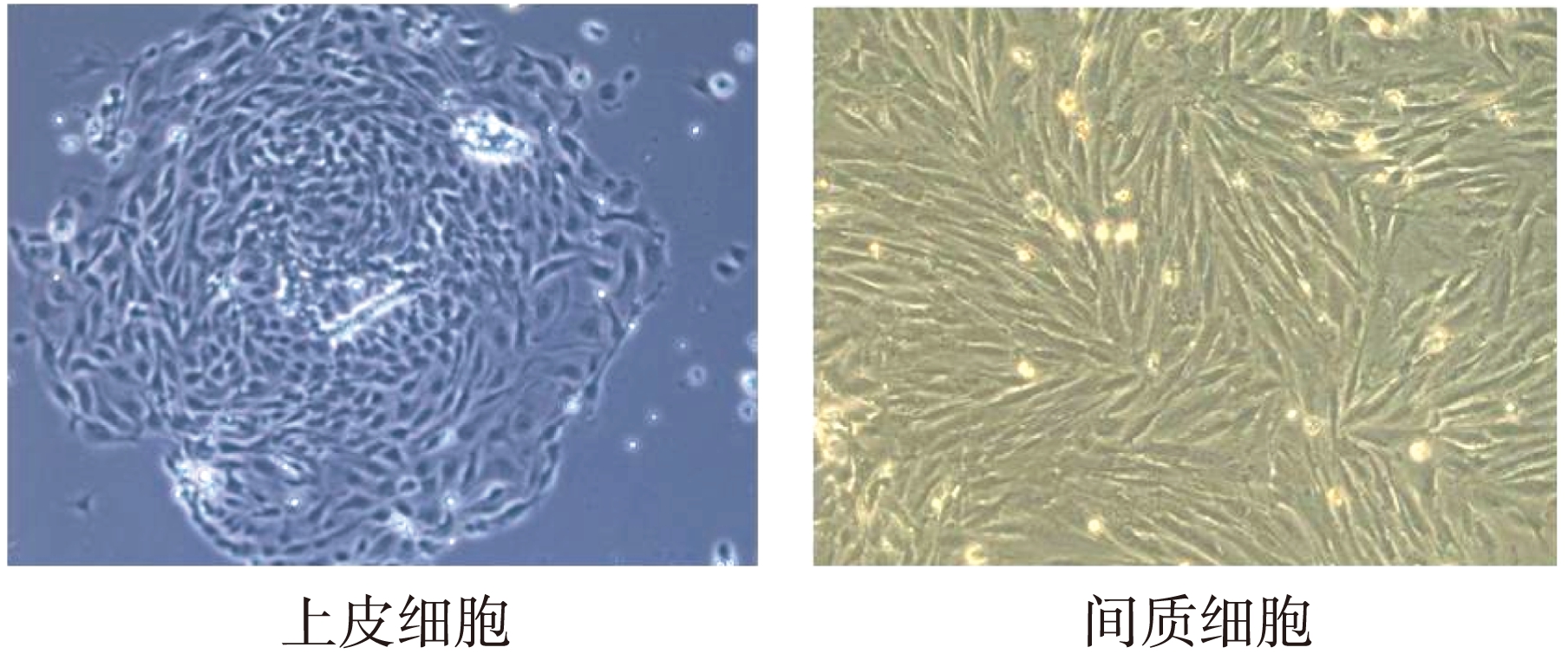
图1 子宫内膜腺上皮及间质细胞呈不同生长形态
Fig.1 The morphology of endometrial glandular epithelial and stromal cells(400×)
·基础研究·
陆 雯, 瞿俊杰, 万小平
(同济大学附属第一妇婴保健院妇产科,上海 201204)
【摘要】目的 优化人正常子宫内膜腺上皮细胞分离和原代培养的方法,提供子宫内膜相关疾病研究的体外细胞模型。方法 采用酶消化、筛网过滤、离心的方法体外分离和培养人子宫内膜腺上皮与间质细胞。腺上皮细胞鉴定采用光学显微镜下观察细胞形态;免疫细胞荧光及免疫细胞化学法检测上皮细胞角蛋白(CK)和间质细胞波形蛋白(Vim)的表达。结果 经诊刮获得的18份标本中有17份分离培养成功;细胞形态符合腺上皮细胞特征,CK免疫荧光及免疫化学染色阳性,Vim染色阴性,纯度达90%以上;正常原代人子宫内膜腺上皮细胞不能传代,培养5~6d后细胞逐渐衰老。结论 改良后的原代培养方法取材简单,克服了污染问题,可获得高纯度及足够数量的人正常子宫内膜腺上皮细胞作为体外实验模型。
【关键词】子宫内膜; 腺上皮细胞; 细胞原代培养
正常子宫内膜腺上皮细胞体外培养体系的建立是研究子宫内膜相关疾病的重要手段。与肿瘤细胞能永生化生长及传代的特征不同,正常子宫内膜腺上皮细胞体外生长困难,不能传代,仅能通过原代培养的方法获取细胞作为研究模型[1-2]。因此,找到一种简便、高效的原代培养方法对子宫内膜相关疾病的研究至关重要。目前已有的方法存在取材困难(多数为术中切除子宫后刮取)、经阴道取材易污染、获取细胞数较少等问题,使正常子宫内膜腺上皮细胞的原代培养较为困难。本研究从取材、分离及培养方法等方面进行了改进,为人正常子宫内膜腺上皮细胞原代培养提供了简便高效的方法。
1.1 标本获取
标本取自2014年7至10月在本院妇科因异常子宫出血接受经阴道诊刮患者的子宫内膜18例,其中10例为宫腔镜下取得。患者年龄28~45岁,术前3个月内未接受激素治疗。所有标本均经H-E染色及病理证实为正常子宫内膜组织。
1.2 主要试剂及仪器
细胞培养基 DMEM/F12 (1∶1) (美国,Gibco),胎牛血清 (美国,HyClone),胰蛋白酶(美国,HyClone);青霉素100U/ml 、链霉素100U/ml、甲硝唑100U/ml (中国,江阴齐氏);自配磷酸盐缓冲液(phosphate buffer saline, PBS);自配D-Hank’S平衡盐溶液( hank’s balanced salt solution, HBSS);广谱细胞角蛋白(cytokeratin, CK) 抗体(美国,Sigma) 及细胞波形蛋白(Vimentin, Vim) 抗体(美国, CST);150μm 及38μm筛网(中国,上海实生);恒温培养箱(GNP-9080,上海精宏);离心机(德国,Eppendorf Centrifuge 5810R);倒置显微镜(TS100, Nikon)等。
1.3 人正常子宫内膜腺上皮细胞分离及原代培养
参照Zhang[3]和Osteen等[4]的方法,加以改良。(1) 无菌条件下刮取子宫内膜组织3~5g,刮宫时于后穹窿放置无菌小纱布,尽量避免组织与阴道壁接触;将内膜组织置于盛有3ml细胞培养液(DMEM/F12,加双抗及甲硝唑)的无菌收集管中,尽快进行分离培养;(2) 超净台下操作,以D-Hank’S液+双抗 (青霉素100U/ml+链霉素100U/ml)+甲硝唑100U/ml洗液洗涤组织3次,并浸泡5min;再以细胞培养液洗涤3次,尽量去除红细胞;(3) 将内膜组织剪碎成2~3mm3小块,使用0.1%胰酶-EDTA消化,置37°C恒温消化约30min,每隔10min震荡一次, 并镜检观察其消化情况;(4) 将消化后的组织细胞悬液轻柔吹打,使用100目(150μm孔径)筛网过滤组织悬液,去除黏液及未消化组织;(5) 滤过液再使用400目(38μm孔径)筛网过滤分离上皮细胞及间质细胞;收集滤液,离心半径10cm,1000r /min,离心10min,弃上清液,沉淀物主要为间质细胞;使用细胞培养液反冲筛网,所得反冲液主要含内膜腺上皮细胞团;(6) 离心半径 10cm,1000r/min,离心5min,弃上清液,收集沉淀的腺上皮细胞团;(7) 将腺细胞重悬计数后接种于含10%胎牛血清的DMEM-F12培养基(加双抗),置于湿润的含相对体积分数为5% CO2的37℃培养箱中,24h后换液。
1.4 子宫内膜腺上皮细胞鉴定
(1) 倒置相差显微镜观察腺上皮细胞和间质细胞的形态差异;(2) 免疫细胞荧光及免疫细胞化学: 细胞角蛋白(CK)及波形蛋白(Vim)分别是上皮及间质细胞的特异性标记。采用免疫细胞荧光及免疫细胞化学法,通过检测CK和Vim 对原代分离培养的子宫内膜腺上皮和间质细胞进行染色鉴定。将两种细胞分别接种于多聚赖氨酸预处理的盖玻片,4%多聚甲醛固定。一抗: 小鼠抗人细胞CK 抗体 1∶200,兔抗人细胞Vim 抗体1∶200。分别于光学显微镜及荧光显微镜及下观察,镜下取10个不同视野进行细胞计数,计算细胞纯度。
2.1 细胞分离及培养结果
共获取经阴道诊刮的子宫内膜标本17例,其中10例为宫腔镜下取得。其中增殖期内膜12例,全部分离培养成功;分泌期内膜6例,5例分离培养成功。培养成功率94%,1例因发生污染培养失败。每1g子宫内膜组织可获得(5~8)×106个成活的上皮细胞。
2.2 腺上皮细胞形态学和生物学特点
子宫内膜腺上皮及间质细胞呈不同生长形态(图1)。培养24h后腺上皮细胞贴壁,为旋涡状排列的致密单层细胞团,铺路石样生长,边缘清晰,细胞外形似蝌蚪;3~5d细胞进入对数生长期;6 d后腺上皮细胞单个细胞体积变大,胞质开始出现大量空泡,边缘模糊,逐渐衰老死亡,周围成纤维细胞迅速生长替代上皮细胞。上皮细胞经消化传代后大量死亡,存活细胞均为间质细胞形态。间质细胞呈长梭形生长,单层,排列紧密,3~4d达对数生长期,可在传10代以内保持基本形态不变。

图1 子宫内膜腺上皮及间质细胞呈不同生长形态
Fig.1 The morphology of endometrial glandular epithelial and stromal cells(400×)
2.3 免疫细胞荧光及免疫细胞化学鉴定
对分离所得腺上皮细胞进行免疫细胞荧光及免疫细胞化学鉴定,可见在超过90%内膜腺上皮细胞中CK在胞浆内染色阳性, 而Vim表达阴性(图2、3)。

图2 免疫细胞荧光对正常子宫内膜腺上皮细胞纯度鉴定
Fig.2 The purity of isolated normal endometrial epithelia cells by immunofluorescence staining(400×)
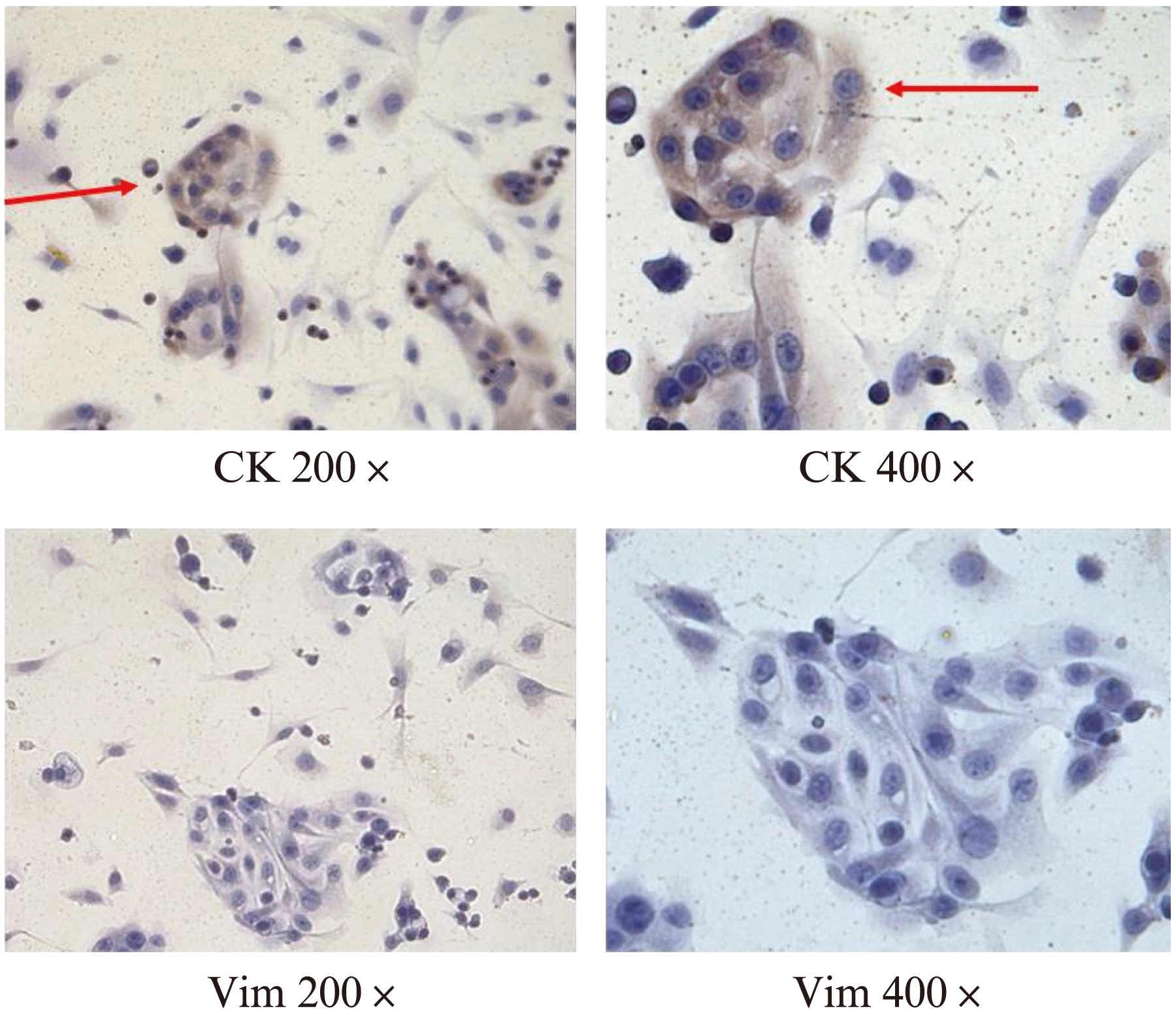
图3 免疫细胞化学对正常子宫内膜腺上皮细胞纯度鉴定
Fig.3 The purity of isolated normal endometrial epithelia cells by immunocytochemistry staining
子宫内膜随性激素发生周期性变化是女性维持正常生育功能的必要条件,一旦这种周期平衡发生改变将会导致不孕、内膜异位症、肿瘤等疾病的发生,而这些疾病的发生机制目前尚未完全明确。从伦理及实际操作的角度而言,基于体外细胞模型的研究较体内动物实验更为简便易行;从实验技术角度而言,由于子宫内膜组织构成复杂,若能将不同细胞成分(主要为腺上皮细胞及间质细胞)分离培养将更有助于对疾病发生机制的深入研究。
正常子宫内膜腺上皮细胞不能传代和建株,因此原代细胞的分离培养是目前子宫内膜相关疾病研究的主要体外细胞模型来源。现有的方法囿于取材困难(多数为术中切除子宫后刮取)、经阴道取材易污染、操作步骤复杂、获取细胞数较少等问题而难以掌握应用。本研究在取材、消化、分离技术等方面进行了优化,操作简便。
首先,本研究从取材方面进行了优化。由于阴道内存在大量细菌,经阴道刮宫获取的子宫内膜极易受细菌污染而培养失败,故既往研究中的子宫内膜样本多数通过手术切除子宫后直接刮取获得[1-2]。而经手术获得样本远不及刮宫获取样本简便易行,且功血等疾病的子宫内膜的取材主要经诊刮获取[5]。主要从以下步骤进行了优化: (1) 取 材时在后穹窿放置无菌小纱布,尽量避免标本与阴道壁直接接触。(2) 获取标本后即放入加有双抗及甲硝唑的细胞培养液进行转运,并以加有双抗及甲硝唑的D-Hank’S液多次冲洗标本,并浸泡5min。由于阴道菌群主要为厌氧菌,对甲硝唑敏感,因此在培养液及冲洗液中加入甲硝唑可大大降低污染的发生率,本研究中取材的18例标本仅1例发生污染。
第二,本研究对组织消化步骤进行了改良。多数学者目前使用胶原酶对组织进行消化,消化时间在1~2h不等[1,5-8]。胶原酶对胶原消化作用强,但对上皮细胞的消化作用不大,虽然能提高腺上皮细胞的存活率,但获得的细胞数较少。王欣等[5]学者的研究采用低浓度梯度、分次消化的方法可获得较理想的细胞活性及产量,但操作步骤较多,单次分离培养需要较长时间。本研究在团队既往对小鼠内膜上皮分离培养采用双酶(胶原酶Ⅰ型和胰蛋白酶联合)多次消化的基础上进行了改进[9],采用0.1%胰蛋白酶单次消化的方法,仅需要30min的消化时间可得到(5~8) ×106 个成活的上皮细胞/1g内膜组织。但需注意在消化时需每隔10min震荡一次,并镜检观察其消化情况,当消化液中含有较多成团上皮细胞时即可终止。
第三,本研究采用不同孔径的滤网分次过滤分离细胞,简便易行。先使用150μm孔径的筛网去除黏液及未消化组织,再使用38μm孔径的筛网分离上皮及间质细胞。经过消化后上皮细胞多成团,而间质细胞则分散为单个细胞,经过试用不同孔径的筛网进行分离,发现38μm孔径的筛网能使上皮细胞的产量达到较高水平,且细胞纯度能达到90%。虽然Mylonas[10]在滤网分次过滤的基础上加用Ficoll纯化,可使纯度达95%以上,但细胞损失量较大,是否加用此法需考虑后续实验的实际需求。
综上,本研究从取材开始优化,并采用胰蛋白酶单次短时消化,不同孔径的滤网分次过滤的方法,对人正常子宫内膜腺上皮细胞原代分离培养的方法进行了改良,为子宫内膜相关疾病的研究提供了较好的体外细胞模型。
【参考文献】
[1] 谭先杰,刘东远,郎景和,等.子宫内膜腺上皮及基质细胞分离、培养作为子宫内膜异位症体外细胞模型的探索[J].现代妇产科进展,2002,11(1): 30-32.
[2] Chan RW, Mak AS, Yeung WS, et al. Human female reproductivetract epithelial cell culture[J]. Methods Mol Biol, 2013,945: 347-363.
[3] Zhang L, Rees MC, Bicknell R. The isolation and long-term culture of normal human endometrial epithelium and stroma. Expression of mRNAs for angiogenic polypeptides basally and on oestrogen and progesterone challenges[J]. J Cell Sci,1995,108 (1): 323-331.
[4] Osteen KG, Hill GA, Hargrove JT, et al. Development of a method to isolate and culture highly purified populations of stromal and epithelial cells from human endometrial biopsy specimens[J]. Fertil Steril,1989,52(6): 965-972.
[5] 王欣,成娅,程湘,等.人子宫内膜腺上皮细胞原代培养方法的改进[J].重庆医学,2005,34(5): 702-703.
[6] Li X, Pishdari B, Cui P, et al. Regulation of androgen receptor expression alters AMPK phosphorylation in the endometrium: in vivo and in vitro studies in women with polycystic ovary syndrome[J].Int J Biol Sci,2015,11(12): 1376-1389.
[7] Valentijn AJ, Saretzki G, Tempest N, et al. Human endometrial epithelial telomerase is important for epithelial proliferation and glandular formation with potential implications in endometriosis [J]. Hum Reprod, 2015,30 (12): 2816-2828.
[8] Memarzadeh S, Zong Y, Janzen DM, et al. Cell-autonomous activation of the PI3-kinase pathway initiates endoumetrial cancer from adult uterine epithelium[J]. PNAS,2010,107(40): 17298-17303.
[9] 夏宇红,瞿俊杰,贺银燕,等.小鼠子宫内膜原代上皮细胞及间质细胞的优化分离和培养[J].现代妇产科进展,2013,22(7): 549-552.
[10] Mylonas I, Speer R, Makovitzky J, et al. Immunohistochemical analysis of steroid receptors and glycodelin A (PPl4)in isolated glandular epithelial cells of normal human endometrium[J]. Histochem Cell Biol, 2000,114 (5): 405-411.
Optimized method for isolation and primary culture ofnormal human endometrial epithelial cells
LU Wen, QU Jun-jie, WAN Xiao-ping
(Dept. of Obstetrics and Gynecology, Shanghai First Maternity and Infant Hospital, Tongji University, Shanghai 201204, China)
【Abstract】Objective To develop an optimized method for separation and primary culture of normal human endometrial epithelial cells. Methods The human endometrial epithelial cells were isolated with enzymatic digestion, after filtration and centrifugation the cells were identified by light microscopy and immunocytochemistry/immunofluorescence staining with cytokeratin and vimentin monoclonal antibodies.Results The primary culture of human endometrial epithelial cells was successfully establi-shed in 17 out of 18 endometrial samples from biopsy specimens. The morphology of the cells maintained the biologic characteristics of endometrial glandular epithelial cells.The cells were stained positively with cytokeratin and negatively with vimentin (purity>90%). The glandular epithelial cells could not be passaged, and the cells aging after 5-6d. Conclusion The modified method developed in this study can be used to obtain high purity and adequate normal endometrial glandular epithelial cells for study of endometrial diseases.
【Key words】endometrium; epithelial cell; primary cell culture
doi:10.16118/j.1008-0392.2016.03.005
收稿日期:2015-12-28
基金资助:国家自然科学基金(81402144、81272885、81472427);同济大学青年优秀人才培养行动计划(1400804)
作者简介:陆 雯(1981—),女,主治医师,博士.E-mail: luwen@51mch.com
通信作者:万小平.E-mail: wanxiaoping@tongji.edu.cn
【中图分类号】R 246.3
【文献标志码】A
【文章编号】1008-0392(2016)03-0028-04