·基础研究·
As2O3诱导NB4、HL-60细胞凋亡的机制研究
张雪莲1, 周尊海1, 张利强3, 王 博1, 贾玉芳4, 梁爱斌2
(1. 同济大学附属杨浦医院内分泌科,上海 200090; 2. 同济大学附属同济医院血液科,上海 200065; 3. 上海赛金生物医药有限公司,上海 201203; 4. 济宁市第一人民医院妇产科,山东 济宁 272011)
【摘要】目的 探讨三氧化二砷(As2O3)在体外抑制急性早幼粒白血病(acute promyelocyticleukemia, APL)细胞NB4、HL-60细胞增殖,诱导细胞凋亡的分子机制。方法 通过WST-8法检测上述两个细胞株的增殖抑制曲线;用AnnexinV/PI流式细胞术检测细胞的凋亡;用Real time PCR检测凋亡相关基因Caspase-3、Caspase-8、Caspase-9、Bcl-2、Bax、p53、C-myc、Survivin在As2O3处理前后的表达变化,同时用Westernblot检测凋亡相关蛋白Caspase-3、Caspase-8、Caspase-9、Bcl-2、Bax、P53在As2O3处理前后的表达变化。结果 As2O3能够显著抑制两种细胞增殖, Westernblot检测及Realtime PCR结果显示,As2O3处理引起了两种细胞中Bax、Caspase-3、Caspase-8 、Caspase-9基因表达水平增加,且蛋白表达水平上都出现了活性形式的Caspases。NB4细胞中Survivin、C-myc、Bcl-2的基因表达水平都显著降低,突变型p53蛋白在细胞内的量同样显著下降;HL-60细胞的C-myc表达水平显著降低,但Survivin、Bcl-2表达水平无明显变化。结论 As2O3能在药物临床浓度范围内有效抑制急性早幼粒白血病细胞HL-60、NB4的细胞增殖, 但方式不同;1.5μmol/L浓度的As2O3对NB4细胞生长的抑制体现在诱导细胞分化并诱导细胞凋亡,对HL-60细胞生长的抑制只体现在诱导细胞分化。HL-60细胞中高表达的Survivin、Bcl-2抑制了细胞的凋亡。NB4、HL-60细胞株中P53基因的细胞遗传学变异的不同可能是As2O3对这两种细胞增殖抑制机制差异的主要原因之一。
【关键词】As2O3; 细胞凋亡; NB4; HL-60; survivin; p53
20世纪70年代,国内医务工作者最早发现As2O3对(acute promyelocytideukmia, APL)有显著疗效。此后国内学者研究发现As2O3对急性早幼粒细胞白血病的治愈率达到了90%。国外学者发现As2O3可以诱导早幼粒细胞白血病细胞分化和凋亡[1]。 NB4细胞在低浓度条件下,As2O3诱导细胞趋向分化,而在高浓度条件下,As2O3诱导细胞趋向凋亡[2]。在PML-RARa融合蛋白阴性的HL-60细胞中,同样表现出低浓度As2O3诱导细胞分化,高浓度As2O3诱导凋亡的现象[3],但诱导凋亡所需的浓度大幅度高于NB4细胞。陈赛娟等发现了As2O3诱导NB4细胞系分化与凋亡的分子机制[4],揭示了NB4细胞中的PML-RARa融合蛋白是As2O3的靶蛋白。但在PML-RARa融合蛋白阴性的HL-60细胞中,深入探讨As2O3诱导凋亡的研究较少,为此本研究对比研究了在药理浓度条件下As2O3诱导NB4和HL-60细胞分化与凋亡过程中的区别,探讨其分子机制的异同,以期为As2O3临床应用提供理论基础。
1 材料与方法
1.1 细胞、试剂
HL-60和NB4细胞系由上海交通大学医学院附属瑞金医院引进。As2O3购自哈尔滨伊达药业有限公司;RPMI 1640、IMDM培养基及FBS购自Gibco公司;Cell Counting Kit-8购自同仁化学研究所;Annexin V-FITC Apoptosis Detection Kit I购自BD公司;BCA蛋白定量分析试剂盒、Chemiluminescent HRP Substrate购自Thermo公司;RNAsimple总RNA提取试剂盒购自天根生化科技有限公司;Power SYBR Green PCR Master Mix购自Applied Biosystems公司。
1.2 细胞培养
NB4、HL-60细胞用含有5%FBS的RPMI 1640培养液常规培养,细胞密度保持在(1×105~5×105)/ml。取对数生长期的细胞进行实验。
1.3 WST-8法测定细胞增殖抑制率
取细胞密度为1×105/ml的对数生长期细胞,按不同给药方式将上述三个细胞系各分8组,其中6组为实验组(As): 加入As2O3后使各组终浓度为0.5、1.0、2.5、5.0、10.0、25.0μmol/L;1组为对照组(Ac): 不含药物只含细胞的培养基;1组为空白组(Ab): 不含细胞和药物的培养基。培养48h后,每孔加入CCK-8 10μl,继续培养3~5h后,测定波长450nm处的D。根据如下公式计算细胞存活率: 细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%。
1.4 流式细胞术分析细胞凋亡
取细胞密度为1×105/ml的细胞。每个细胞系分为两组: 未加药的对照组和加入终浓度为1.5μmol/L As2O3的实验组。常规培养24、48、72h 后将细胞离心、洗涤,加入AnnexinⅤ及PI染色,用流式细胞术检测细胞凋亡。
1.5 实时荧光定量PCR检测凋亡相关基因的表达
收集药物处理24h、48h、72h的实验组和对照组细胞,提取RNA,并反转录成cDNA。实时荧光定量PCR在ABI Prism 7500系统上扩增目的基因。引物序列见表1。以β-actin为内参,应用相对定量法(2-ΔΔCt)进行定量分析。
表1 引物序列
Tab.1 Sequences of primers

基因名称引物序列(5'→3')上游引物下游引物产物长度/bpCaspase-3GATTATCCTGAGATGGGTTTATGTATATCACGCATCAATTCCACAAT189Caspase-8GTAATGACAATCTCGGACTCTCTCCCTAATGCTGTGAAGTTTG164Caspase-9GGACGACATCTTTGAGCAGTGGAAATTAAAGCAACCAGGCATCT118Bcl-2TCGCCCTGTGGATGACTGAGCATCCCAGCCTCCGTTATC124BaxTTTGCTTCAGGGTTTCATCCACCATGTTACTGTCCAGTTCGT149SurvivinACCACCGCATCTCTACATTCAAGCAAGTCTGGCTCGTTCTCAGTG116C-mycCTCCACACATCAGCACAACTACTTCGCCTCTTGACATTCTCCT167CD11bAACGCAATGACCTTCCAAGAGAGCTGTAGTCGCACTGGTAGAG141P53AGCCGCAGTCAGATCCTAGCGAGCCCAGACGGAAACCGTAGC190β-actinGAACGGTGAAGGTGACAGCAGGTGGACTTGGGAGAGGACTGG200
1.6 Western blot法检测凋亡相关蛋白的表达
收取药物处理后细胞,提取细胞总蛋白,并用BCA法测定蛋白浓度,煮沸变性。经SDS-PAGE,之后转膜,脱脂奶粉封闭1h,并一抗4℃孵育过夜,二抗孵育,经ECL化学发光法检测蛋白的表达,Image QuantTM LAS 4000凝胶图像分析系统扫描分析结果。
1.7 统计学处理
采用SPSS 18.0软件进行统计学分析。不同时间点基因表达与对照组间比较采用t检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 As2O3对HL-60 、NB4细胞增殖抑制
两细胞株在不同浓度As2O3处理48h条件时的增殖抑制率结果经统计学分析,两株细胞系之间的增殖抑制率有显著差异(P<0.05,n=5)。从As2O3浓度-细胞增殖抑制率关系图(图1)可得知,NB4对As2O3的细胞增殖抑制敏感性与HL-60接近,但略高。利用Grahpad Prism 5软件计算得到NB4、HL-60的IC50值分别为1.3μmol/L、2.1μmol/L。
2.2 As2O3处理各细胞系的凋亡情况
以1.5μmol/L的As2O3处理细胞,在不同时间(24h、48h、72h)用AnnexinV-FITC/PI流式细胞术检测细胞的凋亡情况。结果显示,随着处理时间的增加,在NB4中凋亡细胞比例迅速上升,由24h的5.43%上升到48h的52.56%,72h的70.67%,见图2 A-D。而HL-60凋亡细胞数量并未随着As2O3处理时间的延长而明显增加,只是从对照的1.38%增加到 72h 的2.38%,见图2 E~H。可以看出NB4细胞对1.5μmol/L 的As2O3诱导细胞凋亡的敏感度强,而HL60对1.5μmol/L 的As2O3诱导的细胞凋亡具有抵抗性。
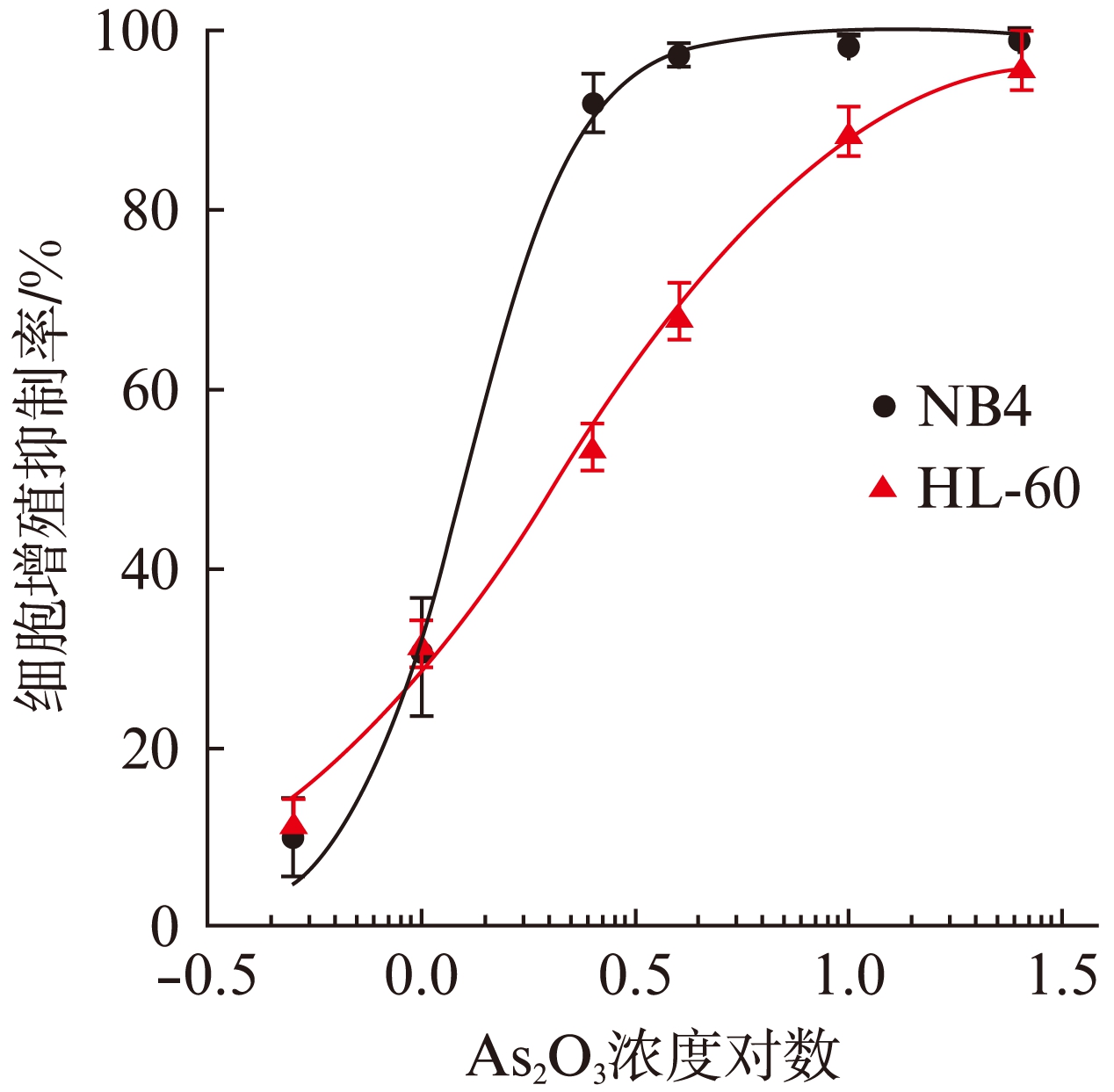
图1 不同浓度As2O3对细胞的增殖抑制率(n=5)
Fig.1 Effect of As2O3 on inhibition rate of cell proliferation in NB4 and HL60 cells

图2 A-D、E-H分别表示HL60、NB4细胞系control、24h、48h、72h的细胞流式检测结果
Fig.2 The result of Flow cytometric with Annexin-V/PI staining
2.3 As2O3处理过程中各细胞株的凋亡相关基因的表达情况
1.5μmol/L As2O3作用于NB4、HL-60后,两个细胞株在细胞增殖抑制率接近的情况下,出现细胞凋亡率差距显著的现象。为了探究这一现象背后分子机制的异同,检测了1.5μmol/L As2O3处理后,两种细胞中Caspase3、Caspase8、Caspase9、Bcl-2、Bax及Survivin、C-myc、CD11b等基因表达的变化趋势,也考察了NB4细胞中的突变型p53基因的表达变化。同时也分析了各基因在不同细胞中的相对表达情况。
As2O3处理前后Caspase-3、Caspase-8、Caspase-9及Bcl-2、Survivin基因在HL-60细胞株中mRNA表达水平明显高于NB4,是NB4细胞的mRNA表达水平的2~8倍。Caspase-3、Caspase-8、Caspase-9基因在药物处理后各基因表达水平增长趋势及幅度较为接近,见图3A、B、C。在对As2O3诱导凋亡敏感的NB4细胞株中,Survivin基因的mRNA表达水平在药物处理的24h时就显著下降;Bcl-2基因的mRNA表达水平在药物处理的24h时也已明显下降,见图4D;在对As2O3诱导凋亡不敏感的HL60细胞株中,Bcl-2基因的mRNA表达水平在药物处理的72h内下降不明显,见图3D,Survivin基因的mRNA表达水平在药物处理48h后才明显下降,见图4D。
As2O3处理前后HL-60细胞中Bax基因表达无显著上升,但NB4细胞中Bax基因在药物处理后其mRNA 表达水平上升趋势快、增加幅度大,见图3E。
Bcl-2/Bax值(mRNA表达水平比值)在两细胞系中表达水平有着明显的差异P<0.01,见图3中F所示,Bcl-2/ Bax表达水平的比值在NB4中下降趋势显著,24h后即迅速下降,由未处理时的4.47下降到药物处理48h时的0.86。在NB4细胞株中Bcl-2/Bax值接近1的时间与细胞出现大量凋亡的时间基本一致。HL-60细胞株中的Bcl-2/ Bax表达水平的比值在药物处理前后一直在6.71~8.48之间波动,下降趋势不明显,Bcl-2基因的表达量一直显著大于Bax。
药物处理后,NB4细胞、HL-60细胞中的C-myc的基因表达水平急剧下降,处理24h的表达量与未处理前相比分别下降了60.5%和47.9%;两者细胞中C-myc的基因表达水平下降幅度与其对As As2O3的增殖抑制敏感度强弱呈正相关(r=0.7582)。
在As2O3诱导下NB4细胞中p53基因表达量稍有增加,而P53缺失的HL60细胞中则检测不到p53基因的表达,见图4C。

图3 As2O3处理NB4、HL60细胞不同时间对Caspase-3、Caspase-8、Caspase-9、Bcl-2、Bax及C-myc等基因表达的影响
Fig.3 Effect of As2O3 on mRNA expression of Caspase-3, Caspase-8, Caspase-9, Bcl-2, Bax and C-myc in NB4 and HL60 cells
A、B、C、D、E分别表示As2O3处理前后,各细胞株中caspase3/8/9、Bcl-2、Bax基因表达变化情况;F表示As2O3处理前后,各细胞株中Bcl-2与Bax基因表达水平比值的变化情况;误差棒表示标准偏差(s),n=3;*P<0.05; **P<0.01
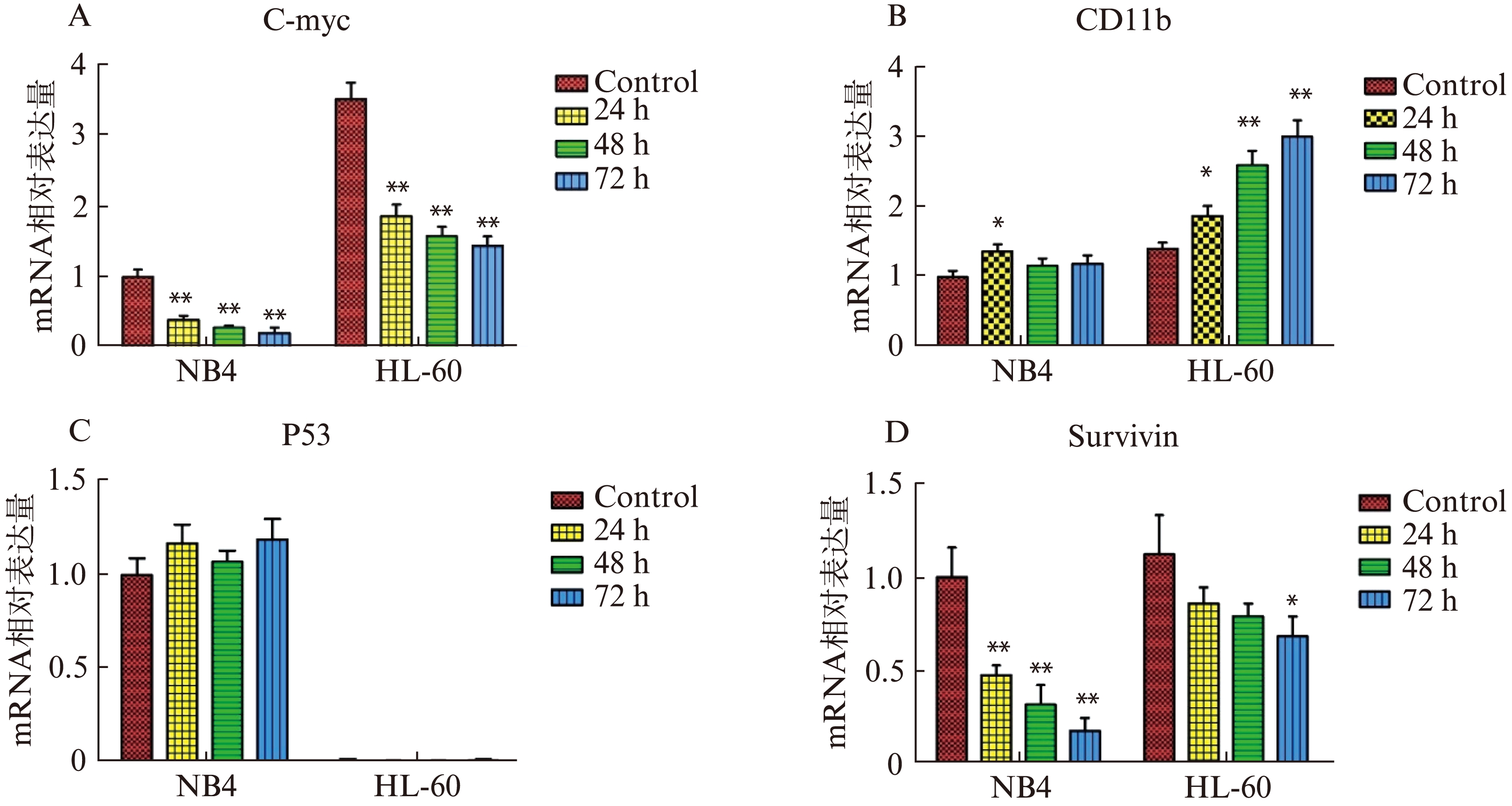
图4 As2O3处理NB4、HL60细胞不同时间C-myc、CD11b、p53及Survivin等基因表达的变化
Fig.4 Effect of As2O3 on the mRNA expression of C-myc、CD11b、P53 and Survivin in NB4 and HL60
误差棒表示标准偏差(s),n=3,*P<0.05; ** P<0.01
2.4 As2O3处理过程中各细胞系的凋亡相关蛋白的表达情况
NB4细胞在As2O3处理12h时,Caspase-3、Caspase-8、Caspase-9已经都出现裂解带,并且随着As2O3处理时间的延长,Caspase-3、Caspase-8、Caspase-9的前体蛋白表达量呈不断增加的趋势,其活性形式的蛋白量也明显增加。Bax蛋白表达量也表现出了随着As2O3处理时间的延长而上升的趋势,Bcl-2则表现出相反的趋势(图5)。这说明NB4细胞内,在蛋白水平上Bcl-2/ Bax比值也是不断下降的,与基因表达比值变化趋势一致。
HL-60细胞在As2O3处理12h时,Caspase-3、Caspase-8出现了裂解带,而Caspase-9直到72h时才出现裂解带。随着As2O3处理时间的延长,Caspase3、Caspase8、Caspase9的前体蛋白表达量呈不断增加的趋势,但其活性形式的蛋白表达量没有明显的增加。Bax蛋白表达量也表现出了随着As2O3处理时间的延长而略上升的趋势(图5),但Bcl-2蛋白表达量下降的趋势不明显。
NB4细胞中突变型P53蛋白在As2O3诱导 12h 后表达量即明显下降,24h后急剧下降,48h后细胞内的突变型P53蛋白已检测不到(图5),与此同时细胞出现大量凋亡现象(图2C)。HL60细胞中则始终检测不到突变型P53蛋白(图5)。
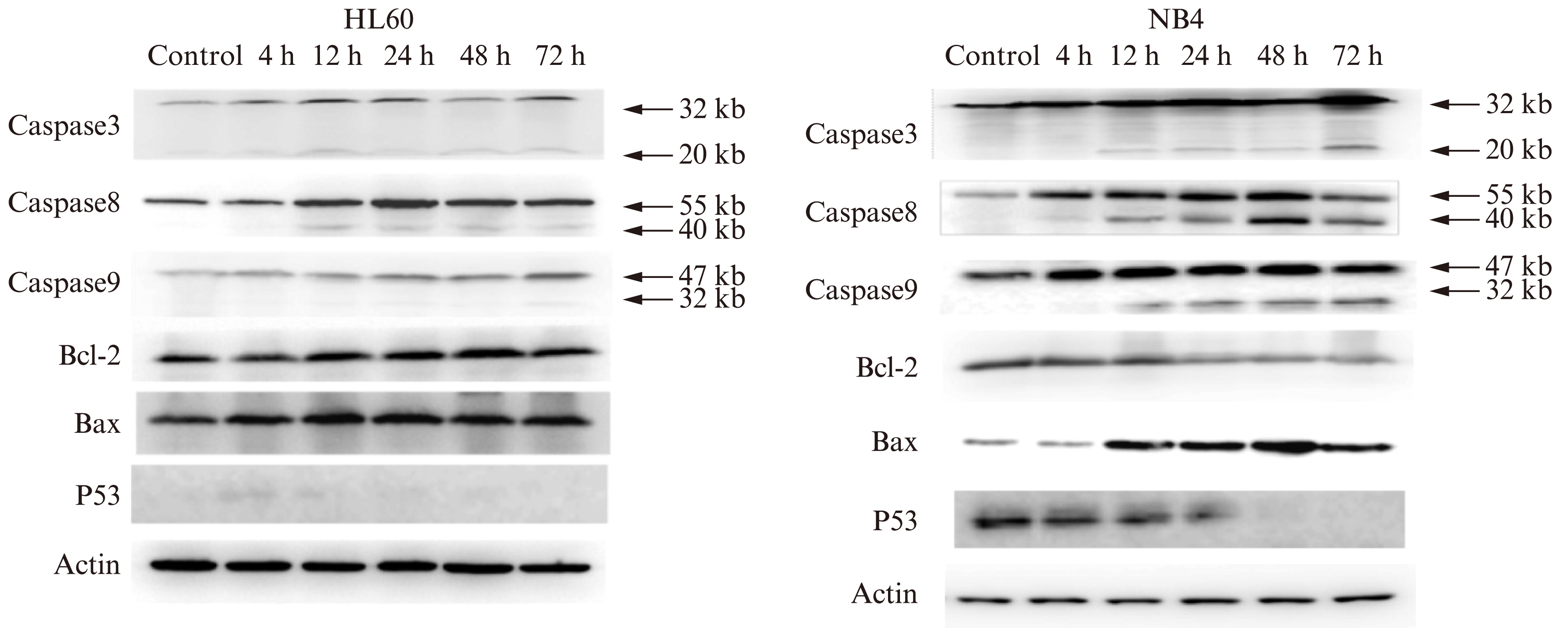
图5 Western blot法检测各细胞系的凋亡相关蛋白的表达
Fig.5 Effect of As2O3 on expression of apoptosis-related protein in NB4 and HL60 cells detected by Western blotting
3 讨 论
As2O3通过促进细胞分化、抑制细胞增生、促进细胞凋亡及抑制肿瘤血管生成等多种途径发挥抗肿瘤作用[5]。
已有的研究表明, C-myc作为一种原癌蛋白,有推进细胞周期、促使细胞转化、抑制细胞分化的作用[6]。CDllb是髓系细胞分化的重要标志,在髓系细胞逐渐分化成熟过程中的表达会逐渐升高[7]。在本研究中,As2O3处理后HL-60的CDllb基因表达水平不断上升,C-myc基因表达水平不断下降,表明在1.5μmol/L的As2O3浓度处理72h内,HL-60趋向于分化,细胞增殖被抑制。NB4在As2O3处理后CD11b基因的表达水平先小幅度上升,48h后细胞出现大量凋亡,同时细胞CD11b表达量下降。而在此过程中C-myc基因表达水平不断下降。表明在1.5μmol/L As2O3浓度处理后,NB4细胞经历了分化过程后又趋向凋亡,从而细胞增殖被抑制。
正如As2O3对NB4细胞表现出的诱导凋亡作用一样,As2O3抗肿瘤的作用还表现在促进肿瘤细胞凋亡。细胞的凋亡主要通过两条途径进行一条为死亡受体途径,亦称外源性途径;另一条途径称为线粒体途径,亦称内源性途径。已有的一些研究表明As2O3可以直接抑制癌细胞生长,激活Caspase-8或者Caspase-9、Caspase-3 等机制诱导凋亡[8]。
As2O3处理后,两株细胞的Caspases-3、Caspases-8、Caspases-9在基因及蛋白水平的表达上都显示出了上升的趋势。在Western blot检测中,4~12h内 Caspases-3、Caspases-8在两株细胞中都出现了活性形式,且NB4中Caspase-9也出现了活性形式,并且随着时间的延长而增加。而在HL-60细胞中,Caspase-9的活性形式在72h时才出现,显著晚于 NB4。Caspase-8、Caspase-9活性形式的出现说明在我们所选用的药物浓度条件下,As2O3可以诱导两株细胞凋亡信号激活,并最终激活了细胞凋亡的执行者caspase-3。在这两株细胞中,细胞凋亡的死亡受体途径中的起始因子Caspase-8和线粒体途径中的起始因子Caspase-9在As2O3处理后都出现了基因及蛋白水平的表达增强,表明这两条凋亡途径都被激活。
细胞凋亡结果表明,NB4细胞在As2O3处理24h、48h、72h后,早中期细胞凋亡率与对照组相比分别显著增加,见图2A-D;HL-60细胞在同样的时间点上细胞凋亡率与对照组相比无明显变化,见图2E-H。说明这两株细胞对As2O3诱导的凋亡敏感度有显著区别,NB4对As2O3诱导凋亡高度敏感,而HL60对As2O3诱导凋亡则是耐受的。
HL-60和NB4相比较,在对As2O3细胞增殖生长抑制敏感度方面接近,但在As2O3诱导的凋亡敏感度方面,NB4显著敏感于HL-60。并且,HL-60在As2O3处理后凋亡通路被激活却没有明显的凋亡现象。为了解释这些现象,检测了凋亡抑制基因Bcl-2及凋亡促进基因Bax在基因及蛋白水平的表达情况及凋亡抑制基因Survivin在基因水平的表达情况。
Bcl-2家族蛋白在细胞凋亡的线粒体途径中起着非常重要的作用, 它们通过维持抗凋亡、促凋亡成员的平衡来维持线粒体膜的完整性[9],细胞中单独的Bcl-2表达水平的下降或Bax表达水平的上升并不能决定细胞是否凋亡,而Bcl-2/Bax比值的降低则表明细胞走向凋亡[10-11]。Survivin蛋白是迄今发现的最强的凋亡抑制因子。研究发现Survivin基因可以直接抑制Caspase-3和 Caspase-7的活性,从而阻断细胞的凋亡过程[12]。研究结果显示在两株细胞中其Survivin基因为高表达,说明与文献报道的造血系统肿瘤经常存在Survivin过度表达情况一致[13]。
As2O3处理NB4细胞后,与Survivin基因和Bcl-2基因表达快速下调。Survivin基因表达的下调解除了对线粒体中细胞色素C释放及Caspase-3 活性的的抑制,消除了凋亡抑制环节;同时NB4细胞中Bcl-2表达下降,且Bcl-2/bax比值下降,意味着线粒体膜通透增加,有利于细胞色素C的释放,促进凋亡信号的传递[14],在NB4细胞中,As2O3从抑制Survivin基因表达和上调Bcl-2/bax比值两个方面,解除抑制凋亡因素,促进凋亡信号沿着线粒体途径向下传递。这是NB4细胞出现细胞凋亡的重要原因。而在HL-60细胞中,Bcl-2表达量是NB4中表达量的4~9倍,并且随着As2O3处理时间增加而上调;同时Bcl-2/bax比值也在As2O3处理过程中没有明显的变化,表明线粒体途径在在As2O3处理过程仍然被高表达的Bcl-2抑制;表达量未明显下降的Survivin同样是抑制HL-60细胞中线粒体途径的重要因素。HL-60细胞株中Caspases-9活性形式的出现较晚,也可以证实该细胞中线粒体途径被抑制。HL-60细胞中,Caspase-3、Caspase-8在12h时就出现了活性形式,而Caspases-9活性形式的出现较晚,说明HL-60细胞在As2O3诱导12h内死亡受体途径最先激活,并且由此途径激活了Caspase3,而线粒体途径在As2O3诱导72h后才被激活。虽然 12h 后HL60细胞中就出现了活性形式的Caspase3,但由于Survivin基因表达未显著下降,细胞内的Survivin蛋白抑制了Caspase3的活性,使得凋亡信号的向下传导被阻断,所以HL-60并没有走向凋亡。这些研究结果提示: 在NB4细胞中,As2O3通过线粒体途径和死亡受体途径有效地诱导凋亡细胞凋亡;而在HL-60细胞中,Bcl-2及Survivin不能被As2O3有效地抑制,线粒体途径的激活被显著延滞,通过死亡受体途径产生的活性形式的Caspase3也被Survivin抑制了活性,导致了HL60细胞凋亡的抑制。
两种细胞在p53基因的细胞遗传学变异上有显著的区别[15],NB4细胞中存在野生型p53基因的突变,HL60细胞中p53基因缺失,NB4细胞中有突变型p53基因及蛋白的表达,HL60细胞中则没有p53基因及蛋白的表达,并且这两种细胞都存在Survivin基因的过度表达[16]。Survivin与p53在肿瘤的发生发展过程中起着重要作用,两者之间的关系密切,通过直接相互作用及p2l-Rb-E2F信号通路等相互作用。有研究表明野生型p53在体内可与Survivin启动子结合,从而抑制Survivin基因的转录和蛋白的表达及p53基因的突变,由于显性负效应作用,突变型P53蛋白抑制了野生型p53蛋白的功能,丧失了对Survivin基因转录的抑制作用,从而可以使Suvivin基因的异常高表达[17-18]。
As2O3处理后,NB4细胞中p53基因的表达量没有明显变化,见图4C,但突变型P53蛋白在细胞内的水平呈现出显著的下降,见图5。说明As2O3降低了突变型P53蛋白对野生型P53正常生理功能的抑制。已有的研究证实As2O3通过破坏PML及PML-NBs降解PML/RARa,从而保护P53正常的生理功能[19]。Joe等研究结果也显示,在NB4细胞中As2O3通过P53途径诱导细胞凋亡[20]。据此可推断出As2O3诱导后,NB4细胞中野生型P53的功能得到恢复,有效抑制了Survivin基因的表达,从而解除了Survivin对细胞凋亡的抑制,使NB4细胞最终走向凋亡。HL60细胞中直接抑制Survivin基因表达的p53基因缺失,造成As2O3不能通过p53信号通路直接抑制Survivin基因表达,所以,HL-60细胞在As2O3诱导后Survivin基因下调不显著。由于As2O3诱导HL-60走向分化的同时也显著下调C-myc基因表达,所以HL-60细胞增殖被显著抑制[21]。但高表达的Survivin基因制仍然继续抑制细胞凋亡途径。这可能是NB4和HL60细胞对As2O3的细胞增殖抑制率相近,而对Al2O3诱导的细胞凋亡率差异显著的原因之一。
【参考文献】
[1] Lo-Coco F, Avvisati G, Vignetti M, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia[J]. N Engl J Med, 2013,369(2): 111- 121.
[2] Chen SJ, Zhou GB, Zhang XW, et al. From an old remedy to a magic bullet: molecular mechanisms underlying the therapeutic effects of arsenic in fighting leukemia[J]. Blood, 2011,117(24): 6425-6437.
[3] Zhang YL, Ren JH, Cui LY, et al. Effects of As2O3 on the proliferation, differentiation and apoptosis of HL-60 cells and its related mechanisms[J]. J experimental hematology, 2015,23(3): 647-652.
[4] Zhang XW, Yan XJ, Zhou ZR, et al. Arsenic trioxide controls the fate of the PML-RARα oncoprotein by directly binding PML[J]. Science, 2010,328(5975): 240-243.
[5] Zhang Y, Sun M, Shi W, et al. Arsenic trioxide suppresses transcription of hTERT through down-regulation of multiple transcription factors in HL-60 leukemia cells[J]. Toxicol Lett, 2015,232(2): 481-489.
[6] Lin CY, Lovén J, Rahl PB, et al. Transcriptional amplification in tumor cells with elevated c-Myc[J]. Cell, 2012,151(1): 56-67.
[7] 徐莉敏,张登海,杨春欣,等.雷公藤红素诱导白血病细胞分化成熟的影响[J]. 同济大学学报: 医学版, 2010,31(3): 23-27.
[8] Alimoghaddam K. A review of arsenic trioxide and acute promyelocytic leukemia[J]. Int J Hematolncol Stem Cell Res, 2014,8(3): 44.
[9] Cory S, Huang DCS, Adams JM. The Bcl-2 family: roles in cell survival and oncogenesis[J]. Oncogene, 2003,22(53): 8590-8607.
[10] Llambi F, Green DR. Apoptosis and oncogenesis: give and take in the BCL-2 family[J]. Curr Opin Genet Dev, 2011,21(1): 12-20.
[11] Morales CD, Calvi o E, Rubio V, et al. Apoptosis induced by paclitaxel via Bcl-2, Bax and caspases 3 and 9 activation in NB4 human leukaemia cells is not modulated by ERK inhibition[J]. Exp Toxicol Pathol,2013,65(7): 1101-1108.
o E, Rubio V, et al. Apoptosis induced by paclitaxel via Bcl-2, Bax and caspases 3 and 9 activation in NB4 human leukaemia cells is not modulated by ERK inhibition[J]. Exp Toxicol Pathol,2013,65(7): 1101-1108.
[12] Iland HJ, Seymour JF. Role of arsenic trioxide in acute promyelocytic leukemia[J]. Curr Treat Options Oncol, 2013,14(2): 170-184.
[13] Guindalini RSC, Machado MCM, Garicochea B. Monitoring survivin expression in cancer: implications for prognosis and therapy[J]. Mol Diagn Ther, 2013,17(6): 331-342.
[14] Wood WG, Igbavboa U, Muller WE, et al. Statins, Bcl-2, and apoptosis: cell death or cell protection?[J]. Mol Neurobiol, 2013,48(2): 308-314.
[15] Allende-Vega N, Krzywinska E, Orecchioni S, et al. The presence of wild type p53 in hematological cancers improves the efficacy of combinational therapy targeting metabolism[J]. Oncotarget, 2015,6(22): 19228-19245.
[16] Rizzo MG, Zepparoni A, Cristofanelli B, et al. Wt-p53 action in human leukaemia cell lines corresponding to different stages of differentiation[J]. Br J Cancer, 1998,77(9): 1429.
[17] Wang Z, Fukuda S, Pelus LM. Survivin regulates the p53 tumor suppressor gene family[J]. Oncogene, 2004,23(49): 8146-8153.
[18] Okada H, Bakal C, Shahinian A, et al. Survivin loss in thymocytes triggers p53-mediated growth arrest and p53-independent cell death[J]. J Exp Med, 2004,199(3): 399-410.
[19] Louria-Hayon I, Grossman T, Sionov RV, et al. The promyelocytic leukemia protein protects p53 from Mdm2-mediated inhibition and degradation[J]. J Biol Chemi,2003,278(35): 33134-33141.
[20] Joe YS, Jeong JH, Yang S, et al. ATR, PML, and CHK2 play a role in arsenic trioxide-induced apoptosis[J]. J Biol Chem, 2006,281(39): 28764-28771.
[21] Jiang G, Albihn A, Tang T, et al. Role of Myc in differentiation and apoptosis in HL60 cells after exposure to arsenic trioxide or all-trans retinoic acid[J]. Leuk Res, 2008,32(2): 297-307.
Mechanisms of arsenic trioxide-induced apoptosis in NB4 and HL60 cells
ZHANG Xue-lian1, ZHOU Zun-hai1, ZHANG Li-qiang3, WANG Bo1, JIA Yu-fang4, LIANG Ai-bin2
(1. Dept. of Endocrinology, Yangpu Hospital, Tongji University, Shanghai 200090, China; 2. Dept. of Hematology, Tongji Hospital, Tongji University, Shanghai 200065, China; 3. Shanghai Cellgene bio Pharmaceutical Co. Ltd., Shanghai 201203, China; 4. Dept. of Gynecology, Jining First People’s Hospital, Jining 272011, Shandong Province, China)
【Abstract】Objective To investigate the mechanism of arsenic trioxide (As2O3) -induced apoptosis in acute promyelocytic leukemia(APL)NB4 and HL60 cells.Methods NB4 and HL60 cells were treated with As2O3 at different concentrations. Cell proliferation was determined by WST-8 assay. The apoptosis rate was detected by flow cytometry with annexinV-FITC/PI double staining.The mRNA expression of apoptosis-related genes caspase-3, Caspase-8, Caspase-9, Bcl-2,Bax, the proto-oncogene C-myc, survivin, p53 and granulocytes differentiation antigen CD11b was detected by RT-PCR. The expression of apoptosis-related proteins caspase-3, Caspase-8, Caspase-9, Bcl-2,Bax was determined by Western blotting. Results Arsenic trioxide proliferation of NB4 and HL60 cells with similar sensitivity. As2O3 induced apoptosis of NB4 cells, but induced HL-60 differentiation to mature stage. Western blot detection and RT-PCR results showed that As2O3 treatment caused up-regulation of Bax, caspase-3, Caspase-8, Caspase-9, CD11b mRNA levels, and protein levels of caspase-3, Caspase-8, Caspase-9 in both cell lines. The expression of survivin, C-myc, Bcl-2 and mutated p53 in NB4 cells treated with As2O3 significantly decreased. The expression of C-myc in HL60 cells treated with As2O3 significantly decreased, but survivin and Bcl-2 expression levels were not changed. Conclusion Arsenic trioxide can effectively inhibit proliferation of NB4 and HL60 cells, and induce apoptosis of NB4 cells, while induce HL-60 differentiation to mature stage. These effects may be associated with the altered expression of survivin, Bcl-2 and mutated p53 genes.
【Key words】arsenic trioxide; cell apoptosis; NB4; HL-60; survivin; p53
doi:10.16118/j.1008-0392.2016.03.002
收稿日期:2015-09-12
基金项目:国家自然科学基金(81270615);上海市卫生局科研基金(20134470)
作者简介:张雪莲(1979—),女,主治医师,硕士.E-mail: 13761219860@163.com
通信作者:梁爱斌.E-mail: 1ab7182@tongji.edu.cn
【中图分类号】R 551
【文献标志码】A
【文章编号】1008-0392(2016)03-0008-08






 o E, Rubio V, et al. Apoptosis induced by paclitaxel via Bcl-2, Bax and caspases 3 and 9 activation in NB4 human leukaemia cells is not modulated by ERK inhibition[J]. Exp Toxicol Pathol,2013,65(7): 1101-1108.
o E, Rubio V, et al. Apoptosis induced by paclitaxel via Bcl-2, Bax and caspases 3 and 9 activation in NB4 human leukaemia cells is not modulated by ERK inhibition[J]. Exp Toxicol Pathol,2013,65(7): 1101-1108.