·基础研究·
胎鼠不同造血部位的形态学和组织化学研究
李亚梅1, 梁爱斌2, 汪俊帮2, 方 霞1, 张 炎1, 张 虹1
(1. 同济大学附属同济医院临床药理室,上海 200065; 2. 同济大学附属同济医院血液科,上海 200065)
【摘要】目的 观察胚胎11.5d(embryonic 11.5d, E11.5)不同造血部位的解剖结构和造血干细胞(hematopoietic stem cell, HSC)相关基因的转录水平、定位和形态,探讨不同造血部位HSC的起源、迁移、扩增和发育机制。方法 运用尼氏(Nissl)染色、苏木精-伊红(htoxylin eosin, H-E)染色和免疫荧光技术(immunofluorescence technique, IF)观察E11.5小鼠胎盘(placenta, PL)、卵黄囊(yolk sac, YS)、主动脉-性腺-中肾(aorta-gonad-mesonephros, AGM)区、胎肝(fetal liver, FL)和头部(head, Hd)的形态学和组织学变化,以及运用实时定量基因扩增荧光检测系统(real-time quantitative, PCR, detecting system, QPCR)检测HSC相关基因的转录水平。结果 Nissl和H-E染色结果显示E11.5小鼠AGM区背主动脉、PL血管迷路、YS血管、Hd脑血管和FL血窦富含血细胞;CD34、CD45、CD133、c-kit、Sca-1和Runx1在不同造血部位均有表达(P<0.05),其中PL表达水平显著高于其他造血部位(P<0.05);IF结果显示CD34在不同造血部位均有表达,YS血管和PL迷路血管呈强阳性;AGM区背主动脉和泌尿生殖嵴内皮细胞、Hd脑血管周围可见CD45呈弱阳性,而FL则显示CD45为阴性。c-kit和CD133在YS血管和PL迷路血管同为强阳性。结论 HSC产生关键时期,胚鼠PL和YS中HSC发育最旺盛。永久造血起源于小鼠胚内AGM区,而不同造血部位HSC的迁移与血管内皮细胞密切相关,HSC可能通过AGM区血管内皮迁移进入血液循环,首先到达 PL的血管迷路,然后定植于FL,扩增或维持HSC。
【关键词】组织学; 形态学; 造血干细胞; 造血部位; 胎鼠
造血的研究经过漫长的探索,目前已经在小鼠胚胎卵黄囊(Yolk sac, YS)、主动脉-性腺-中肾(aorta-gonad-mesonephros,AGM)区、胎盘(placenta, PL)和胎肝(fetal liver, FL)中发现造血干细胞(hematopoietic stem cell, HSC)的存在[1],而胚胎11.5d(embryonic 11.5d, E11.5)则为HSC产生的关键时期[2-3]。近来研究显示,小鼠头部(Head, Hd)亦为HSC的发育位点[4]。然而,对于HSC产生的关键时期胚鼠不同造血部位的形态学与组织学比较研究尚未见报道。为了推进我国造血系统的基础和临床研究,本实验旨在探讨E11.5小鼠不同造血部位的解剖结构和HSC的表达水平、定位及形态,以期为小鼠HSC起源、迁移、扩增及发育机制提供直接的形态学和组织学依据。
1 材料与方法
1.1 实验小鼠
6~8周龄雌、雄性清洁级ICR小鼠(体质量: 28~35g),购买自上海西普尔-必凯实验动物有限公司,饲养于同济大学附属同济医院实验动物中心。开展的所有实验动物研究符合2006年科学技术部发布的《关于善待实验动物的指导性意见的要求》。
1.2 试剂和实验器材
1×磷酸盐缓冲液(1×PBS,索莱宝,北京)、4%多聚甲醛(PFA,赛戈,上海)、胎牛血清(FBS, Gibco, USA)、0.25%胰酶(Gibco, USA)、苏木精-伊红染料(H-E,索莱宝,北京)、Nissl染料、PrimeScriptTM RT试剂盒(Takara, Japan)、HieffTM qPCR SYBR® Green Master Mix(翊圣,上海)、TRIzol(Invitrogen, USA)、CD34(BD, USA)、CD117(Cat.553356, BD, USA)、CD45(Cat. 35-0451, eBioscience, USA)、CD133(eBioscience, USA)、分析天平、70目尼龙过滤网、眼科剪刀两把、眼科镊子两把、胰岛素针2支、35mm和100mm培养皿、15ml EP管、解剖显微镜、光学显微镜、切片机、ABI 7900HT 实时定量PCR仪、Eppendorf 5702R低温离心机。
1.3 方法
1.3.1 E11.5小鼠不同造血部位的获取 于傍晚将ICR雌、雄小鼠按3∶1合笼过夜,次日清晨观察到阴栓的雌鼠予以分笼喂养,记为胚龄0.5d(E 0.5)。于雌鼠受孕后11.5d取出胎鼠PL、YS、Hd、AGM区和FL组织。操作方法: 颈椎脱臼处死妊娠小鼠后用75%酒精喷洒腹部,剪开腹腔,暴露子宫,剪断子宫颈与子宫系膜,用镊子将子宫拉出体腔,立即放入含10%FBS的PBS培养皿中。将培养皿放在解剖显微镜下分别剥除胎膜和PL;分离出YS;截断胎鼠Hd;截取胎鼠前、后肢芽中间部分,去除背部体节和肠系膜分离获取AGM区;打开胸腔,暴露内脏,小心分离FL。
1.3.2 E11.5小鼠整胚Nissl染色 将E11.5小鼠整胚(含YS)和PL用4% PFA固定过夜,次日清晨更换25%蔗糖脱水过夜,24h后进行标本纵断面冰冻组织切片,行Nissl染色,显微镜下观察不同造血部位的形态结构。
1.3.3 E11.5小鼠整胚H-E染色 将E11.5小鼠整胚(含YS)和PL用4% PFA固定过夜,次日清晨更换25%蔗糖脱水过夜,24h后进行标本纵断面冰冻组织切片,行H-E染色,显微镜下观察不同造血部位的形态结构。
1.3.4 实时定量基因扩增荧光检测
1.3.4.1 RNA提取 使用TRIzol®(美国生命技术公司)分别提取E11.5不同造血部位,包括PL、YS、Hd、AGM区和FL的总RNA,利用分光光度仪测量RNA浓度。
1.3.4.2 RNA的反转录 使用PrimeScriptTM RT试剂盒(RR047A, Takara)进行RNA反转录,具体步骤如下: (1) 去除RNA中的基因组DNA: 400ng RNA,加入2.0μl 5×gDNA Eraser Buffer,1.0μl gDNA Eraser,用RNase Free水补齐至10μl。42℃反应2min后立即放置冰上。(2) RNA反转录: 在上一步反应完成的10μl体系基础上,加入1.0μl PrimeScript RT Enzyme Mix, 1.0μl RT Primer Mix,4.0μl 5×PrimeScript Buffer, 用 4.0μl 的RNase Free水补齐至20μl。37℃反应 15min,85℃反应5s,4℃ 终止反应。
1.3.4.3 QPCR 采用HieffTM qPCR SYBR® Green Master Mix(High Rox Plus)(11203ES03,上海翊圣生物科技有限公司),具体反应体系如下: Master Mix(High Rox Plus)5μl,上游引物0.2μl,下游引物 0.2μl,cDNA 50ng,RNase Free水补齐至10μl。应用ABI 7900HTPCR仪进行反应: 95℃ 5min预变性;95℃解链10s,60℃反应30s,40个循环。以GAPDH作为内参基因,确保反应的质量和效率。每个样本(PL、YS、Hd、AGM区和FL)均取三只孕鼠,每只孕鼠取7个胚胎的PL、YS、Hd、AGM区和FL,重复三次。本研究中各基因引物序列如下(5′~3′),见表1。
表1 各基因引物序列
Tab.1 List of primers used for QPCR experiments

目的基因引物序列(5'~3')目的基因引物序列(5'~3')GAPDH-FAGGTCGGTGTGAACGGATTTGc-kit-FGCCACGTCTCAGCCATCTGGAPDH-RTGTAGACCATGTAGTTGAGGTCAc-kit-RGTCGCCAGCTTCAACTATTAACTCD34-FAGCGGTACAGGAGAATGCAGSca-1-FAGGAGGCAGCAGTTATTGTGGCD34-RATCAGGCAGAGAGCTACCCASca-1-RCGTTGACCTTAGTACCCAGGACD45-FAACACCTACACCCAGTGATGFlk-2-FGCTGTACGTGCTAAGAAGACCCD45-RTTGGCTGCTGAATGTCTGAGFlk-2-RAGCATCTGATGTCTGTTCCGACD133-FCCTTGTGGTTCTTACGTTTGTTGRunx1-FGATGGCACTCTGGTCACCGCD133-RCGTTGACGACATTCTCAAGCTGRunx1-RGCCGCTCGGAAAAGGACAA
1.3.4.4 统计学分析 本研究中QPCR数据采用2-ΔΔCt法计算各基因mRNA的相对表达量,以GAPDH作为内参基因,各组数据均以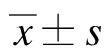 表示,采用单因素方差分析(ANOVA)比较E11.5不同造血部位的基因表达量。所有分析均运用SPSS 20.0统计软件进行,P<0.05表示差异有统计学意义。
表示,采用单因素方差分析(ANOVA)比较E11.5不同造血部位的基因表达量。所有分析均运用SPSS 20.0统计软件进行,P<0.05表示差异有统计学意义。
1.3.5 免疫荧光 烤温箱55℃烤片30min。滴加一抗(1∶500),4℃冰箱过夜。滴加二抗(HAM,1∶500),室温孵育 3h,再滴加三抗Cy3(1∶1000),Hoechest33258(1∶2000),避光孵育1h。晾干,75%甘油封片。
2 结 果
2.1 E11.5小鼠不同造血部位
显微镜下可见此时胚胎血液循环已经建立。PL呈圆盘状;YS为一层富含血管的透明膜囊,膜囊上卵黄动脉(vitelline artery, Va)清晰可辨,胚胎被包裹在内。Hd血管明显,心脏呈椭圆形,FL位于心脏下方,肝小叶结构明显。AGM区为去除背侧神经管后的下方条形组织,中空结构,背主动脉清晰可见,见图1。
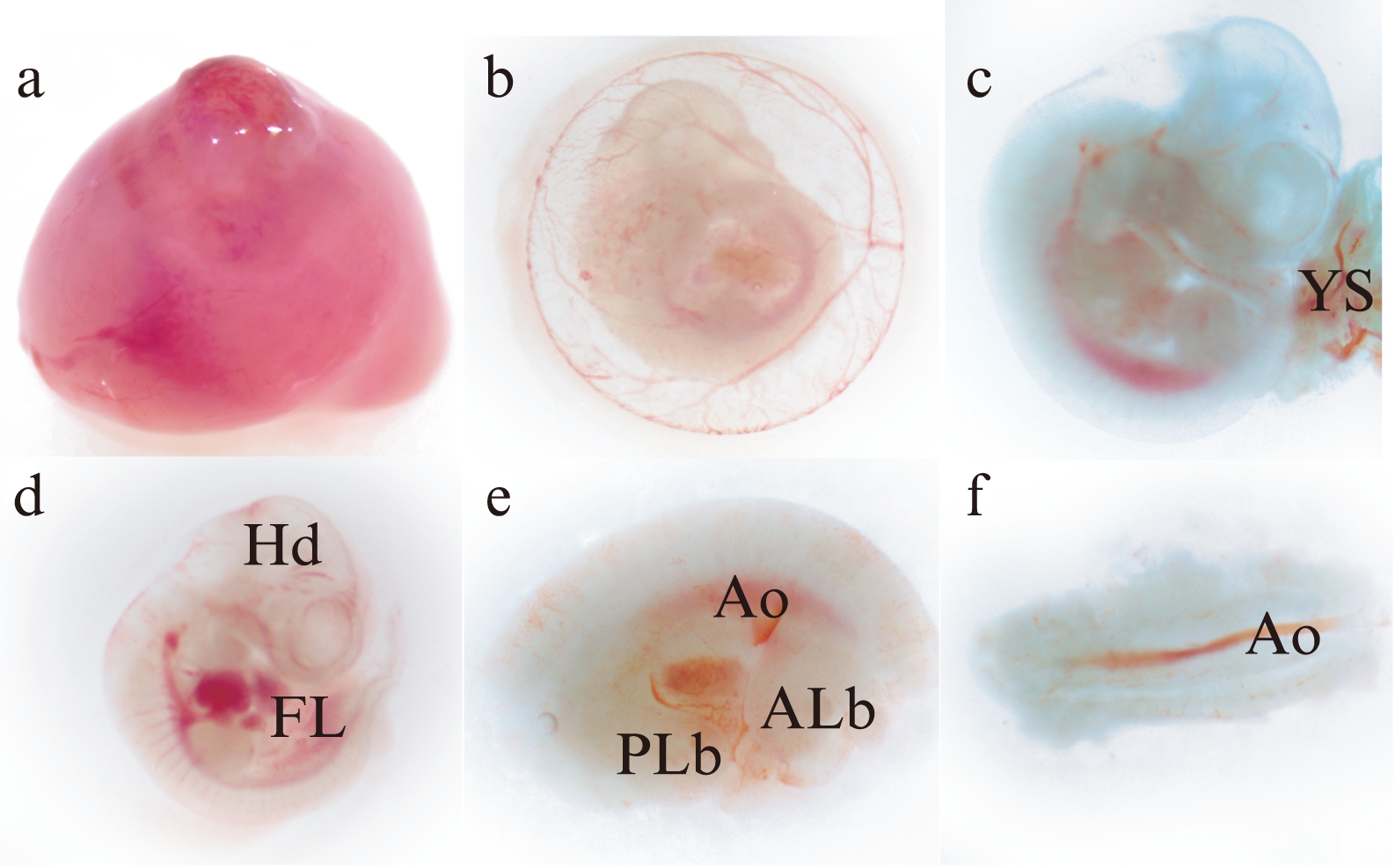
图1 E11.5小鼠不同造血部位解剖示意图
Fig.1 Anatomical diagrams of multiple hematopoietic at E11.5 mice
图a: E11.5小鼠单个子宫;b: 剥除胎膜、胎盘后,由卵黄囊(用YS表示)包裹的胚胎;c: 剥离YS,以及卵黄动脉和脐带;d: 完整的小鼠胚胎,头部(用Hd表示)以及胎肝(用FL表示);e: 截取小鼠上肢芽(用ALb表示)和下肢芽(用PLb表示)之间的部分,以及背主动脉(用Ao表示);f: 去除背侧神经管后分离得到AGM区
2.2 E11.5小鼠PL和整胚Nissl染色结果
Nissl染色结果显示: Hd间脑漏斗状凹槽处可见散在的血细胞;YS边缘曲折,可见血细胞分布;FL肝细胞呈索状排列,FL中不规则血窦明显;AGM区背主动脉腔内可见较多的造血细胞,生殖嵴腺可见圆形中肾管;PL为盘型,最外层为绒毛膜板(chorionic plate, CP),中间为胎盘迷路(labyrinthine placenta, Lb),Lb中有很多附着薄层内皮细胞的血管,血管腔内富含血细胞,见图2。
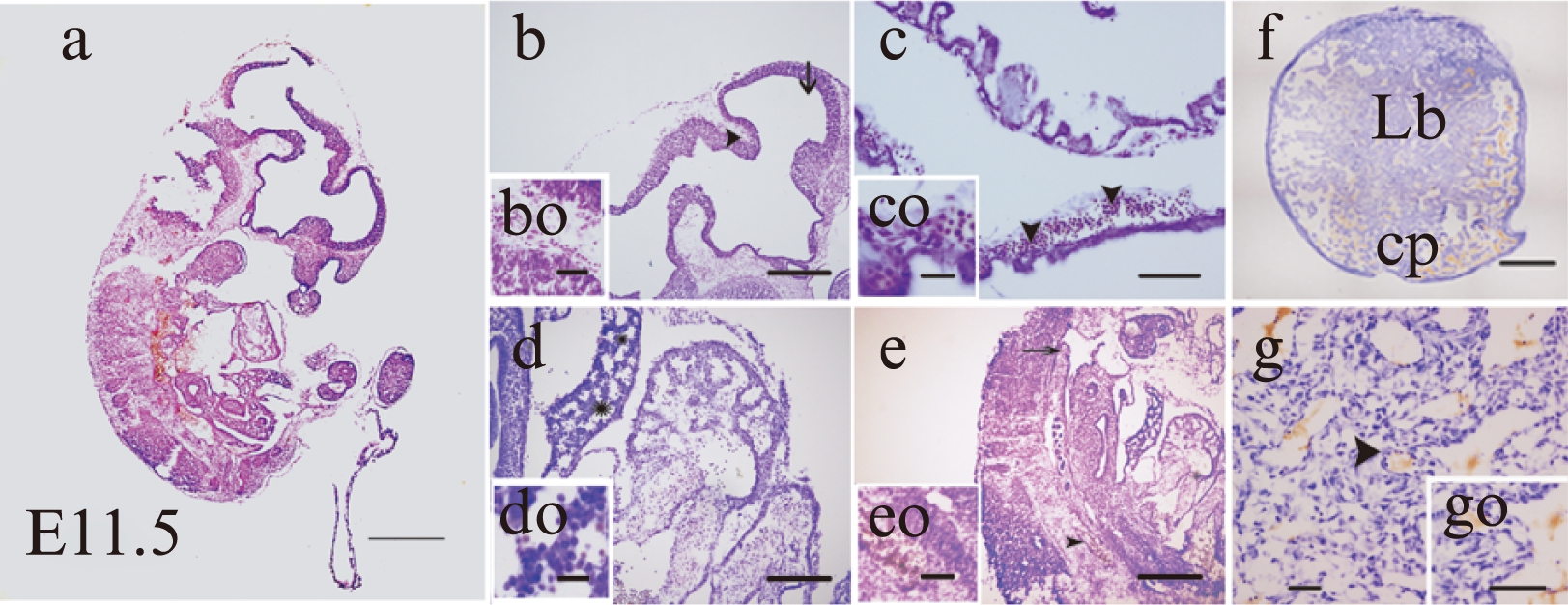
图2 E11.5小鼠整胚Nissl染色
Fig.2 Nissl staining of whole embryo at E11.5 mice
图a: 发育第11.5天小鼠完整胚胎,Nissl染色(×40);b: 头部,“→”代表端脑泡,“△”代表第四脑室(×40);c: 卵黄囊,“△”代表血细胞(×200);d: 胎肝,“※”代表胎肝血细胞(×100);e: AGM区,“→”中肾管(午非管),“△”代表背主动脉(×100);f: 完整胎盘,最外围绒毛膜板用CP表示,中间胎盘迷路用Lb表示(×40);g: Lb血管腔内富含血细胞(×200);小图bo、co、do、eo、go分别为原b、c、d、e、g图的基础上扩大2倍,下方标尺为50μm。×40下方标尺代表500μm;×100下方标尺代表200μm;×200下方标尺代表50μm
2.3 E11.5小鼠PL和整胚H-E染色结果
H-E染色结果显示: 细胞核被染成深蓝紫色,细胞浆被染成粉红色,血细胞呈鲜红色;Hd第三、四脑室壁、间脑漏斗状凹槽处可见散在的血细胞;YS边缘曲折,血岛细胞较大,核仁明显;FL中可见肝细胞呈不规则的索状,胞核较大,肝细胞索之间相互连接成网并与血窦相互交错,血窦形状不规则,内含造血细胞,个别细胞胞核较大;胎盘为盘型,可见Lb中有很多附着薄层内皮细胞的血管,形状不规则,血管管腔内富含血细胞,且在CP大血管中含有许多大核细胞;背主动脉由1~2层扁平细胞组成,腔内可见较多的血细胞,胞核圆形,见图3。
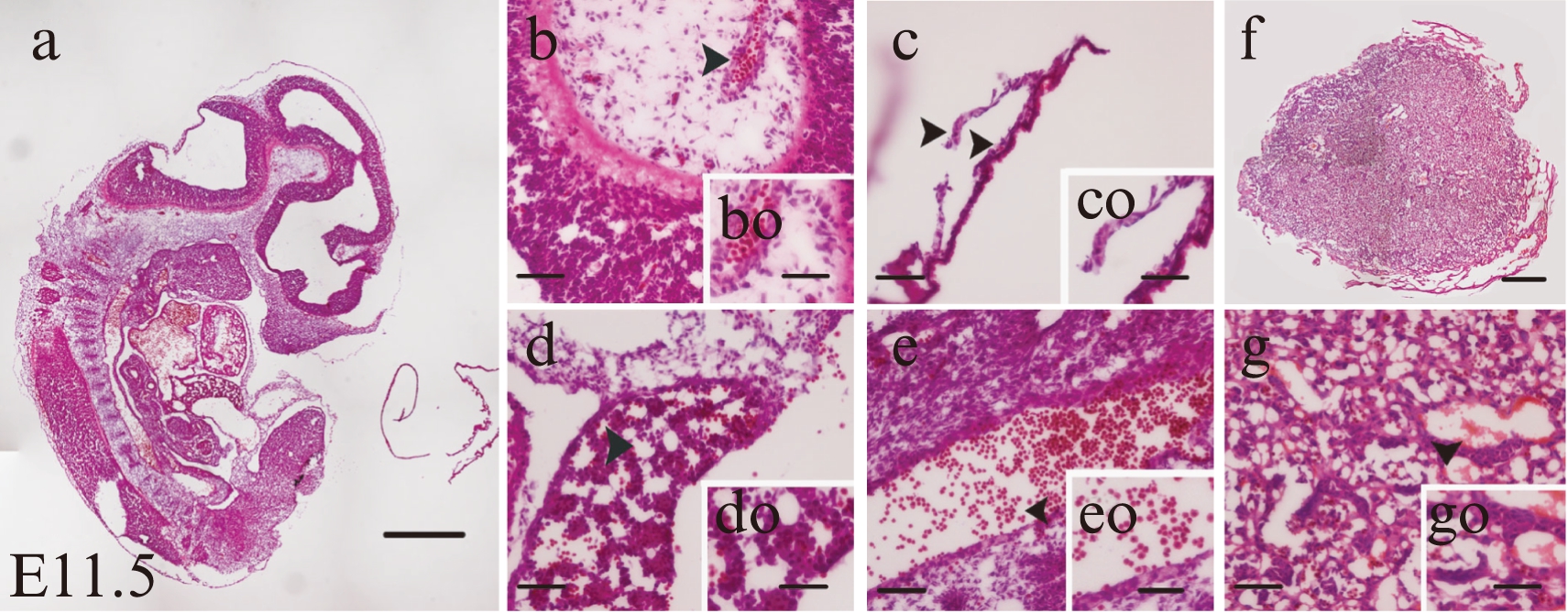
图3 E11.5小鼠整胚H-E染色
Fig.3 H-E staining of whole embryo at E11.5 mice
图a: 发育第11.5天小鼠完整胚胎,苏木精-伊红染色(×40);b: 头部,“△”代表间脑漏斗状区域内血细胞(×200);c: 卵黄囊,“△”代表血细胞(×200);d: 胎肝,“△”代表FL血细胞(×200);e: AGM区,“△”代表背主动脉血细胞(×200);f: 完整胎盘(×40);g: Lb血管腔内富含血细胞(×200);小图bo、co、do、eo、go(×400),下方标尺代表50μm;×40下方标尺代表500μm;×200下方标尺代表50μm
2.4 HSC相关基因在E11.5小鼠不同造血部位中的表达
运用QPCR技术分析E11.5小鼠胚胎AGM区、PL、YS、Hd和FL中HSC相关基因的表达差异,见图4。结果显示CD34、CD45、CD133、c-kit、Sca-1,以及 HSC发育调控分子的主要转录因子Runx1在E11.5均有表达。
在造血组织PL中,CD34 、CD45、c-kit、Sca-1和Runx1表达明显高于AGM区对照组(P<0.05);而CD133表达与AGM区之间比较,差异无统计学意义(P>0.05)。
FL中的c-kit和Runx1表达水平较AGM区升高(P<0.05);E11.5中CD34、CD45、CD133和Sca-1在FL均有表达,但与AGM区比较,差异无统计学意义(P>0.05)。
2.5 免疫荧光
冰冻切片的免疫荧光结果发现,在小鼠胚胎发育过程中,造血干/祖细胞(hematopoietic stem/progenitor cells, HSPC)的标志物CD34在不同的造血部位(PL、YS、AGM区、Hd和FL)中均有表达,并且在PL和YS中CD34、CD45、CD133和c-kit表达均为强阳性。
PL中HSC阳性细胞主要分布于Lb血管周围内皮细胞及腔内血细胞,且细胞核大,表明内皮生血活动的发生;在YS中很多细胞并不表达HSC标志物,而表达的部位也主要集中于YS血管周围,且较薄胞质中常见表达;CD34在头部脑血管周围为阳性,CD45表现为散在的几个弱阳性细胞,而CD133和c-kit未见表达。而在AGM区和FL中只有散在的几个细胞为阳性;在AGM区背主动脉(dorsal aorta, Ao)内皮细胞和泌尿生殖嵴(urogenital ridges, UGR)内皮细胞呈现CD34弱阳性表达;而非生血组织FL,作为HSC的扩增场所,不表达CD45、CD133和c-kit。FL中CD34阳性细胞数目也非常稀少,表达呈弱阳性,见图5。
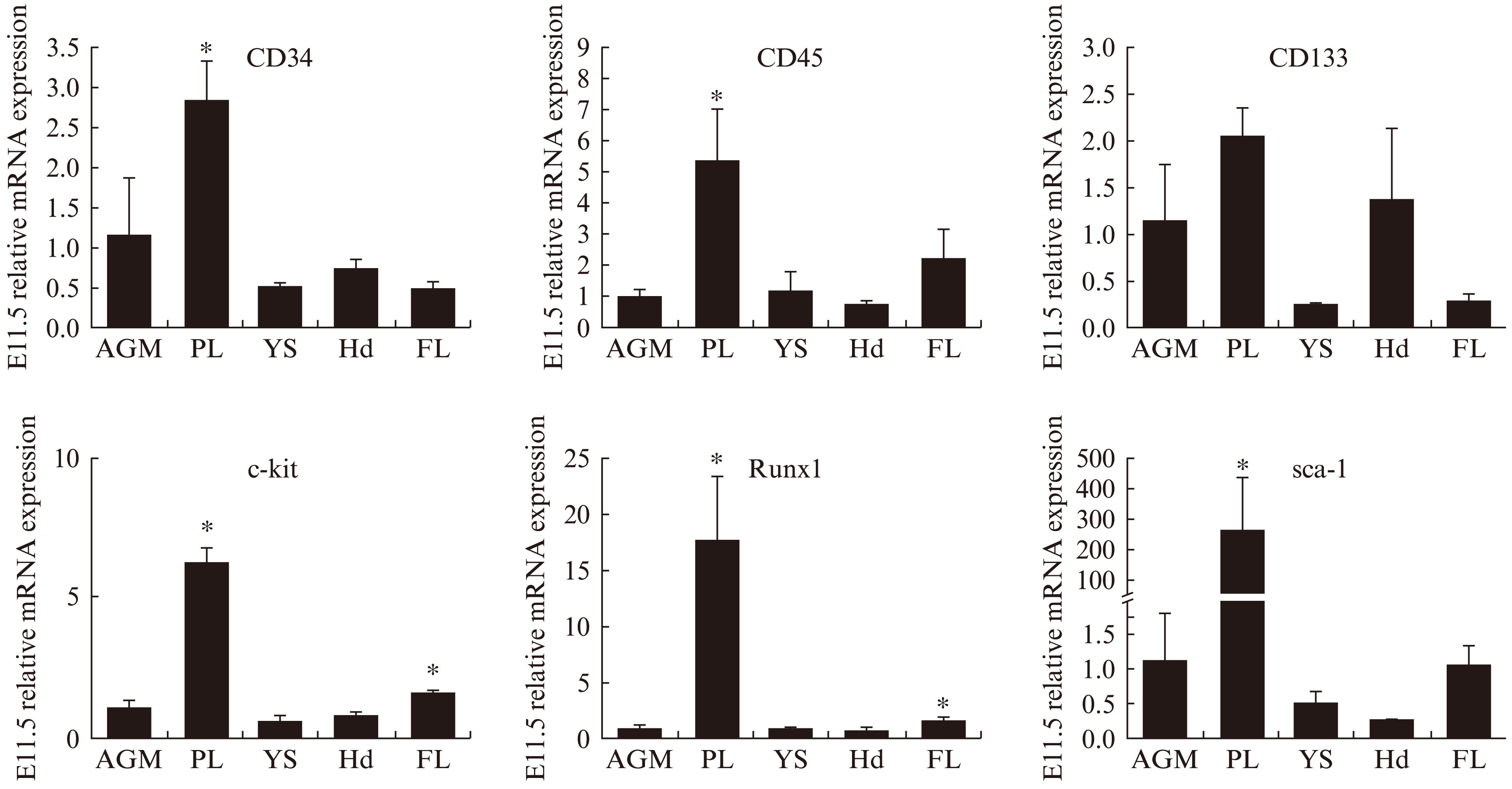
图4 QPCR检测不同造血部位HSC相关基因的表达情况
Fig.4 The expression of HSC related genes in multiple hematopoietic sites by qPCR
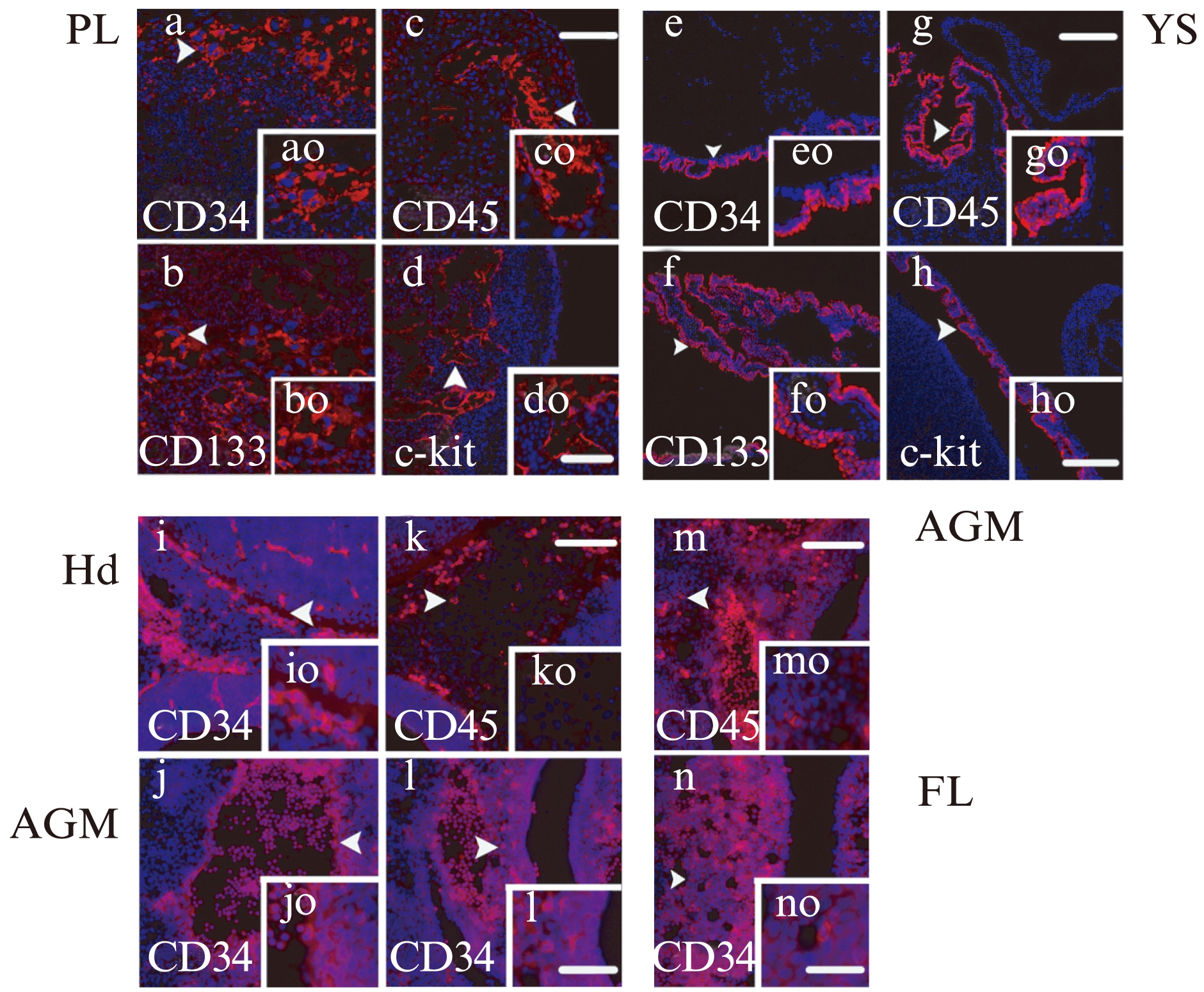
图5 免疫荧光检测不同造血部位HSC相关基因的表达情况
Fig.5 The expression of HSC related genes in multiple hematopoietic sites by immunofluorescence
E11.5不同造血部位HSC反应,箭头所示为阳性细胞,最右下角白色“—”表示标尺,大图为50μm(×200),小图为25μm(×400)
3 讨 论
哺乳动物造血分为原始造血和永久造血,第一次出现的造血是原始造血,小鼠发生于E7.5 YS血岛,HSC首次出现于E9 YS血岛 [5-6]。永久造血的发生晚于原始造血,一般认为小鼠胚胎HSC起源于E10.5 AGM区,到E11.5时HSC数量达到峰值,E12.5 AGM区消失。而E11时HSC可能通过脐动脉迁移至PL,尤其是在E11~E12 Lb中HSC数量急剧增加[7-8]。随后,HSC通过胎儿血液循环逐渐迁移至FL,在E13.5后,HSC在FL中大量增殖、分化,而PL中HSC数量开始逐渐减少。最终BM取代FL成为HSC的主要来源。E10~E12是小鼠胚胎造血的关键时期,因而本研究选取E11.5小鼠不同造血部位进行了相关的形态学和组织学研究。
胚胎中HSC在迁移至FL之前数量非常稀少,而目前胚胎HSC缺乏特异性的标志物,CD34选择性地表达于短期HSC、造血祖细胞、髓系祖细胞、粒细胞-巨噬细胞祖细胞和小血管内皮细胞表面,被认为是HSPC的标志物[9]。证明拥有完全的再建能力的小鼠HSC也可以是CD34阴性。HSC可能是CD34+或CD34-。另外,CD133+富集的亚群与CD34+富集的亚群扩增方式相似,可保留多系增殖的能力[10]。因此,同为HSC标志物的CD133可作为用CD34筛选HSC 和体外扩增的补充。HSC膜上还表达c-kit,其配体分子HSC因子(stem cell factor, SCF)对HSC的分化至关重要。干细胞抗原1(Sca-1)在造血组织和非造血组织中均有表达,可能参与调节B细胞和T细胞的活化[11]。本研究选用多种表面标志物探索E11.5不同造血部位的组织学特征。
PL是高度血管化的造血器官,介导母胎氧气和养分交换,对小鼠胚胎存活与发育至关重要[12]。Christos等[13]发现小鼠PL独立于其他造血器官,PL造血形成包含两种不同的血管区: 一个是能产生HSPC的绒毛膜板大血管,另一个是能产生HSPC的迷路血管。通过Nissl染色,可以清楚地看到组织结构和血细胞的分布,但是并不能分辨细胞核的大小,H-E染色可以清楚地看到在Lb中有很多附着薄层内皮细胞的血管,形状不规则,血管腔内富含血细胞,细胞较小,血管周围富有一层核仁明显的细胞,并散在分布于血管腔内;其次,PL最外层CP大血管中,许多细胞的核仁较大。免疫荧光也显示这些部位的细胞为CD34强阳性。为了鉴定造血组织中是否有HSC 的存在,从表型特征上看其是否有表达CD34、CD133、c-kit等。E11.5 PL中QPCR结果显示CD34、CD45、CD133、c-kit、Sca-1和Runx1明显高表达,说明E11.5时PL中产生大量的造血细胞;而AGM区HSC表达数量却比PL低,且有统计学意义(P<0.05)。免疫荧光显示CD34、CD45、CD133和c-kit为强阳性,均表达于Lb血管薄层内皮细胞及腔中血细胞。证实了小鼠胚胎PL迷路血管的内皮细胞具有生血潜能,E11时HSC迁移至PL,E11~E12 HSC数量急剧增加,即HSC扩散的第一个适宜位置是胎盘的血管迷路。
小鼠胚胎YS是一层富含血管的胚外膜囊,由脏层卵黄囊(visceral yolk sac, VYS)和壁卵黄囊(parietal yolk sac, PYS)组成,主要为红系和髓系细胞。而Yamasaki等[14]研究发现在小鼠E9.5~E14.5均有CD45和c-kit的表达,说明E11.5的YS确实产生了T细胞、B细胞各系细胞等。YS边缘曲折,不规则,免疫荧光显示CD34、CD45、CD133和c-kit均为强阳性,但是在YS中很多细胞并不表达HSC标志物,而且表达的部位也主要集中于YS血管周围,常见表达于较薄胞质中。Nissl染色和 H-E 染色显示血管中心血细胞较大。E11.5小鼠YS中CD34、CD45、CD133、Sca-1和Runx1均低表达(P<0.05),与AGM区比较,没有统计学意义(P<0.05),说明HSC在YS中的扩增并不明显。
研究已证实小鼠AGM区HSC全部富集于背主动脉腹侧。本实验发现E11.5 的AGM区有表达CD45结果。免疫荧光结果显示在AGM区背主动脉腹侧分布有散在的几个CD34和CD45阳性细胞。背主动脉由血细胞、内皮细胞和间质细胞构成,AGM区的产生被认为是内皮-造血转化 (endothelial-to-hematopoietic transition, EHT)而成。只在AGM区背主动脉和泌尿生殖嵴内皮细胞可见表达,充分证明了内皮生血活动的发生。CD133和c-kit也未见明显表达。这也暗示了在胎肝发育过程中,生血细胞与生血内皮细胞之间的相互作用至关重要。
众所周知,小鼠AGM区是胚内HSC发生位点。研究发现Hd也是小鼠胚胎造血发生位点,头部间脑漏斗状凹槽处可见明显的散在血细胞HSC共表达CD34和c-kit,证实小鼠胚胎头部脑血管内皮细胞可能具生血潜能。
在E11时YS和AGM区的HSC就开始迁移至FL,直到E13.5时HSC才开始在FL中增殖、分化,随后FL成为主要的造血器官。E11.5的FL中存在巨核祖细胞(megakaryocyte progenitors, MKPs),表达数个肝脏特异性蛋白,比如甲胎蛋白(α-fetoprotein, AFP),但是这并不像成体骨髓中的巨核细胞(megakaryocytes, MKs),且胚胎MKPs显示CD45为阴性[15]。本实验H-E染色显示在整个FL中散在有很多血细胞,免疫荧光显示FL间隙腔中血细胞并不表达,只有散在的几个细胞呈现为CD34阳性,考虑为干细胞。而QRT-PCR结果显示CD45表达很低,几乎不表达,免疫荧光也未见CD45表达。其他干细胞标志物CD133和c-kit也均未见表达。值得一提的是,Victoria [16]发现不同发育阶段的肝干细胞也表达HSC表面标志物CD34。由此说明,从阳性细胞形态和定位看,表达的极少数阳性细胞很有可能为肝干细胞[17]。上述结果表明,在E11.5小鼠FL肝干细胞主要富集于血管周围,这里可能是肝干细胞或肝造血干细胞的储备区。
综上所述,PL、YS、Hd、AGM区和FL中的HSC有相同的表面标志物CD34,说明这些造血位点可能支持HSC自我更新、分化和迁移。而造血关键是HSC的产生和HSC池的扩增,不同造血组织中检测到的HSC 并不能确定这些组织是否能够产生扩增或维持HSC。HSC产生的关键时期,胚鼠PL和YS中HSC发育最旺盛。永久造血起源于小鼠胚内AGM区,而不同造血部位HSC的迁移与血管内皮细胞密切相关,HSC可能通过AGM区血管内皮迁移进入血液循环,首先到达 PL的血管迷路,然后定植于FL,扩增或维持HSC。目前人们在造血领域的研究已经取得了很大进展,胚胎造血细胞发生与发育和血液系统恶性肿瘤发生之间相互关系的深入研究,将促进血液疾病相关干细胞的靶向治疗[27]。
相信随着研究的不断深入,胚胎造血基础研究也将会取得进一步的成功,并有利于再生医学、基因靶向治疗血液类疾病、先天性免疫相关疾病、扩增脐带血干细胞移植的临床应用。
【参考文献】
[1] Golub R, Cumano A. Embryonic hematopoiesis[J]. Blood Cells Mol Dis, 2013,51(4): 226-231.
[2] Serrano N, Cortegano I, Ruiz C, et al. Megakaryocytes promote hepatoepithelial liver cell development in E11.5 mouse embryos by cell-to-cell contact and by vascular endothelial growth factor A signaling[J].Hepatology, 2012,56(5): 1934-1945.
[3] Anderson H, Patch TC, Reddy PN, et al. Hematopoietic stem cells develop in the absence of endothelial cadherin 5 expression[J].Blood, 2015,126(26): 2811-2820.
[4] Li Z, Lan Y, He W, et al. Mouse embryonic head as a site for hematopoietic stem cell development[J].Cell Stem Cell, 2012,11(5): 663-675.
[5] Garcia MD, Larina IV. Vascular development and hemodynamic force in the mouse yolk sac[J].Front Physiol, 2014,5: 308.
[6] Baron MH. Concise review: early embryonic erythropoiesis: not so primitive after all[J].Stem Cells, 2013,31(5): 849-856.
[7] Rai A, Cross JC. Development of the hemochorial maternal vascular spaces in the placenta through endothelial and vasculogenic mimicry[J].Dev Biol, 2014,387(2): 131-141.
[8] Sugiyama D, Inoue-Yokoo T, Fraser ST, et al. Embryonic regulation of the mouse hematopoietic niche[J].Scientific World J, 2011,11: 1770-1780.
[9] van Galen P, Kreso A, Mbong N, et al. The unfolded protein response governs integrity of the haematopoietic stem-cell pool during stress[J].Nature, 2014,510: 268-272.
[10] Lanuti P, Rotta G, Almici C, et al. Endothelial progenitor cells, defined by the simultaneous surface expression of VEGFR2 and CD133, are not detectable in healthy peripheral and cord blood[J]. Cytometry A. 2016,89(3): 259-270.
[11] Shin JY, Hu W, Naramura M, et al. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias[J].J Exp Med, 2014,211(2): 217-231.
[12] Raynaud CM, Butler JM, Halabi NM, et al. Endothelial cells provide a niche for placental hematopoietic stem/progenitor cell expansion through broad transcriptomic modification[J].Stem Cell Res, 2013,11(3): 1074-1090.
[13] GekaSC, Rhodes KE, Van Harde LB, et al. Hematopoietic stem cell development in the placenta[J]. Int J Dev Biol, 2010,54: 1089-1098.
[14] Yamasaki S, Nobuhisa I, Ramadan A, et al. Identification of a yolk sac cell population with hematopoietic activity in view of CD45/c-Kit expression[J].Dev Growth Differ, 2011,53(7): 870-877.
[15] Serrano N, Cortegano I, Ruiz C, et al. Megakaryo-cytes promote hepatoepithelial liver cell development in E11.5 mouse embryos by cell-to-cell contact and by vascular endothelial growth factor a signaling[J]. Hepatology, 2012,56(5): 1934-1945.
[16] Victoria M. Velazquez, Luke S. et al. Systems biological analyses reveal the HCV-specific regulation of hematopoietic development[J]. Hepatology, 2015,61(3): 843-856.
[17] 张雪莲,梁爱斌.白血病干细胞的相关靶向治疗研究[J].同济大学学报: 医学版,2013,34(4): 120-124.
Morphological and histochemical study of fetal mice in multiple hematopoietic sites
LI Ya-mei1, LIANG Ai-bin2, WANG Jun-bang2, FANG Xia1, ZHANG Yan1, ZHANG Hong1
(1. Dept. of Clinical Pharmacology, Tongji Hospital, Tongji University, Shanghai 200065, China; 2. Dept. of Hematology, Tongji Hospital, Tongji University, Shanghai 200065, China)
【Abstract】Objective To observe the anatomical structure and related gene expression in multiple hematopoietic sites of fetal mice at embryonic 11.5 d (E11.5). Methods The morphology and histology were observed by using Nissl staining, Hematoxylin and Eosin (HE) staining, and immunofluorescence technique; and the mRNA expression of hematopoietic stem cell (HSC) related genes was detected by Real-time quantitative PCR (RT-qPCR) at different hematopoietic sites, including the placenta (PL), yolk sac (YS), aorta-gonad-mesonephros (AGM) region, head (Hd) and fetal liver (FL) of fetal mice at E11.5. Results Nissl and HE staining indicated that placenta labyrinthica, blood vessel of yolk sac, dorsal aorta of AGM, the cerebrovascular head and fetal liver blood sinus contained abundant amount of blood cells. CD34, CD45, CD133, c-kit, sca-1 and Runx1 were expressed significantly at different hematopoietic sites (P<0.05), and compared with other hematopoietic sites, the expression of HSC marker was significantly high in PL(P<0.05). Immunofluorescence technique demonstrated that CD34+ HSC was expressed at different hematopoietic sites, and strongly positive in placenta vascular labyrinth and blood vessels of yolk sac. Additional HSC marker CD45 was lower expressed at dorsal aorta and urogenital ridges of AGM region, head cerebrovascular region, but CD45- cells were present in the fetal liver. Besides, vascular labyrinth of placenta and blood vessel of yolk sac was highly expressed with c-kit and CD133. Conclusion This study demonstrates that HSCs are the most active in embryonic mice PL and YS during a key period of HSC emergence. Definitive hematopoiesis originates from AGM region, and migration of HSCs in multiple hematopoietic sites is closely to the endothelial cells. HSCs may migrate through the vascular endothelial, the first niche for expansion of blood stem cells is the placenta’s vascular labyrinth, HSCs engraft in FL, then amplify or maintain.
【Key words】morphology; histology; hematopoietic stem cell; hematopoietic sites; fetal mice
doi:10.16118/j.1008-0392.2016.03.001
收稿日期:2016-03-22
作者简介:李亚梅(1989—),女,硕士研究生.E-mail: heartlove616@163.com
通信作者:张 虹.E-mail: hongzh97@tongji.edu.cn
【中图分类号】R 551
【文献标志码】A
【文章编号】1008-0392(2016)03-0001-07





