·临床研究·
孔铭颢, 王建忠, 刘 颖
(同济大学附属第十人民医院急诊科,上海 200072)
【摘要】目的 研究慢性阻塞性肺病患者(chronic obstructive pulmonary disease, COPD)体内脂连素(adiponectin, APN)与其他炎症标记物IL-8、IL-6、TNF-α之间的联系。方法 随机选择80名COPD患者(其中60例急性加重患者,20例稳定期患者)及30名健康体检者作为研究对象,分别收集患者血清及诱导痰,ELISA法检测APN、IL-8、IL-6、TNF-α的水平。结果 与健康对照组相比,COPD患者血清及诱导痰中APN的水平均高于健康对照者(P<0.01)。COPD患者血清及诱导痰中APN、IL-8、IL-6、TNF-α的水平均升高,且COPD急性加重患者上述指标均高于COPD稳定期患者(P<0.01)。结论 脂连素联合其他炎症标记物可以作为诊断COPD,尤其是AECOPD患者全身炎症反应的标记物。
【关键词】脂连素; 炎症标记物; 慢性阻塞性肺病; 血清; 诱导痰
慢性阻塞性肺病(chronic obstacle pulmonary diseases, COPD)是一种发生于气道、肺实质和肺血管的慢性非特异性炎症,其发病机制主要是在各种刺激下,炎症细胞被激活,释放各种炎症介质破坏肺组织结构,促进中性粒细胞的炎症反应[1]。脂连素(adiponectin, APN)是一种由脂肪细胞合成的分泌型蛋白[2],有重要的抗炎、抗动脉粥样硬化、抗肥胖的作用[3],参与心血管疾病、糖尿病、代谢综合征等疾病的病理过程。近年来研究发现气道上皮细胞也可以分泌脂连素,以自分泌或者旁分泌的方式调节气道炎症反应[4],参与哮喘、肺癌、肺炎等肺部疾病的炎症过程[5]。例如,目前有研究显示慢性阻塞性肺病急性发作(acute exacerbation chronic obstacle pulmonary diseases, AECOPD)时患者血清中APN浓度升高,当病情缓解稳定后APN浓度下降恢复到基线值[6];血清APN与TNF-α在COPD患者的严重程度方面成正相关[5];血清APN如C反应蛋白、血沉那样作为COPD炎症反应严重度的标记物之一[7],其价值尚待进一步观察和证实。APN联合其他炎症标记物是否能够更好地诊断COPD患者的全身炎症反应,目前尚缺少相关报道。本研究通过检测COPD患者血清、诱导痰中APN与其他炎症标记物如IL-8、IL-6、TNF-α,对这一问题进行初步探索研究。
1.1 一般资料
随机筛选2013年11月至2014年4月在同济大学附属第十人民医院就诊的80例COPD患者为研究对象,包括AECOPD患者60例,COPD稳定期患者20例。其中男性42例,女性38例,平均年龄(76.5±13.5)岁。另外30例健康体检者作为对照,其中男性23例,女性17例,平均年龄(74.2±14.3)岁。所有研究对象年龄、性别差异无统计学意义(P>0.05)。COPD诊断和分期以中华医学会呼吸病学分会制定的慢性阻塞性肺疾病诊治指南[8]为标准。排除标准: (1) X线胸片检查存在肺炎;(2) 入选前4周内使用抗生素;(3) COPD加重病程已大于5日;(4) 呼吸系统之外的其他部位存在细菌感染;(5) 要求排除严重心肝、肾疾病、肺结核、支气管扩张症、肺部恶性肿瘤、高血压、糖尿病等影响患者心肺功能者,无近期服用糖皮质激素治疗史,无神经系统疾病。该研究获得伦理委员会批准进行,所有患者表示知情并签署知情同意书。
1.2 方法
1.2.1 肺功能检查 患者肺功能的分级参照GOLD指南[9]。被检测者进行肺功能测试及支气管舒张试验,测试后得出用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、第1秒用力呼气容积与用力肺活量(FEV1/FVC)、第1秒用力呼气容积占预计值百分比(FEV1%)。根据气流受限程度分级。
1.2.2 诱导痰的收集 所有患者早上6点在医生指导下先用清水漱口、洗鼻,然后吸入3%高张生理盐水气溶胶15min,深咳第1口痰入培养皿中,即刻盐水洗涤后在每1个低倍视野下白细胞数>25个、上皮细胞数<10个的为合格痰标本,否则立即重新留痰。痰液在37 ℃水浴10min,再用0.1%二硫苏糖醇(上海华美生物技术公司)按照1∶4稀释,最后离心,收集上清液备用。
1.2.3 血清标本收集 采集患者静脉血10ml,室温下离心,离心半径13.5cm,2600r/min,离心5min,收集血清在-70 ℃条件下低温保存备检。
1.2.4 检测方法 血清和痰液中APN、IL-8、IL-6、TNF-α水平均采用ELISA法检测。IL-6、IL-8、TNF-α试剂盒购自美国Genzyme公司。脂联素ELISA试剂盒购自美国R&D公司。
1.3 统计学处理
数据采用SPSS 19.0统计分析软件进行统计分析,计量资料用![]() 表示,计数资料之间的比较采用χ2检验,计量资料之间的比较使用t检验和方差分析,P<0.05为差异具有统计学意义。
表示,计数资料之间的比较采用χ2检验,计量资料之间的比较使用t检验和方差分析,P<0.05为差异具有统计学意义。
2.1 COPD组及对照组血清各项炎症指标检测结果
COPD组各项炎症指标APN、IL-8、IL-6、TNF-α浓度均高于对照组,差异有统计学意义(P<0.01),见表1。
表1 COPD组及对照组血清APN及细胞因子检测结果
Tab.1 Serum APN and cytokines levels in COPD patients and control subjects![]()
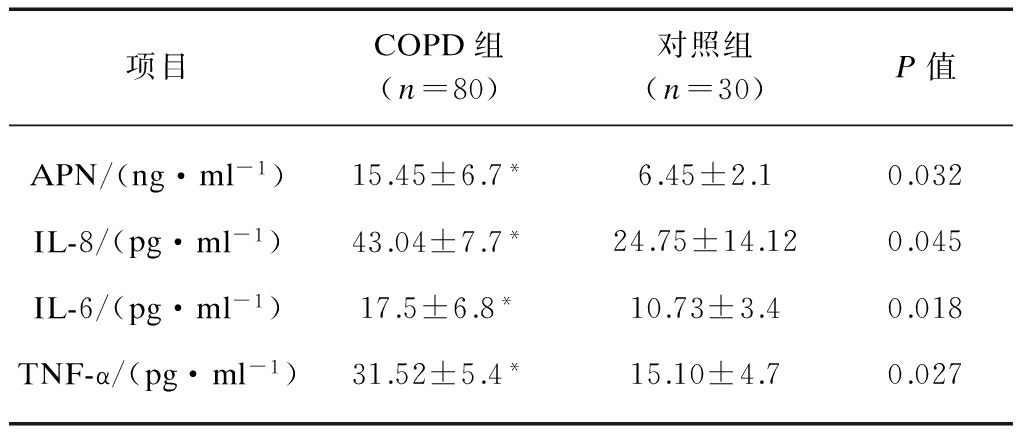
与对照组相比,*P<0.01
2.2 肺功能检测结果
AECOPD组FEV1%、FEV1/FVC与稳定COPD相比均显著下降,差异有统计学意义(P<0.01),符合AECOPD的临床表现,见表2。
表2 AECOPD、稳定COPD患者肺功能检测结果
Tab.2 Lung function in patients with AECOPD and stable COPD![]()
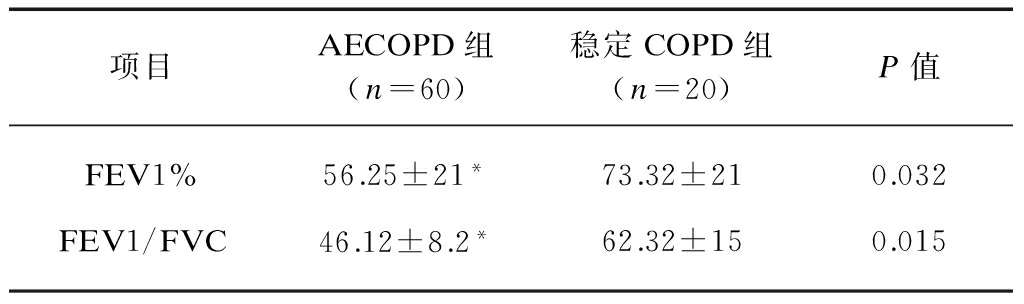
与稳定COPD组相比,*P<0.01
2.3 血清中APN及细胞因子检测结果
AECOPD患者血清APN、IL-8、IL-6、TNF-α浓度显著高于稳定期COPD患者,差异有统计学意义(P<0.01),见表3。
表3 AECOPD、稳定COPD患者血清中APN及细胞因子检测结果
Tab.3 Serum APN and cytokines levels in patients with AECOPD and patients with stable COPD![]()

与稳定COPD组相比,*P<0.01
2.4 诱导痰中APN及细胞因子检测结果
与稳定期COPD患者相比,AECOPD组患者各项指标均显著升高,差异有统计学意义(P<0.01),见表4。
表4 COPD组诱导痰中APN及细胞因子检测结果
Tab.4 APN and cytokines levels in induced sputum of patients with AECOPD and patients with stable COPD group![]()

与稳定COPD组相比,*P<0.01
COPD的病理变化来自于局部的气道炎症以及全身的炎症反应[10],体内炎症细胞被激活后释放多种炎症因子如IL-8、IL-6、TNF-α等,在各种趋化因子的作用下富集于气道、肺泡、肺间质中,导致炎症反应的发生,进而造成肺损伤。APN是一种由脂肪细胞分泌的内源性生物活性多肽[2],主要调节脂肪酸氧化和糖代谢。近几年发现APN与其受体AdipoR1、AdipoR2等也表达于肺组织的各种细胞上,APN可以通过血液循环渗漏到肺泡液中[5]。本研究通过检测COPD患者血清、诱导痰中APN及其他细胞因子如IL-8、IL-6、TNF-α的表达,探索研究APN联合其他炎症标记物是否可以更好的诊断COPD的全身炎症反应。虽然炎症因子在COPD患者肺泡灌洗液中高表达,但是由于在临床上获取肺泡灌洗液很困难,大多数患者不能耐受,因此,在本研究中采用收集诱导痰的方法代替肺泡灌洗液,从而研究气道内炎症因子的变化。
在COPD的主要炎症因子中,IL-8被认为是最重要的[11],因为其可激活中性粒细胞发生脱颗粒,释放多种炎症因子,促进炎症反应。在APN的调控下,气道上皮细胞可以刺激IL-8的表达。TNF-α是多种细胞释放的重要炎症因子,也可以激活中性粒细胞,刺激IL-8的释放。TNF-α的过表达可以导致炎症反应慢性化,加重肺损伤[12]。本研究结果发现COPD患者血清APN、IL-8、IL-6、TNF-α浓度均显著升高,且这些因子在AECOPD患者中的表达又高于稳定期COPD患者,进一步证实COPD是全身性炎症反应。本研究结果还发现,与稳定期COPD患者相比,AECOPD患者诱导痰中APN、IL-8、IL-6、TNF-α浓度也显著升高。根据Krommidas等[6]的报道,在AECOPD中,APN与全身炎症反应过程相关,APN最有可能与IL-6、TNF-α相关。IL-8、IL-6、TNF-α主要是气道炎症细胞分泌的[13],而APN主要是脂肪细胞分泌后释放到外周血中,气道上皮细胞分泌APN的量相对很少,因此APN与气道炎症反应的相关性较其他细胞因子低。血清、诱导痰中各种炎症细胞因子的增加是因为体内炎症细胞的激活所致,但是APN表达水平升高的机制、信号通路等是什么,目前还不清楚。
血清APN联合IL-8、IL-6、TNF-α可以更好地诊断COPD全身炎症及其严重程度,而诱导痰中的IL-8、IL-6、TNF-α可以更好地反应气道炎症。下一步需深入研究COPD患者血清APN高表达的机制,揭示APN参与COPD全身病理变化的信号通路、网络调控途径等,深化对COPD病理过程的认识。
【参考文献】
[1] 张平.慢性阻塞性肺病诊疗新进展[J].中国卫生产业,2014,(8): 191-192.
[2] 李玉群,梁贤球,何晟,等.稳定期COPD患者营养状况与血清脂联素、肺功能、CAT评分的关系[J].安徽医科大学学报,2014,49(7): 969-972.
[3] 李道远,任春琦,玛依努尔·斯买拉洪.血浆脂联素检测在冠心病患者中的临床意义[J].中国医学创新,2013,10(23): 134-136.
[4] 武玉荣,李国吾.慢性阻塞性肺疾病患者血清中脂联素水平的变化及其与肺功能的相关性[J].中国临床研究,2015,28(1): 11-12.
[5] Ali Assad N, Sood A. Leptin, adiponectin and pulmonary diseases[J]. Biochimie, 2012,94(10): 2180-2189.
[6] Krommidas G, Kostikas K, Papatheodorou G, et al. Plasma leptin and adiponectin in COPD exacerbations: associations with inflammatory biomarkers[J]. Respir Med, 2010,104(1): 40-46.
[7] 杨义伟.COPD患者治疗前后血清IL-18、D-D和APN检测的临床意义[J].放射免疫学杂志,2013,26(6): 812-813.
[8] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4): 255-264.
[9] Papala M, Kerenidi N, Gourgoulianis KI. Everyday clinical practice and its relationship to 2010 and 2011 GOLD guideline recommendations for the management of COPD[J]. Prim Care Respir J, 2013,22(3): 362-364.
[10] 晶晶,梁永杰,尹琦,等.白介素6基因多态性与慢性阻塞性肺疾病的相关性研究[J].同济大学学报: 医学版,2013,34(6): 31-34.
[11] 吴红红,魏晓丽,何英.慢性阻塞性肺病患者的血清IL-8、TNF-α变化及其与肺功能的关系[J].新疆医科大学学报,2012,35(10): 1356-1358.
[12] 吴镇湖,许银姬,汤翠英.慢性阻塞性肺病稳定期TNF-α、IL-8水平与及吸烟和肺功能的相关性研究[J].医药前沿,2013,13: 91-92.
[13] 叶新明,钱克俭.重症肺炎支原体肺炎肺泡灌洗液中TNF-α、IL-6、IL-8、IL-10水平观察[J].南昌大学学报: 医学版,2010,50(4): 72-74.
Adiponectin and other inflammatory biomarkers levels in COPD patients
KONG Ming-hao, WANG Jian-zhong, LIU Ying
(Dept. of Emergency, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
【Abstract】Objective To investigate adiponectin(APN) and other inflammatory biomarkers levels in serum and induced sputum in patients with chronic obstructive pulmonary disease(COPD). Methods Eighty COPD patients(20 stable cases and 60 exacerbated cases) and 30 healthy subjects were included in the study. The levels of APN, IL-8, IL-6 and TNF-α in serum and induced sputum were detected by enzyme-linked immunosorbent assay(ELISA). Results The levels of APN in COPD patients were significantly higher than those in control subjects(P<0.01). The levels of APN, IL-8, IL-6 and TNF-α in both serum and induced sputum were significantly higher in AECOPD patients compared to stable COPD patients(all P<0.01). Conclusion APN and other inflammatory biomarkers are increased in COPD patients, suggesting that they may be used for diagnosis of COPD, especially AECOPD.
【Key words】adiponectin; inflammatory biomarker; COPD; serum; induced sputum
doi:10.16118/j.1008-0392.2016.02.024
收稿日期:2015-05-14
作者简介:孔铭颢(1977—),男,主治医师,硕士.E-mail: flashkh77@126.com
【中图分类号】R 562
【文献标志码】A
【文章编号】1008-0392(2016)02-0106-04