·临床研究·
徐 雁, 王玉红, 林善丽, 衣少娜, 葛 俊, 贺延波
(滨州医学院烟台附属医院肾内科,山东 烟台 264100)
【摘要】目的 探讨血清铁调素与维持性血液透析(maintenance hemodialysis, MHD)患者心血管疾病(cardiovascular disease, CVD)的关系。方法 稳定的MHD患者75例入选,年龄匹配的健康人20例为对照组。酶联免疫吸附法测定血清铁调素、晚期氧化蛋白产物(advanced oxidation protein products, AOPP)和IL-6。Spearman相关和线性回归分析铁调素与其他指标的相关性;二分类Logistic回归分析各指标与CVD的相关性。结果 MHD患者铁调素水平显著高于健康对照组[249.2(169.0~475.2)ng/mlvs 84.7(49.6~179.3)ng/ml,P<0.05]。CVD患者铁调素水平明显高于无CVD者[335.9(206.3~514.2)ng/ml vs 210.5(133.6~392.3)ng/ml,P<0.05]。Spearman相关分析显示铁调素与每周促红细胞生成素(EPO)剂量、EPO抵抗指数、铁蛋白、转铁蛋白饱和度、AOPP、高敏C反应蛋白、IL-6及左心室质量指数呈正相关,与血清前白蛋白、总铁结合力、不饱和铁结合力、转铁蛋白呈负相关。线性回归分析显示铁蛋白、总铁结合力、IL-6与铁调素水平独立相关。二分类Logistic回归分析显示铁调素升高为CVD发生的独立危险因素。结论 MHD患者血清铁调素水平与CVD相关,血清铁调素可能是MHD患者CVD新的标志物及治疗靶目标。
【关键词】铁调素; 血液透析; 心血管疾病; 炎症; 铁
心血管疾病(cardiovascular disease, CVD)是维持性血液透析(maintenance hemodialysis, MHD)患者第1位的并发症和死亡原因[1],其发病机制目前存在较多争议。最近国外有学者提出血液透析患者高血清铁调素水平可引起血管内皮细胞及斑块巨噬细胞铁潴留,通过氧化应激引起CVD的发生[2]。而国内目前尚无MHD患者血清铁调素与CVD关系的研究,本研究旨在探讨MHD患者血清铁调素和CVD的关系,拟为MHD患者CVD的治疗提供新的思路。
1.1 一般资料
2014年12月滨州医学院烟台附属医院血透室长期透析患者75例。(1) 入选标准: 病情稳定的18岁以上患者,透析时间大于3个月。(2) 排除标准: 严重心力衰竭、肝脏疾病、严重感染、活动性结核、恶性肿瘤、活动性炎症性疾病服用免疫抑制剂者;1个月内有手术史、输血史或急性心血管事件;曾行腹膜透析、肾移植者;不愿参与研究者。(3) 透析方式: 透析器膜材料均为聚砜膜,为一次性使用,面积1.3~1.5m2。使用标准碳酸氢盐透析液,每周透析3次,每次4h,透析液流量为500ml/min,血流量200~300ml/min。采用低分子肝素抗凝。血管通路为动静脉内瘘或半永久中心静脉置管。另选本院体检中心无肥胖、吸烟史等健康体检者20例为对照。CVD指既往确诊心血管、脑血管或外周血管病,包括心绞痛、心肌梗死、心力衰竭、脑梗死、脑出血、发生内瘘闭塞或曾接受血管重建术者。
患者临床资料收集,包括性别、年龄、糖尿病史、吸烟史、CVD史、促红细胞生成素用量及透析资料等。计算患者体质量指数(body mass index, BMI)。BMI=体质量(kg)/[身高(m)]2。用单室模型spKt/V评价透析充分性。促红细胞生成素抵抗指数=每周促红细胞生成素(EPO)用量/[血红蛋白(g/L)×理想体质量(kg)]。
1.2 方法
1.2.1 实验室检查 生化室常规检测血常规、肾功能、尿酸、钙(Ca)、磷(P)、全段甲状旁腺素(iPTH)、白蛋白、前白蛋白、血脂系列、总铁结合力(TIBC)、不饱和铁结合力(UIBC)、血清铁、转铁蛋白、铁蛋白和高敏C反应蛋白(hsCRP)。转铁蛋白饱和度(TSAT)=血清铁/总铁结合力。电化学发光法检测肌钙蛋白T(cTnT)和氨基末端脑钠肽前体(amino-terminal pro-B-natriuretic peptide, NT-proBNP)。
1.2.2 血清铁调素、晚期氧化蛋白产物(advanced oxidation protein products, AOPP)和IL-6测定 采用酶联免疫吸附法(ELISA)测定。MHD患者周中透析前空腹采血,对照组晨起空腹采血,置血清管,30min内4000r/min,离心半径20cm,离心10min,取血清置-20 ℃冰箱保存备测,检测前标本常温解冻。检测步骤根据试剂盒(武汉Cusabio公司)说明书进行。
1.2.3 颈动脉内膜中层厚度(intima-media thick-ness, IMT)测量 血透结束后患者仰卧位,在颈总动脉远端近分叉部1cm处及颈内动脉起始部上方1cm处后壁进行测量。连续观察颈总动脉及分叉处的横轴和纵轴实时二维图像,取舒张末期图像,从管腔内膜内表面至中膜外表面的垂直距离为颈动脉IMT(Philips SD800超声仪探头频率7.5MHz测定)。
1.2.4 心脏彩超检查 由2位有经验的超声科医师进行(Phillips IE33型彩色多普勒超声心动图仪,探头频率3.5MHz)。患者均在HD结束后2h内左侧卧位,采用美国超声心动图协会推荐方法,测量收缩和舒张期室壁厚度、左心室内径变化和左心室射血分数(left ventricular ejection fraction, LVEF),数据均测3个心动周期,取其平均值。参照文献[3-4]方法计算左心室心肌质量(left ventricular mass, LVM)、左心室质量指数(left ventricular mass index, LVMI)。
1.3 统计学处理
用SPSS 20.0软件进行数据统计分析。正态分布的连续变量采用![]() 表示;偏态分布的连续变量采用中位数(四分位数间距)表示,人口数据用构成比表示。用两独立样本非参数检验、独立样本t检验、 χ2检验比较组间差异。用Spearman相关和线性回归分析(偏态分布资料进行自然对数转换)铁调素与各指标之间的相关性。用二分类Logistic回归分析各指标与CVD的相关性。P<0.05为差异有统计学意义。所有可信区间为95%。
表示;偏态分布的连续变量采用中位数(四分位数间距)表示,人口数据用构成比表示。用两独立样本非参数检验、独立样本t检验、 χ2检验比较组间差异。用Spearman相关和线性回归分析(偏态分布资料进行自然对数转换)铁调素与各指标之间的相关性。用二分类Logistic回归分析各指标与CVD的相关性。P<0.05为差异有统计学意义。所有可信区间为95%。
2.1 患者一般资料
75例血液透析患者,男性40例,女性35例,年龄49~72岁,中位年龄59岁;健康对照组男性11例,女性9例,年龄48~71岁,中位年龄60岁。两组的性别构成和年龄差异无统计学意义。共26例患者发生CVD(34.7%),其中脑梗死8例(30.8%),心肌梗死5例(19.2%),脑出血4例(15.4%),心力衰竭4例(15.4%),心绞痛2例(7.7%),外周血管病2例(7.7%),内瘘闭塞1例(3.8%),MHD患者一般资料见表1。
2.2 血透患者血清铁调素、AOPP及IL-6水平
MHD患者血清铁调素、AOPP及IL-6皆显著高于健康对照组(P<0.05),见表2。
表1 MHD患者血清铁调素与临床及实验室指标相关性的单变量分析
Tab.1 Univariate associations of serum hepcidin with relevant clinical and laboratory parameters in MHD patients

1mmHg=0.133kPa
表2 血透患者及对照组血清铁调素、AOPP及IL-6比较
Tab.2 Comparison of serum hepcidin, AOPP and IL-6 in MHD patients and controls
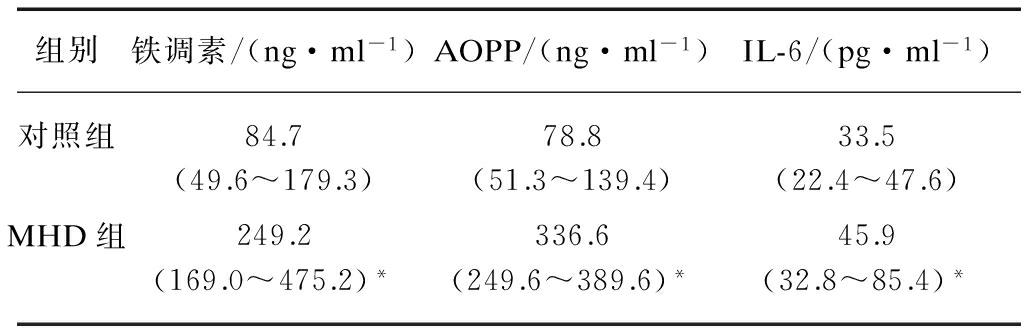
与对照组相比,*P<0.05
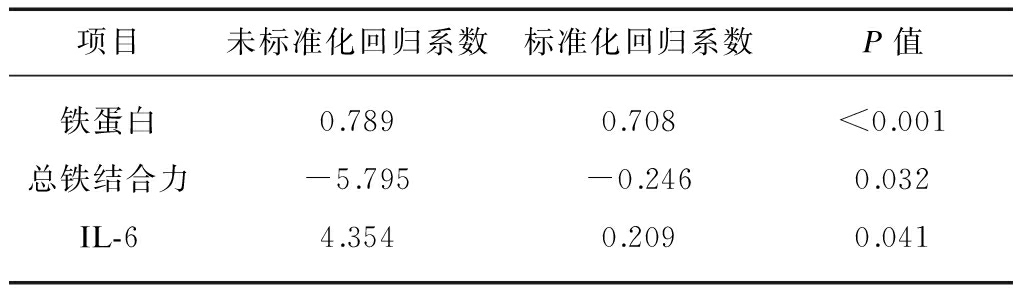
2.3 MHD患者血清铁调素相关因素分析
Spearman相关分析显示血清铁调素与每周EPO剂量、EPO抵抗指数、铁蛋白、TSAT、AOPP、血清hsCRP、IL-6及LVMI呈正相关,与血清前白蛋白、总铁结合力、不饱和铁结合力、转铁蛋白呈负相关,见表1。线性回归分析显示铁蛋白、总铁结合力、IL-6与血清铁调素水平独立相关,见表3。
表3 血透患者血清铁调素与其他指标相关性的线性回归分析
Tab.3 Linear regression analysis of associations between serum hepcidin and laboratory parameters
2.4 CVD患者与非CVD患者血清铁调素水平比较
MHD患者发生CVD者血清铁调素水平明显高于非CVD者[335.9(206.3~514.2)ng/ml vs. 210.5(133.6~392.3)ng/ml,P<0.05]。
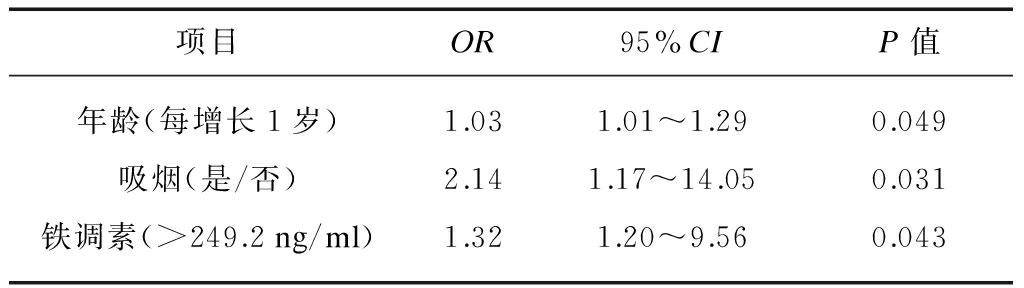
2.5 CVD危险因素的Logistic回归分析
将年龄、性别、糖尿病史、吸烟史、铁蛋白、铁调素、hsCRP、AOPP及IL-6等作为自变量引入回归方程,其中铁蛋白、铁调素、hsCRP、AOPP及IL-6以中位数为界分为两组。二分类Logistic回归分析显示吸烟、高龄及血清铁调素升高为CVD发生的独立危险因素,见表4。
表4 CVD发生危险因素的Logistic回归分析
Tab.4 Binary logistic regression analysis of independent risk factors of CVD
铁调素是一种具有抗细菌和真菌的多肽,其在机体铁代谢平衡的调节中起发挥关键作用[5]。铁调素的表达水平受体内铁水平、炎症、红细胞生成活动及缺氧等因素影响。近年来分别有针对不同人群的研究报道了铁调素与CVD及动脉粥样硬化的关系。这些研究提示铁调素可能通过捕获动脉粥样硬化斑块巨噬细胞中的铁加剧氧化应激从而参与动脉粥样硬化进展,且其可通过铁潴留引起内皮功能障碍[2,6-7]。已有研究通过测定臂踝脉搏波速度显示血液透析患者铁调素-25与患者动脉僵硬度独立相关[2]。van der Weerd等[8]对405例维持性血液透析患者进行了为期3年的随访发现,矫正了炎症因素后铁调素-25与致命及非致命心血管事件相关。针对绝经期妇女的研究[9]显示,由机体铁调素和铁调素与铁蛋白之比决定的机体铁分布,而不是机体总铁负荷在动脉粥样硬化进展中发挥作用。提示血清铁调素可能是CVD新的标志物及治疗靶目标。本研究结果显示MHD患者发生CVD者较非CVD者血清铁调素明显升高,血清铁调素是CVD发生的独立危险因素,与以上研究结果一致。本研究结果显示,铁调素与LVMI呈正相关,考虑可能与铁调素与动脉僵硬度相关,动脉僵硬度增加可引起左心室后负荷增加,长期后负荷增加可引起左心室肥大。此外尚与炎症等因素皆可引起铁调素升高和左心室肥大有关。AOPP是血清白蛋白被次氯酸氧化的产物,是含有双酪氨酸的蛋白交联聚合物。AOPP主要反应蛋白质被氧化的程度。是反映机体氧化应激水平的稳定指标[10]。本研究还显示铁调素与AOPP呈正相关,与文献报道腹膜透析患者铁调素与氧化应激指数及动脉僵硬度呈正相关一致[11]。
本研究结果MHD患者血清铁调素、AOPP及IL-6皆显著高于正常对照组,血清hsCRP显著升高,与既往研究结果一致[12],说明患者体内普遍存在微炎症和氧化应激状态。患者血清铁调素与hsCRP及IL-6呈正相关,说明MHD患者血清铁调素升高与患者体内微炎症状态相关,与文献报道一致[13]。本研究结果显示铁调素与前白蛋白呈负相关,考虑可能与MHD患者体内的微炎症状态造成患者营养不良相关。
本研究结果显示MHD患者血清铁调素与铁蛋白、TSAT呈正相关,与转铁蛋白、总铁结合力及不饱和铁结合力呈负相关,线性回归分析显示铁调素与铁蛋白及总铁结合力独立相关,验证了铁调素与铁的储存及利用密切相关,与我们之前的研究结果及针对非MHD患者的一些研究结果一致[12,14]。铁调素与每周EPO用量和EPO抵抗指数呈正相关,提示铁调素过表达可能是MHD患者产生EPO抵抗的原因之一,降低铁调素水平可能会增加EPO的敏感性。这与动物实验中发现铁调素过表达会消弱机体对EPO的敏感性及一些临床研究结果一致[15]。
总之,铁负荷、炎症状态、铁剂和EPO的应用皆影响MHD患者铁调素表达。患者血清铁调素水平升高与CVD的发生相关。国外已有实验动物模型显示抑制铁调素表达可导致巨噬细胞铁内容物降低,胆固醇外流能力增加,从而泡沫细胞形成减少,动脉粥样硬化减轻[16]。或许抑制铁调素表达会成为MHD患者CVD治疗的新策略。今后需要更大样本量的队列研究来进一步验证铁调素与CVD的关系。
【参考文献】
[1] 徐雁.维持性血液透析患者心血管疾病非传统危险因素分析[D].上海: 复旦大学,2011.
[2] Kuragano T, Itoh K, Shimonaka Y, et al. Hepcidin as well as TNF-alpha are signi cant predictors of arterial stiffness in patients on maintenance hemodialysis[J]. Nephrol Dial Transplant, 2011,26: 2663-2667.
cant predictors of arterial stiffness in patients on maintenance hemodialysis[J]. Nephrol Dial Transplant, 2011,26: 2663-2667.
[3] 徐雁,富秀英,孙美美,等.维持性血液透析患者血清肌钙蛋白T水平的相关影响因素分析[J].中国血液净化,2014,13(7): 497-501.
[4] 徐雁,丁小强,邹建洲,等.维持性血液透析患者血清氨基末端脑钠肽水平与心血管疾病及营养不良的关系[J].肾脏病与透析肾移植杂志,2012,21(5): 439- 443.
[5] Lankhorst CE, Wish JB. Anemia in renal disease: Diagnosis and management[J]. Blood Reviews, 2010,24: 39-47.
[6] Valenti L, Dongiovanni P, Motta BM, et al. Serum hepcidin and macrophage iron correlate with MCP-1 release and vascular damage in patients with metabolic syndrome alterations[J]. Arterioscler Thromb Vasc Biol, 2011,31: 683-690.
[7] Valenti L, Swinkels DW, Burdick L, et al. Serum ferritin levels are associated with vascular damage in patients with nonalcoholic fatty liver disease[J]. Nutr Metab Cardiovasc Dis, 2011,21: 568-575.
[8] van der Weerd NC, Grooteman MPC, Bots ML, et al. Hepcidin-25 is related to cardiovascular events in chronic haemodialysis patients[J]. Nephrol Dial Transplant, 2013,28(12): 3062-3071.
[9] Galesloot TE, Holewijn S, Kiemeney LALM, et al. Serum hepcidin is associated with presence of plaque in postmenopausal women of a general population[J]. Arterioscler Thromb Vasc Biol, 2014,34: 446-456.
[10] Witko-Sarsat V, Friedlander M, Capeillere BC, et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia[J]. Kidney Int, 1996,49(5): 1304-1313.
[11] Ulu SM, Yuksel S, Altuntas A, et al. Associations between serum hepcidin level, FGF-21 level and oxidative stress with arterial stiffness in CAPD patients[J]. Int Urol Nephrol, 2014,46: 753-757.
[12] 徐雁,邹建洲,刘中华,等.血清铁调素与血液透析患者铁负荷及微炎症状态相关[J].上海医学,2012,35(3): 242-246.
[13] Samouilidou E, Pantelias K, Petras D, et al. Serum hepcidin levels are associated with serum trigly-cerides and interleukin-6 concentrationsin patients with end-stage renal disease[J]. Ther Apher Dial, 2014,18(3): 279-283.
[14] Gozdemir E, Kaygusuz I, Kafali H, et al. Is hepcidin a new cardiovascular risk marker in polycystic ovary syndrome[J]? Gynecol Obstet Invest, 2013,75: 196-202.
[15] Rubab Z, Amin H, Abbas K, et al. Serum hecidin levels in patients with end-stage renal disease on hemodialysis[J]. Saudi J Kidney Dis Transpl, 2015,26(1): 19-25.
[16] Saeed O, Otsuka F, Polavarapu R, et al. Pharmacological suppression of hepcidin increases macrophage cholesterol ef ux and reduces foam cell formation and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2012,32: 299-307.
ux and reduces foam cell formation and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2012,32: 299-307.
Relationship of serum hepcidin with cardiovascular disease in maintenance hemodialysis patients
XU Yan, WANG Yu-hong, LIN Shan-li, YI Shao-na, GE Jun, HE Yan-bo
(Dept. of Nephrology, Yantai Hospital Affiliated to Binzhou Medical University, Yantai 264100, Shandong Province, China)
【Abstract】Objective To investigate serum hepcidin level and its relationship with cardiovascular disease(CVD) in maintenance hemodialysis(MHD) patients. Methods Blood samples were obtained from 75 MHD patients before hemodialysis and 20 healthy subjects. Serum hepcidin, advanced oxidation protein products(AOPP) and IL-6 were measured by enzyme-linked immunosorbant assay(ELISA). Spearman correlation and linear regression analysis were used to assess the relationship between serum hepcidin and other parameters. Binary logistic regression analysis was used to assess the relationship between serum hepcidin level and other parameters and CVD in MHD patients. Results Serum hepcidin was significantly higher in MHD patients compared with controls [249.2(169.0-475.2)ng/mlvs. 84.7(49.6-179.3)ng/ml,P<0.05], patients with CVD had higher serum hepcidin levels than those without CVD [335.9(206.3-514.2)ng/ml vs. 210.5(133.6- 392.3)ng/ml, P<0.05]. In MHD patients serum hepcidin level was correlated positively with weekly erythropoietin dose, erythropoietin resistance index, ferritin, transferin saturation, AOPP, high sensitive C reactive protein(hs-CRP), IL-6 and left ventricular mass index; and negatively correlated with serum pre-albumin, total iron-binding capacity, unsaturated iron-binding capacity and transferrin. Linear regression analysis showed that ferritin, total iron-binding capacity and IL-6 were associated hepcidin level. Binary logistic regression analysis showed that higher serum hepcidin level(>249.2ng/ml) was positively and independently associated with CVD (OR=1.32, 95%CI 1.20-9.56, P=0.043). Conclusion Serum hepcidin level is associated with CVD in MHD patients, indicating that it might be a novel biomarker and therapeutic target for CVD.
【Key words】hepcidin; hemodialysis; cardiovascular disease; inflammation; iron
doi:10.16118/j.1008-0392.2016.02.019
收稿日期:2015-06-24
作者简介:徐 雁(1972—),女,副主任医师,博士.E-mail: haoyishengxu@163.com
【中图分类号】R 692.5
【文献标志码】A
【文章编号】1008-0392(2016)02-0082-05