·基础研究·
梁俊娟, 乔晓红, 谢晓恬
(同济大学附属同济医院儿科,上海 200065)
【摘要】目的 探讨骨髓中自然杀伤T细胞(nature killer T cell, NKT)在再生障碍性贫血免疫介导发病机制中的作用。方法 选取14例确诊儿童再生障碍性贫血为再生障碍性贫血组,同年龄正常儿童10例为对照组。流式细胞术检测两组儿童骨髓中NKT含量;利用免疫磁珠法分离纯化NKT细胞后,分别在4种不同体系下进行扩增培养。A: α-Galcer+rhIL-2;B: α-Galcer+rhIL-2+rhG-CSF;C: OCH+rhIL-2;D: OCH+rhIL-2+rhG-CSF。测定NKT细胞在不同培养条件下的扩增倍数;利用酶联免疫斑点技术(Elispot)测定NKT细胞扩增活化后表达IFN-γ、IL-4的斑点形成细胞数(SFCs)。结果 再生障碍性贫血组骨髓中NKT百分率(0.827%±0.022%)明显低于对照组(1.033%±0.073%,Z=-3.810,P=0.000)。在各培养体系中,再生障碍性贫血组和对照组骨髓NKT均可明显扩增。在含有α-Galcer培养体系A和B中,再生障碍性贫血组及对照组NKT细胞的扩增能力均高于OCH体系C和D,差异有统计学意义(P<0.01或P<0.05)。在培养体系中加入rhG-CSF后,再生障碍性贫血组骨髓NKT细胞的扩增能力下降(P<0.01),但表达IFN-γ的SFCs明显减少(P均<0.01);而表达IL-4的SFCs明显升高(P均<0.01)。结论 再生障碍性贫血患儿骨髓NKT的数量和功能均明显低于正常儿童。但再生障碍性贫血骨髓在接受细胞配体(OCH或α-Galcer)+rhIL-2+rhG-CSF作用后,在获得NKT细胞一定程度扩增的同时,提高NKT的IL-4表达,降低NKT的IFN-γ表达,抑制T细胞向Th1分化,而促进T细胞向Th2分化,逆转再生障碍性贫血Th1/Th2异常失衡的免疫介导致病机制,可能成为获得性再生障碍性贫血的有效治疗途径。
【关键词】再生障碍性贫血; 自然杀伤T细胞; α-半乳糖神经酰胺; OCH
再生障碍性贫血(aplasticanemia, AA)是以骨髓造血功能衰竭和全血细胞减少为特征的严重血液病。儿童处于再生障碍性贫血高发年龄段,且重型再生障碍性贫血(severe aplastic anemia, SAA)比例较高,治疗难度大,预后较差[1]。随着基础与临床研究的不断深入,目前对于AA的T淋巴细胞功能异常的“免疫介导”致病机制已基本达成国际共识,认为再生障碍性贫血患者存在Th1细胞优势,通过产生IFN-γ等造血负调控因子,导致骨髓免疫损伤[1-2]。采用抗胸腺细胞球蛋白(ATG)联合环孢菌素A(CSA)等免疫抑制疗法(immunosuppressive therapy, IST)治疗儿童AA已获得一定疗效[3-4],但因临床风险大,显效率有限,且有较高复发率等缺陷,需要进一步探索对于逆转再生障碍性贫血患者T细胞异常的新的有效途径。近年来研究发现,自然杀伤T细胞(natural killer T, NKT)在特异性细胞配体的激活下能够调节Th1/Th2免疫应答,在自身免疫性疾病中的作用已日趋受到国内外学者的关注[5],而有关再生障碍性贫血患者NKT细胞的研究较为罕见。本研究通过研究儿童再生障碍性贫血骨髓中NKT细胞在不同配体和细胞因子刺激培养下的数量和功能改变,探索调节NKT细胞功能在再生障碍性贫血治疗中的潜在价值,为再生障碍性贫血治疗提供新的有效途径。
1.1 研究对象
同济大学附属同济医院儿科2013年3月至2013年12月确诊的获得性再生障碍性贫血患儿14例,中位年龄8岁(2~13岁),其中男6例,女8例;SAA 6例,非重型再生障碍性贫血(NSAA)8例,均经临床、外周血、骨髓细胞形态学、骨髓活检病理学和染色体等检查,符合获得性再生障碍性贫血的诊断标准[6]。因外伤行骨科手术的正常儿童10例为对照组,男6例,女4例,中位年龄7岁(3~11岁),两组年龄、性别差异无统计学意义(P>0.05)。本研究取得医院伦理委员会同意[伦理批号LL(H)0-12-43],并由家长签署知情同意书。
1.2 主要试剂与仪器
人淋巴细胞分离液为上海华精生物高科技有限公司产品;RPMI 1640培养基、胎牛血清购自美国Gibco公司;MS分选柱及Anti-iNKT MicroBeads购自德国Miltenyi公司;HEPA-100 CO2细胞培养箱购自美国Thermo公司;α-半乳糖神经鞘氨醇(α-Galcer)购自美国Alexis公司;OCH及PE标记的CD1d四聚体由美国NIH Tetramer Facility惠赠;FITC标记人CD3单克隆抗体、IFN-γ Elispot试剂盒购自美国eBioscience公司;IL-4 Elispot试剂盒购自瑞典Mabtech公司;FACS Calibur流式细胞仪购自美国BD公司;自动酶联斑点图像分析仪购自美国CTL公司。
1.3 方法
1.3.1 密度梯度离心法制备骨髓单个核细胞(BMMNCs) 无菌采集再生障碍性贫血患儿及对照组儿童骨髓液3~5ml,EDTA抗凝,人淋巴细胞分离液分离BMMNCs,离心半径15cm,2000r/min,离心20min,收集细胞;PBS洗涤2次,离心半径15cm,1500r/min,离心10min,弃上清液后即得到高纯度的BMMNCs悬液,RPMI 1640重悬计数,并取1×105个BMMNCs做流式细胞分析。
1.3.2 免疫磁珠分离法纯化骨髓NKT细胞 将上述制备的BMMNCs 1500r/min,离心半径15cm,离心10min后弃上清液,PBS重悬,加入适量Anti-iNKT MicroBeads(100μl/108个细胞)混匀,按照Anti-iNKT Micro-Beads使用说明书操作步骤提取纯化NKT细胞。
1.3.3 流式细胞术检测磁珠分离前后NKT含量 分别取1×105个免疫磁珠磁分离前的BMMNCs以及分离后的NKT细胞,各加入5μl FITC标记的CD3单抗和PE标记的α-GalCer/CD1d四聚体,标记后行流式细胞术双荧光检测,并设阴性对照。FACS Calibur流式细胞仪进行分析,488nm氩离子激光器激发,根据前向散射角(FSC)和侧向角散射(SSC)散点图,用设门技术(gating),圈出所要分析的淋巴细胞群体,然后检测淋巴细胞上的PE及FITC的荧光强度,数据显示于散点图中。测定时各荧光通道均以相应同种型IgG染色细胞作阴性对照,结果用软件WinMDI 2.9分析。界定α-Galcer/CD1d四聚体-PE及CD3-FITC双阳性表达的细胞为NKT细胞,检测NKT细胞在BMMNCs中的比率及免疫磁珠分离后的纯度。
1.3.4 纯化后NKT的扩增培养 用含80% RPMI 1640+20%胎牛血清的培养基调整纯化的NKT细胞为1×104/ml,于24孔培养板中培养,每孔1ml,每组设3复孔。根据加入不同组合的细胞配体(α-Galcer和OCH)及细胞因子[重组白介素2(rhIL-2)和重组粒系集落刺激因子(rhG-CSF)],将培养体系分为4组。A: α-Galcer+rhIL-2;B: α-Galcer+rhIL-2+rhG-CSF;C: OCH+rhIL-2;D: OCH+rhIL-2+rhG-CSF。各因子的终浓度为α-Galcer 100ng/ml,OCH 100ng/ml, rhIL-2 10U/ml, rhG-CSF 50ng/ml,置于37 ℃、5%CO2及饱和湿度培养箱中培养,每隔2d半量换液并补充上述细胞配体及细胞因子,第7天用计数板法计数扩增活化后的NKT细胞数。
1.3.5 Elispot法检测NKT细胞因子的表达 按照人IL-4 Elispot试剂盒、人IFN-γElispot试剂盒使用说明操作步骤处理扩增活化后的NKT细胞,待斑点形成,室温干燥后使用CTL S5酶联斑点扫描分析仪ImmunoSpot 5.0.3软件分析,测定每105个NKT细胞表达IL-4、IFN-γ的斑点形成细胞数(SFCs)。
1.4 统计学处理
采用SPSS 17.0软件进行分析处理,数据以![]() 表示。两组间资料比较采用t检验或Mann-Whitney检验;多组间均数两两比较采用LSD-t精确检验。P<0.05为差异有统计学意义。
表示。两组间资料比较采用t检验或Mann-Whitney检验;多组间均数两两比较采用LSD-t精确检验。P<0.05为差异有统计学意义。
2.1 再生障碍性贫血组与对照组骨髓中NKT细胞含量的比较
再生障碍性贫血组BMMNCs中NKT细胞的比率为(0.827±0.022)%,较对照组(1.033±0.073)%显著降低(Z=-3.810,P=0.000)。
2.2 免疫磁珠分离后NKT细胞的纯度
经免疫磁珠分离后,利用流式细胞术检测,α-Galcer/CD1d-PE及CD3-FITC双阳性表达的NKT细胞纯度>90%,符合体外扩增培养实验细胞条件。
2.3 骨髓NKT细胞在不同培养体系中扩增倍数对比
细胞配体α-Galcer和OCH均能扩增骨髓NKT细胞,但再生障碍性贫血组和对照组,以及是否采用rhG-CSF,均对NKT细胞扩增存在一定差异。
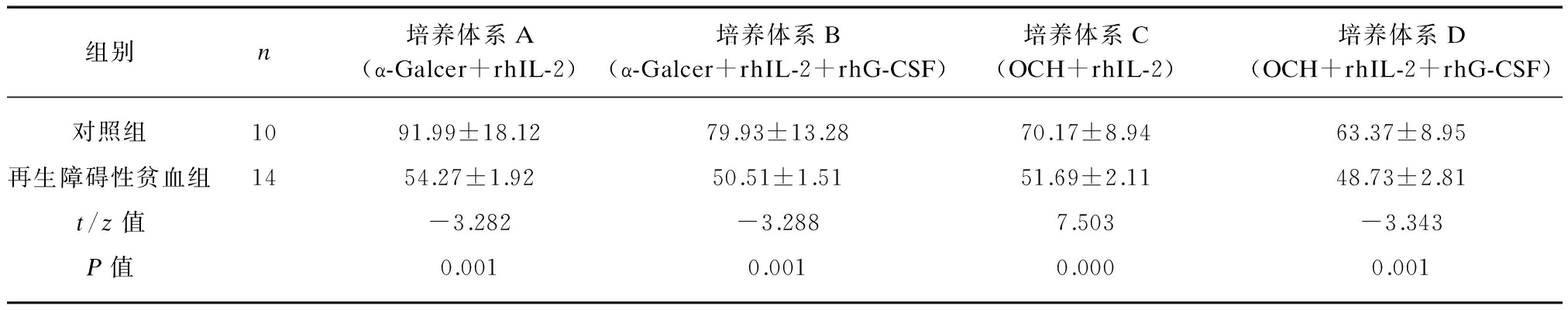
2.3.1 骨髓NKT细胞的扩增 在培养体系A~D中,再生障碍性贫血组和对照组骨髓NKT细胞均有明显扩增,但再生障碍性贫血组的扩增倍数均明显低于对照组(P均<0.01),见表1。
2.3.2 不同细胞配体对NKT细胞扩增能力的影响比较 在配体α-Galcer刺激下,无论是否存在rhG-CSF,NKT细胞的扩增能力均明显高于配体OCH。如对照组及再生障碍性贫血组NKT细胞在培养体系A中的扩增倍数均高于培养体系C,差异有明显统计学意义(t=3.784,P<0.01;t=3.194,P<0.01);对照组及再生障碍性贫血组骨髓NKT细胞在培养体系B中的扩增倍数均高于培养体系D(t=2.873,P<0.01;t=2.203,P<0.05),见表1。
2.3.3 rhG-CSF对NKT细胞扩增能力的影响比较 在含有α-Galcer或OCH的培养体系中加入rhG-CSF后,NKT细胞的扩增倍数均降低。如含α-Galcer培养体系A与B比较,对照组及再生障碍性贫血组的NKT细胞的扩增倍数均明显降低(t=2.090,P<0.05;t=4.652,P<0.01);含OCH的培养体系C与D比较,再生障碍性贫血组NKT细胞的扩增倍数明显降低(t=3.659,P<0.01),而对照组NKT细胞的扩增倍数虽有降低,但差异无统计学意义(t=1.179,P>0.05)。提示细胞因子rhG-CSF可使NKT细胞的扩增能力降低,见表1。
表1 再生障碍性贫血组与对照组NKT细胞在不同培养体系下扩增倍数比较
Tab.1 Amplification multiple of NKT cells from AA and control group under different culture systems![]()
2.4 NKT细胞扩增活化后IFN-γ、IL-4的表达
在培养体系A~D中,再生障碍性贫血组和对照组骨髓NKT细胞经细胞配体α-Galcer和OCH扩增后均能增加表达IFN-γ、IL-4的斑点形成细胞数(SFCs)。但是再生障碍性贫血组和对照组骨髓NKT细胞对于不同细胞配体和细胞因子刺激后产生IFN-γ、IL-4的SFCs存在一定差异。
2.4.1 表达IFN-γ的SFCs数量差异 在对于直接显示α-Galcer或OCH刺激能力的培养体系A和培养体系C进行比较显示,再生障碍性贫血组IFN-γ的SFCs表达分别为33.77±5.04和32.14±5.58,差异无统计学意义(t=0.966,P>0.05),对照组IFN-γ的SFCs表达也无差异(t=1.769,P>0.05);但对照组产生IFN-γ的SFCs均明显高于再生障碍性贫血组(均P<0.01)。然而,在加入rhG-CSF的培养体系B和培养体系D中,再生障碍性贫血组和对照组骨髓NKT细胞产生IFN-γ的SFCs均分别明显低于培养体系A和培养体系C(t=5.114,P<0.01;t=4.810,P<0.01;t=4.539,P<0.01;t=2.702,P<0.05)。说明再生障碍性贫血组产生IFN-γ的SFCs潜力低于对照组,而rhG-CSF可降低IFN-γ的SFCs表达量。可见,再生障碍性贫血骨髓在接受细胞配体(OCH或α-Galcer)+rhIL-2+rhG-CSF作用后,可能在获得NKT细胞一定程度扩增的同时,降低NKT的IFN-γ表达,抑制T细胞向TH1分化,见表2。
表2 再生障碍性贫血组与对照组NKT细胞表达IFN-γ的SFCs
Tab.2 The SFCs expressing IFN-γ of NKT cells from AA and control group![]()

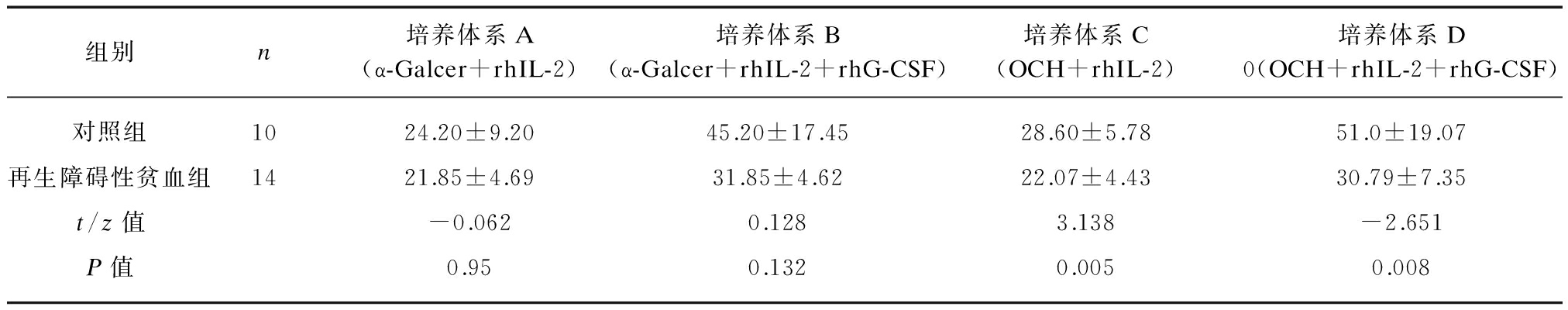
2.4.2 表达IL-4的SFCs数量差异 在对于直接显示α-Galcer或OCH刺激能力的培养体系A和培养体系C进行比较,再生障碍性贫血组IL-4的SFCs表达分别为21.85±4.69和22.07±4.43,差异无统计学意义(t=-0.108,P>0.05),对照组IL-4的SFCs表达也无差异(t=-0.710,P>0.05)。但在含有α-Galcer或OCH的培养体系中加入rhG-CSF后,如培养体系A和培养体系B之比,以及培养体系C和培养体系D之比,均可导致产生IL-4的SFCs显著增高(t=-3.390,P<0.01;t=-4.690,P<0.01;t=-3.520,P<0.01;t=-4.242,P<0.01),见表3。提示再生障碍性贫血骨髓在接受细胞配体(OCH或α-Galcer)+rhIL-2+rhG-CSF作用后,可能在获得NKT细胞一定程度扩增的同时,提高NKT的IL-4表达,促进T细胞向Th2分化。
表3 再生障碍性贫血组与对照组NKT细胞表达IL-4的SFCs
Tab.3 The SFCs expressing IL-4 of NKT cells from AA and control group![]()
NKT细胞为新型的T淋巴细胞亚群,不仅具备T细胞性质,还共表达NK细胞的某些特性[7]。NKT细胞主要识别由非经典的MHC-Ⅰ样分子CD1d提呈的糖脂类抗原,抗原与CD1d分子、T细胞受体形成三联体激活NKT细胞后,能够迅速产生大量的Th1型细胞因子(如IFN-γ、TNF-α等)和Th2型细胞因子(如IL-4、IL-10等),调节T淋巴细胞向Th1或Th2方向分化。根据细胞配体及免疫微环境的不同,NKT细胞产生细胞因子的类型也不同,对T淋巴细胞的分化起了重要调节作用[8]。因此,如能发现通过调节NKT细胞功能,逆转再生障碍性贫血的Th1优势,并使T细胞向Th2分化,则能获得再生障碍性贫血治疗的新的有效途径。目前已有Ⅰ、Ⅱ期临床试验将体外扩增活化后的Vα24+NKT细胞进行体内回输,通过过继细胞免疫疗法行抗肿瘤治疗,已初步获得疗效[9-10],也提示采用NKT细胞扩增和功能调节作为再生障碍性贫血有效疗法的潜在可能性。
NKT细胞的扩增与活化受细胞配体的影响。α-Galcer是目前已知最有效的NKT细胞特异性配体,既往研究显示其同时具有Thl型和Th2型两种免疫反应。通过改变α-Galcer构象衍生而来的NKT细胞配体OCH,被认为具有诱导免疫反应向Th2方向极化的特性。有研究发现在α-Galcer刺激下NKT细胞以IFN-γ的分泌较多,而在OCH刺激下以IL-4分泌为主[11]。Qiao等[2]研究显示,给再生障碍性贫血小鼠腹腔注射OCH后,可降低再生障碍性贫血小鼠血清IFN-γ/IL-4比值,促进NKT细胞向NKT2型细胞转化,经OCH干预后的再生障碍性贫血小鼠血象及骨髓病理均得到明显改善。
本研究显示,通过α-Galcer或OCH刺激培养后,均能获得骨髓NKT细胞明显扩增,并增加表达IFN-γ和IL-4的SFCs。但在培养体系中加入rhG-CSF后,表达IL-4的SFCs显著升高,而表达IFN-γ的SFCs明显降低。提示采用细胞配体(OCH或α-Galcer)+rhIL-2+rhG-CSF作用后,可能在获得NKT细胞一定程度扩增的同时,提高NKT的IL-4表达,促进T细胞向TH2分化,有利于逆转再生障碍性贫血的Th1异常优势,可能成为获得性再生障碍性贫血的有效治疗途径。可能是因为OCH是由α-Galcer的鞘氨醇链被截短衍生而来,故本研究显示OCH对NKT细胞的扩增能力低于α-Galcer,但前期动物实验研究显示OCH可降低再生障碍性贫血小鼠血清IFN-γ/IL-4比值,促进NKT细胞向NKT2型细胞转化,并促进造模再生障碍性贫血小鼠造血功能恢复。经OCH干预后的再生障碍性贫血小鼠血象及骨髓病理均得到明显改善[2、12]。因此,OCH和α-Galcer两者在调节NKT细胞功能,逆转再生障碍性贫血Th1/Th2比例失衡方面的效应差异,仍有待进一步研究予以明确。
【参考文献】
[1] Marsh JCW, Ball SE, Cavenagh J, et al. Guidelines for the diagnosis and management of aplastic anemia[J]. Br J Haematol, 2009,147: 43-70.
[2] Qiao Xiao-hong, Xie Xiao-tian, Jiang Sha-yi, et al. Experimental bone marrow failure in mice ameliorated by OCH via tippling the balance of released cytokines from Th1 to Th2[J]. Immunopharmacol Immunot-oxicol, 2012,34(3): 491-498.
[3] 傅晓燕,谢晓恬,蒋莎义,等.抗胸腺细胞球蛋白治疗儿童再生障碍性贫血的临床研究[J].中华儿科杂志,2011,49(3): 226-230.
[4] Xie Xiaotian, Shi Wei, Zhou Xiaoxun, et al. Comparison of rabbit antithymocyte globulin and Jurkat cell-reactive anti-t lymphocyte globulin as a first-line treatment for children with aplastic anemia[J]. Exp Hematol, 2014,42: 431-438.
[5] Simoni Y, Diana J, Ghazarian L, et al. Therapeutic manipulation of natural killer(NK) T cells in autoimmunity: are we close to reality?[J]. Clini Exp Immunol, 2013,171(1): 8-19.
[6] 张之南,沈悌.血液病诊断及治疗标准[M].3版.北京: 科学出版社,2007: 19-23.
[7] Godfrey DI, Stankovic S, Baxter AG. Raising the NKT cell family[J]. Nat Immunol, 2010,11: 197-206.
[8] Berzins SP, Smyth MJ, Baxter AG. Presumed guilty: natural killer T cell defects and human disease[J]. Nat Rev Immunol, 2011,11(2): 131-142.
[9] Amasaki K, Horiguchi S, Kurosaki M, et al. Induction of NKT Cell-specific immune responses in cancer tissues after NKT cell-targeted adoptive immuno-therapy[J]. Clin Immunol, 2011,138: 255-265.
[10] Richter J, Neparidze N, Zhang L, et al. Clinical regressions and broad immune activation following combination therapy targeting human NKT cells in myeloma[J]. Blood, 2013,121: 423-430.
[11] Lawson V. Turned on by danger: activation of CD1d-restricted invariant natural killer T cells [J]. Immun-ology, 2012,137: 20-27.
[12] 乔晓红,谢晓恬,蒋莎义,等,抗胸腺细胞蛋白与OCH对再生障碍性贫血小鼠治疗作用比较[J].临床儿科杂志,2012,30(5): 464-469.
Bone marrow natural killer T cell activity in children with aplastic anemia
LIANG Jun-juan, QIAO Xiao-hong, XIE Xiao-tian
(Dept. of Pediatrics, Tongji Hospital, Tongji University, Shanghai 200065, China)
【Abstract】Objective To investigate activity of bone marrow nature killer T cell(NKT) and its relation to pathogenesis of aplastic anemia(AA) in children. Methods Fourteen children with aplastic anemia were included in the study and 10 healthy children were selected as controls. The proportion of NKT cells in bone marrow was measured by flow cytometry. Immune magnetic bead separation was used to isolate and purify NKT cells. The purified NKT cells were cultured in four different culture systems.A: α-Galcer and rhIL-2; B: α-Galcer, rhIL-2 and rhG-CSF; C: OCH and rhIL-2; D: OCH, rhIL-2 and rhG-CSF. The amplification of NKT cells after cultured in different systems was calculated. Elispot method was used to analyze the spoting form cells(SFCs) expressing IFN-γ or IL-4. Results The percentage of NKT cells in bone marrow of AA group(0.872%±0.022%) was significantly lower than control group(1.033%±0.073%,Z=-3.810,P=0.000). In each culture system, the bone marrow NKT cells in both groups were significantly amplified. In system A and B containing α-Galcer, the proliferation ability of NKT cells from both AA group and control group were higher than that in C and D(OCH system)(P<0.01 or P<0.05).rhG-CSF decreased the expansion of NKT cells but resulted in decreased SFCs of IFN-γ and elevated SFCs of IL-4 in AA group(P<0.01). Conclusion The quantity and function of NKT cells from children with aplastic anemia are lower than those from healthy children. But NKT cells can be amplified and its function can be improved by interaction with cell ligand OCH or α-Galcer, rhIL-2 and rhG-CSF, which might be a potential therapeutic approach for AA.
【Key words】aplastic anemia; natural killer T cells; α-galactosylceramide; OCH
doi:10.16118/j.1008-0392.2016.02.008
收稿日期:2015-01-26
基金项目:上海市科委重点项目(11JC1411900);上海市卫生局重大项目(2010002)
作者简介:梁俊娟(1987—),女,硕士研究生.E-mail: 517588279@qq.com
通信作者:谢晓恬.E-mail: xtxie@163.com
【中图分类号】R 556+.5
【文献标志码】A
【文章编号】1008-0392(2016)02-0035-05