表1 282例肝病患者的诊断、血清HBV标记物及HBV DNA载量
Tab.1 The diagnoses, serum HBV markers and HBV DNA loads of 282 patients with liver disease
·基础研究·
张占卿1 , 陆 伟1 , 王雁冰1 , 翁齐铖2 , 张智勇2 , 周新兰1
(1. 上海市公共卫生临床中心肝炎二科,上海 201508; 2. 日本富士瑞必欧株式会社上海代表处,上海 200336)
【摘要】目的 探讨血清HBcrAg合理的阴性正常参考值。方法 初治的乙型肝炎患者230例和非乙型肝炎患者52例入选本研究。血清HBcrAg采用化学发光酶免疫法和Fujirebio Lumipulse G1200全自动化学发光免疫系统检测。数据处理和统计分析采用SPSS 16.0软件。结果 血清HBcrAg呈非正态分布(P<0.01)。HBsAg阳性患者血清HBcrAg与HBV DNA呈显著正相关(P<0.01)。血清HBcrAg诊断HBsAg阳性患者的ROC曲线下面积(0.953)显著大于对角参考线下面积(P<0.01)。当血清HBcrAg≥1500U/ml、≥1250U/ml、≥1000U/ml、≥750U/ml、≥500U/ml时,其诊断HBsAg阳性患者的灵敏度和特异度分别为0.865和0.981、0.865和0.962、0.870和0.923、0.896和0.904、0.909和0.885。结论 血清HBcrAg<1000U/ml可能是合理的阴性正常参考值。
【关键词】乙型肝炎核心相关抗原; 化学发光酶免疫法; 正常参考值
乙型肝炎核心抗原(hepatitis B core antigen, HBcAg)仅存在于完整的乙型肝炎病毒(hepatitis B virus, HBV)颗粒,HBV裂解释放的HBcAg极易与血液中预存的抗-HBc结合,因此,检测血清HBcAg的试剂至今未能面世。乙型肝炎e抗原(hepatitis B e antigen, HBeAg)和HBcAg均由HBV前C/C基因编码,其一级结构高度同源。Kimura等[1]和Rokuhara等[2]先后开发和发展了检测血清乙型肝炎核心相关抗原(hepatitis B core-related antigen, HBcrAg)即变性开解为一级结构的HBeAg和HBcAg的EIA(Enzyme immunoassay)和CLEIA(chemiluminescence enzyme immunoassay)试剂;随后,Kimura等[3]发现,CLEIA检测的血清HBcrAg不仅包括HBeAg和HBcAg,而且涵盖HBeAg形成前的中间产物P22cr蛋白。血清HBcrAg的计量单位为U/ml,以大肠埃希菌表达的重组前体HBeAg(pro-HBeAg)为标准,与前体HBeAg 10fg/ml相对应的HBcrAg的免疫反应被定义为1U/ml[1-2]。虽然血清HBcrAg的临床价值正逐步被评价[4-9],但其阴性正常参考值尚未被进一步研究。确定血清HBcrAg阴性正常参考值是进一步合理评价其应用潜能的一个前提条件。本研究就230例乙型肝炎和52例非乙型肝炎肝病患者血清HBcrAg检测的结果,与血清HBV DNA比较,采用受试者工作特征(receiver operating characteristic, ROC)曲线法,探讨血清HBcrAg合理的阴性正常参考值。
1.1 研究对象
2012年1月至2014年12月在上海市(复旦大学附属)公共卫生临床中心住院的初治肝病患者282例,其中乙型肝炎230例,包括急性乙型肝炎8例,慢性乙型肝炎222例;非乙型肝炎52例,包括慢性丙型肝炎14例,非酒精性脂肪肝5例,原因不明肝炎33例。诊断符合中华医学会肝病学分会、感染病学分会《慢性乙型肝炎防治指南(2010版)》,中华医学会肝病学分会、传染病与寄生虫病学分会《丙型肝炎防治指南》,中华医学会肝病学分会《非酒精性脂肪性肝病诊疗指南(2010年修订)》中的标准。HBsAg阳性且HBeAg阳性患者中,男95例,女41例,男∶女 = 2.32∶1;年龄10~66岁,平均(33.90±10.08)岁;HBsAg阳性但HBeAg阴性患者中,男57例,女37例,男∶女= 1.54∶1;年龄17~63岁,平均(41.79±11.28)岁;HBsAg阴性且抗-HBc阴性患者中,男16例,女10例,男∶女 = 1.60∶1;年龄18~86岁,平均(44.27±17.95)岁;HBsAg阴性但抗-HBc阳性患者中,男12例,女14例,男∶女 = 0.86∶1;年龄28~72岁,平均(49.81±12.32)岁,见表1。
表1 282例肝病患者的诊断、血清HBV标记物及HBV DNA载量
Tab.1 The diagnoses, serum HBV markers and HBV DNA loads of 282 patients with liver disease

1.2 血清HBcrAg和HBsAg、HBeAg、HBV DNA检测
早晨空腹采集静脉血,分离血清,-40℃冻存。血标本留用得到了上海市(复旦大学附属)公共卫生临床中心伦理委员会的批准。血清HBcrAg采用化学发光酶免疫法(sensitive chemiluminescence enzyme immunoassay, CLEIA)和Fujirebio Lumip-ulse G1200全自动化学发光免疫系统检测,试剂由Fujirebio株式会社提供,批准文号: SAX5031(日本),检测上限为107IU/ml,如超过检测上限,则血清作10倍稀释后重新检测。血清HBsAg和HBeAg采用化学发光微粒子免疫法(chemiluminescence microparticle imuno-assay, CMIA)和Abbott Architect I2000全自动化学发光免疫系统及其配套试剂检测,正常参考值分别为<0.05IU/ml和<1.0 S/CO;其中HBsAg检测上限为250IU/ml,如超过检测上限,则血清作500倍稀释后重新检测。血清HBV DNA采用Bio-Rad Icycler荧光定量PCR仪检测,试剂购自深圳匹基生物工程有限公司,检测范围5×102~5×107 IU/ml。
1.3 统计学处理
数据处理和统计分析采用SPSS 16.0软件。血清HBcrAg和HBV DNA的正态性检验采用单样本Kolmogorov-Smirnov检验。HBsAg阳性患者血清HBcrAg与HBV DNA之间的相关性采用Pearson相关分析。血清HBcrAg和HBV DNA在血清HBV标记物不同表达模式患者之间的差异比较采用Mann-Whitney U检验。血清HBcrAg和HBV DNA阴性正常参考值的确定采用ROC曲线法,根据ROC曲线确定血清HBcrAg和HBV DNA鉴别HBV感染状态的最佳截断值,计算基于最佳截断值的诊断参数,P<0.05为差异有统计学意义。
2.1 HBsAg阳性患者血清HBcrAg和HBV DNA的分布特征
血清HBcrAg和HBV DNA均表现为非正态分布(Z = 2.451和Z=2.391,P均<0.01),见图1。采用Blom、Tukey、Rankit、Waerden 4种方法进行正态性秩转换,血清HBcrAg和HBV DNA仍表现为非正态分布(Z=2.575和Z=2.078、Z=2.575和Z=2.079、Z=2.573和Z=2.073、Z=2.581和Z=2.088,P均<0.01)。
2.2 HBsAg阳性患者血清HBcrAg与HBV DNA之间的相关性
HBsAg阳性且HBeAg阳性和HBsAg阳性但HBeAg阴性患者,血清HBcrAg与HBV DNA均呈显著正相关(r=0.597,P<0.01和r=0.675, P<0.01);HBsAg阳性患者,血清HBcrAg与HBV DNA呈显著正相关(r=0.787, P<0.01)。
2.3 血清HBcrAg和HBV DNA鉴别HBsAg与HBsAg阴性患者的ROC曲线
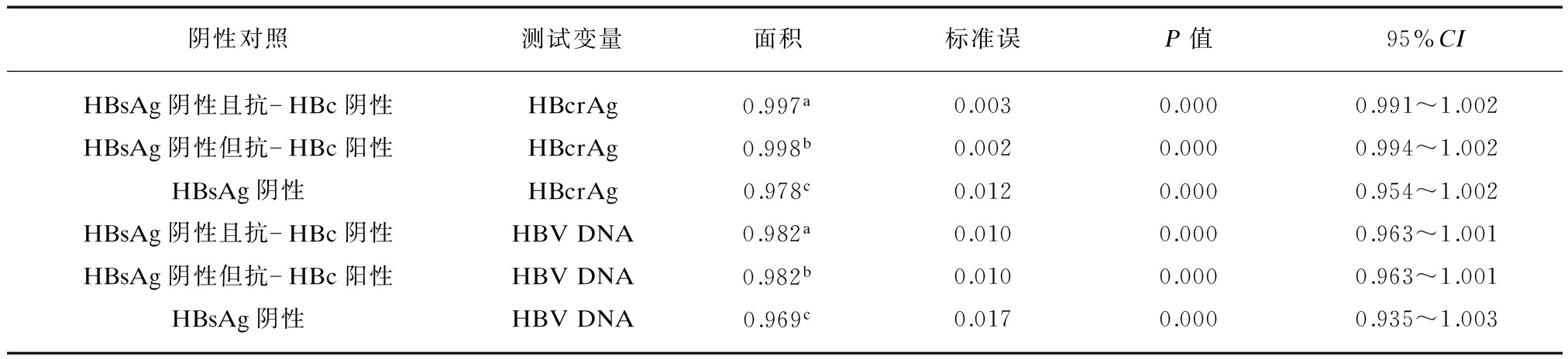
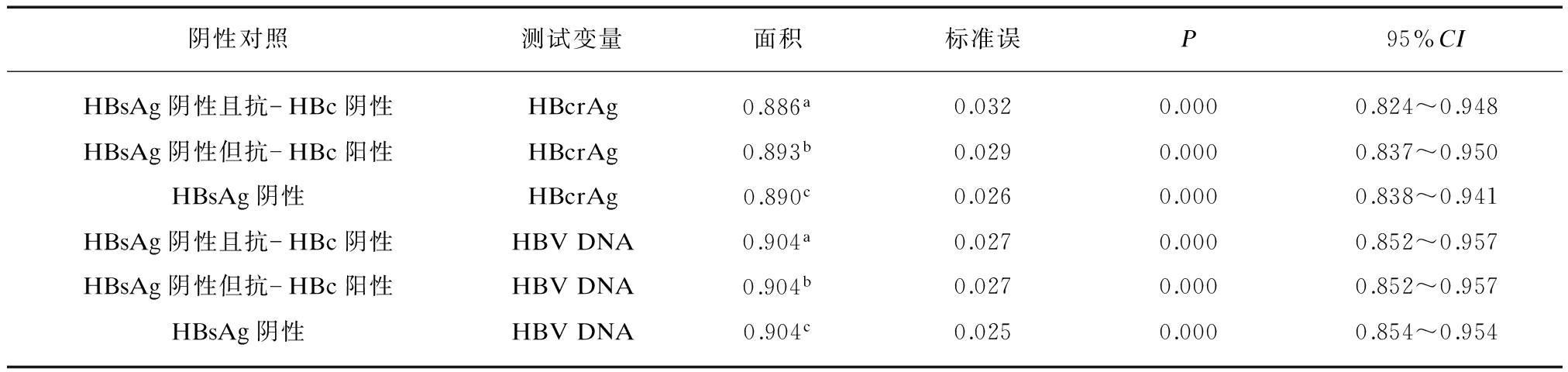
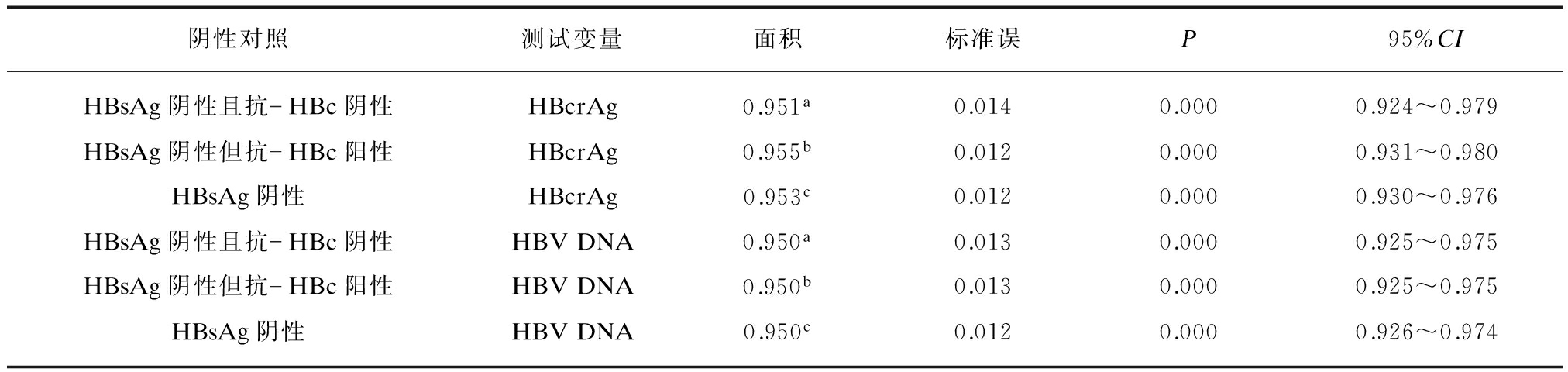
分别以HBsAg阴性且抗-HBc阴性、HBsAg阴性但抗-HBc阳性、HBsAg阴性为对照,血清HBcrAg和HBV DNA诊断HBsAg阳性且HBeAg阳性、HBsAg阳性但HBeAg阴性、HBsAg阳性患者的ROC曲线下面积均显著大于对角参考线下面积(P均<0.01),并且血清HBcrAg与HBV DNA诊断HBsAg阳性且HBeAg阳性、HBsAg阳性但HBeAg阴性、HBsAg阳性患者的ROC曲线下面积之间的差异均无统计学意义(P均>0.05),见表2~4,图1A~C。
基于HBsAg阴性且抗-HBc阴性、HBsAg阴性但抗-HBc阳性、HBsAg阴性对照的血清HBcrAg诊断HBsAg阳性且HBeAg阳性与HBsAg阳性但HBeAg阴性患者的ROC曲线下面积之间的差异有统计学意义(Z=3.454、Z=3.612、Z=3.073,P均<0.01),血清HBV DNA诊断HBsAg阳性且HBeAg阳性与HBsAg阳性但HBeAg阴性患者的ROC曲线下面积之间的差异也有统计学意义(Z=2.709、Z=2.709、Z=2.150,P均<0.01)。
表2 血清HBcrAg和HBV DNA诊断HBsAg阳性且HBeAg阳性患者的ROC曲线下面积
Tab.2 Areas under the ROC curves of serum HBcrAg and HBV DNA for diagnosing HBsAg-positive with HBeAg-positive patients
a: Z = 0.811, P = 0.418; b: Z = 0.885, P = 0.373; c: Z = 0.244, P = 0.803
表3 血清HBcrAg和HBV DNA诊断HBsAg阳性但HBeAg阴性患者的ROC曲线下面积
Tab.3 Areas under the ROC curves of serum HBcrAg and HBV DNA for diagnosing HBsAg-positive with HBeAg-negative patients
a: Z = 0.243, P = 0.810; b: Z = 0.157, P = 0.873; c: Z = 0.219, P = 0.826
表4 血清HBcrAg和HBV DNA诊断HBsAg阳性患者的ROC曲线下面积
Tab.4 Areas under the ROC curves of serum HBcrAg and HBV DNA for diagnosing HBsAg-positive patients
a: Z=0.030, P=0.976; b: Z=0.159, P=0.873; c: Z=0.100, P=0.920

图1 血清HBcrAg和HBV DNA鉴别HBsAg阳性与HBsAg阴性患者的ROC曲线
Fig.1 ROC curves of serum HBcrAg and HBV DNA for discriminating HBsAg-positive and HBsAg-negative patients
(1) 测试变量: A: HBsAg阳性且HBeAg阳性,B: HBsAg阳性但HBeAg阴性,C: HBsAg阳性;(2) 阴性对照: HBsAg阴性
2.4 血清HBcrAg和HBV DNA鉴别HBsAg阳性与HBsAg阴性患者的最佳截断值及对应的诊断参数
分别以HBsAg阴性且抗-HBc阴性、HBsAg阴性但抗-HBc阳性、HBsAg阴性为对照,血清HBcrAg诊断HBsAg阳性且HBeAg阳性患者的最佳截断值分别为≥1875U/ml、≥1327U/ml、≥1648U/ml,其对应的灵敏度和特异度分别为0.993和0.962、0.993和0.962、0.982和0.962;诊断HBsAg阳性但HBeAg阴性患者的最佳截断值分别为≥649U/ml、≥548U/ml、≥849U/ml,其对应的灵敏度和特异度分别为0.766和0.923、0.787和0.885、0.755和0.923;诊断HBsAg阳性患者的最佳截断值分别为≥649U/ml、≥1648U/ml、≥1648U/ml,其对应的灵敏度和特异度分别为0.900和0.923、0.865和1.000、0.865和0.981。见表5~7。
血清HBV DNA诊断HBsAg阳性且HBeAg阳性患者的最佳截断值分别为≥569IU/ml、≥569IU/ml、≥561IU/ml,其对应的灵敏度和特异度分别为0.963和1.000、0.963和1.000、0.969和0.981;诊断HBsAg阳性但HBeAg阴性患者的最佳截断值分别为≥515IU/ml、≥515IU/ml、≥515IU/ml,其对应的灵敏度和特异度分别为0.809和1.000、0.809和1.000、0.809和1.000;诊断HBsAg阳性患者的最佳截断值分别为≥515IU/ml、≥515IU/ml、≥515IU/ml时,其对应的灵敏度和特异度分别为0.900和1.000、0.900和1.000、0.900和1.000,见表5~7。
表5 血清HBcrAg和HBV DNA鉴别血清HBsAg阳性且HBeAg阳性与HBsAg阴性患者的最佳截断值及其对应的诊断参数
Tab.5 Optimal cutoffs and the corresponding diagnostic parameters of serum HBcrAg and HBV DNA for discriminating HBsAg-positive with HBeAg-positive patients
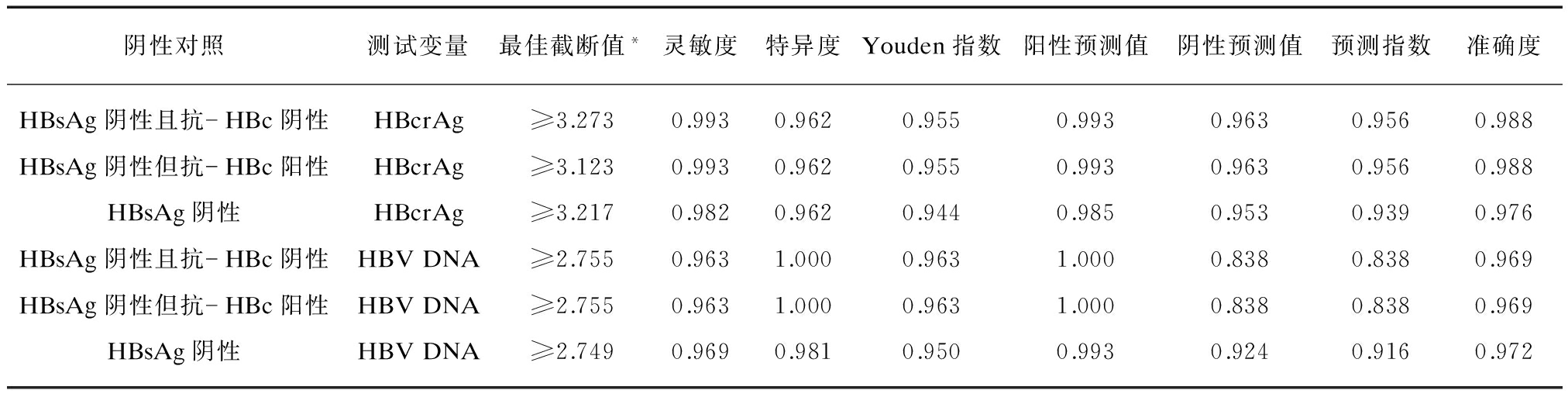
*计量单位: HBcrAg: log10 U/ml; HBV DNA: log10 IU/ml
表6 血清HBcrAg和HBV DNA鉴别血清HBsAg阳性但HBeAg阴性与HBsAg阴性患者的最佳截断值及其对应的诊断参数
Tab.6 Optimal cutoffs and the corresponding diagnostic parameters of serum HBcrAg and HBV DNA for discriminating HBsAg-positive with HBeAg-negative patients

*计量单位: HBcrAg: log10 U/ml; HBV DNA: log10 IU/ml
表7 血清HBcrAg和HBV DNA鉴别血清HBsAg阳性与HBsAg阴性患者的最佳截断值及其对应的诊断参数
Tab.7 Optimal cutoffs and the corresponding diagnostic parameters of serum HBcrAg and HBV DNA for discriminating HBsAg-positive and HBsAg-negative patients
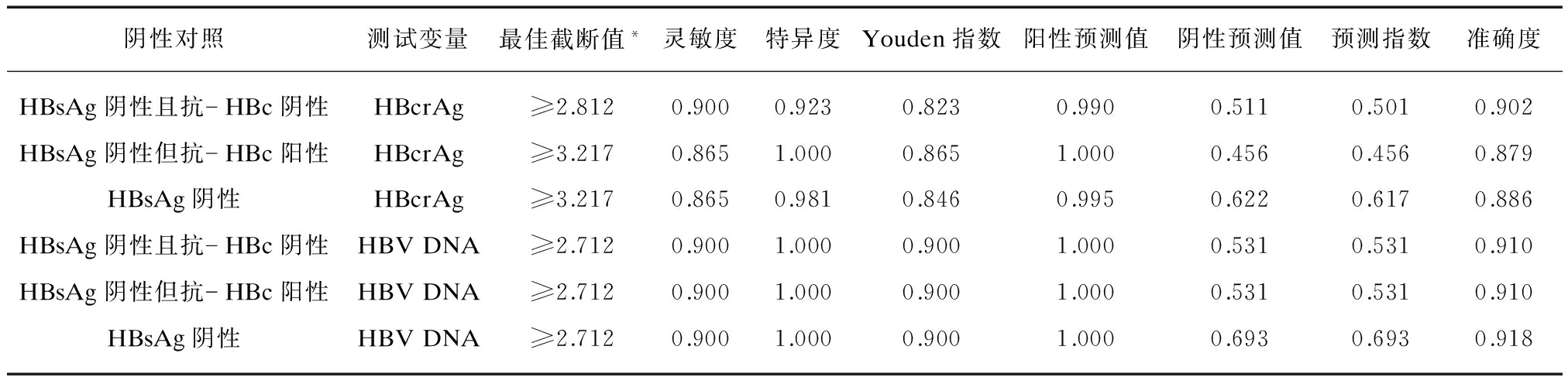
*计量单位: HBcrAg: log10 U/ml; HBV DNA: log10 IU/ml
2.5 血清HBcrAg和HBV DNA鉴别HBsAg阳性与HBsAg阴性患者的合理截断值及对应的诊断参数
以HBsAg阴性为对照,当血清HBcrAg≥1500U/ml、≥1250U/ml、≥1000U/ml、≥750U/ml、≥500U/ml时,其诊断HBsAg阳性患者的灵敏度和特异度分别为0.865和0.981、0.865和0.962、0.870和0.923、0.896和0.904、0.909和0.885;当血清HBV DNA≥500IU/ml时,其诊断HBsAg阳性患者的灵敏度和特异度分别为0.900和1.000,见表8。
表8 血清HBcrAg鉴别血清HBsAg阳性与HBsAg阴性患者的截断值及其对应的诊断参数
Tab.8 Cutoffs and the corresponding diagnostic parameters of serum HBcrAg for discriminating HBsAg-positive and HBsAg-negative patients

初步的应用研究[2,4-9,10]认为,慢性乙型肝炎患者血清HBcrAg水平与血清HBV DNA载量和肝组织内HBV DNA、HBV cccDNA含量均呈显著正相关;在核苷(酸)类药物治疗过程中,血清HBcrAg水平动态变化与血清HBV DNA载量保持平行,但其变化幅度小于血清HBV DNA;血清HBcrAg水平的动态变化对核苷(酸)类药物治疗中的耐药和停药后复发有预测作用。最近,Seto等[11]采用Lumipulse G1200检测了349例慢性HBV感染者的血清HBcrAg水平,结果显示,从免疫耐受期、经免疫激活期到免疫控制期,血清HBcrAg水平逐步降低;但从免疫控制期到免疫再激活期,血清HBcrAg水平有所升高;血清HBcrAg水平在免疫耐受期与免疫激活期、免疫激活期与免疫控制期、免疫控制期与免疫再激活期之间的差异均有统计学意义。提示血清HBcrAg定量检测有预测慢性HBV感染状态和潜在的预测慢性乙型肝炎疾病状态的效能。
血清HBcrAg定量检测性能评价的研究文献较少。Kimura等[1]的开发研究指出,血清HBcrAg的检测范围为4×102~1×107U/ml;批内和批间变异系数分别为9.8%~11.3%和4.3%~12.7%;108例HBsAg阴性且HBV DNA阴性健康对照和丙型肝炎患者的血清HBcrAg均<8.9×102U/ml,其平均值分别为(4.5±1.3)U/ml和(4.5±1.0)U/ml。因此,研究者将血清HBcrAg的阴性正常参考值暂定为1×103U/ml。最近,Park等[12]对血清HBcrAg Lumipulse G1200定量检测的性能进行了再评价,检测高水平HBcrAg混合血清(平均HBcrAg: 312.74kU/ml)的批内、批间和日间变异系数分别为3.1%、2.9%和1.4%,低水平HBcrAg混合血清(平均HBcrAg: 0.13kU/ml)的批内、批间和日间变异系数分别为39.8%、34.7%和2.0%;但是,受高水平和低水平血清HBcrAg样本数量的限制,研究者对血清HBcrAg的线性范围未做验证。提示Fujirebio Lumipulse G1200检测低水平血清HBcrAg的精度有限。
有限的血清HBcrAg定量检测性能评价的研究[1,12]是基于血清HBcrAg的正态分布,但是,研究者对血清HBcrAg的分布特征未做描述。本研究显示,血清HBcrAg(log10U/ml)或HBV DNA(log10IU/ml)均表现为非正态分布;无论HBeAg阳性或阴性HBV感染者,血清HBcrAg与HBV DNA均呈显著正相关;不考虑HBeAg状态,血清HBcrAg与HBV DNA呈高度正相关。因此,采取ROC曲线法确定血清HBcrAg的阴性正常参考值应当是更合理的方法。
本研究分别以HBsAg阴性且抗-HBc阴性、HBsAg阴性但抗-HBc阳性、HBsAg阴性作为阴性对照,以HBsAg阳性且HBeAg阳性和HBsAg阳性且HBeAg阴性作为HBV感染的状态变量,绘制ROC曲线,结果显示,虽然基于三类阴性对照人群的血清HBcrAg与HBV DNA诊断HBsAg阳性且HBeAg阳性和HBsAg阳性但HBeAg阴性感染的ROC曲线下面积之间的差异均无统计学意义,但基于同类阴性对照人群的血清HBcrAg和HBV DNA诊断HBsAg阳性且HBeAg阳性与HBsAg阳性但HBeAg阴性感染的ROC曲线下面积之间的差异均有统计学意义;基于Youden指数确定的基于同类阴性对照人群的血清HBcrAg诊断HBsAg阳性且HBeAg阳性与HBsAg阳性且HBeAg阴性感染的最佳截断值的差异较大,而血清HBV DNA诊断HBsAg阳性且HBeAg阳性与HBsAg阳性且HBeAg阴性感染的最佳截断值的差异较小,提示与血清HBV DNA相比,血清HBcrAg诊断HBV感染的阴性参考值的变异相对较大。
Seto等[11]的研究曾将血清HBcrAg阴性正常参考值设定为<100U/ml,但缺乏相关的文献支持。本研究对血清HBcrAg≥1500U/ml、≥1250U/ml、≥1000U/ml、≥750U/ml、≥500U/ml 诊断HBsAg阳性患者的灵敏度、特异度和准确度进行比较的结果指出,将HBcrAg≥1000U/ml 或≥750U/ml 诊断HBsAg阳性患者的稳定性较好。本研究结果支持HBcrAg定量检测性能评价研究[12]和开发研究[1]的结论: 与血清HBV DNA相比,CLEIA检测低水平的血清HBcrAg的精度有限;血清HBcrAg<1000U/ml可能是合理的阴性正常参考值。
【参考文献】
[1] Kimura T, Rokuhara A, Sakamoto Y, et al. Sensitive enzyme immunoassay for hepatitis B virus core-related antigens and their correlation to virusload[J]. J Clin Microbiol,2002, 40(2): 439-445.
[2] Rokuhara A, Tanaka E, Matsumoto A, et al. Clinical evaluation of a new enzyme immunoassay for hepatitis B virus core-related antigen; a marker distinct from viral DNA for monitoring lamivudine treatment[J]. J Viral Hepat, 2003, 10(4): 324-330.
[3] Kimura T, Ohno N, Terada N, et al. Hepatitis B virus DNA-negative dane particles lack core protein but contain a 22-kDa precore protein without C-terminal arginine-rich domain[J]. J Biol Chem, 2005,280(23): 21713-21719.
[4] Rokuhara A, Sun X, Tanaka E, et al. Hepatitis B virus core and core-related antigen quantitation in Chinese patients with chronic genotype B and C hepatitis B virus infection[J]. J Gastroenterol Hepatol, 2005,20(11): 1726-1730.
[5] Suzuki F, Miyakoshi H, Kobayashi M, et al. Correlation between serum hepatitis B virus core-related antigen and intrahepatic covalently closed circular DNA in chronic hepatitis B patients[J]. J Med Virol, 2009,81(1): 27-33.
[6] Matsumoto A, Tanaka E, Minami M et al. Low serum level of hepatitis B core-related antigen indicates unlikely reactivation of hepatitis after cessation of lamivudinetherapy[J]. Hepatol Res, 2007,37(8): 661-666.
[7] Tanaka E, Matsumoto A, Yoshizawa K, et al. Hepatitis B core-related antigen assay is useful for monitoring the antiviral effects of nucleoside analoguetherapy[J]. Intervirology, 2008,51(Suppl 1): 3-6.
[8] Hosaka T, Suzuki F, Kobayashi M, et al.HBcrAg is a predictor of post-treatment recurrence of hepatocellular carcinoma during antiviral therapy[J]. Liver Int, 2010,30(10): 1461-1470.
[9] Okuhara S, Umemura T, Joshita S, et al. Serum levels of interleukin-22 and hepatitis B core-related antigen are associated with treatment response to entecavir therapy in chronic hepatitisB[J]. Hepatol Res, 2014,44(10): E172- E180.
[10] Wong DKH, Tanaka Y, Lai CL, et al.Hepatitis B virus core-related antigens as markers for monitoring chronic hepatitis B Infection[J]. J Clin Microbiol, 2007,45(12): 3942-3947.
[11] Seto WK, Wong DK, Fung J, Linearized hepatitis B surface antigen and hepatitis B core-related antigen in the natural history of chronic hepatitisB[J]. Clin Microbiol Infect, 2014,20(11): 1173-1180.
[12] Park Y, Hong DJ, Shin S, et al. Performance evaluation of new automated hepatitis B viral markers in the clinical laboratory: two quantitative hepatitis B surface antigen assays and an HBV core-related antigen assay[J]. Am J Clin Pathol, 2012,137(5): 770-777.
Negative normal reference value of serum hepatitis B core-related antigen
ZHANG Zhan-qing1, LU Wei1, WANG Yan-bing1, WENG Qi-cheng2, ZHANG Zhi-yong2, ZHOU Xin-lan1
(1. Division Ⅱ of Department of Hepatology, Shanghai Public Health Clinical Center, Fudan University, Shanghai 201508, China; 2. Shanghai Representative Office, Fujirebio Incorporation of Japan, Shanghai 200336, China)
【Abstract】Objective To explore the rational negative normal reference value of serum hepatitis B core-related antigen (HBcrAg). Methods Two hundred and thirty patients with Naïve hepatitis B and 52 non- hepatitis B patients were enrolled in the study. Serum HBcrAg levels were measured by Fujirebio Lumipulse G1200 automatic chemiluminescence immunoassay system. SPSS 16.0 software was used for data processes and statistical analyses. Results Serum HBcrAg values were non-normal distribution (P<0.01). Serum HBcrAg values were positively correlated with HBV DNA in HBsAg-positive patents (P<0.01). The area under ROC curve of serum HBcrAg in the diagnosis of HBsAg-positive patients was 0.953. When the cut-off values of serum HBcrAg were taken as 1500U/ml, 1250U/ml, 1000U/ml, 750U/ml, 500U/ml, the sensitivity and specificity in diagnosis of HBsAg-positive patients were 0.865 and 0.981, 0.865 and 0.962, 0.870 and 0.923, 0.896 and 0.904, 0.909 and 0.885. Conclusion Serum HBcrAg<1000U/ml may be the reasonable negative normal reference value.
【Key words】hepatitis B core-related antigen; chemiluminescence enzyme immunoassay; normal reference
doi:10.16118/j.1008-0392.2016.02.006
收稿日期:2015-12-02
基金项目:上海市卫生和计划生育委员会重点科研项目(20134032);国家传染病“十二五”科技重大专项(2013ZX10002005)
作者简介:张占卿(1964—),男,主任医师,硕士.E-mail: doctorzzqsphc@163.com
【中图分类号】R 512.6+2
【文献标志码】A
【文章编号】1008-0392(2016)02-0024-07