·基础研究·
Drak2在高糖诱导胰岛β细胞凋亡中的作用
王广宇1, 吴国亭2
(1. 上海市普陀区人民医院内分泌科,上海 200060; 2. 同济大学附属第十人民医院内分泌科,上海 200072)
【摘要】目的 探讨Drak2在高糖诱导的胰岛β细胞凋亡中的作用。方法 不同浓度葡萄糖诱导刺激,模拟体外胰岛细胞糖毒性损伤后的细胞凋亡模型,通过CCK8检测葡萄糖作用后细胞的存活率;Western印迹法检测不同糖浓度时Drak2的表达情况,完成糖浓度的筛选。构建Drak2-pcDNA3.0质粒,应用基因转染技术构建Drak2过表达可诱导细胞系,Western印迹法分析糖诱导前后胰岛β细胞Drak2的表达。Real-Time PCR测定Drak2、Bax、Bcl-2的mRNA水平,流式细胞法测定诱导前后的凋亡情况。结果 CCK8结果显示,随着培养液中糖浓度上升,Rinm 5mf凋亡逐渐增加,随着时间的增加(24、48、72h)凋亡也逐渐增加,呈一定的量效关系。Western印迹法显示在糖浓度22.2mmol/L培养72h时,Drak2的表达量最多。构建Drak2过表达,在转染6h后开始葡萄糖诱导,在高糖诱导72h时过表达组Drak2蛋白是正常组的6倍。Real-Time PCR显示,过表达组Drak 2 mRNA在葡萄糖诱导前开始增加,在高糖诱导72h时增高明显(P<0.05),凋亡相关基因BAX、Bcl-2表达均有增加(P<0.05)。流式细胞仪检测显示高糖诱导后,过表达组凋亡率明显高于正常组(P<0.05)。结论 Drak 2过表达促进高糖诱导的胰岛β细胞凋亡。
【关键词】Drak2; 葡萄糖; β细胞; 凋亡
无论1型糖尿病还是2型糖尿病,诊断时β细胞已丧失50%~80%,β细胞数量减少与细胞凋亡有关,糖尿病时胰岛β细胞凋亡加速[1-2],在糖尿病的早期由于胰岛素抵抗导致胰岛β细胞功能增强,胰岛细胞的负荷加重;随着病情的进展,胰岛β细胞的功能逐渐衰竭,主要表现为细胞功能降低和细胞数目减少,现已发现高糖、高脂和某些细胞炎性介质如TNF-α等是诱导胰岛β细胞功能衰竭的重要因素。DAP凋亡诱导激酶2(Drak2)是丝氨酸苏氨酸蛋白激酶家族,有研究发现Drak2在T细胞凋亡中起着相当重要的作用[3-4],而T细胞与其他细胞的凋亡,如胰岛β细胞凋亡等有很大的共性。本研究旨在探讨Drak2在高糖诱导的β细胞凋亡中的作用。
1 材料与方法
1.1 试剂与仪器
Rin m5f细胞株购自美国ATCC公司,DMEM高糖培养基购自美国Hyclone公司,反转录试剂盒购自美国ABI公司,限制性内切酶(EcoRI、BamHI)、CIAP、T4 DNA连接酶购自日本TaKaRa公司,TOP10感受态细胞、质粒小量抽提试剂盒购自中国天根生化公司,SYBR GREEN购自美国ABI公司,BCA蛋白浓度测定试剂盒购自上海西唐生物科技有限公司。
1.2 细胞培养
选用Rin m5f细胞株,采用DMEM高糖培养基,添加15%胎牛血清,1%Hepes缓冲液及1%青链双抗,于37℃含5%CO2条件下培养。
1.3 过表达质粒的构建
过表达质粒采取PC-DNA3.0载体,细胞提取RNA并反转录后,针对DRAK2全长序列设计PCR引物并加入BamHI及EcoRI酶切位点,PCR取得DRAK2基因并测序正确后,对载体及PCR产物双酶切4h,去磷酸化0.5h,纯化后连接过夜取连接产物转化TOP10感受态细胞,涂LB培养板(含AMP抗性培养基)培养过夜,挑单克隆菌落,170r/min摇菌12h,抽提质粒,测序正确后备用。
1.4 细胞转染
选择对数生长期细胞作为转染细胞。转染前1d,在不包含抗生素的培养基中接种细胞,转染时细胞的汇合度要达到30%~50%。对每孔细胞,用无血清培养基稀释质粒至250μl,温和混匀,室温静置5min;用无血清培养基稀释脂质体至250μl,温和混匀室温静置5min;将质粒和脂质体混合(总体积 500μl),室温孵育 20min;将 500μl 脂质体-DNA复合物加入Rin-m5f细胞,摇动培养板,轻轻混匀;CO2培养箱中37℃培养6h,弃去无血清培养基,换成2ml完全培养基。
1.5 糖毒性筛选试验
指数生长期的细胞收集计数后,(3~4)×105/ml接种96孔板,使其葡萄糖终浓度分别为: 0、5.5、11.1、22.2、33.3、44.4和 55.5mmol/L。分别培养1、2、3d,用于细胞增殖能力检测。各孔均设3各复孔。Western印迹法检测初筛的不同葡萄糖浓度作用不同时间时Drak2蛋白的表达情况,选择一个最适的培养时间和浓度。
1.6 CCK-8实验
上述Rin-m5f细胞经不同葡萄糖作用后及后续转染后,每孔加入10μl的CCK8溶液,37℃孵育4h;使用酶标仪450nm波长测定各孔的吸光度值(D450),计算出3个平行孔的均值。计算细胞存活率: 以不加糖的空白对照,即浓度为0孔的D450为对照,细胞存活率=实验组D450/对照组D450×100%。
1.7 Real-Time PCR检测Drak2、Bax、Bcl-2 mRNA的表达
6孔板细胞抽提RNA并反转录后,使用ABI Prism 7900HT型荧光定量PCR仪,通过SYBR GREEN法测Drak2、Bcl-2、Bax基因mRNA表达水平,以GAPDH为内参,10μl反应体系,OPN引物序列上游5′-TCTGATGAGACCGTCACTGC-3′,下游5′-ACGGAGTCTGATAGAGTAGG-3′。反应条件如下: 95℃ 5min预变性,95℃ 15s,65℃ 35s,共40个循环。
1.8 Western 印迹法检测Drak2蛋白的表达
提取总蛋白后,蛋白定量采用BCA蛋白定量法,进行蛋白变性(20μl,5×SDS-PAGE loading buffer,10μl mol/L DTT,70μl 样品,100℃沸水5min),SDS-PAGE电泳,转膜(湿转),封闭与抗体杂交,显影、定影。
1.9 统计学处理
SPSS 13.0软件处理数据。组间差异采用方差分析,各实验组与对照组比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 高糖对Rin-m5f细胞存活的影响
不同浓度的葡萄糖(0、5.5、11.1、22.2、33.3、44.4、55.5mmol/L)作用于Rin-m5f细胞(24、48、72h),随着葡萄糖浓度的增加,Rin-m5f的存活率下降,提示葡萄糖可抑制Rin-m5f细胞的生长,并呈现一定的量效关系,且同一作用时间各浓度的细胞存活率与对照组(葡糖糖浓度为0mmol/L)相比,差异有统计学意义(P<0.05)。
2.2 Drak2蛋白在不同糖浓度、不同时间作用下的表达情况
CCK8结果显示,Drak2蛋白表达在11.1mmol/L、22.2mmol/L、33.3mmol/L差异有统计学意义,Rin-m5f细胞分别在三者浓度作用下培养24、48、72h,结果显示Rin-m5f细胞在糖浓度为22.2mmol/L、培养72h时,Drak2蛋白表达量最大,见图1。后续诱导实验都是以此为标准。
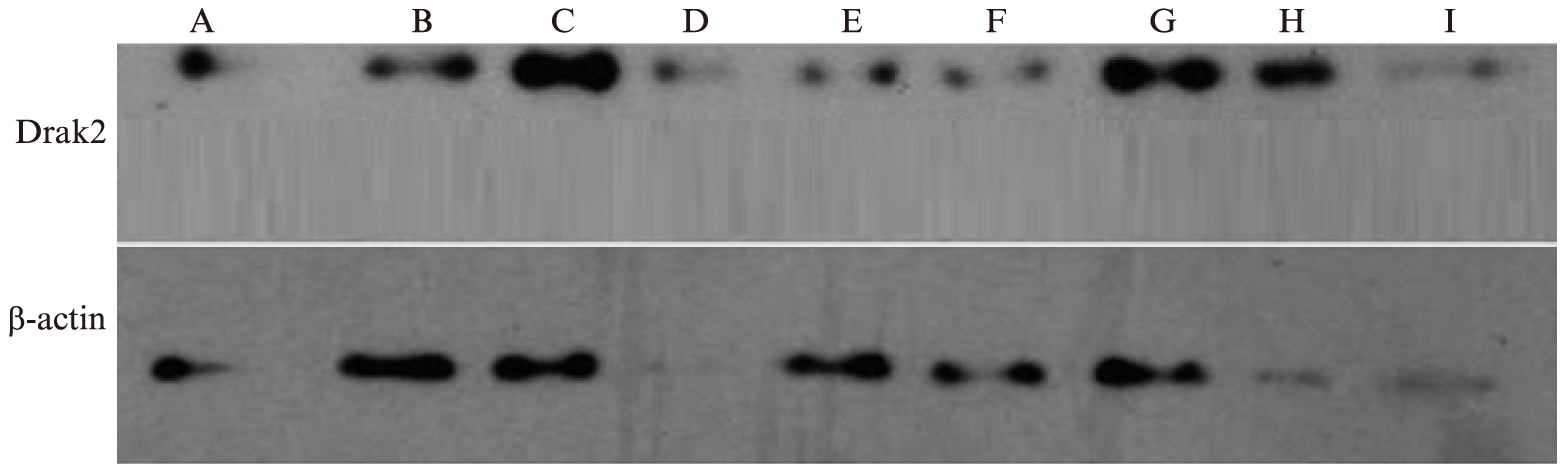
图1 不同糖浓度作用不同时间Drak2蛋白的表达
Fig.1 Expressions of Drak2 protein in different glucose concentration and different time
A: 11.1mol/L葡萄糖培养24h;B: 11.1mol/L葡萄糖培养48h;C: 33.3mol/L葡萄糖培养24h;D: 22.2mol/L葡萄糖培养24h;E: 22.2mol/L葡萄糖培养48h;F: 33.3mol/L葡萄糖培养48h;G: 11.1mol/L葡萄糖培养72h;H: 22.2mol/L葡萄糖培养72h;I: 33.3mol/L葡萄糖培养72h
2.3 转染中脂质体浓度、质粒浓度的筛选
转染时分别将质粒4、6、8、10μl稀释至250μl,脂质体分别由4、6、8、10μl稀释至250μl,6h后更换完全培养基,24h后评价转染效率,发现质粒和脂质体都为6μl时转染效率最高,而在两者浓度为10μl 时细胞存活率非常低,可能是由于脂质体浓度高,对细胞的毒性所致,见图2。
图2 转染后摄片
Fig.2 The image after transfection
A: 普通光;B: 荧光;脂质体和质粒均为6μl
2.4 Real-Time PCR检测Drak2、Bax、Bcl-2 mRNA的表达
Rin-m5f细胞正常组、阴性对照组、过表达组、阳性对照组葡萄糖诱导前后Real-Time PCR检测Drak2、Bax、Bcl-2 mRNA的相对表达,计算过表达组与对照组的扩增倍数,Real-Time PCR结果显示,Drak2 mRNA在葡萄糖诱导前过表达组就开始增加,在高糖诱导72h时,增高明显(P<0.05),凋亡相关基因Bax、Bcl-2表达均有增加(P<0.05),见表1。
表1 葡萄糖诱导前后不同组Dark2、Bax及Bcl-2 mRNA表达
Tab.1 Dark2, Bax and Bcl-2 mRNA expression in different groups before and after glucose induction
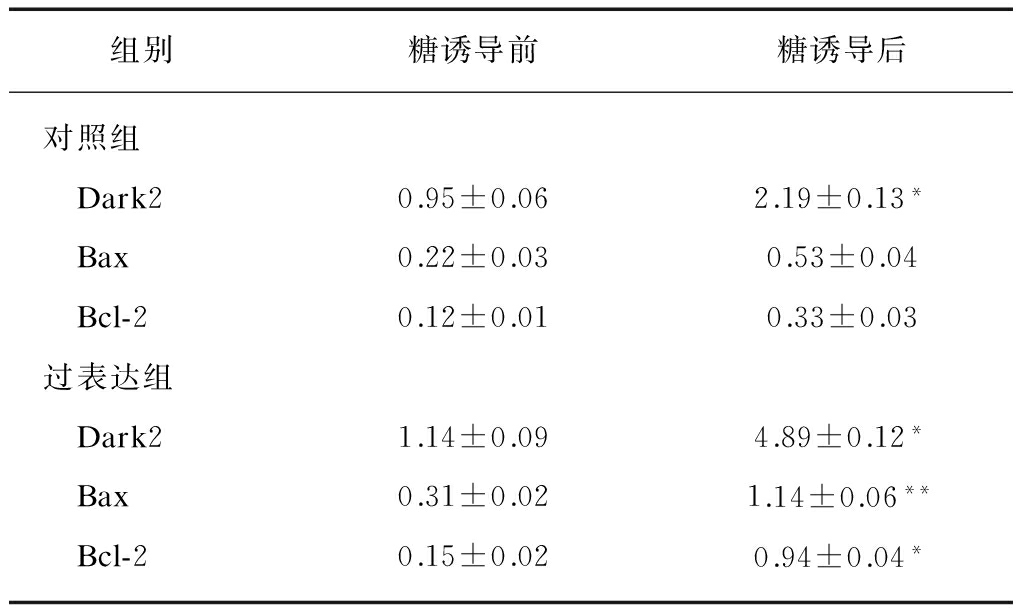
组别糖诱导前糖诱导后对照组 Dark20.95±0.062.19±0.13* Bax0.22±0.030.53±0.04 Bcl-20.12±0.010.33±0.03过表达组 Dark21.14±0.094.89±0.12* Bax0.31±0.021.14±0.06** Bcl-20.15±0.020.94±0.04*
与阴性对照组相比,*P<0.05, **P<0.01
2.5 各组Drak2蛋白的表达情况
在转染6h后开始葡萄糖诱导。Western印迹法显示,各组(正常组、阴性对照组、过表达组、阳性对照组)在诱导前,Drak2蛋白的表达差异无统计学意义(P>0.05),见图3;在高糖诱导72h,过表达组Drak2蛋白是正常组的6倍,见图4。
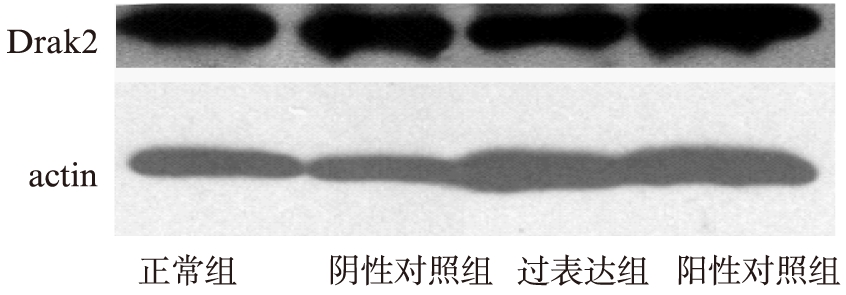
图3 诱导前各组Drak2蛋白表达情况
Fig.3 Drak2 protein expression in different groups before glucose induction
2.6 各组细胞早期凋亡率
流式细胞仪检测显示在22.2mmol/L葡萄糖作用下,各组细胞凋亡均增加,说明高糖可以诱导胰岛β细胞凋亡;但是各组在同样浓度葡萄糖(22.2mmo/L)作用相同的时间下(72h),各组凋亡增加情况不同,正常组高糖诱导后,凋亡增加43%[(3.5±0.1)% vs. (5.0±0.1)%],过表达组凋亡增加440%[(2.9±0.3)% vs. (15.9±0.4)%],与正常组相比,差异有统计学意义(P<0.05)。
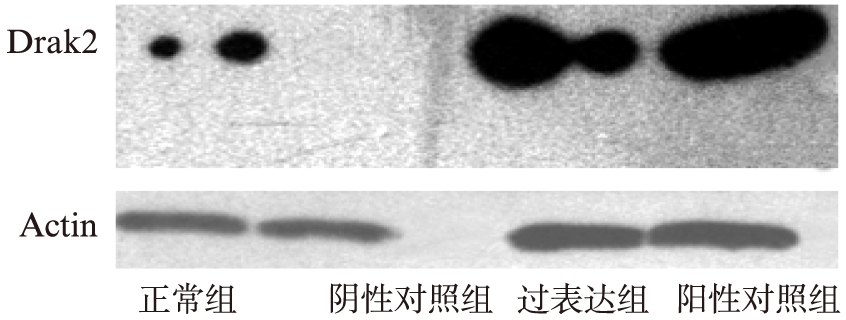
图4 诱导后各组Drak2蛋白表达情况
Fig.4 Drak2 protein expression in different groups after glucose induction
3 讨 论
目前,全球糖尿病患者数已超过3亿,中国接近1亿[5]。无论1型还是2型糖尿病,都存在β细胞凋亡,而Drak2基因位点2q32.3,靠近糖尿病基因致病位点。有研究发现Drak2在T细胞凋亡中起重要作用,近年来,它成为很多疾病包括自身免疫性疾病的新靶点[6],那么Drak2是否对高糖环境诱导的胰岛β细胞凋亡也有影响呢?是否能成为糖尿病的新靶点呢?
胰岛β细胞功能障碍及胰岛素抵抗是2型糖尿病发病的基本环节,当β细胞不能适应环境变化分泌适量的胰岛素时,血糖就会升高,若不及时控制,高血糖最终会导致一系列的恶性循环,即“葡萄糖毒性”,引起胰岛β细胞凋亡。本研究也证实了在高糖条件下,胰岛β细胞凋亡率会增加。Rin-m5f细胞正常组在22.2mmol/L的葡萄糖作用72h时,细胞凋亡率由3.5%增加到5%,而且随着糖浓度的升高,其细胞存活率在逐渐下降,如CCK8结果所示。但是高糖引起胰岛β细胞凋亡的具体机制至今尚未完全阐明,目前主要认为高浓度的葡萄糖通过干扰β细胞线粒体内糖代谢、使β细胞膜表面潜在的自身抗原表达增加、改变Bcl蛋白家族之间的平衡等来调节胰岛β细胞凋亡水平。虽然机制并不明确,但是可以确定高糖的毒性,因此,应及早对糖尿病患者进行干预治疗,积极控制高血糖,这对保护胰岛β细胞功能,延长β细胞功能衰竭是至关重要的。
本研究证实了Drak2过表达促进了高糖诱导的胰岛β细胞的凋亡,在过表达模型组中,诱导后是诱导前的540%。而正常组,诱导后是诱导前的144%倍,过表达组凋亡增加的倍数接近正常组的400%,可见过表达Drak2可增加高糖诱导的胰岛β细胞的凋亡。这与动物研究结果相似。Drak2到底都通过何种途径和信号通路引起胰岛β凋亡,是接下来需要做的工作,探讨其机制,为糖尿病的防治提供新的思路。
【参考文献】
[1] Marchetti P, Dotta F, Lauro D,et al. An pverview of pancreatic beta-cell defects in human type 2 diabetes: implications for treatment[J].Regul Pept,2008,146(1- 3): 4-11.
[2] Matveyenko AV, Butler PC. Beta-cell deficit due to increased apoptosis in the human islet amyloid polypeptide transgenic(HIP) rat recapitulates the metabolic defects present in type 2 diabetes[J]. Diabetes, 2006,55(7): 2106-2114.
[3] Mao J, Qiao X, Luo H, et al.Transgenic drak2 over expression in mice leads to increased T cell apoptosis and compromised memory T cell development[J]. J Biol, 2006,281: 12587-12595.
[4] Weist BM, Hernandez JB, Walsh CM. Loss of DRAK2 signaling enhances allogeneic transplant survival by limiting effector and memory T cell responses[J]. Am J Transplant, 2012,12(8): 2220-2227.
[5] 顾玉春,王清秀.糖尿病神经病变患者行蛛网膜下腔阻滞麻醉的研究进展[J].同济大学学报: 医学版2015,35(1): 120-124.
[6] Leonczak P, Ling-jie Gao, Ramadori AT,et al.Synthesis and structure-activity realtionship studies of 2(1,3,4-Oxadiazole-2(3H)-thione)-3-amino-5-arylthieno(2,3-b) pyridines as inhibitors of DRAK2[J]. Chem Med Chem,2014,9: 2087-2601.
Effects of Drak2 on apoptosis of pancreatic beta cells induced by high glucose
WANG Guang-yu1, WU Guo-ting2
(1. Dept. of Endocrinology, People’s Hospital of Putuo District, Shanghai 200060, China; 2. Dept. of Endocrinology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
【Abstract】Objective To investigate the effect of Drak2 on apoptosis of pancreatic betacells induced by high glucose. Methods Murine Rin-m5f pancreatic β-cells were culturedin vitro and the cell apoptosis model was established by high glucose. Cell viability was detected by CCK8 method. The expression of Drak2 was analyzed by Western blotting. Drak2-pcDNA3.0 was transfected in Rin-m5f cells to establish stable Drak2-overexpressing cells. The expression of Drak2 induced by glucose in the both cell lines was confirmed by immunofluorescence staining. Drak2 mRNA, Bax mRNA, Bcl-2 mRNA were quantitated by Real-Time PCR. The apoptosis was deterrmined by flow cytometry. Results The viability of Rin-m5f cells was significantly reduced in a dose-dependent manner after exposure to glucose at the range of 0-55.5 mmol/L for 24, 48 and 72 h; the expression of Drak2 was the highest when cells were cultured with glucose at 22.2 mmol/L for 72h. With glucose, the expression of Drak2 in over-expression cells was six times of the control cells as measured by Western blotting. Drak2 mRNA was increased before induction, which was highly significant after 72 h in over-expression group(P<0.05). From flow cytometric assay, the percent of apoptosis in over-expression group was highly significant, compared to the control group (P<0.05).Conclusion Drak2 overexpression results in increased β-cell apoptosis induced by glucose stimulation.
【Key words】Drak2; glucose; β cell; apoptosis
doi:10.16118/j.1008-0392.2016.02.005
收稿日期:2015-11-29
基金项目:上海市科委科技攻关重大项目(04DZ19507)
作者简介:王广宇(1985—),女,住院医师,硕士研究生.E-mail: wo198501@163.com
通信作者:吴国亭.E-mail: WGT1212@hotmail.com
【中图分类号】R 589.1
【文献标志码】A
【文章编号】1008-0392(2016)02-0019-05





