·基础研究·
目标区域测序诊断CRB1突变导致的视网膜变性
王 敏1, 王 娟1, 徐 鼎2, 吕立夏1,3, 王 方2, 徐国彤1,3
(1. 同济大学医学院眼科研究所临床视觉科学实验室,上海 200092; 2. 同济大学附属第十人民医院眼科,上海 200072;3. 同济大学医学院再生医学系生物化学与分子生物学教研室,上海 200092)
【摘要】目的 研究一例疑是视网膜变性的患儿,进行基因检测并作出明确的基因诊断。方法 常规检查患儿和家属的眼睛,特别是视网膜的情况。收集患者及家庭成员的外周静脉血液,提取基因组DNA。通过目标区域外显子组序列捕获联合新一代测序(简称目标区域测序),利用生物信息学分析筛选出一系列可能的突变,再通过Sanger测序和共分离研究进行验证,从而确定先证者的致病突变。最后,通过PCR和Sanger测序检测突变基因。结果 患儿视力障碍严重,眼底检查所见符合视网膜变性。其他人眼睛正常。基因诊断结果表明,先证者携带CRB1基因的复合杂合性致病突变(c.3521G>C和c.1141_1142 insTGGCT)。这两个突变分别来源于父亲(c.3521G>C, p.C1174S)和母亲(c.1141_1142insTGGCT),为隐性遗传。患儿的弟弟(新生儿)只有一个c.1141_1142 insTGGCT突变,表明他不会发病。建议新生儿长大后在生育前要进行遗传检查和咨询。结论 目标区域测序的基因诊断方法是检测视网膜变性疾病突变基因的强大工具,有利于对患者做出早期、明确、分子水平的诊断,在特定疾病的理解、预防和预后判定方面能发挥重要作用。同时为其尚无法做临床检查和诊断的新生儿弟弟进行了基因诊断,通过预测,排除了发病的可能。
【关键词】基因诊断; 目标区域测序; CRB1基因; 视网膜变性
视网膜变性是一类常见的、遗传性致盲眼病。与这类疾病发病相关的基因缺陷很多,crumbs同系物1基因(crumbs homolog 1, CRB1; Gene ID: 23418, OMIM 604210)是果蝇基因的人类同源物,仅在人类视网膜和大脑中表达。有研究预测,其编码的蛋白质CRB1为一种跨膜蛋白,以跨膜域和胞外域为主,包括表皮生长因子(epidermal growth factor, EGF)样结构域,钙结合表皮生长因子(calcium-binding epidermal growth factor, cbEGF)样结构域以及层粘连蛋白laminin AG样结构域,能与其他细胞外或跨膜蛋白相互作用。研究表明,小鼠中CRB1的突变可影响视网膜的结构及光感受器细胞的生长[1-2],提示其在视网膜中具有非常重要的作用。
据报道,多个严重且较常见的视网膜变性疾病都可能与CRB1基因突变有关[3-4],如视网膜色素变性12(retinitis pigmentosa 12, RP12, OMIM 600105),Leber先天性黑朦8(leber congenital amaurosis 8, LCA8),视杆-视锥和视锥-视杆营养不良,视网膜色素变性伴有coats-like渗出性血管病变,视网膜异常分层等。CRB1突变导致其编码的光感受器细胞内节的蛋白质异常可能是这些疾病的共同的病理学基础。目前,视网膜变性疾病的发病机制并不明确,并没有良好的治疗手段。有研究曾用大鼠诱导性多能干细胞诱导分化神经前体细胞,有可能作为细胞移植治疗视网膜退行性疾病的供体细胞[5]。而深入认识CRB1基因,有可能对多个视网膜变性的预防和治疗有所帮助,为基因治疗打下良好基础。
本研究采用目标区域外显子组序列捕获联合新一代测序(简称目标区域测序,target exome capture and next generation sequencing)的方法,诊断出疑为视网膜变性的患儿携带有CRB1复合杂合性致病突变(c.3521G>C和c.1141_1142 insTGGCT),并对其刚出生的弟弟进行了预测,从而排除了其弟弟发生严重视网膜变性的可能,提示此方法在特定疾病诊断和预后判定等方面可以发挥重要作用。
1 资料与方法
1.1 一般资料
患儿为同济大学附属第十人民医院眼科遗传门诊就医的患者为男性,3岁。此外,家长也带患儿弟弟(新生婴儿)来本门诊进行遗传咨询,并要求对婴儿进行基因诊断。受试对象来自中国浙江省,汉族人。本研究遵循赫尔辛基宣言,参与者或监护人均需充分了解并签署知情同意书。研究过程严格遵守临床研究的制度。眼科医生对受试者进行眼科检查。受试者外周静脉采集2ml血液。使用RelaxGene血液基因组提取试剂盒(DP319)[天根生化科技(北京)有限公司]试剂,严格按照说明书提取DNA。
1.2 方法
1.2.1 运用目标区域测序进行分子遗传分析 采用文献中的定制目标区域试剂盒[6],即定制设计AgilentTM SureSelect外显子序列。将基因组DNA与定制目标区域试剂盒结合,运用IlluminaTM Miseq平台对结合的外显子片段进行高通量测序。最后运用生物信息学软件找出突变体及相关注释。
1.2.2 新一代测序数据注释和分析 通过使用自行设定的筛选程序,首先预测假定的致病突变体,包括dbSNP和NCBI数据库(http:∥ncbi.nlm.nih.gov)未包含的可导致阅读框改变的无义、错义、短小的插入或缺失片段,以及所有位于外显子-内含子交界区的突变体。
1.2.3 基因突变致病性的评估 用Sanger测序法对预测的致病突变进行验证,并对患者及其父母进行共分离分析。用PCR扩增包含突变位点的基因组片段。利用GenBank数据库找出CRB1基因DNA、mRNA和蛋白质序列(NC_000001.10,NM_201253.2,NP_957705.1)。运用PrimerSelect软件(Lasergene 8.0; DNASTAR, Inc.)设计引物,对突变片段进行扩增,PCR产物送上海博尚生物技术有限公司进行测序。引物序列见表1。PCR扩增子序列经Sanger测序法验证后,运用Seqman软件(Lasergene 8.0; DNASTAR, Inc.)比较测序序列与参考序列以确定突变。每个致病突变在300个正常人标本中进行验证。
表1 PCR和Sanger测序验证用到的引物序列
Tab.1 Sequence of primers used for PCR and Sanger sequencing
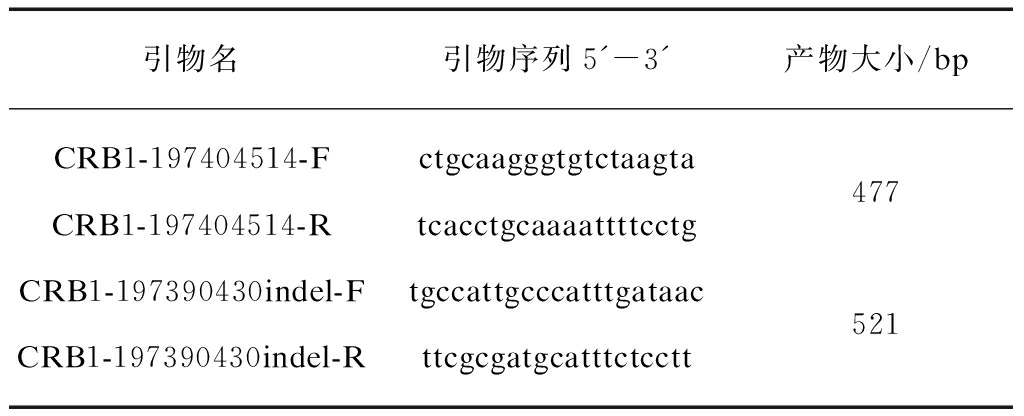
引物名引物序列5'-3'产物大小/bpCRB1-197404514-FctgcaagggtgtctaagtaCRB1-197404514-Rtcacctgcaaaattttcctg477CRB1-197390430indel-FtgccattgcccatttgataacCRB1-197390430indel-Rttcgcgatgcatttctcctt521
2 结 果
2.1 目标区域测序
使用目标区域测序,同时测定了226个遗传性视网膜变性相关基因的序列。生物信息学分析获得带注释的测序数据。患者的DNA片段中含有3732个SNP和305个小的插入和缺失(indels)。也应用互补数据分析对相关度高的遗传变异进行选择。通过使用自定义过滤系统,使候选突变体的数量减少到69个SNP和小的插入和缺失(indels)。最后对这些筛选的致病突变做进一步分析。
2.2 特定突变的致病性分析及验证
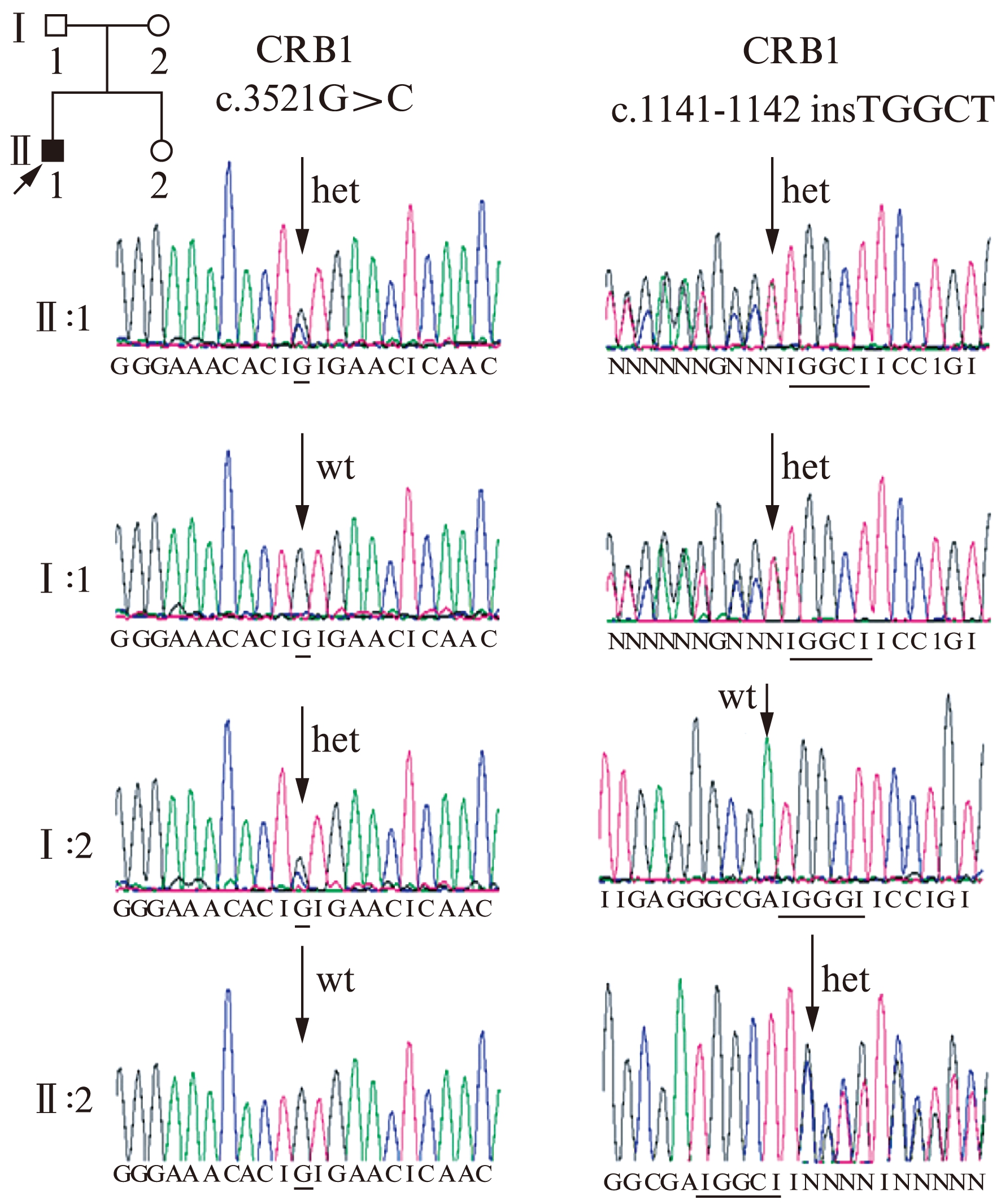
对筛选的致病突变进行分析后,发现视网膜变性患儿(先证者)同时携带CRB1基因的两个突变(图1): 一个杂合的错义突变(c.3521G>C,p.C1174S)和一个杂合的插入突变(c.1141_1142insTGGCT,p.F381Lfs*11)。这两个杂合性突变均为致病性突变。c.3521G>C(p.C1174S)突变可以导致位于EGF15功能域的非极性半胱氨酸被极性丝氨酸替代。相关脊椎动物同源比对分析(Magalign软件分析)显示,半胱氨酸在CRB1蛋白质1174位高度保守(图2)。
c.1141_1142insTGGCT(p.F381Lfs*11)突变定位在cbEGF9结构域,这种突变导致阅读框发生改变,从而截断蛋白质,只留下390个氨基酸残基,而完整的CRB1共含有1294个氨基酸残基。
对家庭成员进行共分离研究的结果表明,患者的父亲只携带突变(c.3521G>C),而母亲也只携带另一个突变(c.1141_1142insTGGCT),两人表型均正常。检查了新生儿的这两个突变情况,结果表明患儿只有一个突变(c.1141_1142insTGGCT)。新生儿和母亲所携带的CRB1突变信息情况一样,是致病基因的携带者,但不会患病。家系中各成员携带的CRB1突变分析见表2。
300个正常对照个体中未同时出现CRB1基因的两种突变。
表2 家系中各成员携带的CRB1突变分析
Tab.2 CRB1 mutation analysis of the family members
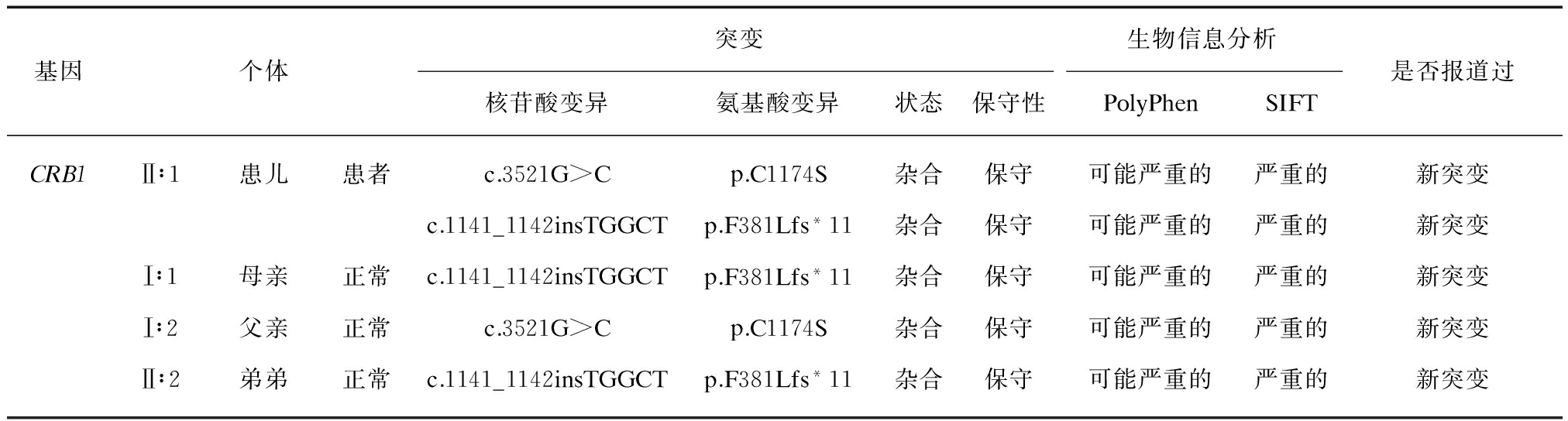
基因个体突变生物信息分析核苷酸变异氨基酸变异状态保守性PolyPhenSIFT是否报道过CRB1Ⅱ∶1患儿患者c.3521G>Cp.C1174S杂合保守可能严重的严重的新突变c.1141_1142insTGGCTp.F381Lfs*11杂合保守可能严重的严重的新突变Ⅰ∶1母亲正常c.1141_1142insTGGCTp.F381Lfs*11杂合保守可能严重的严重的新突变Ⅰ∶2父亲正常c.3521G>Cp.C1174S杂合保守可能严重的严重的新突变Ⅱ∶2弟弟正常c.1141_1142insTGGCTp.F381Lfs*11杂合保守可能严重的严重的新突变
注: 利用生物信息学工具PolyPhen(Polymorphism Phenotyping)和SIFT(sortingintolerant from tolerant),通过分析目的蛋白序列的保守性以及突变氨基酸的生化特性来预测氨基酸的替换对蛋白质功能造成的影响
2.3 临床检查结果
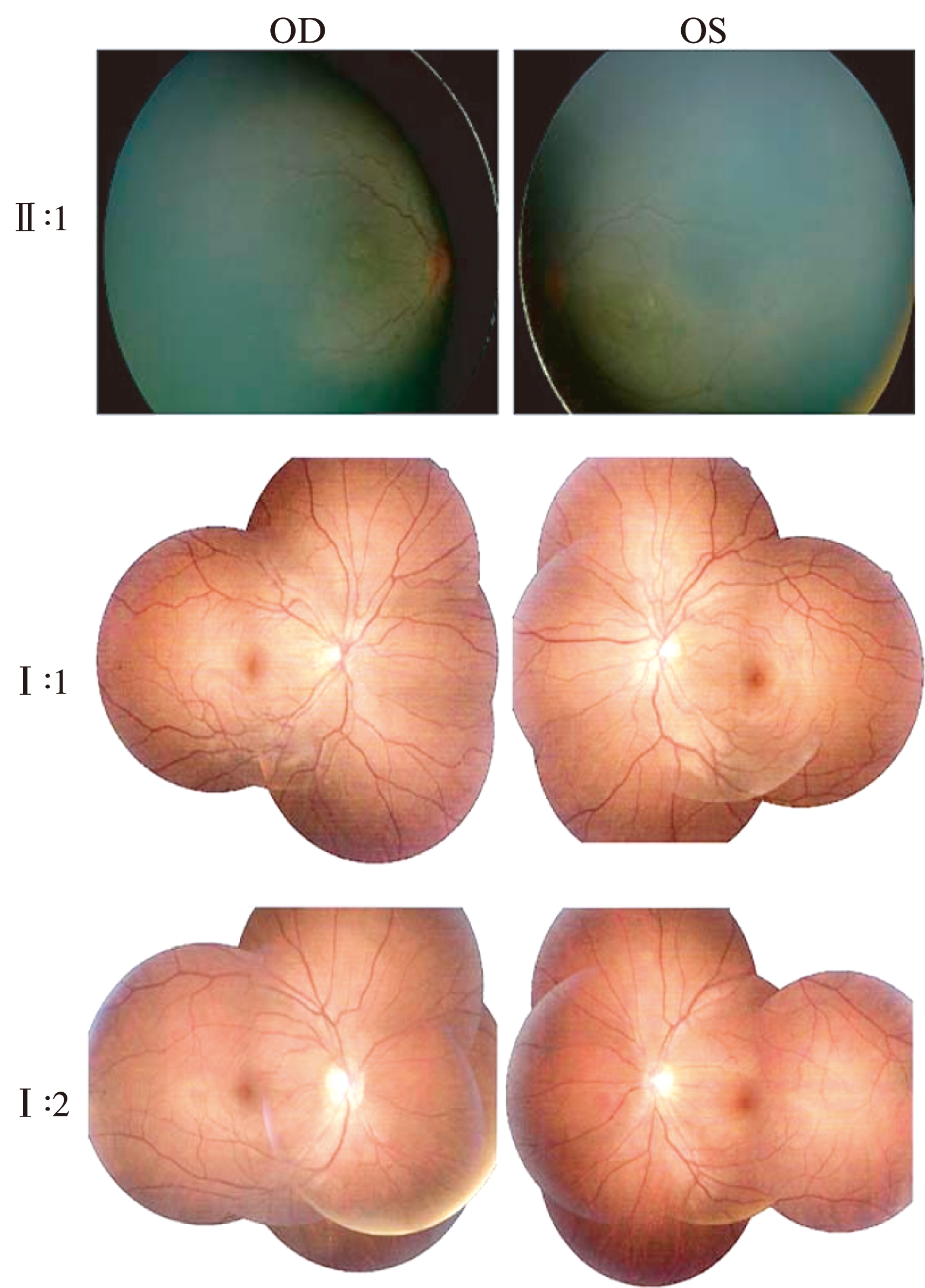
患儿男性,3岁,出生后2个月由父母发现眼睛异常。3岁时第一次就诊。患者为早产儿,出生时仅34周+2,体质量2000g。其症状为: 目不能追逐物体,视力低下,眼球震颤。就诊时能配合医生检查。检查发现患者具有LCA的典型表现[7]: 眼手征兆(Oculodigital,眼球内陷),无畏光,双眼视力仅为眼前指数。眼底检查可见: 视盘小、色红,血管细,弥漫性地毯样视网膜变性,黄斑区金箔样反光,黄斑变性区及其周围区可见白点(图3),后极部有圆形或不规则色素沉积[8-9],视网膜异常分层,与文献报道一致。ERG反应消失,无记录波形(数据未显示)。光学相干断层扫描(OCT)检查显示,视网膜变薄和光感受器细胞层缺失(数据未显示)。
患儿视力很差,接近完全失明。结合CRB1复合杂合性突变的确认,诊断为Leber先天性黑朦(LCA; OMIM 20400),这是一种发病最早、症状最严重的遗传性视网膜变性疾病。
其父母否认近亲结婚。父母双方各携带一个CRB1杂合性突变。两人均近视,但矫正视力正常,眼底检查和视野也均表现正常。患儿和父母的临床信息见表3。
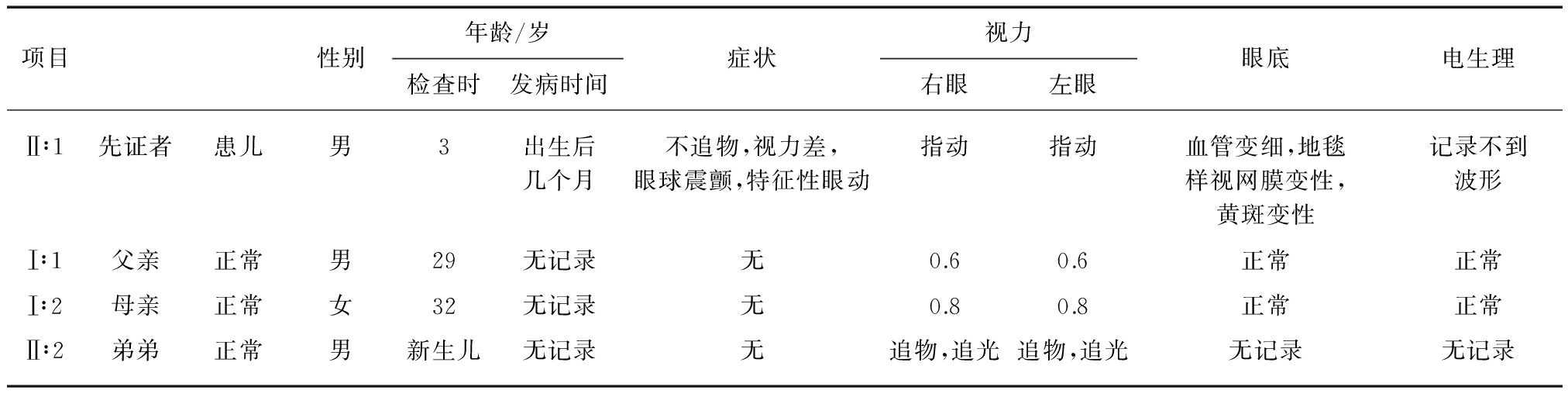
项目性别年龄/岁检查时发病时间症状视力右眼左眼眼底电生理Ⅱ∶1先证者患儿男3出生后几个月不追物,视力差,眼球震颤,特征性眼动指动指动血管变细,地毯样视网膜变性,黄斑变性记录不到波形Ⅰ∶1父亲正常男29无记录无0.60.6正常正常Ⅰ∶2母亲正常女32无记录无0.80.8正常正常Ⅱ∶2弟弟正常男新生儿无记录无追物,追光追物,追光无记录无记录
3 讨 论
CRB1突变在视网膜变性中较多见。有英国[4]和西班牙[10]曾报道,CRB1突变占视网膜变性患者约11%。CRB1突变在瑞典[11]、日本[12]也都有引起LCA的报道。相比之下,国内关于LCA群体中CRB1突变的报道很少[8-9,13]。有一项研究显示,在87个汉族LCA患者中,CRB1突变占11.5%,频率仅次于GUCY2D(16.1%),是LCA的第二常见病因[8]。研究表明,CRB1突变在视网膜变性发病及研究中占有重要地位。明确诊断后,可以直接解决10%以上患者的疾病预测,加深对CRB1突变致病机制的认识。
CRB1是目前一个已知的、确定的眼底变性致病基因。本研究通过大规模基因测序发现大量的SNP,并从疑为视网膜变性的患者中发现了CRB1基因的两个突变位点: c.3521G>C和c.1141_1142 insTGGCT;没有发现其他可能的致病变异。父亲携带的c.3521G>C变异和母亲携带的c.1141_1142insTGGCT变异在该家系中传递符合常隐特征,而这两种突变在300个正常对照个体中未同时出现。因此,推断CRB1基因被确认为该患儿致病基因。
本研究中,患儿携带的这种复合的CRB1杂合性突变促成了疾病的发生。其中的c.1141_1142 insTGGCT(p.F381Lfs*11)突变,可导致蛋白质在转录和翻译时被截短,只剩下360个氨基酸。而另一个突变c.3521G>C(p.C1174S)位于EGF结构域,该位点氨基酸在进化上保守,该位点发生突变对蛋白功能影响重大。结合临床表现,本研究提供的基因诊断,为这个临床诊断不明确的严重视网膜变性的先证者最终诊断为Leber先天性黑朦提供了有力的证据。患儿的弟弟(新生儿)被检查出仅遗传了他母亲的一个CRB1基因的突变(c.1141_1142 insTGGCT),预测这个新生儿将仅为携带者,眼睛正常表型。这一诊断和预测,消除了孩子家长的思想负担,使这个家庭能正常生活。提醒适龄婚姻生育青年人需要及时进行遗传咨询,以保证后代健康。
目前,视网膜变性疾病的诊断仍是基于临床检查和病理学的诊断。在分子水平,遗传性视网膜变性所涉及的突变基因数以百计,致病机制也多有不同。这使得被诊断为视网膜变性的患者的表型异质性非常明显,从表现轻微,进展缓慢到早期发病并致盲,加之发病机制不清楚,使得针对视网膜变性的治疗效果难以令人满意,基因治疗也无从谈起。随着分子生物学分子遗传学技术的进展,现在有条件对这类患者及家属进行明确的基因诊断,使视网膜变性疾病的亚型得以明确,有助于帮助患者判断预后、预测其眼病的发病情况和特征,以便及早干预,同时也为理解各亚型视网膜变性的发病机制和后续的基因治疗奠定基础。
本研究表明,目标区域测序是一个可靠、敏感、低成本及高效率的基因诊断方法,能提供明确的遗传分析。基因诊断能以强有力的证据对遗传异质性特别高的视网膜变性疾病作出精准的临床诊断。在这个研究中,不仅对先证者作出了明确的基因诊断,还成功地检测出新生儿的遗传情况,排除了其发生严重视网膜变性的可能,使产前诊断和优生在这个家庭成为可能,可以并推广到其他患者和家庭。借助这一基因诊断技术,可以为有需要的生育年龄的群体和婴幼儿提供一个高效、精准的医学服务,促使优生优育。
【参考文献】
[1] Greferath U, Vessey KA, Jobling AI, et al. The role of histamine in the retina: studies on the hdc knockout mouse[J]. Plos One, 2014,9(12): e116025.
[2] Pellissier LP, Alves CH, Quinn PM, et al. Targeted ablation of crb1 and crb2 in retinal progenitor cells mimics leber congenital amaurosis[J]. Plos Genet, 2013,9(12): e1003976.
[3] Ehrenberg ML, Pierce EA, Cox GF, et al. CRB1: one gene, many phenotypes[J]. Semin Ophthalmol, 2013,28(5-6): 397-405.
[4] Henderson RH, Mackay DS, Li Z, et al. Phenotypic variability in patients with retinal dystrophies due to mutations in CRB1[J]. Br J Ophthalmol, 2011,95(6): 811-817.
[5] 曲泽澎,管圆,崔璐,等.大鼠诱导性多能干细胞向神经前体细胞诱导分化研究[J].同济大学学报: 医学版,2013,34(3): 1-6.
[6] Consugar MB, Navarro-Gomez D, Place EM, et al. Panel-based genetic diagnostic testing for inherited eye diseases is highly accurate and reproducible, and more sensitive for variant detection, than exome sequencing[J]. Genet Med, 2015,17(4): 253-261.
[7] Bujakowska K, Audo I, Mohand-Said S, et al. CRB1 mutations in inherited retinal dystrophies[J]. Hum Mutat, 2012,33(2): 306-315.
[8] Chen Y, Zhang Q, Shen T, et al. Comprehensive mutation analysis by whole-exome sequencing in 41 Chinese families with leber congenital amaurosis[J]. Invest Ophthalmol Vis Sci, 2013,54(6): 4351-4357.
[9] Li L, Xiao X, Li S, et al. Lack of phenotypic effect of triallelic variation in SPATA7 in a family with leber congenital amaurosis resulting from CRB1 mutations[J]. Mol Vis, 2011,17: 3326-3332.
[10] Corton M, Tatu SD, Avila-Fernandez A, et al. High frequency of CRB1 mutations as cause of early-onset retinal dystrophies in the Spanish population[J]. Orphanet J Rare Dis, 2013,8: 20.
[11] Jonsson F, Burstedt MS, Sandgren O, et al. Novel mutations in CRB1 and ABCA4 genes cause leber congenital amaurosis and Stargardt disease in a Swedish family[J]. Eur J Hum Genet, 2013,21(11): 1266-1271.
[12] Kuniyoshi K, Ikeo K, Sakuramoto H, et al. Novel nonsense and splice site mutations in CRB1 gene in two Japanese patients with early-onset retinal dystrophy[J]. Doc Ophthalmol, 2015,130(1): 49-55.
[13] Yang L, Wu L, Yin X, et al. Novel mutations of CRB1 in Chinese families presenting with retinal dystrophies[J]. Mol Vis, 2014,20: 359-367.
Genetic diagnosis of CRB1 mutations in retinal degenerative diseases by target exon sequencing
WANG Min1, WANG Juan1, XU Ding2, LV Li-xia1,3, WANG Fang2, XU Guo-tong1,2,3
(1. Laboratory of Clinical Vision Science, Tongji Eye Institute, Tongji University, Shanghai 200092, China;2. Dept. of Ophthalmology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China;3. Teaching and Research Section of Biochemistry andMolecular Biology, Regenerative Medicine, Medical College, Tongji University, Shanghai 200092, China)
【Abstract】Objective To investigate genetic diagnosis of CRB1 mutations in retinal degeneration by target exon sequencing. Methods A 3-year child with suspected Leber’s congenital amaurosis(LCA) and 3 family members were included in the study. Peripheral vein blood was collected and genome DNA was extracted; the target exon capture and next generation sequencing(Candidate Exon Sequencing) was performed. Sanger sequencing validation and family cosegregation study were used to identify the causative mutation based on bioinformatic analysis. Results Compound heterozygote mutations of CRB1 gene, c.3521G>C and c.1141_1142 insTGGCT, were identified in the proband. The gene mutations(c.3521G>C, p.C1174S) and(c.1141_1142insTGGCT) were detected from the father and mother of the proband, respectively; while only one mutation(c.1141_1142 insTGGCT) was detected in proband’s younger brother. Conclusion Target exon sequencing can be used to screen known causative gene for retinal degenerative diseases.
【Key words】genetic diagnosis; target exome capture; CRB1; retinal degeneration
doi:10.16118/j.1008-0392.2015.06.003
收稿日期:2015-06-05
基金项目:国家自然科学基金(81100674);上海市卫生局项目(2010Y145,20134222);中山眼科中心眼科学国家重点实验室开放课题(2013KF05)
作者简介:王 敏(1986—),女,硕士.E-mail: wm0323@126.com
通信作者:徐国彤.E-mail: gtxu@tongji.edu.cn
【中图分类号】R 15211
【文献标志码】A
【文章编号】1008-0392(2015)06-0013-06