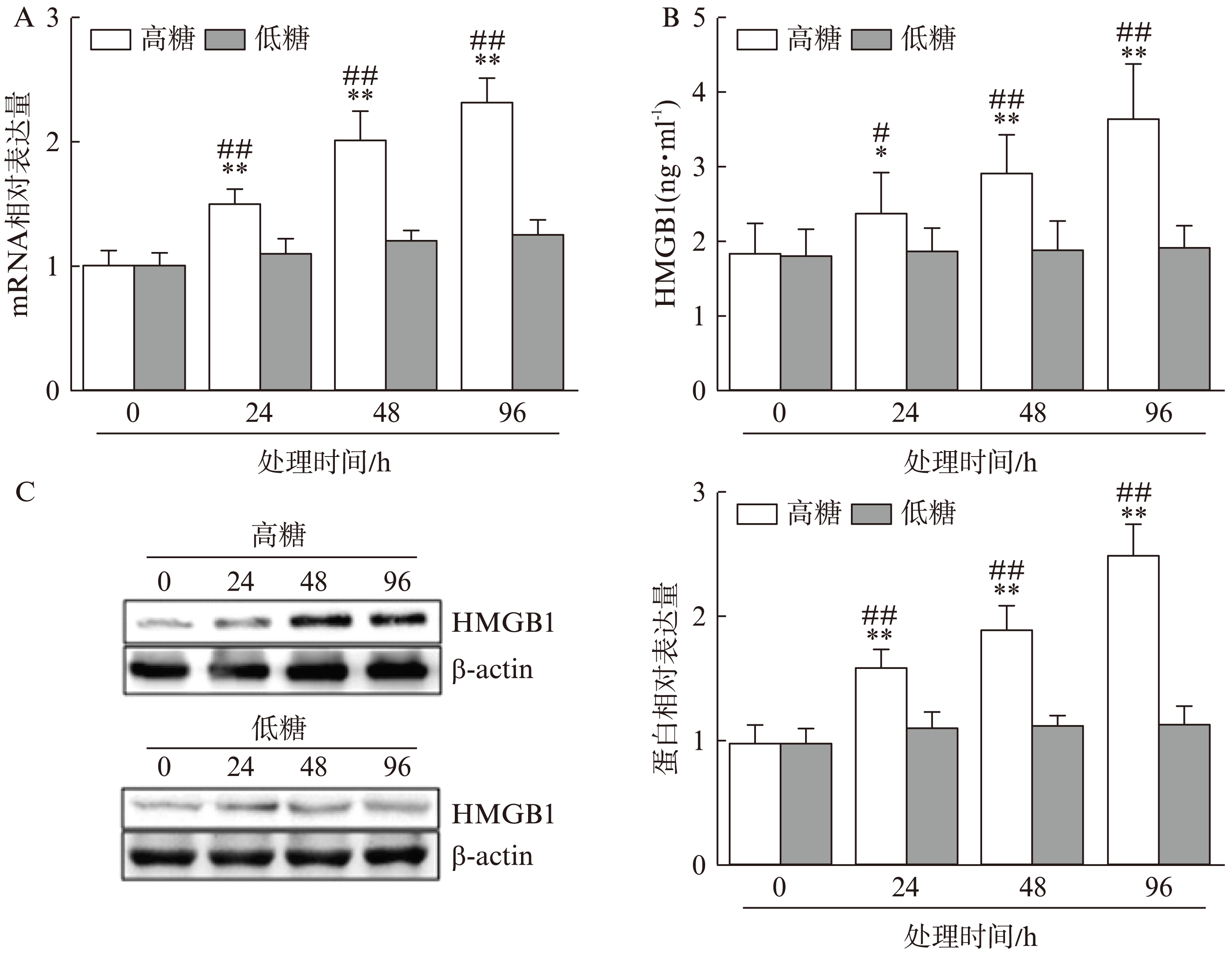
图1 高糖培养条件下人HRCEC中HMGB1的表达及分泌
Fig.1 HMGB1 expression and secretion in HRCEC cultured with high glucose concentration
A. HMGB1 mRNA相对表达量;B. ELISA检测HMGB1的分泌量;C. HMGB1蛋白表达及定量(相较于0h处理组,*P<0.05,**P<0.01;相较于低糖相应处理时间组,#P<0.05,##P<0.01)
·基础研究·
【摘要】目的 研究胰高血糖素样多肽1(glucagon like peptide 1, GLP-1)对高糖环境下培养的人视网膜微血管内皮细胞(human retinal capillary endothelial cells, HRCEC)中,高迁移率组蛋白B1(high mobility group box-1 protein, HMGB1)表达的影响及相关机制。方法 高糖刺激HRCEC不同时间(24h、48h及96h)后,分别使用不同浓度的GLP-1(10mmol/L、100nmol/L及1000nmol/L)刺激HRCEC 96h后,分别通过RT-PCR、ELISA及Western Blot检测HMGB1的mRNA、分泌及蛋白水平。使用高糖和GLP-1刺激细胞1h后,Western Blot检测HMGB1表达相关信号通路(p38 MAPK、JNK和NF-κB)磷酸化水平。结果 相较于正常糖水平,高糖促使HMGB1的mRNA、分泌及蛋白水平显著升高,GLP-1可有效抑制这一效应。高糖可显著性激活p38 MAPK、JNK和NF-κB,而GLP-1则抑制高糖所诱导的这些信号通路激活。结论 GLP-1可能通过抑制高糖刺激下HMGB1的表达及炎症信号通路激活,从而抑制糖尿病视网膜病变的发生及发展。
【关键词】胰高血糖素样多肽1; 微血管内皮细胞; 高迁移率组蛋白B1
糖尿病视网膜病变(diabetic retinopathy, DR)的发病机制复杂[1]。炎症在糖尿病视网膜病变发生和进展中扮演重要角色,尤其在增殖型糖尿病视网膜病变中[2],炎症因子表达和释放可诱导视网膜血管内皮损伤及视网膜新生血管的形成[3]。抑制炎症反应过度激活可能是糖尿病视网膜病变治疗的重要策略[4]。
高迁移率组B1(high mobility group box-1 protein, HMGB1)蛋白是高度保守的非组蛋白染色体结合蛋白,广泛表达和分布于哺乳动物组织细胞中,在炎症反应中发挥重要的调控作用[5]。在病理状态下,视网膜内皮细胞释放HMGB1到胞外,而细胞外的HMGB1通过识别并结合Toll样受体2(Toll-like receptor 2, TLR2)[6],Toll样受体4(Toll-like receptor 4, TLR4)[7],糖基化终末产物受体(receptor for advanced glycation end, RAGE)[8],进一步放大炎症,最终造成内皮细胞损伤及血管新生。
胰高血糖素样多肽1(glucagon like peptide 1, GLP-1)主要由回肠末端和结肠L细胞分泌,通过与特异性受体(GLPR)结合使胞内cAMP、钙离子和磷脂酶水平升高,激活PKA、PKC、PI3K、Epac2等信号通路,促进胰岛素基因表达和分泌,其已成为控制血糖和治疗糖尿病的有效药物[9]。GLP-1在调控血糖的同时,可抑制细胞氧化应激和凋亡[10],改善缺血后心肌细胞的功能[11],延缓神经细胞退行性病变[12],发挥胰岛外生理作用。然而,GLP-1在糖尿病视网膜病变中的作用及机制尚不清楚,特别是其对炎症因子HMGB1是否具有调控作用,未见有相关报道。
本实验通过研究高糖环境下,GLP-1对人视网膜微血管内皮细胞中HMGB1表达的影响,初步探索GLP-1在糖尿病视网膜病变中的作用及机制。
1.1 材料
人视网膜微血管内皮细胞(human retinal capillary endothelial cell, HRCEC)购自Invitrogen公司。GLP-1购自Sigma-Aldrich公司。M131培养基、低血清生长添加剂(low serum growth supplement, LSGS)及葡萄糖购自Gibco公司。荧光实时定量PCR相关试剂购自ABI公司。ELISA试剂盒购自R&D Systems公司。HMGB1抗体、磷酸化p38 MAPK、JNK和NF-κB蛋白抗体购自Abcam公司。酶标仪购自Bio-Rad公司。PCR仪为ABI StepOne。细胞培养箱和超净工作台购自Thermo公司。
1.2 HRCEC培养及实验分组
HRCEC用含有M131+10% LSGS、青霉素(100U/mL)及链霉素(100U/mL)的培养基培养,于37℃、5% CO2及饱和湿度条件下培养。将HRCEC接种于6孔板中培养。分别用不同葡萄糖浓度的M131培养基培养24h、48h及96h(正常糖浓度组: D-葡萄糖5.5mmol/L;高糖组: D-葡萄糖25.5mmol/L),收集细胞培养上清、总mRNA及蛋白。GLP-1干预组: 使用不同浓度GLP-1(10mmol/L、100nmol/L和1000nmol/L,以PBS为对照)加入高糖培养基,96h后收集细胞培养上清、总mRNA及蛋白。GLP-1对细胞信号通路调控作用检测: 内皮细胞使用高糖及高糖+GLP-1(1000nmol/L),并以正常糖浓度刺激为正常对照,刺激1h后,收集细胞总蛋白,检测相应细胞信号通路磷酸化水平。
1.3 ELISA法测定HMGB1蛋白浓度
收集各实验组细胞培养上清,根据HMGB1检测ELISA试剂盒操作步骤进行相应实验,检测结果使用Bio-Rad酶标仪读取D450值换算,每组检测重复三次,计算统计学差异度。
1.4 进行统计学分析
收集细胞,Trizol法提取总RNA,紫外分光光度法检测mRNA浓度和纯度,反转录合成cDNA。HMGB1 mRNA表达定量分析使用荧光实时定量PCR。HMGB1扩增引物序列: 正义链5′-TTG GTG ATG TTG CGA AGA-3′,反义链5′-CAG CCT TGA CAA CTC CCT-3′。β-actin扩增引物序列: 正义链5′-CGT GGA CAT CCG CAA AG-3′,反义链5′-TGG AAG GTG GAC AGC GA-3′。PCR程序为95℃变性30s;95℃变性10s后,65℃延伸31s,重复40次循环。使用StepOne软件v 2.1读取数据并进行分析。
1.5 Western检测蛋白表达水平
细胞总蛋白样品(100μg)进行SDS-PAGE电泳,并进行蛋白质转印至PVDF膜上。转印至PVDF膜上的蛋白进行Western Blot检测,一抗稀释比率为1∶500,二抗稀释比率为1∶5000,杂交完成后加入HRP显色发光液显色,使用X光胶片曝光记录蛋白磷酸化水平。对X光胶片上蛋白曝光强度进行灰度值测定,Quantity One分析软件分析比较蛋白在刺激后的磷酸化水平的改变。
1.6 统计学分析
连续变量以均数±标准差表示,计量资料比较使用单因素方差分析(One-way ANOVA)。P<0.05表示差异有统计学意义。
2.1 高糖促进人视网膜微血管内皮细胞中HMGB1表达及分泌
高糖培养24h、48h和96h后,收集细胞培养上清、总mRNA及蛋白。通过RT-PCR检测HMGB1的mRNA表达水平,ELISA法检测HMGB1分泌变化,Western Blot检测HMGB1蛋白表达情况。结果发现,相较于正常糖浓度培养,高糖培养24h、48h和96h后HMGB1 mRNA表达水平分别提高1.5倍、2倍和2.3倍,且差异均有统计学意义(P<0.01,图1A);培养上清液中HMGB1浓度分别提高1.3倍、1.6倍和2倍且差异均有统计学意义(P<0.05,图1B);HMGB1蛋白表达水平分别提高1.6倍、1.9倍和2.5倍,且差异均有统计学意义(P<0.01,图1C)。

图1 高糖培养条件下人HRCEC中HMGB1的表达及分泌
Fig.1 HMGB1 expression and secretion in HRCEC cultured with high glucose concentration
A. HMGB1 mRNA相对表达量;B. ELISA检测HMGB1的分泌量;C. HMGB1蛋白表达及定量(相较于0h处理组,*P<0.05,**P<0.01;相较于低糖相应处理时间组,#P<0.05,##P<0.01)
2.2 GLP-1抑制高糖培养条件下HMGB1的表达和分泌
分别使用10nmol/L、100nmol/L及1000nmol/L GLP-1作用于高糖培养的HRCEC细胞96h后(以PBS处理为对照),收集细胞培养上清、总mRNA及蛋白,分别检测HMGB1的mRNA、分泌及蛋白表达情况。结果发现,相较于PBS对照组,10nmol/L、100nmol/L及1000nmol/L的GLP-1均显著性抑制了HMGB1的mRNA(图2A)、分泌(图2B)及蛋白表达水平(图2C),且差异均具有统计学意义(P<0.01)。而且随GLP-1浓度提高,HMGB1的mRNA、分泌及蛋白表达水平呈剂量依赖性下降。
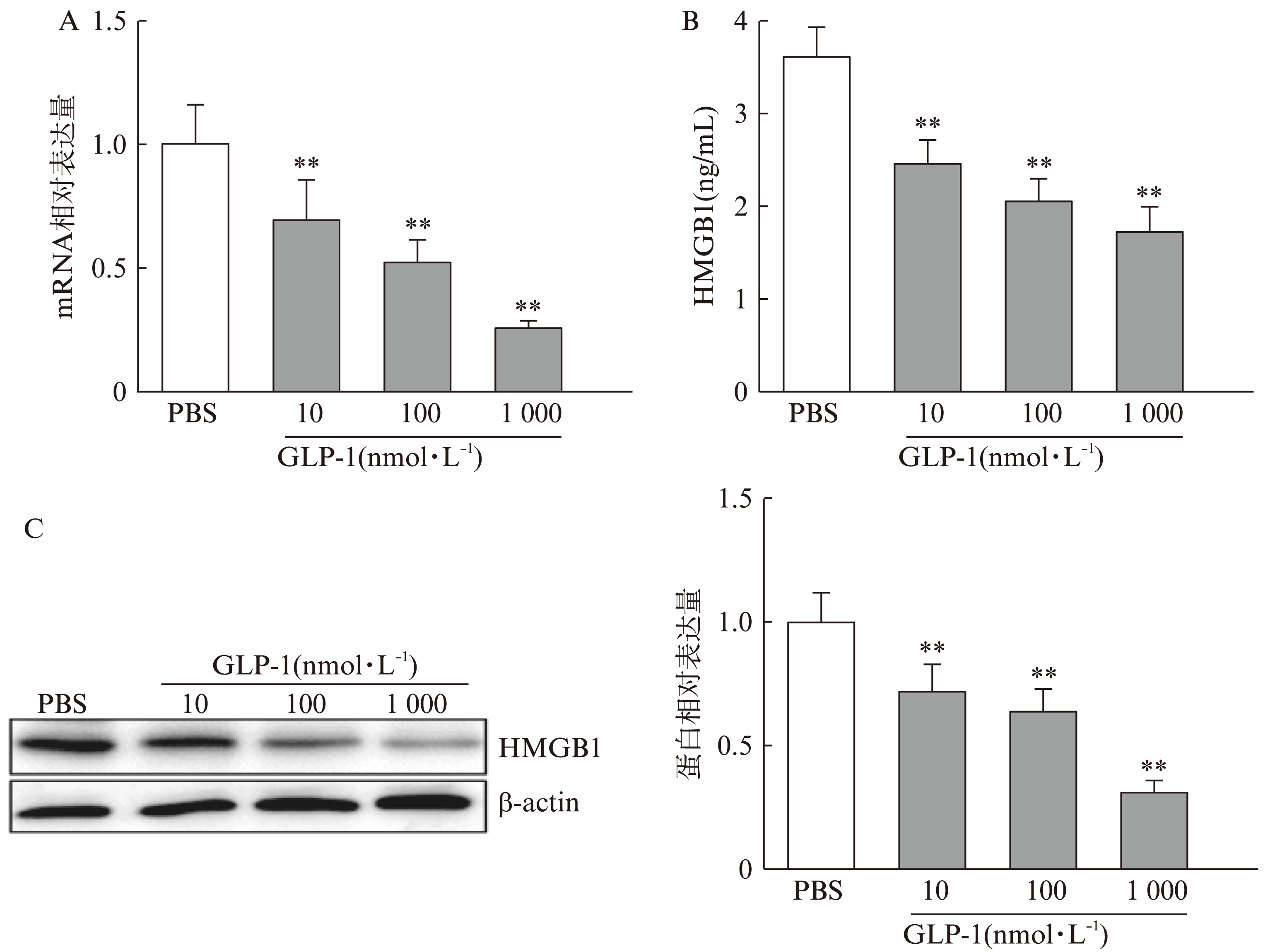
图2 GLP-1抑制高糖培养条件下HMGB1的表达和分泌
Fig.2 GLP-1 attenuates the expression and secretion of HMGB1 cultured with high glucose concentration
A. HMGB1 mRNA相对表达量;B. ELISA检测HMGB1的分泌量;C. HMGB1 蛋白表达及定量(相较于PBS处理组,**P<0.01)
2.3 GLP-1抑制HMGB1表达相关信号通路
使用高糖和GLP-1刺激人视网膜微血管内皮细胞1h后,通过Western Blot检测HMGB1表达调控相关细胞信号通路分子P38、JNK及NF-κB激活情况。结果发现,在高糖刺激1h后,P38、JNK及NF-κB磷酸化水平均显著升高。但是,在加入1000nmol/L的GLP-1后,高糖所引起的P38、JNK及NF-κB激活升高受到显著性抑制,见图3。
糖尿病合并视网膜病变涉及多种细胞及分子机制,目前的研究认为固有免疫反应可能是主要机制之一[13]。研究证实,高糖刺激可作为独立因素促进HMGB1表达升高,这一结果提示,糖尿病所导致的血糖异常升高与炎症反应之间的相互调控作用[14],与糖尿病时视网膜内皮功能异常有着密切相关性。一方面,高血糖促进血清中蛋白的糖基化修饰水平升高,进而导致组织中糖基化终末产物(advanced glycation end, AGE)累积增加,而AGE与其受体(RAGE)结合并激活其下游炎症信号通路,如MAPK通路、JNK通路和NF-κB的磷酸化级联反应,最终通过核内转录元件(c-Fos,c-Jun等)引起炎症相关基因HMGB1表达升高[15]。另一方面,高血糖诱导HMGB1表达上升并大量释放到细胞外,与其相应受体(白介素1受体、Toll样受体或RAGE受体)结合,进一步激动炎症下游信号通路,加剧并放大炎症反应[16]。
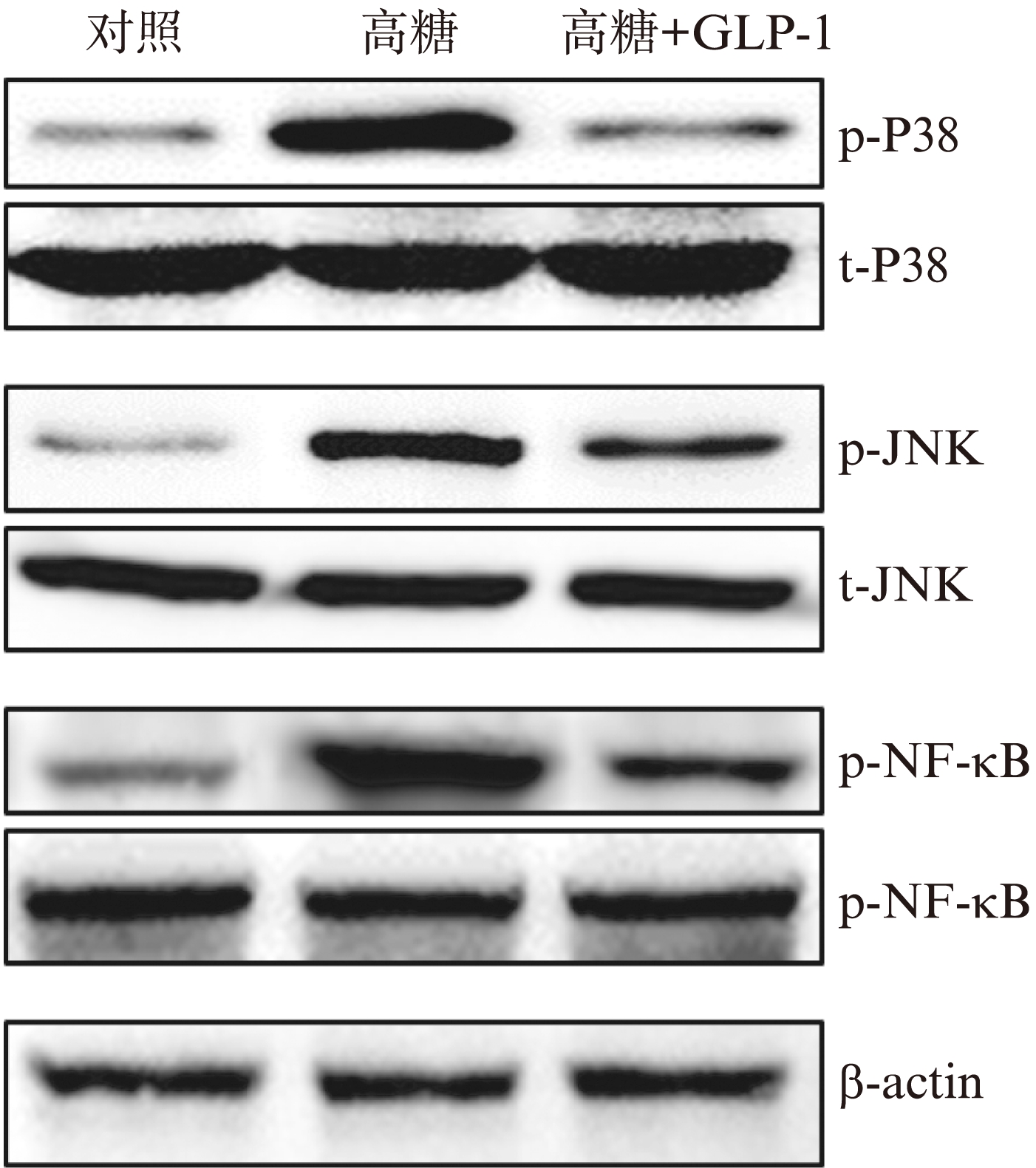
图3 GLP-1抑制HMGB1表达相关信号蛋白磷酸化
Fig.3 GLP-1 inhibits the phosphorylation of signal molecules associated with expression and secretion of HMGB1
GLP-1是葡萄糖水平依赖的胰岛素样多肽,其通过结合胰岛或胰岛外细胞膜上GLPR进而发挥生理调节功能。有报道发现,GLPR表达于人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)上,而激活HUVEC细胞上的GLPR可有效抑制细胞内氧化应激水平[17]。本研究中,使用高糖刺激HRCEC,并观察GLP-1对HRCEC细胞炎症反应的效应,结果发现GLP-1可显著抑制HMGB1表达,并呈剂量依赖性抑制作用。这一结果提示,GLP-1可能通过其受体GLPR参与炎症调节。
HMGB1的表达受到p38 MAPK、JNK及NF-κB等主要炎症通路的调控,本研究结果显示,GLP-1可显著性抑制p38 MAPK、JNK及NF-κB的磷酸化水平,进而导致HMGB1表达下降。同时,发现GLP-1抑制了HMGB1在细胞外的分泌量,这一效应可能抑制HMGB1介导自身表达和炎症级联放大效应。
本研究探讨了高糖环境下,GLP-1对炎症反应的调控作用及机制,特别是其对炎症因子HMGB1表达的调控作用,这些研究结果提示,GLP-1可能发挥抑制糖尿病视网膜病变的治疗作用。
【参考文献】
[1] Sim R, Hern
R, Hern ndez C. Novel approaches for treating diabetic retinopathy based on recent pathogenic evidence[J]. Prog Retin Eye Res, 2015,48: 160-180.
ndez C. Novel approaches for treating diabetic retinopathy based on recent pathogenic evidence[J]. Prog Retin Eye Res, 2015,48: 160-180.
[2] Semeraro F, Cancarini A, dell’Omo R, et al. Diabetic retinopathy: vascular and inflammatory disease[J]. J Diabetes Res, 2015,2015: 582060.
[3] Rangasamy S, McGuire PG, Franco Nitta C, et al. Chemokine mediated monocyte trafficking into the retina: role of inflammation in alteration of the blood-retinal barrier in diabetic retinopathy[J]. PLoS One, 2014,9(10): e108508.
[4] Deliyanti D, Zhang Y, Khong F, et al. FT011 a novel cardiorenal protective drug reduces inflammation, gliosis and vascular injury in rats with diabetic retinopathy[J]. Plos One, 2015,10(7): e0134392.
[5] Lee SA, Kwak MS, Kim S, et al. The role of high mobility groupbox 1 in innate immunity[J]. Yonsei Med J, 2014,55(5): 1165-1176.
[6] Mersmann J, Iskandar F, Latsch K, et al. Attenuation of myocardial injury by HMGB1 blockade during ischemia/reperfusion is toll-like receptor 2-dependent[J]. Mediators Inflamm, 2013,2013: 174168.
[7] Yang X, Wang H, Zhang M, et al. HMGB1: a novel protein that induced platelets active and aggregation via Toll-like receptor-4, NF-κB and CGMP dependent mechanisms[J]. Diagn Pathol, 2015,10(1): 134.
[8] Cheng M, Liu H, Zhang D, et al. HMGB1 enhances the AGE-induced expression of CTGF and TGF-β via RAGE-dependent signaling in renal tubular epithelial cells[J]. Am J Nephrol, 2015,41(3): 257-266.
[9] 孙艺璇,邵莉.脑肠肽与胰岛素分泌[J].同济大学学报: 医学版,2014,35(3): 133-136.
[10] Mangmool S, Hemplueksa P, Parichatikanond W, et al. Epac is required for GLP-1R-mediated inhibition of oxidative stress and apoptosis in cardiomyocytes[J]. Mol Endocrinol, 2015,29(4): 583-596.
[11] Sandoval DA, D’Alessio DA. Physiology of progluc-agon peptides: role of glucagon and GLP-1 in health and disease[J]. Physiol Rev, 2015,95(2): 513- 548.
[12] McClean PL, Hölscher C. Lixisenatide a drug developed to treat type 2 diabetes, shows neuropro-tective effects in a mouse model of Alzheimer’s disease[J]. Neuropharmacology, 2014,86: 241-258.
[13] Hogan AE, Gaoatswe G, Lynch L, et al. Glucagon-like peptide 1 analogue therapy directly modulatesinnate immune-mediated inflammation in individuals with type 2 diabetes mellitus[J]. Diabetologia, 2014,57(4): 781-784.
[14] 崔丽,李纪明,罗轶玮,等.高糖抑制PI3K/AKT通路诱导人冠状动脉内皮细胞凋亡的研究[J].同济大学学报: 医学版,2014,35(1): 30-34.
[15] Xie J, Méndez JD, Méndez-Valenzuela V, et al. Cellular signalling of the receptor for advanced glycation end products(RAGE)[J]. Cell Signal, 2013,25(11): 2185-2197.
[16] Chen XL, Zhang XD, Li YY, et al. Involvement of HMGB1 mediated signalling pathway in diabetic retinopathy: evidence from type 2 diabetic rats and ARPE-19 cells under diabetic condition[J]. Br J Ophthalmol, 2013,97(12): 1598-1603.
[17] Onuma H, Inukai K, Kitahara A, et al. The glucagon-like peptide 1 receptor agonist enhances intrinsic peroxisome proliferator-activated receptor γ activity in endothelial cells[J]. Biochem Biophys Res Commun, 2014,451(2): 339-344.
Effects of glucagon like peptide 1 on high glucose induced expression of high mobility group box-1 protein in human retinal capillary endothelial cells and its mechanism
【Abstract】Objective To investigate the effects and related mechanisms of glucagon like peptide 1(GLP-1) on mRNA and protein expression of high mobility group box-1 protein(HMGB1) in human retinal capillary endothelial cell(HRCEC) induced by high glucose. Methods Human retinal capillary endothelial cells(HRCECs) were treated with GLP-1 in different doses(10nmol/L,100nmol/L,1000nmol/L) for 24h, 48h and 96h, the expression of HMGB1 mRNA and protein was detected with RT-PCR and Western Blot, respectively. HMGB1 contents in culture medium were measured by ELISA. Phosphorylation level of p38 MAPK, JNK, and NF-κB was also measured by Western Blot. Results Compared with normal glucose culture, mRNA and protein expression level, and release of HMGB1 were significantly increased in HRCECs with high glucose culture, which was attenuated by treatment with GLP-1 in a dose-dependent manner. GLP-1 inhibited phosphorylation level of p38 MAPK, JNK, and NF-κB. Conclusion GLP-1 might attenuate the inflammation through inhibiting over-expression of HMGB1 in high glucose condition, which might prevent the diabetic retinopathy.
【Key words】glucagon like peptide 1; capillary endothelial cell; high mobility group box-1 protein
doi:10.16118/j.1008-0392.2015.06.002
收稿日期:2015-08-09
基金项目:国家自然科学基金(31171419)
【中图分类号】R 587
【文献标志码】A
【文章编号】1008-0392(2015)06-0008-05