随着CT检查的普及,HRCT的广泛应用,以及近年开展的低剂量CT筛查肺癌,使肺磨玻璃结节(ground-glass opacity,GGO)的检出逐渐增多,越来越受到影像科及临床医生重视。GGO在CT上表现为肺部较淡薄的密度增高影,是由肺泡腔的不完全填充、炎症所致肺间质增厚、水肿、纤维化、肿瘤性增生、肺泡部分萎陷、正常呼吸状态或毛细血管的血容量增加所致。随着高分辨率CT的广泛应用,越来越多的肺GGO被发现,然而,肺GGO除见于早期支气管肺癌,尤其是早期细支气管肺泡癌(bronchioloal-veolar carcinoma,BAC)及不典型腺瘤样增生(atypical adenomatoid hyperplasia,AAH),也可以见于炎性病变、局灶性出血或纤维化等[1]。肺GGO仍然难以鉴别,而对肺GGO诊断及鉴别将直接影响随后的处理:是手术切除或者随访,还是穿刺。PET/CT作为目前最先进的肿瘤诊断工具,具备显示病变生化代谢特点和统览全身的能力,对于肺部磨玻璃结节影的诊断具有一定指导意义[2]。目前,关于PET/CT诊断肺GGO的研究较少。本研究回顾分析82例肺GGO的影像学特点,探讨18 F-FDG PET/CT对诊断肺内良恶性GGO的临床应用价值。
1 资料与方法
1.1 一般资料
收集了2012年1月至2013年1月在同济大学附属肺科医院首诊初治的共82例HRCT初筛检查发现肺GGO,后行18F-PET/CT检查的患者的临床资料及CT、PET/CT影像学资料。所有患者均配套我院64排HRCT影像资料。本研究经过了通院伦理委员会审批,所有参加患者均给予签署书面知情同意书。
1.2 显像剂与仪器
显像剂为18F-FDG(放射化学纯度为98%),由中国人民解放军455医院核医学科提供。显像仪器为美国 GE公司生产的 Discovery VCT 64排PET/CT。
1.3 检查方法
患者禁食6 h以上,检查当日嘱其勿做剧烈运动。检查前查血糖(血糖浓度控制在7.0 mmol/L),测身高、体质量。安静避光、平卧15 min后注射示踪剂 10 ~15 mci,显像剂注射剂量 5.55 MBq/kg,静脉注射后继续静卧40~60 min,进行全身扫描。用螺旋CT透射扫描,扫描锁骨区、腋窝、双肺野。CT扫描层厚3.75 mm,120 kV,自动毫安秒,矩阵512×512,球管旋转速度0.5 s/周,扫描方式HQ模式,扫描视野50 cm,重建层厚2.5 mm。PET:矩阵128×128,采集时间3 min/床位。重建条件:迭代重建,子集28,迭代次数2。重建层厚4.25 mm。PET/CT三维图像重建通过Entegra工作站完成。同时测定相应部位PET/CT的标准摄取值(standardized up take value,SUV)。
1.4 图像分析
所有的CT图像的采集均来自上海市肺科医院影像科。所有PET/CT均于中国人民解放军455医院进行。PET/CT检查均在HRCT检查日起不超过1周内进行。PET/CT图像由分别由两位影像学专家及肺部疾病专家解读分析,所有参与读图者均未知患者诊断结果。读图最终结果通过4名专家协商一致确定。PET/CT结果采用半定量分析,测量病灶部位SUV,包括平均摄取值及最大摄取值。
1.5 诊断方法
所有病例均有明确的手术病理诊断或经临床随访证实的,如经临床随访或适当的抗感染、激素治疗消失的,归类为良性病灶。
1.6 统计学处理
所有的统计分析均采用SPSS 17.0软件进行。采用χ2检验或Fisher精确检验分类变量的比较,采用独立非配对t检验连续变量进行比较。采用单因素分析评估GGO影像学表现特点的差异。采用logistic回归模型进行多因素分析,以确定恶性GGO的独立预测因子。P<0.05为差异有统计学意义。通过ROC曲线绘制检验PET/CT SUV值对GGO鉴别的预测价值。
2 结 果
2.1 患者临床资料分析
82例患者中,良性GGO 32例,恶性50例。女性29例,男性53例;年龄33~79岁,中位年龄56岁;非吸烟患者58例,吸烟患者24例;无肿瘤家族史60例,肿瘤家族史22例;癌标异常7例,75例各项癌标均正常;分期早期75例,中晚期7例。良恶性GGO临床资料分布特点见表1。
表1 良恶性GGO临床资料分布
Tab.1 Clinical data of benign and malignant GGO
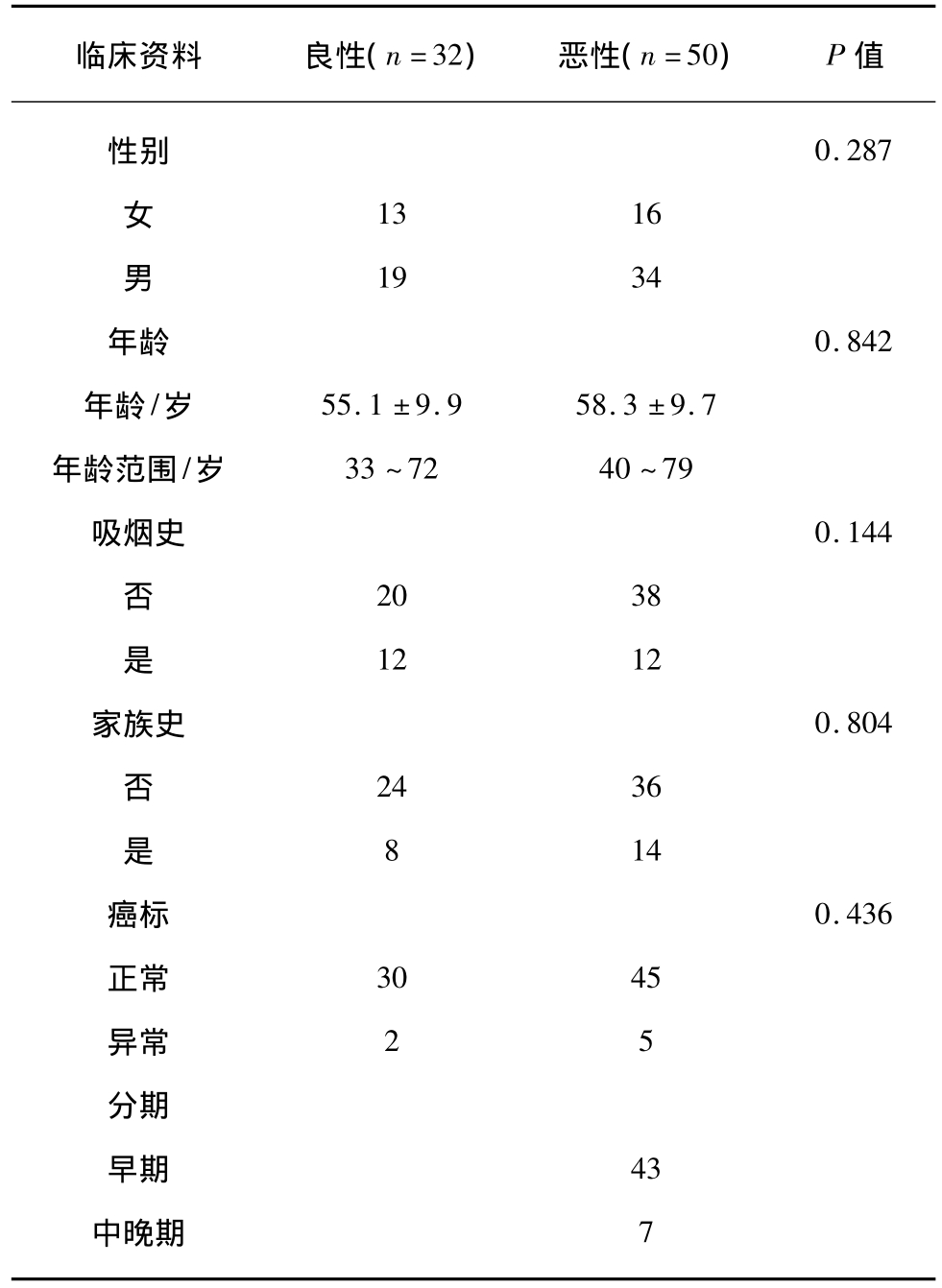
临床资料 良性(n=32) 恶性(n=50) P值性别 0.287女13 16男19 34年龄0.842年龄/岁 55.1 ±9.9 58.3 ±9.7年龄范围/岁 33~72 40~79吸烟史0.144否20 38是12 12家族史0.804否24 36是8 14癌标0.436正常 30 45异常 2 5分期早期 43中晚期7
2.2 病灶影像学特点分析
研究纳入的GGO影像学特点包括:GGO部位、大小、密度、分叶、毛刺、胸膜凹陷征、边缘、充气空泡征、纵膈肺门淋巴结。良恶性GGO影像学特点分布见表2。
单因素分析显示:恶性GGO中,混合型密度、分叶、毛刺、胸膜凹陷征、边界不清、充气空泡征的比例更高,差异存在统计学意义(P<0.05)。
多因素分析中,混合型(ORR:0.069,95%CI:0.008 ~ 0.615,P=0.017)、边 界 不清(ORR:46.899,95%CI:3.518 ~ 625.211,P=0.004)及分叶(ORR:0.051,95%CI:0.005 ~0.477,P=0.009)是恶性 GGO的预测因子,见图1~3、表3。
表2 良恶性GGO影像学特点分布
Tab.2 The distribution of imaging features of benign and malignant GGO
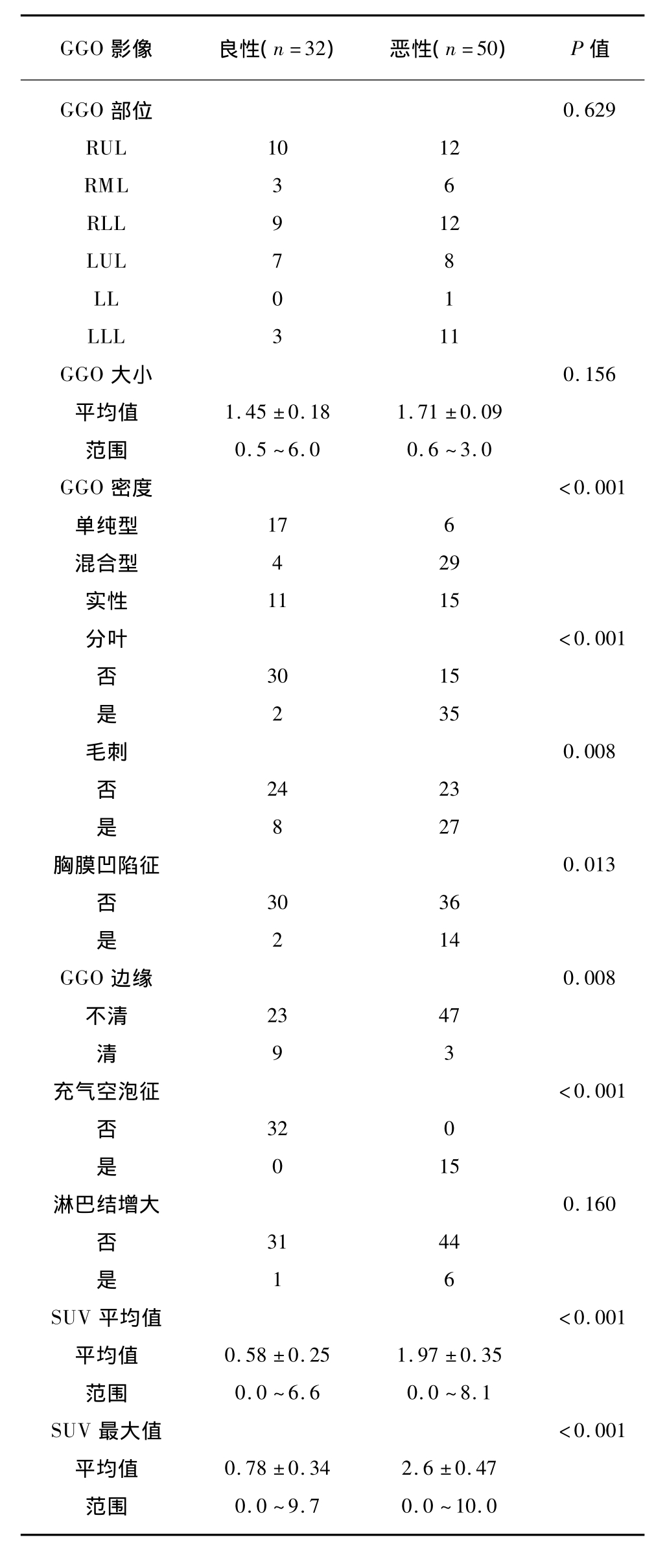
GGO影像 良性(n=32) 恶性(n=50) P值GGO 部位 0.629 RUL 10 12 RML 3 6 RLL 9 12 LUL 7 8 LL 0 1 LLL 3 11 GGO大小0.156平均值 1.45 ±0.18 1.71 ±0.09范围 0.5 ~6.0 0.6 ~3.0 GGO密度<0.001单纯型 17 6混合型 4 29实性 11 15分叶<0.001否30 15是2 35毛刺0.008否24 23是8 27胸膜凹陷征0.013否30 36是2 14 GGO边缘0.008不清 23 47清9 3充气空泡征<0.001否32 0是0 15淋巴结增大0.160否31 44是1 6 SUV平均值<0.001平均值 0.58 ±0.25 1.97 ±0.35范围 0.0 ~6.6 0.0 ~8.1 SUV最大值<0.001平均值 0.78 ±0.34 2.6 ±0.47范围 0.0 ~9.7 0.0 ~10.0
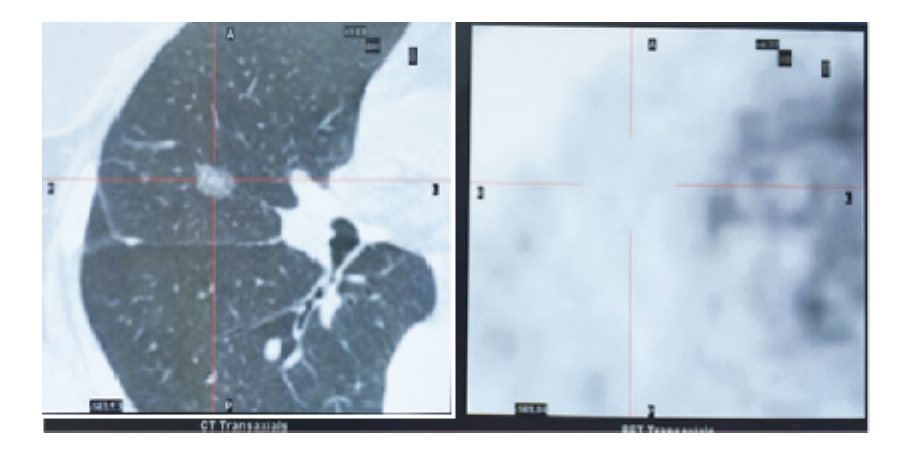
图1 混合型GGO Fig.1 Mixed type GGO
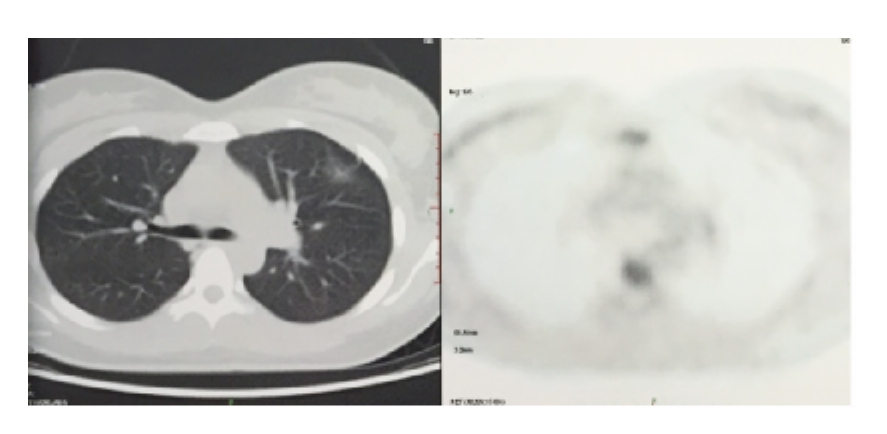
图2 边界不清GGO
Fig.2 The unclear boundary GGO

图3 分叶GGO Fig.3 Leaf GGO
表3 恶性GGO临床及影响的多因素分析
Tab.3 Multivariate analysis of malignant GGO
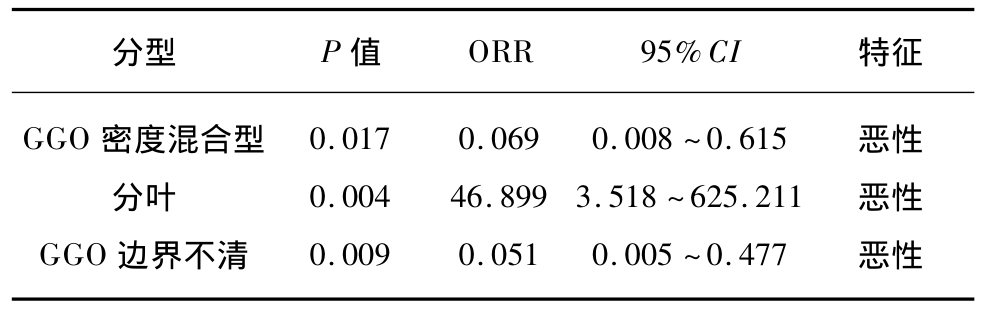
分型 P值 ORR 95%CI 特征GGO 密度混合型 0.017 0.069 0.008~0.615 恶性分叶 0.004 46.899 3.518 ~625.211 恶性GGO 边界不清 0.009 0.051 0.005 ~0.477恶性
2.3 病灶SUV值分析
单因素分析中,SUV平均值及最大值对于鉴别良恶性GGO有意义(表3),但ROC曲线分析结果显示SUV最大值与平均值对于GGO的良恶性鉴别准确性较低(AUC=0.679、0.682)。
2.4 PET/CT对恶性GGO的诊断与CT比较
PET/CT对恶性GGO的诊断与CT比较,其敏感性明显高于 CT(94.0%vs 48.0%),特异性无明显差别(90.6%vs 90.6%)。
3 讨 论
对于GGO患者,仅仅通过胸部CT检查来判定病灶性质是有很大困难,临床上根据气管镜、肺穿刺、痰检等相关检查诊断也要难于结节、占位病灶,继而影响到患者下一步的治疗方案。而PET/CT作为一种敏感有效的检查手段,其对于GGO的临床诊断价值受到人们的关注[3]。
本研究中纳入82例首诊初治的肺GGO,其中51例有病理诊断,31例通过治疗随访确诊。本研究发现,混合型、边界不清及分叶是恶性GGO的预测因子。
GGO单纯型即影像学表现为边缘清楚的均一的半透明密度影,混合型则表现为磨玻璃样病灶伴中央结节状、条状、片状、带状致密影。其中,混合型GGO临床上一直认为恶性可能高,建议早期手术干预[4-5]。本研究将GGO细分为低密度单纯型、混合型及高密度单纯型,结果显示混合型GGO高度提示恶性肿瘤,与既往研究结论相同。
空泡征是肺GGO重要的恶性征象。研究报道,在55例恶性GGO中,31例(56%)病灶出现空泡征支气管充气征,认为边界的清晰程度和病灶内部的含气腔隙是提示恶性的重要征象,其余征象的价值不大。其关于边界清晰度对GGO诊断的意义与本研究的结论相似。但本研究认为空泡征不足以支持恶性GGO的诊断,GGO的密度类型、分叶及边界才是恶性GGO的独立预测因子,这与 Nambu等[6]的研究结论相类似。
分叶征也是恶性肺GGO重要征象之一。范丽等[7]报道,分叶是恶性病变的征象,但不是所有的恶性病变都会出现这样的重要征象。本组资料中,分叶征也是提示恶性GGO的征象。
18F-FDG PET/CT以FDG SUV作为诊断的参考指标。通常肿瘤细胞的恶性程度越高,肿瘤细胞代谢越活跃,SUV就越高。高FDG摄取与病变的恶性程度呈正相关。对于良恶性病变SUV参考值范围的界定,有研究[8]提出SUV>2.5一般考虑恶性,而SUV<2.5一般考虑良性,但是这种标准的提出是建立在实性结节的研究中,GGO中并无相关cut-off值。在本研究中,有60例GGO的SUV最大值<1,43例GGO的FDG无摄取,表明GGO样肺癌并非无18F-FDG PET/CT,但多数为F-FDG轻度或者极低摄取,尤其是实性成分较少的 GGO,FFDG摄取并不稳定。本研究也发现SUV最大值与平均值对于GGO的良恶性鉴别准确性较低(AUC=0.679、0.682),而研究[9]也认为 SUV 值对于GGO的良恶性鉴别存在有争议。尽管本研究中SUV值的ROC分析显示SUV值对于恶性GGO的准确率较低,但是仍然表明18F-FDG PET/CT较传统CT对于恶性GGO的诊断灵敏度更高。依据GGO的影像特点,结合SUV最大值最为辅助参考,18F-FDG PET/CT对于恶性GGO的早期诊断会有很大价值。
在本研究中,GGO的大小对于良恶性的鉴别诊断无意义,这与其他研究略有不同。Nakata等[10]研究表明,鉴别肺 GGO良恶性大小的临界值为10 mm。研究[9,11]表明,肺 GGO 大于 8 mm 多为恶性。研究[12]也强调10 mm以上的GGO需警惕恶性可能。但这些研究样本量偏少,而且部分研究细支气管肺泡癌比例过大,结果仍有争议。一般来说,如果肺部结节样病灶在2年期间内无变化或缩小,则该病灶通常被认为良性。然而,在实际临床工作中,部分患者的孤立性结节样病灶存在数年以上,亦未出现明显大小改变,但最终确诊为BAC[13-14]。部分表现为GGO的病灶,甚至会缩小,但是密度通常会增高[15]。
本研究也有不足之处,如样本量仍偏小,过多FDG未摄取GGO病例等,希望未来纳入更多病例,并适当调整扫描策略,以期获得更完全资料进行分析。
【参考文献】
[1] Coo JM,Park CM,Lee HJ.Ground-glass nodules on chest CT as imaging biomarkers in the management of lung adenocarcinoma[J].Am J Roentgenol,2011,196(3):533-543.
[2] 高永举,Zsoct Szabo.细支气管肺泡癌18F-FDG PET/CT显像的代谢和形态特征[J].中华核医学杂志,2009,29:238-241.
[3] Miele E,Spinelli GP,Tomao F,et al.Positron Emission omography(PET)radiotracers in oncologyutility of F-Huoro-deoxy-glucose(FDG)-PET in the management of patients with non-small-cell lung cancer(NSCLC)[J].J Exp Clin Cancer Res,2008,27:52.
[4] 高然,石建奎,张洪.肺良、恶性磨玻璃结节的CT影像分析[J].中国临床医生,2011,39(9):42-44.
[5] 仲晨曦,赵珩,澹台冀澄,等.胸腔镜手术治疗肺单纯性磨玻璃样病灶[J].中华胸心血管外科杂志,2012,28(4):227-229.
[6] Nambu A,Araki T,Taguchi Y,et al.Focal area of ground-glass opacity and ground-glass opacity predominance on thin-section CT:discrimination between neoplastic and non neoplastic lesions[J].Clin Radiol,2005,60(9):1006-1017.
[7] 范丽,刘士远,李清楚,等.肺部局灶性磨玻璃密度结节多排螺旋CT征象良恶性的Logistic回归分析[J].第二军医大学学报,2010,31(10):1060-1064.
[8] Khalaf M,Abdel-Nabi H,Baker J,et al.Relation between nodulesizeand 18F-FDG-PET SUV for maglignant and benign pulmonary nodules[J].J Hematol Oncol,2008,1:13.
[9] Kim HK,Choi YS,Kim K,et al.Management of ground glass opacity lesions detected in patients with otherwise operable non-small cell lung cancer[J].J Thorac Oncol,2009,4(10):1242-1246.
[10] Nakata M,Saeki H,Takata I,et al.Focal ground glass opacity detected by low-dose helical CT[J].Chest,2002,121(5):1464-1467.
[11] Lee HJ,Coo JM,Lee CH,et al.Predictive CT findings of malignancy in ground glass nodules on thinsection chest CT:the efects on radiologist performance[J].Eur Radiol,2009,19(3):552-560.
[12] 刘晓飞,姚昊,王志忠,等.18F-FDGPET/CT对磨玻璃结节样肺癌的临床应用价值[J].现代肿瘤医学,2014,22(5):1090-1093.
[13] Min JH,Lee HY,Lee KS,et al.Stepwise evolution from a focal pure pulmonaryground-glass opacity nodule into an invasive lung adenocarcinoma:an observation for more than 10 years[J].Lung Cancer,2010,69(1):123-126.
[14] Lindell RM,Hartman TE,Swensen SJ,et al.5-year lung cancer screening experience:growth curves of 18 lung cancers compared to histologic type,CT attenuation,stage,survival,and size[J].Chest,2009,136(6):1586-1595.
[15] Duann CW, HungJJ, HsuPK,etal. Surgical outcomes in lung cancer presenting as ground-glass opacities of 3 cm or less:a review of 5 years experience[J].J Chin Med Assoc,2013,76(12):693-697.