牙胚发育过程中组织和细胞的分化都是由许多分子组成的信号网络调控的,这些信号网络包括生长因子、受体分子、信号转导分子和转录因子等。受体分子在生长因子的作用下,将信号传导至细胞内,细胞内信号转导分子被激活,从而活化转录因子使其转位至核内最终活化靶基因,由此调控牙胚的发育。钙离子是细胞生命活动的重要分子,作为细胞内二级信使调节细胞的各种功能,从细胞分裂、分化直至凋亡。近年来,研究[1]揭示了经典瞬时受体电位通道(transient receptor potential canonical channel,TRPC)是一种重要的具有多种功能的跨膜信号转导分子,由TRPC通道调节的钙离子流动直接引起细胞内钙信号改变从而影响后续信号活动及细胞功能。现已发现哺乳动物的TRPC超家族包括7个成员即TRPC 1~TRPC7。其中TRPC1与外胚层发育而来的表皮及神经组织密切相关[2-3],而对于同一胚层发育而来的牙齿,它们的关系尚未见报道。本研究探讨TRPC1在大鼠牙胚发育过程中的作用机制。
1 材料与方法
1.1 主要试剂和仪器
TRPC1的兔抗鼠的多克隆抗体购自以色列Alomone公司;多聚甲醛、乙二胺四乙酸二钠、石蜡、无水乙醇、二甲苯等购自上海生物工程有限公司;苏木精、伊红染液购自南京建成科技有限公司;免疫组化SABC试剂盒、DAB显色试剂盒购自武汉博士德公司;枸橼酸钠抗原修复液购自北京中山生物技术有限公司;石蜡切片机、石蜡展片机、石蜡烤片机购自德国Leica公司;电热恒温鼓风干燥箱购自上海跃进生物器械有限公司;光学显微镜及照相系统购自日本Nikon公司。
1.2 动物模型及标本制备
取3月龄SD大鼠(同济大学动物实验中心提供),以雌雄比2∶1合笼,阴栓出现当天中午定为胚胎发育的第0.5天(E0.5)。选择磨牙发育各期标本,牙齿发育第 14.5、16.5、18.5 天(E14.5、E16.5、E18.5)以及出生后第1、7天(P1、P7)的 SD 大鼠各5只。乙醚过量处死孕鼠及出生后大鼠,E14.5、E16.5、E18.5组可取大鼠头部,出生后大鼠可在体式显微镜下分离并切取含下颌第一磨牙的下颌骨。标本置于4%的多聚甲醛中固定24 h,经过固定后的组织常规脱水,透明,石蜡定向包埋,行冠状5 μm切片。P1、P7标本需置于100 g/L EDTA中脱钙完全后,再行常规脱水、透明、包埋、切片。
1.3 方法
1.3.1 H-E染色 石蜡切片脱蜡至水后,使用H-E染色剂,按说明书进行H-E染色,观察组织形态变化。
1.3.2 免疫组织化学染色 石蜡切片脱蜡至水后,使用SABC试剂盒,按说明书进行免疫组化染色,一抗使用1∶50稀释的TRPC1多克隆抗体。滴加新鲜配制DAB显色液显色,苏木精复染后脱水、透明、封片。以PBS代替一抗设为空白对照。
1.3.3 阳性结果判定 根据细胞胞浆或胞膜染色强度可分为:阴性(胞浆内无棕黄色颗粒或呈均匀一致的淡黄色,与背景一致);弱阳性(胞浆内可见淡黄色颗粒明显于背景);阳性(胞浆内可见棕黄色颗粒);强阳性(胞浆内可见大量深棕色颗粒),TRPC1阳性表达细胞膜或胞质呈棕黄色。
2 结 果
2.1 H-E 染色结果
E14.5大鼠磨牙牙胚处于蕾状期,可见牙板末端的上皮细胞增生,形成上皮芽状如花蕾,其构成细胞类似基底细胞,呈立方或矮柱状。上皮下方和周围的外胚间充质细胞增生、聚集包绕上皮芽(图1A)。E16.5大鼠磨牙处于帽状期,上皮芽继续向外胚间充质延伸生长,基底部向内凹陷如帽状,此时形成的成釉器分化为3层细胞:外釉上皮层、内釉上皮层和星网状层。外胚间充质形成了牙乳头和牙囊(图1B)。E18.5大鼠磨牙牙胚处于钟状早期,在该期随着成釉器的发育,内釉上皮凹陷更深,形似吊钟,成釉器分化为4层:外釉上皮层、内釉上皮层、星网状层和中间层(图1C)。P1大鼠磨牙牙胚处于钟状晚期,内釉上皮细胞分化为高柱状的成釉细胞,相邻的牙乳头细胞分化为具有分泌功能的前成牙本质细胞,有少许牙本质形成(图1D)。P7大鼠磨牙处于牙根形成期,P7已有牙釉质、牙本质及牙髓组织形成,颈环处形成赫特维希上皮根鞘(HERS)(图1E)。
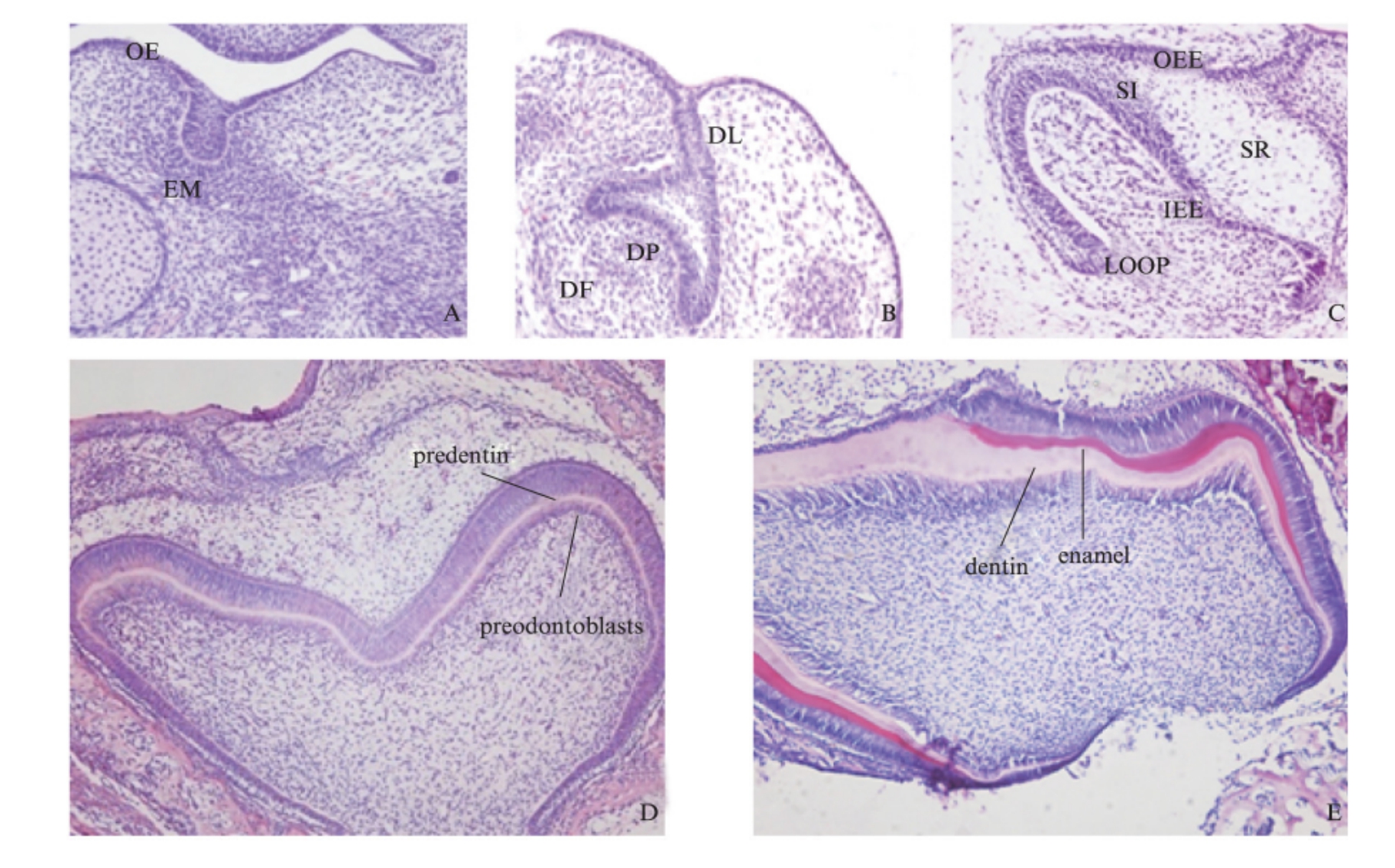
图1 大鼠牙齿发育 E14.5、E16.5、E18.5、P1、P7 标本 H-E 染色结果
Fig.1 H-E staining results of developing rat tooth germ on the days of E14.5、E16.5、E18.5、P1、P7
A为E14.5大鼠磨牙,处于蕾状期;B为E16.5大鼠磨牙,处于帽状期;C为E18.5大鼠磨牙,处于钟状早期;D和E分别为
P1和P7大鼠磨牙,处于钟状晚期;D、E放大倍数为100,A、B、C放大倍数为200;OE:口腔上皮;DL:牙板;DP:牙乳头;
DF:牙囊;EM:外胚间充质;OEE:外釉上皮层;IEE:内釉上皮层;SR:星网状层;SI:中间层
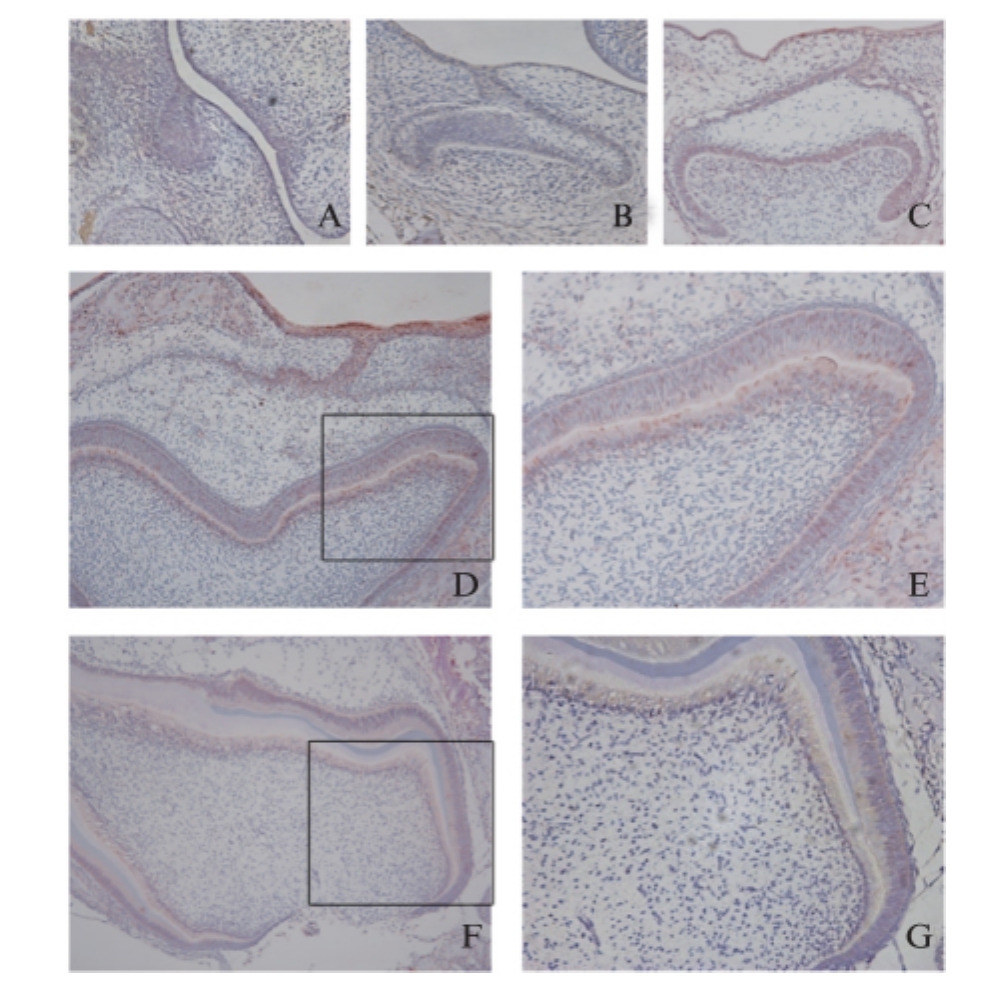
图 2 大鼠牙齿发育 E14.5、E16.5、E18.5、P1、P7 标本TRPC1免疫组化染色结果
Fig.2 TRPC1 immunohistochemical staining of developing rat tooth germ on the days of E14.5、16.5、18.5、P1、P7
A为E14.5免疫组化染色;B为E16.5免疫组化染色;C为E18.5免疫组化染色;D、E为P1免疫组化染色;F、G为P7免疫组化染色;E、G分别为图D、F所示方框区域的放大,其中图D、F放大倍数为100,图 A、B、C、E、G 放大倍数为200
2.2 免疫组化结果
TRPC1在蕾状期(E14.5)表达:牙板上皮、牙蕾上皮及其下方周围间充质细胞呈弱阳性表达(图2A);帽状期(E16.5)表达:外釉上皮、内釉上皮及口腔牙板上皮细胞可见阳性表达,牙囊呈弱阳性表达,星网状层细胞呈阴性表达(图2B);钟状早期(E18.5)表达:外釉上皮、内釉上皮、牙板上皮、中间层细胞呈强阳性表达,牙囊及部分牙乳头细胞呈弱阳性表达,星网状层细胞呈阴性表达(图2C);钟状晚期(P1)表达:成釉细胞、成牙本质细胞及近成牙本质细胞层的牙乳头细胞呈强阳性表达,外釉上皮、星网状层细胞及牙囊呈弱阳性表达(图2D、图2E);硬组织形成期(P7)表达:在成釉细胞、成牙本质细胞可见阳性表达,牙乳头细胞皆为阴性表达(图2F、图 2G)。
3 讨 论
经典瞬时受体电位通道是近年来备受重视的具有多种功能的跨膜信号转导分子,被认为是受体门控式钙通道(receptor operated calcium channel,ROC)和钙池操纵式钙通道(store-operated calcium channel,SOC)的分子基础[4]。哺乳动物的 TRPC超家族中共发现7个成员即TRPC 1~TRPC7,其中TRPC1已被证实在各种细胞类型中与SOC密切相关[5-6]。将TRPC1表达于人HSG(下颌下腺细胞)可以呈数倍地增强该细胞的钙库依赖性钙流入(store-operated calcium entry,SOCE),并且细胞内源性SOCE可以因TRPC1的反义cDNA表达而大大削弱[7]。Cai等[8-9]发现,TRPC 通道在人的牙龈角化上皮细胞上有表达,其中TRPC1在牙龈角质细胞分化过程中发挥关键作用。在帕金森病的小鼠模型中,TRPC1对于维持钙平衡,促进神经元存活抑制神经元的退化从而减缓或者预防疾病的发展过程起到了关键作用[10]。TRPC1参与了外胚层组织细胞内钙平衡调节,从而影响细胞的移动、增殖和分化。TRPC1是否参与同一胚层发育而来的牙齿的发育过程是目前研究的热点。
本实验首次证实在大鼠牙胚发育过程中TRPC1呈动态时空表达模式:(1)从牙胚发育早期上皮细胞就表达TRPC1,尤其钟状早期内釉细胞及钟状晚期(硬组织形成期)成釉上皮细胞质TRPC1强阳性表达;(2)成釉细胞及成牙本质细胞在钟状晚期时TRPC1呈强阳性表达,至牙根形成期时成釉细胞及成牙本质细胞质阳性表达TRPC1,而牙乳头间充质细胞变为弱阳性表达,至牙根形成期时未见表达。本研究从细胞水平定位TRPC1在牙胚发育过程中的动态表达,发现TRPC1的表达可能与成釉器的发展阶段有关。帽状期和钟状期属于牙胚发育早期,此期上皮细胞中TRPC1通道呈阳性表达并且信号逐渐增强,该通道可能对上皮细胞有重要作用,而牙囊等间充质细胞TRPC1通道呈弱阳性表达,该通道可能部分参与细胞信号转导的过程。虽然TRPC1通道的精确调节机制并不十分清楚,其在牙胚发育中的表达变化可能与由TRPC1通道调节的钙离子流动有关。钙离子与机体各项生理活动都有着十分密切的关联,由TRPC1通道调节的钙离子流动对于机体神经等组织细胞的增殖分化起重要作用,同时,TRPC1通道可以与其他通道相互作用形成具有不同特性的通道,如在人下颌下腺细胞中TRPC1通道与TRPC家族其他通道相互作用可以形成具有相对地钙离子选择性的阳离子通道,另外,TRPC1通道也可与广泛的信号蛋白相互作用,该通道信号复合体包含关键的钙离子信号蛋白可作用于激动剂激活信号如PLC、CaM等的上游,对细胞的信号调节具有重要作用[1]。牙胚发育早期,上皮与间充质相互作用,细胞信号传导增强,需要大量钙离子参与,推测由TRPC1通道调节的钙离子流动可能参与了上皮细胞的增殖与分化,这提示TRPC1可能在牙胚细胞增殖、分化和发育中发挥重要作用。
随着成釉器的发育,内釉细胞分化为成釉细胞,当成釉细胞分化成熟后诱导牙乳头细胞分化为早期的成牙本质细胞,此时细胞已具备合成蛋白的功能,而后前成牙本质细胞再分化成熟为成牙本质细胞,在成釉器钟状晚期时开始形成牙本质;硬组织形成期分化成熟的成釉细胞和成牙本质细胞分泌有机基质并矿化,此期釉质与牙本质完成矿化过程。而TRPC1在钟状晚期的成釉细胞和成牙本质细胞呈强阳性表达,在硬组织形成期阳性强度减弱,提示TRPC1可能与成釉细胞和成牙本质细胞的分化成熟密切相关,但对于成釉细胞和成牙本质细胞调控的矿化过程所起作用相对减弱。此外,最近的研究发现成骨细胞的增殖与TRPC1密切相关。Abed等[11]采用干扰RNA的方法证实TRPC1对于成骨细胞中钙离子内流和细胞增殖起关键作用,由于牙齿和骨组织二者组成相似,形成机制相仿,提示TRPC1通道可能与成釉细胞及成牙本质细胞中钙离子内流有密切关系,推测TRPC1在硬组织形成和矿化中起重要作用,这对于了解TRPC1的功能提供了新的视野,为后续实验提供了新的研究方向。
本实验研究发现TRPC1在早期牙胚发育各阶段的表达具有一定时空表达特异性,并与之前研究发现的 TRPC1通道的生理功能进行探讨,提示TRPC1可能在牙发育过程中对于牙胚细胞增殖、分化和上皮-间充质相互作用的起重要影响,并与成釉细胞和成牙本质细胞的分化、成熟及功能发挥密切相关。
【参考文献】
[1] Ong HL,de Souza LB,Cheng KT,et al.Physiological functions and regulation of TRPC channels[J].Handb Exp Pharmacol,2014,223:1005-1034.
[2] Leuner K,Kraus M,Woelfle U,et al.Reduced TRPC channel expression in psoriatic keratinocytes is associated with impaired differentiation and enhanced proliferation[J].PLoS One,2011,6(2):e14716.
[3] McGurk JS,Shim S,Kim JY,et al.Postsynaptic TRPC1 function contributes to BDNF-induced synaptic potentiation at the developing neuromuscular junction[J].J Neurosci,2011,31(41):14754-14762.
[4] Liao Y,Abramowitz J,Birnbaumer L,et al.The TRPC family of TRP channels:roles inferred(mostly)from knockout mice and relationship to ORAI proteins[J].Handb Exp Pharmacol,2014,223:1055-1075.
[5] Ambudkar IS,Ong HL,Liu X,et al.TRPC1:the link between functionally distinct store-operated calcium channels[J].Cell Calcium,2007,42(2):213-223.
[6] Beech DJ.TRPC1:store-operated channel and more[J].Pflugers Arch,2005,451(1):53-60.
[7] Liu X,Wang W,Singh BB,et al.Trp1,a candidate protein for the store-operated Ca2+influx mechanism in salivary gland cells[J].J Biol Chem,2000,275(5):3403-3411.
[8] Cai S,Fatherazi S,Presland RB,et al,TRPC channel expression during calcium-induced differentiation of human gingival keratinocytes[J].J Dermatol Sci,2005,40(1):21-28.
[9] Cai S,Fatherazi S,Presland RB,et al.Evidence that TRPC1 contributes to calcium-induced differentiation of human keratinocytes[J].Pflugers Arch,2006,452(1):43-52.
[10] Selvaraj S,Sun Y,Watt JA,et al.Neurotoxininduced ER stress in mouse dopaminergic neurons involves downregulation of TRPC1 and inhibition of AKT/mTOR signaling[J].J Clin Invest,2012,122(4):1354-1367.
[11] Abed E,Labelle D,Martineau C,et al.Expression of transient receptor potential(TRP)channels in human and murine osteoblast-like cells[J].Mol Membr Biol,2009,26(3):146-158.