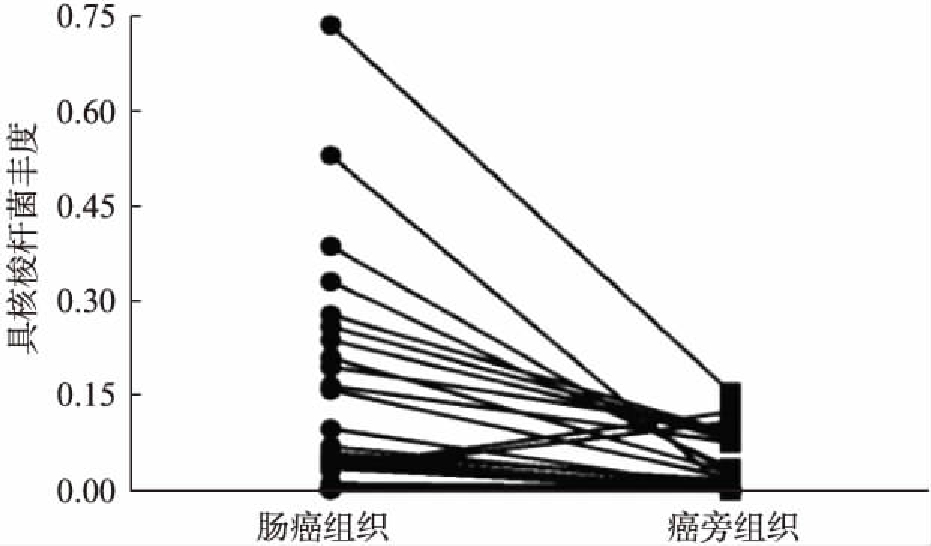
图1 具核梭杆菌在大肠癌及其癌旁组织中丰度
Fig.1 Relative abundance of Fusobacterium nucleatum in colorectal carcinomas and paracancerous tissues
·基础研究·
(同济大学附属第十人民医院普外科,上海 200072)
【摘要】目的 研究具核梭杆菌在大肠癌与癌旁组织中的丰度变化及其组织定位,探讨与大肠癌发生的相关性。方法 收集35例大肠癌及其癌旁组织标本,应用实时荧光定量PCR技术检测具核梭杆菌在肠癌及其癌旁组织的丰度,荧光原位杂交检测该杆菌在肠癌组织中的定位。结果 具核梭杆菌在77.1%(27/35)的肠癌和相应癌旁组织均可检出,17.1%(6/35)的肠癌和癌旁组织均不可检出,5.7%(2/35)的肠癌组织检出,癌旁组织未检出;且肿瘤部位具核梭杆菌丰度显著高于癌旁组织(P<0.01)。荧光原位杂交显示具核梭杆菌主要定植于肠黏膜表面。具核梭杆菌在肠癌组织中的丰度与患者的性别、年龄、肿瘤大小、浸润深度,淋巴结转移、临床肿瘤分期无关(P>0.05)。结论 具核梭杆菌在肠癌组织中呈高感染负荷状态,且主要附定值与大肠癌黏膜表面,可能与大肠癌的发生相关。
【关键词】大肠肿瘤;具核梭杆菌;丰度
大肠癌(colorectal cancer,CRC)是最常见的消化道恶性肿瘤之一[1]。每年有超过100万新发病例,超过50万人死于结直肠癌[2]。结直肠癌发病机制复杂。研究[3-4]发现,家族性腺瘤息肉病、大肠癌个人或家族史、肠道慢性炎症、大肠腺瘤、年龄>50岁都是罹患大肠癌的危险因素,饮食、生活习惯、肠道菌群也对肠癌的发生有着重要作用。
正常情况下,肠道菌群以厌氧菌为主,双歧杆菌和乳酸杆菌为主的益生菌与肠上皮细胞特异性受体结合有序定植于肠道,形成一道有层次的生物屏障,保护肠道免受病原菌黏附和侵袭[5]。研究[6-8]表明,肠道菌群改变与大肠癌密不可分,这些菌群通过调控肠上皮细胞增殖分化、提供营养物质、抑制病原菌过度增殖、参与炎症反应、调节肠道免疫系统等影响肠道肿瘤的发生;在小鼠肠炎模型中应用抗生素或肠道菌群移除均可显著降低肠炎相关性大肠癌的发病率[9-10];作为大肠癌发生的高危因素,高脂、高蛋白饮食、饮酒和慢性炎症可能通过改变肠道菌群的结构与功能参与大肠癌的发生[11-13]。最新研究[14-15]表明,梭杆菌属在大肠癌中较癌旁组织丰度显著增高,具核梭杆菌(Fusobacterium nucleatum)增高尤为明显,表明具核梭杆菌感染可能与大肠癌发生有关。但尚未明确具核梭杆菌在大肠癌变过程中的丰度变化趋势及其促进肠道黏膜癌变的作用机制。本实验通过收集肠癌及其癌旁组织,采用RT-PCR检测肠癌及其癌旁组织中具核梭杆菌丰度,荧光原位杂交检测肠黏膜具核梭杆菌定性定位,探讨具核梭杆菌感染与大肠癌的相关性。
1.1 材料
荧光定量PCR试剂盒购于TaKaRa公司;5′端和3′端地高辛双标记的具核梭杆菌特异探针和肠道菌群通用探针由生工生物工程(上海)股份有限公司合成;荧光素标记的地高辛抗体购自罗氏公司。
1.2 荧光定量PCR
取液氮冷冻的组织,按TRIzol一步法抽提总RNA,紫外分光光度计测RNA浓度,凝胶电泳确定RNA片段完整性。采用Reverse Transcriptase M-MLV进行反转录合成cDNA,具体操作参照试剂盒说明书。以cDNA作为模板,以β-Actin和具核梭杆菌特异16sRNA引物进行PCR扩增。β-Actin作为内参。β-Actin上游引物序列:CCCA-AGGCCAACCGCGAGAAGATG,下游:GTC-CCGGCCAGCCAGGTCCAGA。具核梭杆菌16s-RNA上游引物序列:CTTAGGAATGAGA-CAGAGATG,下游:TGATGGTAACATACGAAA-GG。PCR反应体系为TaKaRa SYBR Premix Ex Taq 10μl,上下游引物各0.4μl,cDNA 2μl,超纯水7.2μl共20μl反应体系。反应条件为:95℃变性10s,60℃退火20s,72℃延伸20s共40个循环。每组设3个副孔,采用2-ΔCt值计算具核梭杆菌的相对丰度(ΔCt值=具核梭杆菌CT值-β-Actin CT值)。
1.3 荧光原位杂交(FISH)
肠癌组织石蜡切片经二甲苯脱蜡,乙醇(100%、85%、70%)梯度复水后溶菌酶(10U/μl 1% PBS)37℃处理20min,用PBS漂洗,梯度乙醇脱水(70%、85%、100%),自然晾干。于暗处将含探针浓度为5ng/μl的杂交缓冲液加至杂交区域,封片,56℃杂交过夜。具核梭杆菌特异探针序列[16]:Digoxigenin-5′-CGCAATACAGAGTTGAGC-CCTGC-3′-Digoxigenin。肠道菌群通用探针序列[17]:Digoxigenin-5′-GCTGCCTCCCGTAGGAGT-3′-Dig-oxigenin。杂交过夜后将载玻片于58℃预热的杂交缓冲液漂洗10min,PBS漂洗,暗处自然晾干。将荧光素标记的地高辛抗体滴在杂交区域,暗处37℃孵育30min,PBS冲洗,滴加10μl DAPI,封片。-20℃冻存,1h后荧光显微镜进行观察杂交信号并拍照。
1.4 统计学处理
采用SPSS 19.0统计软件进行数据分析,采用非参数检验比较具核梭杆菌与临床病例参数的关系及肿瘤和癌旁组织丰度差异。P<0.05为差异有统计学意义。
2.1 具核梭杆菌在肿瘤和癌旁组织中丰度
RT-PCR可在82.9%(29/35)的肠癌组织、77.1%(27/35)的癌旁组织中检出具核梭杆菌,且具核梭杆菌丰度在癌组织显著高于癌旁组织(P<0.01),见图1;但其丰度与肠癌中患者性别、年龄、肿瘤大小、浸润深度、淋巴结转移、肿瘤临床分期无关(P>0.05),见表1。

图1 具核梭杆菌在大肠癌及其癌旁组织中丰度
Fig.1 Relative abundance of Fusobacterium nucleatum in colorectal carcinomas and paracancerous tissues
表1 具核梭杆菌丰度与临床病例参数的关系
Tab.1 The relationship between Fusobacterium nucleatum abundance and clinical parameters
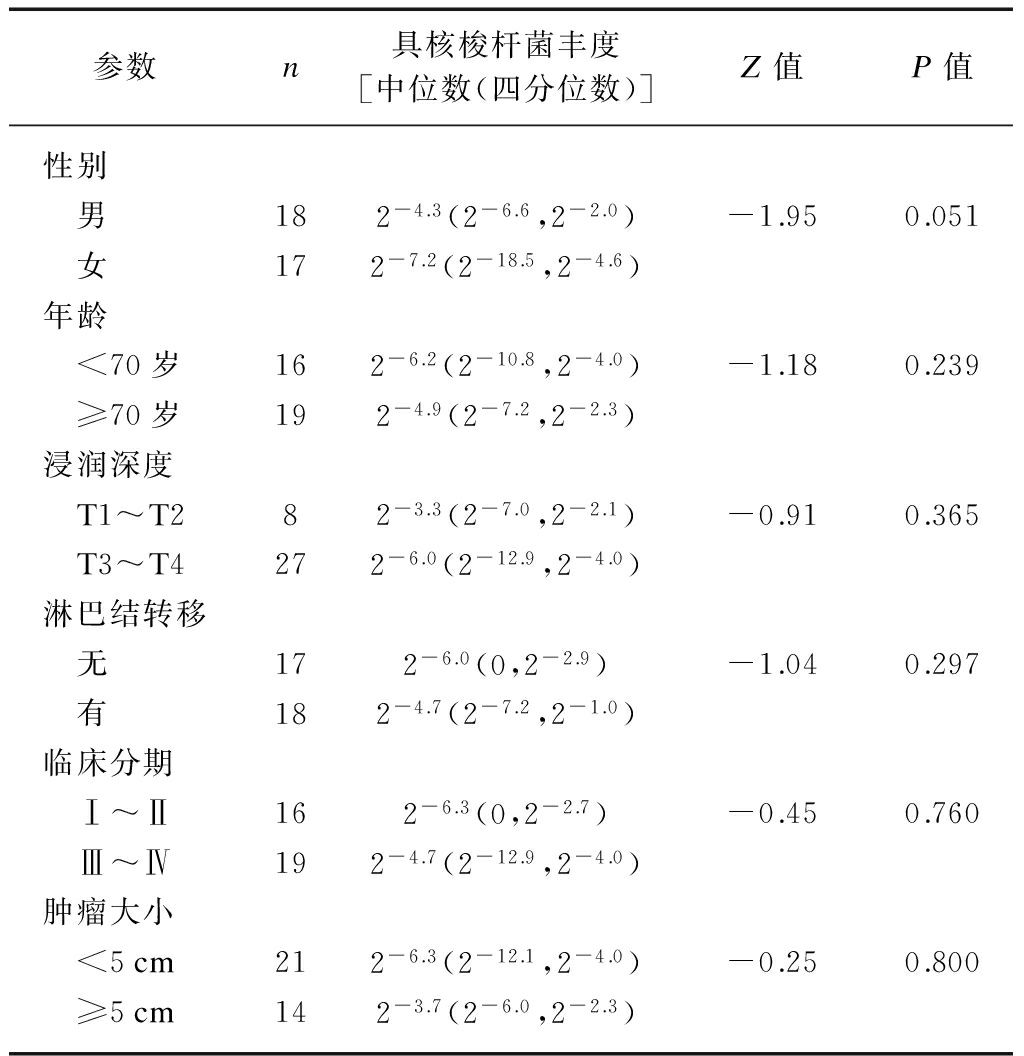
参数n具核梭杆菌丰度[中位数(四分位数)]Z值P值性别 男182-4.3(2-6.6,2-2.0)-1.950.051 女172-7.2(2-18.5,2-4.6)年龄 <70岁162-6.2(2-10.8,2-4.0)-1.180.239 ≥70岁192-4.9(2-7.2,2-2.3)浸润深度 T1~T282-3.3(2-7.0,2-2.1)-0.910.365 T3~T4272-6.0(2-12.9,2-4.0)淋巴结转移 无172-6.0(0,2-2.9)-1.040.297 有182-4.7(2-7.2,2-1.0)临床分期 Ⅰ~Ⅱ162-6.3(0,2-2.7)-0.450.760 Ⅲ~Ⅳ192-4.7(2-12.9,2-4.0)肿瘤大小 <5cm212-6.3(2-12.1,2-4.0)-0.250.800 ≥5cm142-3.7(2-6.0,2-2.3)
2.2 具核梭杆菌荧光原位杂交定位分析
为进一步分析具核梭杆菌在肠道中定位和定性,通过荧光原位杂交对肠癌中具核梭杆菌分析表明,具核梭杆菌主要定位于肠黏膜表面,见图2。
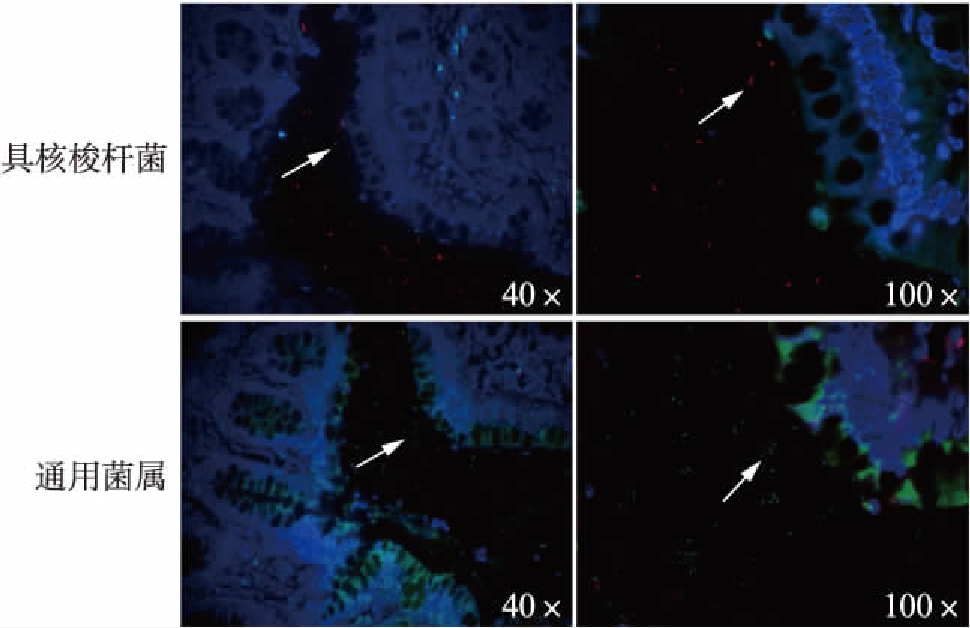
图2 肠癌组织具核梭杆菌荧光原位杂交
Fig.2 Fluorescence in situ hybridization of Fusobacterium nucleatum in colorectal cancer tissues
红色信号表示具核梭杆菌,蓝色信号表示通用菌属
具核梭杆菌是一种专性厌氧的革兰阴性菌,可黏附和侵入多种上皮细胞;且为较强的机会致病菌,与牙周炎和多种其他疾病相关。在鼻窦炎、心内膜炎、化脓性关节炎、扁桃体炎等感染灶中菌可分离出具核梭杆菌[18-20];其侵入胎膜可引起早产和死胎[21]。过去普遍认为具核梭杆菌主要在口腔定植,很少定植于肠道。近年来,通过荧光原位杂交发现急性阑尾炎患者手术切除阑尾标本中侵袭性梭杆菌属(包括具核梭杆菌)的丰度显著升高[22],提示具核梭杆菌可通过口腔进入肠道,参与肠道感染性疾病的发生。研究采用16sDNA测序技术发现具核梭杆菌在肠癌组织呈高感染负荷现象,推测具核梭杆菌感染可能与大肠癌的发生相关。本研究证实大肠癌有具核梭杆菌高感染负荷现象,具核梭杆菌在肠癌中检出率82.9%,癌旁组织77.1%,且前者丰度显著高于后者(P<0.05);但与肠癌患者的性别、年龄、肿瘤大小、浸润深度、淋巴结转移、肿瘤临床分期无关。原位荧光杂交显示,具核梭杆菌主要黏附定植于肠道黏膜上皮,表明其感染可能与肠癌发生相关。
具核梭杆菌具有黏附、侵袭性,可黏附侵入多种上皮细胞并和其他细菌形成共聚性菌斑[23]。大肠肿瘤发生过程中伴随明显的肠屏障损伤,利于肠道菌群代谢期产物在病变部位富集;这些菌群或其代谢产物通过激活肿瘤相关免疫细胞,诱导IL-23、IL-17多种炎性因子产生,进一步促进肿瘤的生长和进展[24];同其他菌属相比,肿瘤部位具核梭杆菌富集更加明显[16-17],这可能与梭杆菌属与上皮细胞黏附侵袭能力较强有关。有研究发现,具核梭杆菌侵入细胞,通过激活维甲酸诱导基因I,激活NF-KB通路,促进炎症反应[25];或通过IL-1β转化酶和NF-KB途径诱导外周血单个核细胞和外周血多形核细胞的凋亡,从而逃避免疫反应[26]。目前Fn的分子机制研究大多在其本身侵袭定植及局部炎症反应的毒性作用,对结肠上皮细胞后续分子信号影响尚未深入报道。
为明确具核梭杆菌的促癌机制,研究发现具核梭杆菌参与肿瘤浸润淋巴细胞的募集,而后者产生的促炎免疫微环境可驱动大肠癌发生[27]。Kostic等[27]对肠道自发成瘤小鼠(APCmin/+)灌胃添加具核梭杆菌,发现小鼠肠道组织中骨髓源性CD11b+淋巴细胞浸润且有促癌作用,树突状细胞、免疫抑制性细胞(MDSCs)以及表达精氨酸酶1的肿瘤相关巨噬细胞(TAMs)均显著增多。通过对133例大肠癌组织进行具核梭杆菌丰度检测,发现其丰度不但与TAMs、MDSCs及DCs等免疫细胞标志物表达水平有高度协同性,而且与NF-KB及多种促炎基因表达水平显著正相关,从而驱动肠上皮细胞在促炎免疫微环境中向大肠癌演变。Rubinstein等[28]发现,具核梭杆菌表面的黏附素FadA可结合E钙粘蛋白(E-cadherin)细胞外重复结构域EC5,诱导炎症因子介导的E-钙粘素内摄,激活细胞内的β-catenin信号,上调Wnt通路,引起肠上皮细胞癌变;瘤体内注射活性FadAc可促进移植瘤生长,而注射具核梭杆菌可在3~5d内引起具核梭杆菌侵入大肠癌移植瘤并导致脓肿形成(E.coli或者FadA阴性的具核梭杆菌则不能)。针对FadA与E-Cadherin的EC5结合的特性,利用Co-IP鉴定并设计了一段与FadA结合部位(EC53区)互补的11个氨基酸的合成肽(ASANWTIQYND),发现该多肽是拮抗和抑制Fn侵袭性的最短肽段,可阻断FadA与E-cadherin结合,终止具核梭杆菌激活Wnt通路引起的结肠上皮细胞恶性增殖。目前,具核梭杆菌的在大肠癌发生发展中的作用尚不十分明确,有待进一步研究。
肠道微生态平衡对维持机体健康状态有重要作用。越来越多的证据表明,肠道菌群在大肠癌的发病中发挥关键作用。随着这些宿主-细菌相互作用的机制日益明确,先天免疫和适应性免疫反应在肿瘤发病中的作用也得到了重视。故需进一步论证肠道菌群、饮食和免疫系统在大肠癌发病中的作用。本实验表明具核梭杆菌感染可能与肠癌相关,但其感染是大肠癌促发因素还是大肠癌发生后局部肿瘤微环境改变引起具核梭杆菌黏附定植,仍需进一步研究。
【参考文献】
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69- 90.
[2] Wang X,Kuang YY,Hu XT.Advances in epigenetic biomarker research in colorectal cancer[J].World J Gastroenterol,2014,20(15):4276-4287.
[3] Bamia C,Lagiou P,Buckland G,et al.Mediterranean diet and colorectal cancer risk:results from a European cohort[J].Eur J Epidemiol,2013,28(4):317-328.
[4] Sobhani I,Amiot A,Le Baleur Y,et al.Microbial dysbiosis and colon carcinogenesis:could colon cancer be considered a bacteria-related disease?[J].Therap Adv Gastroenterol,2013,6(3):215-229.
[5] Ley RE,Peterson DA,Gordon JI.Ecological and evolutionary forces shaping microbial diversity in the human intestine[J].Cell,2006,124(4):837-848.
[6] Rowland IR.The role of the gastrointestinal microbiota in colorectal cancer[J].Curr Pharm Des,2009,15(13):1524-1527.
[7] Greer JB,O’Keefe SJ.Microbial induction of immunity,inflammation,and cancer[J].Front Physiol,2011,1:168.
[8] Zhu Y,Michelle LT,Jobin C,et al.Gut microbiota and probiotics in colon tumorigenesis[J].Cancer Lett,2011,309(2):119-127.
[9] Garrett WS,Punit S,Gallini CA,et al.Colitis-associated colorectal cancer driven by T-bet deficiency in dendritic cells[J].Cancer Cell,2009,16(3):208-219.
[10] Uronis JM,Muhlbauer M,Herfarth HH,et al.Modulation of the intestinal microbiota alters colitis-associated colorectal cancer susceptibility[J].PLoS One,2009,4(6):e6026.
[11] Davis CD,Milner JA.Gastrointestinal microflora,food components and colon cancer prevention[J].J Nutr Biochem,2009,20(10):743-752.
[12] Muegge BD,Kuczynski J,Knights D,et al.Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans[J].Science,2011,332(6032):970-974.
[13] Chambers WM,Warren BF,Jewell DP,et al.Cancer surveillance in ulcerative colitis[J].Br J Surg,2005,92(8):928-936.
[14] Castellarin M,Warren RL,Freeman JD,et al.Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma[J].Genome Res,2012,22(2):299-306.
[15] Kostic AD,Gevers D,Pedamallu CS,et al.Genomic analysis identifies association of Fusobacterium with colorectal carcinoma[J].Genome Res,2012,22(2):292-298.
[16] Sigge A,Essig A,Wirths B,et al.Rapid identif-ication of Fusobacterium nucleatum and Fusobacterium necrophorum by fluorescence in situ hybridization[J].Diagn Microbiol Infect Dis,2007,58(2):255-259.
[17] Amann RI,Binder BJ,Olson RJ,et al.Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations[J].Appl Environ Microbiol,1990,56(6):1919-1925.
[18] Weber G,Borer A,Riesenberg K,et al.Infective endocarditis due to Fusobacterium nucleatum in an intravenous drug abuser[J].Eur J Clin Microbiol Infect Dis,1999,18(9):655-657.
[19] Brook I,de Leyva F.Microbiology of tonsillar surfaces in infectious mononucleosis[J].Arch Pediatr Adolesc Med,1994,148(2):171-173.
[20] Marina M,Strong CA,Civen R,et al.Bacteriology of anaerobic pleuropulmonary infections:preliminary report[J].Clin Infect Dis,1993,16(Suppl 4):S256-262.
[21] Han YW,Redline RW,Li M,et al.Fusobacterium nucleatum induces premature and term stillbirths in pregnant mice:implication of oral bacteria in preterm birth[J].Infect Immun,2004,72(4):2272-2279.
[22] Swidsinski A,Dorffel Y,Loening-Baucke V,et al.Acute appendicitis is characterised by local invasion with Fusobacterium nucleatum/necrophorum[J].Gut,2011,60(1):34-40.
[23] Allen-Vercoe E,Strauss J,Chadee K.Fusobacterium nucleatum:an emerging gut pathogen?[J].Gut Microbes,2011,2(5):294-298.
[24] Grivennikov SI,Wang K,Mucida D,et al.Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth[J].Nature,2012,491(7423):254-258.
[25] Lee P,Tan KS.Fusobacterium nucleatum activates the immune response through retinoic acid-inducible gene I[J].J Dent Res,2014,93(2):162-168.
[26] Jewett A,Hume WR,Le H,et al.Induction of apoptotic cell death in peripheral blood mononuclear and polymorphonuclear cells by an oral bacterium,Fusobacterium nucleatum[J].Infect Immun,2000,68(4):1893-1898.
[27] Kostic AD,Chun E,Robertson L,et al.Fusobact-erium nucleatum potentiates intestinal tumorigenesis and modulates the tumorimmune microenvironment[J].Cell Host Microbe,2013,14(2):207-215.
[28] Rubinstein MR,Wang X,Liu W,et al.Fusobact-erium nucleatum promotes colorectal carcino-genesis by modulating E-cadherin/beta-catenin signa-ling via its FadA adhesin[J].Cell Host Microbe,2013,14(2):195-206.
Differences of Fusobacterium nucleatum abundance between colorectal cancer and adjacent tissue
【Abstract】Objective To compare the abundance ofFusobacterium nucleatum in colorectal carcinoma tissue and matched adjacent tissue.Methods Thirty five paired samples of colorectal carcinoma and adjacent tissue were colected.RT-PCR was used to detect the abundance of Fusobacterium nucleatum in carcinoma tissues and adjacent tissues.The location of Fusobacterium nucleatum was determined by fluorescence in site hybridization (FISH).Results Fusobacterium nucleatum was detected in 77.1%(27/35)of carcinoma tissues and matched adjacent tissues.In 2 cases,Fusobacterium nucleatum was detected in carcinoma tissues but not in matched adjacent tissues.The abundance of Fusobacterium nucleatum in cancer tissues was significantly higher than that in adjacent tissues(P<0.01).FISH confirmed that Fusobacterium nucleatum mainly colonized in intestinal mucosa.Fusobacterium nucleatum abundance is not correlated with the sex,age,tumor size,invasive depth,lymph node metastasis and tumor stage (P>0.05).Conclusion Fusobacterium nucleatum is prevalent in colorectal cancer and is mainly colonized in intestinal mucosa,indicating that Fusobacterium nucleatum may play a role in colorectal carcinogenesis.
【Key words】colorectal cancer;Fusobacterium nucleatum;abundance
doi:10.16118/j.1008-0392.2015.05.007
收稿日期:2014-12-25
基金项目:国家自然科学基金(81472262,81230057);上海市市级医院新兴前沿技术局联合攻关项目(SHDC12012106)
【中图分类号】R 657.5
【文献标志码】A
【文章编号】1008-0392(2015)05-0034-05