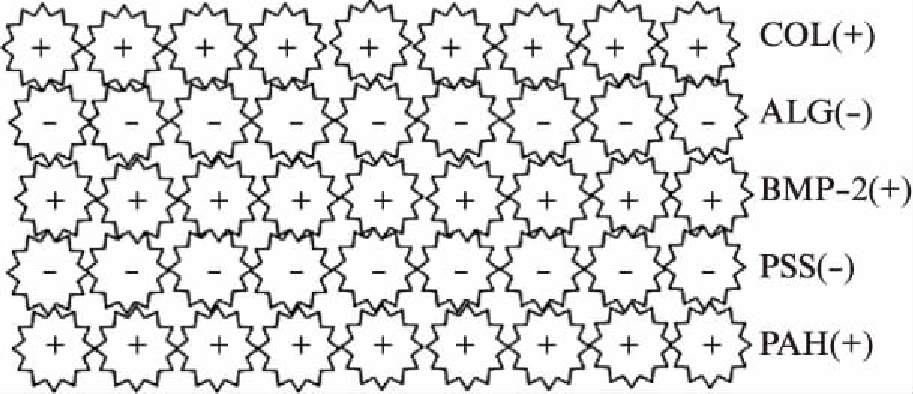
图1 [(PAH/BMP-2)/PSS]/[COL/ALG]20薄膜涂层示意图
Fig.1 The sketch of [(PAH/BMP-2)/PSS]/[COL/ALG]20 film
·基础研究·
(1.同济大学附属口腔医院口腔生物医学及转化医学实验室,上海 200072;2.上海市口腔病防治院,上海 200001)
【摘要】目的 测试在加力状态下,层层自组装BMP-2控释涂层的缓释效果,并检测其对牙周膜干细胞(periodontal ligament stem cells,PDLSC)的成骨诱导作用。方法 通过层层自组装技术在Flexcell加力六孔板上负载[(PAH/BMP-2)/PSS][COL/ALG]20涂层,利用ELISA检测加力状态下缓释涂层21d内释放的BMP-2浓度;将4~6代PDLSCs种于预置BMP-2控释涂层的BioFlex专用六孔培养板,置于FX-4000T加力系统中,加载动态张应力(10%形变牵张力,20Hz),各组作用时间均为1h/次,3次/d,间隔4h加力,分别培养3、5、7d。对照组为非预置涂层添加BMP-2培养液(100ng/ml)的BioFlex板同条件下加力培养;使用用Real-Time PCR和Western印迹法分析PDLSCs在不同张应力作用前后,其表型标志Runx2, ALP和OCN在 mRNA和蛋白水平的表达变化情况。结果 实验结果显示,与对照组相比,实验组加力3、5、7d后,Runx2、ALP和OCN标志物mRNA与蛋白表达差异有统计学意义(P<0.05)。结论 [(PAH/BMP-2)PSS]/[COL/ALG]20涂层对hPDLSCs在加力状态下成骨向分化能力具有显著增强作用。
【关键词】骨形态蛋白-2;缓释涂层;加力状态;牙周膜干细胞
层层自组装技术是一种应用广泛的材料表面改性方法,该方法可通过形成纳米尺度的超薄膜,调控生物分子负载的层数和种类,实现生物分子的控释,在组织工程领域被广泛应用。
本研究采用层层自组装技术制备BMP-2控释纳米涂层,构建以胶原(colleagen, COL)和海藻酸钠(alginate, ALG)作为控释阻隔层的控释系统,并将BMP-2控释纳米涂层自组装到Flexcell专用加力六孔板的硅胶膜表面,研究加力状态下,层层自组装BMP-2控释涂层的缓释效果,并检测其对牙周膜干细胞(periodontal ligament Stem cells, PDLSC)的成骨诱导作用。
1.1 材料和仪器
a-MEM 培养基、胎牛血清购自美国 Gibco 公司;胶原COL购自法国Symatese公司;海藻酸钠ALG购自美国NovaMatrix公司;BMP-2、ELISA试剂盒购自美国Abcam公司;Bioflex加力板、FX-4000T张应力加载系统购自美国Flexcell公司。
1.2 方法
1.2.1 PDLSC 细胞培养和接种 选择无龋无炎症的正畸减数牙,拔除后立即置于含双抗和10%血清的α-MEM培养液中。刮取根中1/3的健康牙周膜,放入培养箱培养。约1周后有原代细胞爬出。
制备单细胞悬液吹匀,计数并调整细胞密度,种于96孔板,8~12h后镜下观察标记单个细胞孔,待标记孔克隆长至孔底40%左右时,扩大培养。
1.2.2 Bioflex加力板上BMP-2控释纳米涂层的构建 配制浓度为1mg/ml的PAH、PSS聚电解质溶液,0.3mg/ml的COL、ALG水溶液。将带正电荷的BMP-2溶液分散在上述PAH溶液中,BMP-2浓度为1μg/ml。用HCl调整pH值至6.5。将 (PAH/BMP-2)溶液以2ml/孔加入Bioflex六孔加力板浸润10min后,用去离子水润洗3次,再加入PSS溶液2ml/孔浸润10min,用去离子水洗涤,形成[(PAH/BMP-2)/PSS]的生长因子结构涂层;加入2ml/孔带正电荷的COL溶液中10min后,用去离子水润洗3次,再每孔加入2ml带负电的ALG溶液浸润10min,用去离子水洗涤,形成[COL/ALG]的涂层结构。再经20次循环,在Bioflex加力板上形成[(PAH/BMP-2)/PSS]/[COL/ALG]20 的超分子薄膜结构,控释BMP-2(图1)。

图1 [(PAH/BMP-2)/PSS]/[COL/ALG]20薄膜涂层示意图
Fig.1 The sketch of [(PAH/BMP-2)/PSS]/[COL/ALG]20 film
1.2.3 加力状态下控释涂层缓释BMP-2的检测 将上述方法构建的附有BMP-2控释纳米涂层的Bioflex加力板置于 FX-4000T 加载系统中,加载相同形式的动态张应力(10%形变牵张力,2Hz),各组作用时间均为1h/次,3次/d,每次加力间隔 4h。从加力的第1天起孔板内加入2ml 0.01mmol/L PBS溶液,24h后收集全部液体并重新加入2ml的0.01mmol/LPBS溶液,持续收集21d。将上述收集的液体按照BMP-2试剂盒的操作说明加样后使用酶标仪检测21d内BMP-2的溶解情况,并绘制成图表。
1.2.4 PDLSCs加力培养和样本收集 将PDLSCs分别接种到附有BMP-2控释纳米涂层的Bioflex加力板和无BMP-2控释纳米涂层的Bioflex加力板上,静置48h等待细胞贴壁,在显微镜下观察细胞已贴壁后,将两组加力板置于FX-4000T 加载系统中,加载相同形式的动态张应力(10%形变牵张力,2Hz),各组作用时间均为1h/次,3次/d,每次加力间隔4h。分别收集加力3、5、7d的细胞冻存、标号,等待检测。
1.2.5 荧光定量RT-PCR检测 用TRIzol法分别提取实验组及对照组加力3、5、7d后的牙周干细胞的总RNA,反转录成cDNA,检测runx2、ALP、OCN的表达,以β-actin为内参。
β-actin:上游引物为5′-CATTAAGGAGAAGC-TGTGCT-3′,下游引物为5′-GTTGAAGGTAGTT-TCGTGGA-3′;runx2:上游引物为5′-ACTTCCTG-TGCTCGGTGCTG-3′,下游引物为5′-TCGTTA-CCCGCCATGACAGT-3′;ALP:上游引物为5′-CAGTTGAGGAGGAGAACCCG-3′,下游引物为5′-GTAGACACCCCCATCCCATC-3′;OCN:上游引物为5′-GGAGCCCCAGTCCCCTACCC-3′,下游引物为5′-GCGCCGATAGGCCTCCTGAA-3′。PCR反应参数:95℃ 2min;94℃ 10s,59℃ 10s,72℃ 40s,40个循环。取不同实验重复3次。
1.2.6 Western 印迹法检测蛋白的表达 制作凝胶,取各个处理组蛋白提取液调整浓度,每孔中加上样液20μg,留1孔加10μl预染Marker,恒压电泳。转膜结束后室温封闭。
孵育袋中加入TBST稀释的Runx2 (1∶1000)、ALP (1∶1000)、OCN (1∶1000)和GAPDH (1∶2000),孵育过夜,再加入二抗室温孵育。膜与化学发光检测试剂反应,暗室中用X胶片感光、显影、定影。
1.3 统计学处理
实验数据使用 SPSS 20.0软件包进行单因素方差分析。P<0.05为差异有统计学意义。
2.1 ELISA检测加力状态下BMP-2控释涂层的缓释曲线
BMP-2纳米涂层能够控释BMP-2。第1~3天是突释上升期,BMP-2的释放浓度从(39±2.62) ng/ml快速增长到(101±2.61) ng/ml;第3~15天,BMP-2的释放处于稳定平台期,浓度在(87±7.25)~(107±4.01) ng/ml小幅度变化;第16~21天,BMP-2的释放处于衰减期,浓度下降至(28±6.14) ng/ml,见图2。
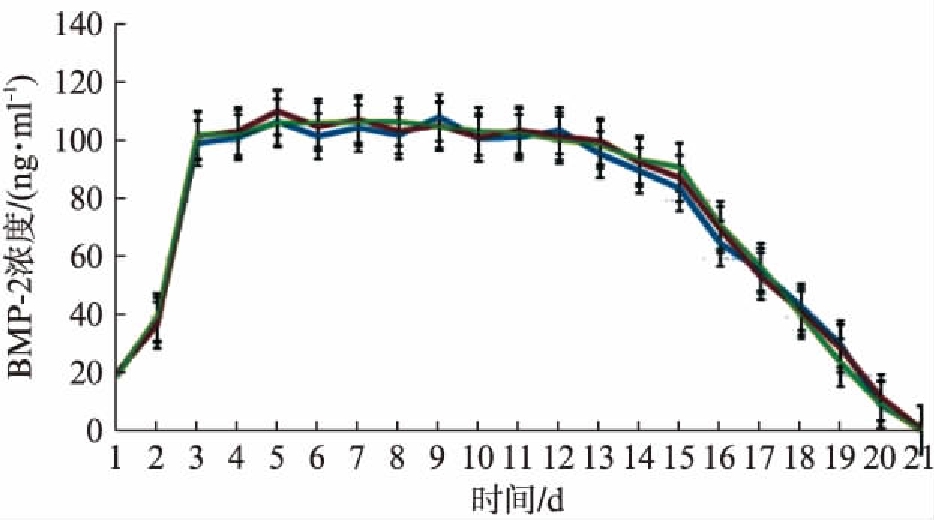
图2 [(PAH/BMP-2)/PSS]/[COL/ALG]20涂层加力状态下每日释放量控释曲线
Fig.2 The daily release curve of [(PAH/BMP-2)/PSS]/[COL/ALG]20 film under mechanical force
2.2 Real-Time PCR检测结果
不同加力时长状态下实验组与对照组的标志物 mRNA 的 RQ 值显示,Runx2、ALP、OCN 的mRNA 水平随时间的增加呈上升趋势,3、5、7d,差异均有统计学意义(P<0.05),且对照组与实验组在共同加力时长状态下,差异均有统计学意义(P<0.05)。实验组与对照组在不同加力时常状态下各标志物mRNA的RQ 值见表1。
表1 各标志物mRNA的RQ值
Tab.1 The RQ value of Runx2, ALP and OCN mRNA
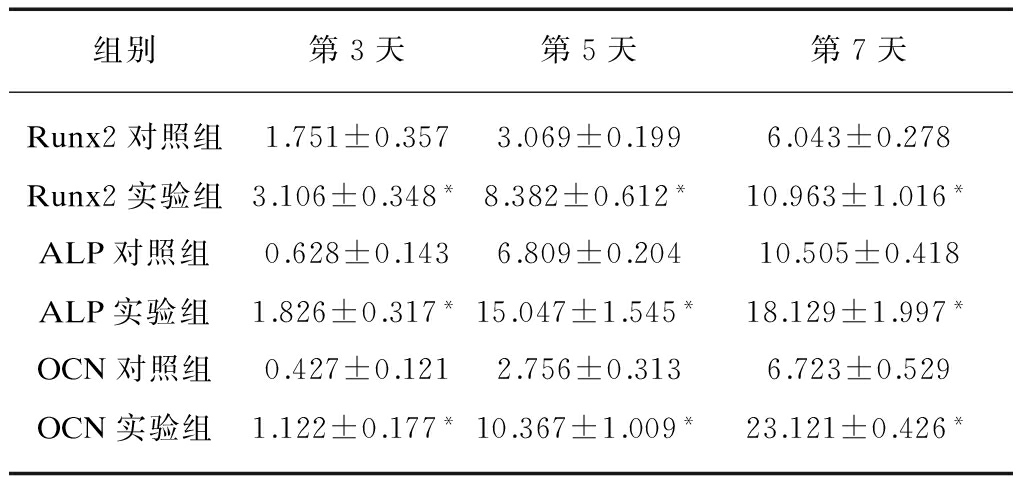
组别第3天第5天第7天Runx2对照组1.751±0.3573.069±0.1996.043±0.278Runx2实验组3.106±0.348*8.382±0.612*10.963±1.016*ALP对照组0.628±0.1436.809±0.20410.505±0.418ALP实验组1.826±0.317*15.047±1.545*18.129±1.997*OCN对照组0.427±0.1212.756±0.3136.723±0.529OCN实验组1.122±0.177*10.367±1.009*23.121±0.426*
与对照组比较,*P<0.05
2.3 Western 印迹法检测结果
实验组与对照组细胞在3个加力时间段的Runx2蛋白水平表达均随加力时间增加而呈上升趋势,各加力时长点差异均有统计学意义(P<0.05)。其中加力5d时的Runx2表达量差异最大(图3)。在加力3、5、7d时,实验组与对照组ALP蛋白水平表达均随加力时间增加而呈上升趋势,各加力时长点实验组与对照组差异均有统计学意义(P<0.05)。加力3、5、7d三个时间段,实验组与对照组细胞变化趋势相似,但是实验组的5、7d变化程度为更明显(P<0.001)。对照组的3、5、7d呈线性增长趋势,而实验组的3、5、7d呈对数增长趋势(图4)。实验组与对照组的细胞在加力3、5、7d时间段的ALP蛋白水平表达均随加力时间增加而呈上升趋势,各加力时长点实验组与对照组差异均有统计学意义(P<0.05)。加力3、5、7d三个时间段,实验组与对照组细胞变化趋势相似,但是实验组的5d与7d变化程度为更明显(P<0.001)。对照组的3、5、7d呈线性增长趋势,而实验组的3、5、7d呈对数增长趋势(图5)。
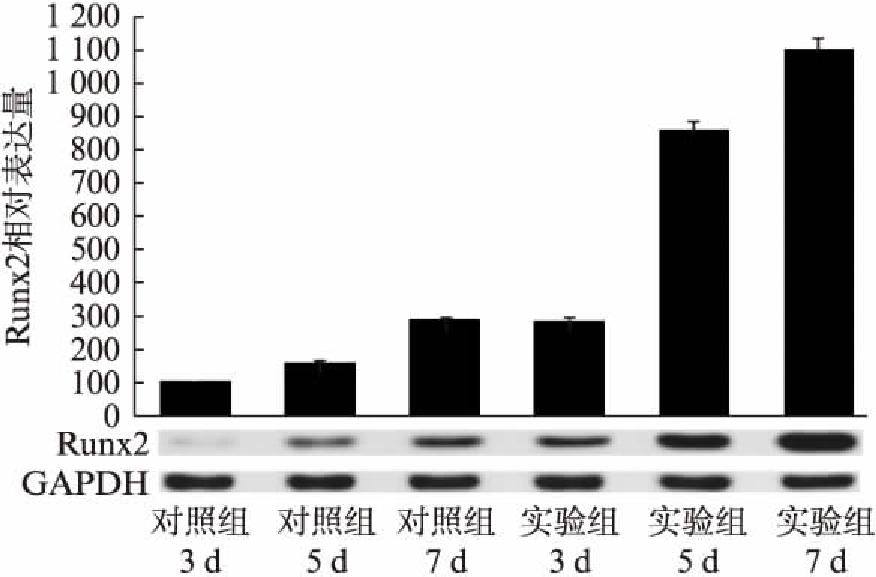
图3 实验组与对照组细胞在加力3、5、7d时的Runx2蛋白表达
Fig.3 Expression of Runx2 protein in experiment and control groups under mechanical force for 3d, 5d and 7d
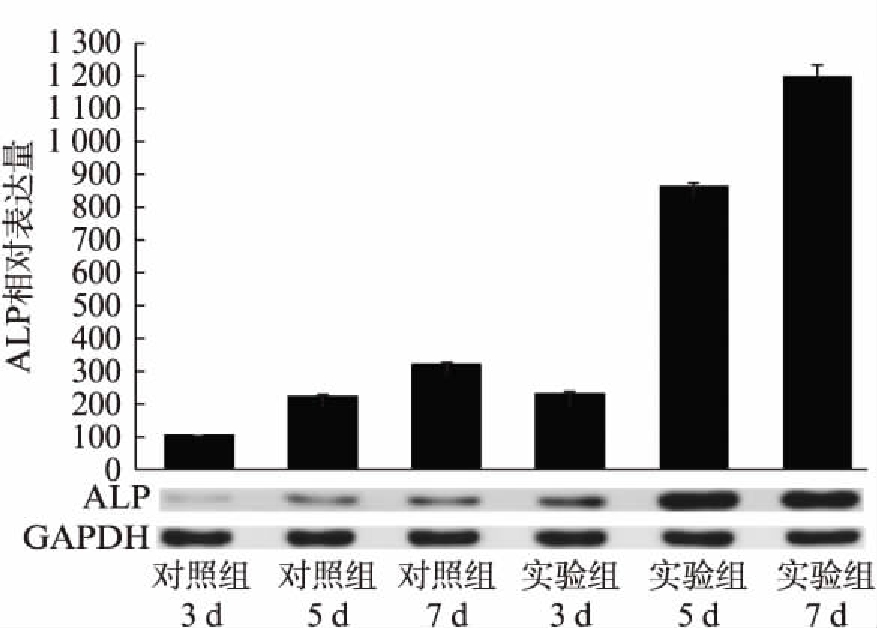
图4 实验组与对照组细胞在加力3、5、7d时的ALP蛋白表达
Fig.4 The expression of protein ALP in experiment and control groups under mechanical force for 3d, 5d, 7d
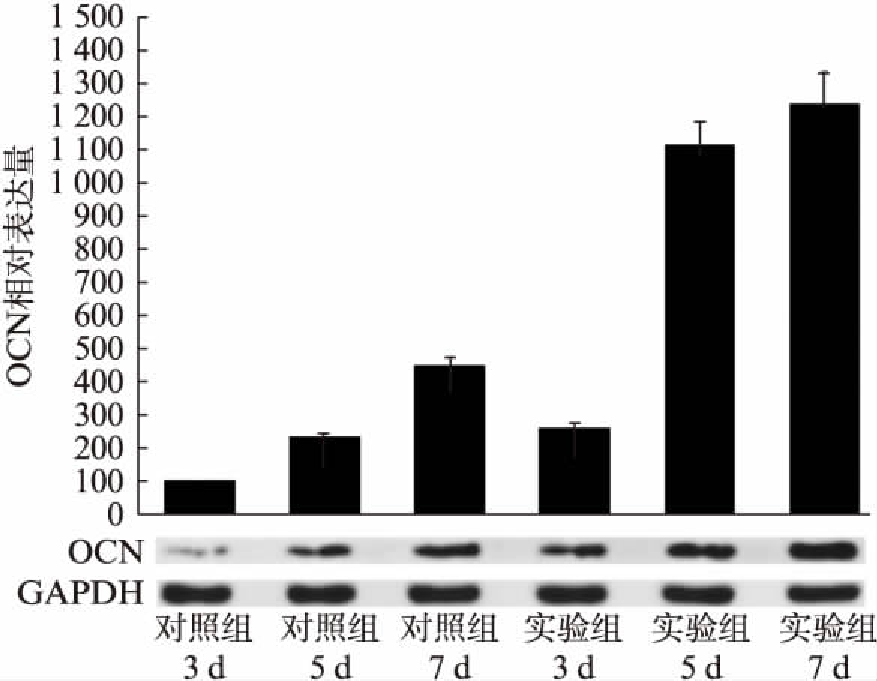
图5 实验组与对照组细胞在加力3、5、7d时的OCN蛋白表达
Fig.5 The expression of OCN protein in experiment and control groups under mechanical force for 3d, 5d, 7d
机械应力是能够对骨组织的形成和破坏吸收造成影响的重要因素。在正畸治疗中,牙齿在矫治力作用下,围绕牙根周围的牙槽骨发生应力改建,继而在矫治力的作用下产生牙移动。 牙周膜复合体在牙周改建过程中具有重要作用,机械张应力作用可牙周膜细胞成骨相关基因和蛋白的表达升高[1-2]。相关研究已经证实BMPs在促进牙周干细胞成骨方面有着显著的作用。在牙周相关的治疗当中,咀嚼力与正畸力都是不可忽视的重要影响因素,良好的生物材料应该具有加力状态下缓释生物因子的性能。研究已经证实(PAH/PSS)自组装涂层可以控释BMP-2,并诱导骨髓间充质干细胞成骨分化。然而遗憾的是,目前尚未有加力状态下,控释涂层诱导PDLSCs成骨分化的相关研究。
本实验采用的FX-4000T 加载系统,是由计算机控制的一种机械应力加载装置。其工作原理是将细胞种于底部是弹性硅胶膜的BioFlex培养板内,通过真空压力抻拉培养板底部的硅胶膜,可引起细胞的形变,从而为体外培养的细胞提供精确的、可控的、可重复的、静态的或者周期性的应力变化。目前,该装置在体外细胞应力实验中广泛应用[3-4]。本研究在预置BMP-2控释纳米涂层的BioFlex加力六孔板(实验组)与标准BioFlex加力六孔板(对照组)上接种PDLSCs 并加载形式相同的牵张力,观察牵张力作用3、5、7d时,PDLSCs 成骨相关标志物的表达是否升高,进而分析BMP-2控释纳米涂层在加力状态下对PDLSCs成骨分化的影响作用。
为达到模拟牙周膜细胞在口腔内承受的生理机械力(咀嚼力)的目的,通过分析以往有限元分析的数据资料得出,hPDLSCs施加最大形变10%的力较为适合[5];通过比较文献中牙周膜细胞应力实验[3-5]的研究方法,设置本实验中牵张力加载的频率为2Hz(即 0.5s 拉伸 0.5s 松弛),每次加力1h,每天加力3次,间隔4h,持续时间分别为3、5、7d,收集样本后采用Real-Time PCR和Western印迹法来检测实验组与对照组hPDLSCs成骨相关基因和蛋白的表达变化。
各成骨细胞标志物的表达变化与机械应力加载的方式、时间有着密切的联系。Runx2是一种与骨相关重要的转录因子,在骨形成的各个阶段均能够发挥作用,特别是在间充质细胞在向成骨细胞分化的初始阶段当中,起到了至关重要的作用[6]。本研究中,实验组与对照组的Runx2的mRNA水平在3、5、7d三个时间节点不断升高,差异均有统计学意义(P<0.05),Runx2蛋白水平的变化也得到了同样的结果。由此可得出预置BMP-2控释纳米涂层的BioFlex加力六孔板(实验组)与标准BioFlex加力六孔板(对照组)上接种 PDLSCs并加载形式相同的牵张力,实验组Runx2的表达升高比对照组更为明显。ALP是成骨细胞的另外一个重要标志物,见于成熟的骨祖细胞、前成骨细胞和成骨细胞。ALP的活性高低可以反映相应细胞成骨方向转化的大致趋势,它与成骨细胞的分化、成熟呈正相关性[7]。本研究发现实验组与对照组中PDLSCs中的 ALP 在mRNA和蛋白水平的表达均随时间而升高,且实验组与对照组的Runx2的mRNA水平和蛋白表达水平在3、5、7d三个时间节点差异均有统计学意义(P<0.001)。OCN是成骨细胞合成并分泌的一种非胶原蛋白,为成骨细胞晚期的重要标志物,一般认为其表达受Runx2的调控,并会随着Runx2的上升而上升。本研究发现,实验组与对照组OCN的mRNA水平与蛋白水平随时间变化都有不同程度的升高,且mRNA水平与蛋白水平在3、5、7d三个时间节点差异均有统计学意义(P<0.05),5、7d时差异更明显(P<0.001)。3d时,3组蛋白水平表达均有提升(P<0.05),提示[COL/ALG]涂层可能有助于细胞在加力状态下的早期黏附增殖。7d时,3组蛋白表达差异均有统计学意义(P<0.001),提示缓释涂层有利于BMP-2成骨诱导作用的发挥,在分化中后期依然可以起到显著地促分化功效。
综上所述,BMP-2涂层修饰组Runx2、ALP、OCN活性均显著高于对照组,表明[(PAH/BMP-2)/PSS]/[COL/ALG]20涂层对PDLSCs的成骨分化能力具有显著增强作用。
【参考文献】
[1] Al-Nbaheen M, Vihnubalaji R, Ali D, et al.Human stromal (mesenchymal) stem cells from bone marrow, adipose tissue and skin exhibit differences in molecular phenotype and differentiation potential[J].Stem Cell Rev, 2013,9(1):32-43.
[2] Han Y, Pan JS.Wang XL, et al.Cyclic strain promotes migration and proliferation of human periodontal ligament cell via PI3K signaling pathway[J].Cell Mol Bioeng, 2010,3(4):369-375.
[3] Lee YH, Nahm DS, Jung YK, et al.Differential gene expression of periodontal ligament cells after loading of static compressive force[J].J Periodontol, 2007,78(3):446-452.
[4] Nakao K, Goto T, Gunjigake KK, et al.Intermittent force induces high RANKL expression in human periodontal ligament cells[J].J Dent Res, 2007,86(7):623-628.
[5] de Araujo RM, Oba Y, Moriyama K.Identification of genes related to mechanical stress in human periodontal ligament cells using microarray analysis[J].J Periodontal Res, 2007,42(1):15-22.
[6] Garlet TP, Coelho U, Silva JS, et al.Cytokine expression pattern in compression and tension sides of the periodontal ligament during orthodontic tooth movement in humans[J].Eur J Oral Sci, 2007,115(5):355-362.
[7] Alhashimi N, Frithiof L, Brudvik P, et al.Orthodontic movement induces high numbers of cells expressing IFN-gamma at mRNA and protein levels[J].J Interferon Cytokine Res, 2000,20(1):7-12.
Effects of self-assemble BMP-2 controlled-release nano-film on osteogenic differentiation of periodontal ligament stem cells under mechanical force
【Abstract】Objective To assess the effect of self-assemble BMP-2 controlled-release nano-film on osteogenic differentiation of periodontal ligament Stem cells (PDLSCs) under mechanical force.Methods Bioflex Plates were coated with self-assembly [(PAH/BMP-2)/PSS][COL/ALG]20 multi-layers modified nano-films, and then the delivery concentration of BMP-2 was detected by ELISA.The PDLSCs were cultured into six-well Bioflex Plates pre-coated with the multi-layers modified nano-films, and then placed in the Flexcell FX-4000T Tension Plus System.PDLSC were subjected to the distinct mechanical forces (10% static tension force, 20Hz, 1h×3/d, for 3d, 5d or 7d).Control cells were cultured in BioFlex plates with BMP-2 (100ng/ml) instead of BMP-2 nano-films.Then the expression of Runx2, ALP and OCN mRNA and protein was detected by Real-Time PCR and Western blot techniques, respectively.Results The expressions of Runx2, ALP and OCN mRNA and protein in BMP-2 nano-biofilm group were significantly higher than those in control group (P<0.05).Conclusion The BMP-2 controlled release nano-flim can significantly promote the osteoblast differentiation of hPDLSCs cultured under mechanical force.
【Key words】BMP-2; controlled-release film; mechanical status; periodontal ligament Stem cells
doi:10.16118/j.1008-0392.2015.05.006
收稿日期:2015-04-27
基金项目:国家自然科学基金(81470768)
【中图分类号】R 781
【文献标志码】A
【文章编号】1008-0392(2015)05-0029-05