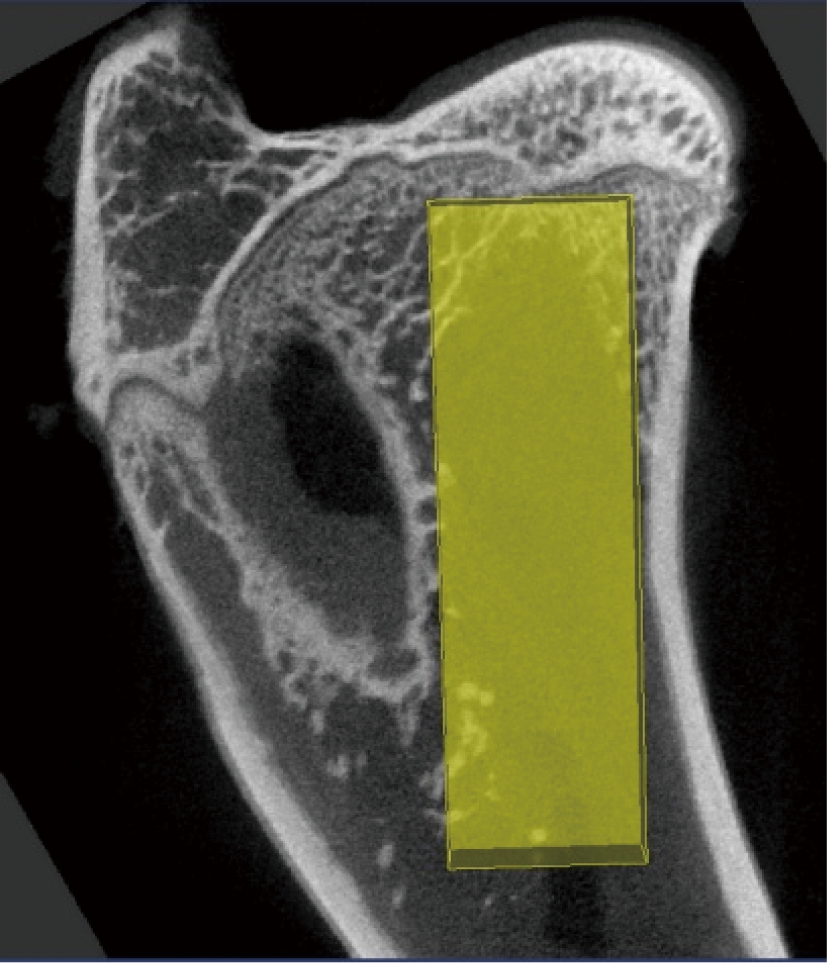
图1 骨标本Micro-CT扫描ROI选取
Fig.1 ROI selection in Micro-CT scan
·基础研究·
(同济大学附属第十人民医院放射科,上海 200072)
【摘要】目的 采用显微CT(Micro-CT)评估催产素(oxytocin, OT)干预骨质疏松(osteoporosis, OP)后的骨质及骨微结构时序变化规律。 方法 60只20周龄新西兰雌性大白兔随机分为对照组、OP模型组和OT干预组,每组20只。对照组施行假手术,OP组行双侧卵巢切除术(ovariectomy, OVX)。OT组在兔OVX术后第2周起,每天皮下注射催产素持续8周或至实验时间点为止,对照组和OP组则皮下注射生理盐水。三组分别在术后第0、4、8、10、12周处死,获取兔左后股骨上段行Micro-CT扫描,计测骨组织矿物质密度(tissue mineral density, TMD)和主要骨微结构参数,三组间结果进行比较、统计学分析。结果 OP组TMD、骨体积分数 (bone volume fraction,BV/TV)、骨小梁数目(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)从第8周开始较对照组明显降低 (P<0.05),骨结构模型指数(structure model index,SMI)、骨小梁间隙(trabecular space,Tb.Sp)则较对照组明显升高(P<0.05)。OT组TMD直到第12周较对照组明显降低(P<0.05),而BV/TV、Tb.N从第8周开始较OP组明显增加(P<0.05),Tb.Th从第10周开始较OP组增加(P<0.05),SMI、Tb.Sp从第8周开始较OP组明显降低(P<0.05)。结论 OP模型兔早期活体OT干预可有效减缓骨质衰败程度,Micro-CT能动态观察其病理生理变化过程,OT可能是一种有效防治OP的药物。
【关键词】骨质疏松;显微CT;骨组织矿物质密度;催产素
骨质疏松症(osteoporosis,OP)是一种骨质密度减低、骨微结构衰败为特征的系统代谢性骨病,常伴发脆性骨折事件[1-2]。目前,OP以二磷酸盐为代表抗骨质吸收治疗药物,可引起骨硬化症的副作用[3-5];而甲状旁腺素(parathyrin, PTH)有明显罹患骨肉瘤风险和“代谢时间窗”限制[6-7]。
骨组织矿物质密度(tissue mineral density,TMD)是反映骨强度的标准指标。Micro-CT技术可以全面、精确、无创地测量骨微结构,在实验动物OP研究方面得到了广泛应用[8]。研究[9]发现动物卵巢切除术后(ovariectomy, OVX)后,骨小梁厚度可以增厚、变薄、先变薄后增厚抑或无变化,结论不一。
催产素(oxytocin, OT)能促进其向成骨分化,抑制向脂肪细胞分化[10]。本研究通过OT干预兔OP模型,在术后不同时间点利用Micro-CT测定股骨上段标本的TMD及骨微结构参数,探讨OT干预OP骨质及骨微结构变化的规律,为进一步明确OT的治疗价值提供理论依据。
1.1 动物及实验设计
本实验经同济大学附属第十人民医院伦理委员会审核批准,并严格遵照动物保护及使用准则施行。60只20周龄骨发育成熟新西兰大白兔(体质量 1.8~3.2kg,同济大学实验动物材料部提供)随机分为对照组(Sham组)、OP模型组(OP组)、OP模型+OT干预组(OT组),每组20只。3组实验兔经静脉注射3%异戊巴比妥钠(30mg/kg)后行Sham手术或OVX手术。OT组实验兔自OVX术后2周起,每日皮下注射1mg/kg OT至第8周或实验截止点,对照组和OP组则每日皮下注射15ml生理盐水。3组实验兔OVX术前及术后5d均注射抗生素预防感染(青霉素4×105U·kg-1,2次/d),给予12h光照、12h黑暗循环,标准兔笼饲养,饲养温度20~25℃,相对湿度为40%~65%,自由进水、食物,术前及术后各时间点均称体质量。所有实验兔在术后0、4、8、10、12周时间点、经过量麻醉(50mg/kg)处死,采集左股骨上段骨标本,行Micro-CT扫描和骨病理学检测[11]。
1.2 离体Micro-CT扫描
离体右后股骨上段骨标本的Micro-CT扫描在复旦大学附属公共卫生中心完成。股骨上段骨标本扫描参数如下:X线管电压80kV;管电流450μA;扫描时间400ms/层;角度增益0.5°,扫描方式360°;平均帧数2×2;探测器组件模式 1;视野80×45m,各向同性分辨率45μm × 45μm × 45μm;获得图像数720[12-13]。定量分析系统采用GE Healthcare eXplore MicroView V.2.0后处理软件,锥形束扫描和三维重建技术获取2D图像,三维定位图像显示感兴趣野(region of interest,ROI)为5mm (AP) × 6mm (RL) × 17mm (FH) 的矩形框(图1)。骨标本分析参数包括:TMD、骨体积分数(bone volume fraction,BV/TV),结构模型指数(structure volume fraction, SMI), 骨小梁数目(trab-ecular number, Tb.N), 骨小梁厚度 (trabecular thickness, Tb.Th)和骨小梁间隙(trabecular space, Tb.Sp)[14]。

图1 骨标本Micro-CT扫描ROI选取
Fig.1 ROI selection in Micro-CT scan
1.3 统计学处理
采用SPSS 17.0统计分析软件,计量资料用![]() 表示。Shapiro-Wilk检测数据常态化分布情况。3组间TMD、骨微结构参数采用双因素方差分析和Bonferroni因果测验,各时间点参数采用两组间配对t检验比较。P<0.05为差异有统计学意义。
表示。Shapiro-Wilk检测数据常态化分布情况。3组间TMD、骨微结构参数采用双因素方差分析和Bonferroni因果测验,各时间点参数采用两组间配对t检验比较。P<0.05为差异有统计学意义。
2.1 Micro-CT扫描参数可重复性
Micro-CT扫描由专业技术员操作,TMD、骨微结构参数测定如方法部分所述。TMD、骨微结构参数取同一ROI扫描数据的3次平均值,变异系数(coefficient of variation,CV)分别如下:TMD为1.87%~2.01%, BV/TV为0.72%~0.85%,SMI为0.94%~1.27%,Tb.N为0.81%~0.96%,Tb.Th为0.69%~0.86%,Tb.Sp为0.88%~1.07%。
2.2 骨微结构参数测定
3组实验兔左股骨上段标本骨微结构参数测定结果见表1。3组实验兔股骨上段标本术后不同时间点TMD变化和二维显微图像见图2~3。对照组TMD值初始呈逐渐降低趋势,至假手术后10周较基点(第0周)明显降低(t=9.25, P=0.025)。OP组TMD在OVX术后第8周、10周、12周分别较对照组降低30.3%(P=0.037)、45.9% (P=0.003)、58.6% (P<0.001),BV/TV、Tb.N值亦较对照组相应时间点明显降低,而SMI、Tb.Sp值则明显上升(P<0.001)。OT组TMD值自术后第8周较OP组明显增加(t=24.57,P<0.001),至术后第12周较对照组显著降低,两者差异有统计学意义(t=11.47,P=0.012)。与OP组比较,OT组BV/TV于第8、10、12周分别增加11.25% (P=0.023),29.19% (P<0.001),32.37% (P<0.001),Tb.N值分别增加15.21% (P=0.017),20.57% (P=0.005),和29.47% (P<0.001),Tb.Th值在第10周、第12周分别增加17.09% (P<0.001)、14.19% (P<0.001),SMI和Tb.Sp值在第8周分别降低10.24% (P=0.032) 和8.47% (P=0.041),在第10周分别降低16.77% (P=0.020)和14.47% (P=0.033),在第12周分别降低 24.48% (P=0.018) 和18.67% (P=0.011)。
表1 3组实验兔术后各时间点股骨上段主要骨微结构参数
Tab.1 Micro-structural parameters of proximal femur trabecula in three groups at different time points after operation
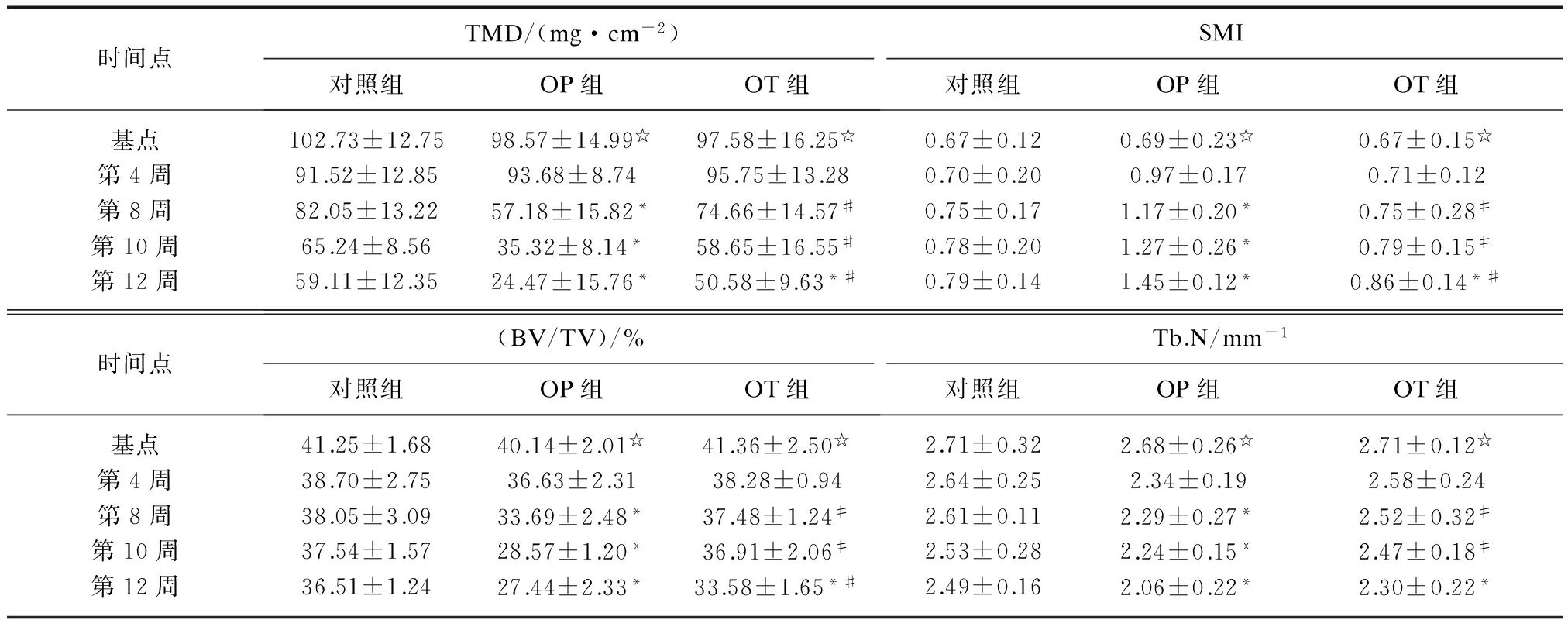
时间点TMD/(mg·cm-2)对照组OP组OT组SMI对照组OP组OT组基点102.73±12.7598.57±14.99☆97.58±16.25☆0.67±0.120.69±0.23☆0.67±0.15☆第4周91.52±12.8593.68±8.7495.75±13.280.70±0.200.97±0.170.71±0.12第8周82.05±13.2257.18±15.82*74.66±14.57#0.75±0.171.17±0.20*0.75±0.28#第10周65.24±8.5635.32±8.14*58.65±16.55#0.78±0.201.27±0.26*0.79±0.15#第12周59.11±12.3524.47±15.76*50.58±9.63*#0.79±0.141.45±0.12*0.86±0.14*#时间点(BV/TV)/%对照组OP组OT组Tb.N/mm-1对照组OP组OT组基点41.25±1.6840.14±2.01☆41.36±2.50☆2.71±0.322.68±0.26☆2.71±0.12☆第4周38.70±2.7536.63±2.3138.28±0.942.64±0.252.34±0.192.58±0.24第8周38.05±3.0933.69±2.48*37.48±1.24#2.61±0.112.29±0.27*2.52±0.32#第10周37.54±1.5728.57±1.20*36.91±2.06#2.53±0.282.24±0.15*2.47±0.18#第12周36.51±1.2427.44±2.33*33.58±1.65*#2.49±0.162.06±0.22*2.30±0.22*
(续表1)
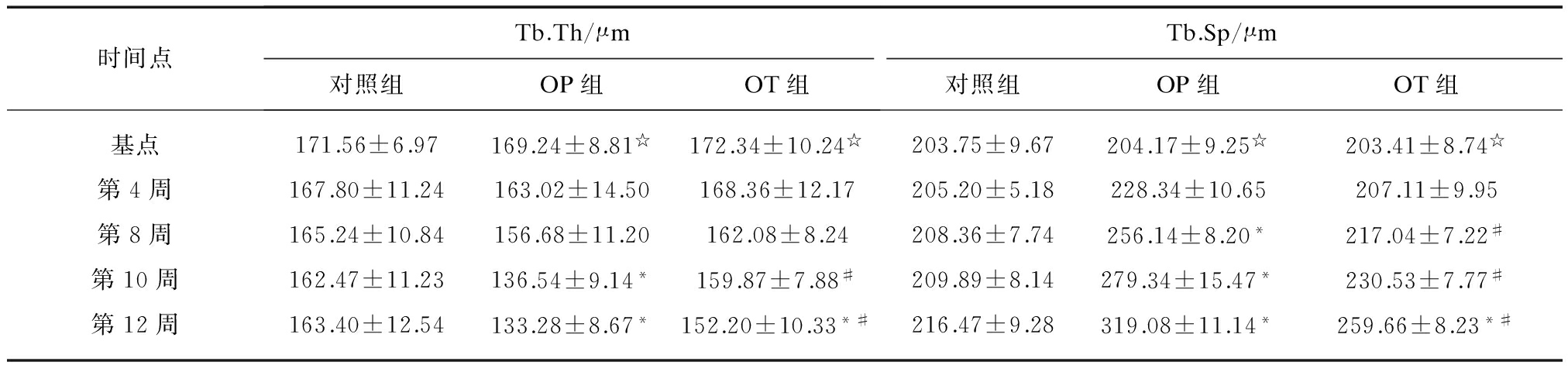
时间点Tb.Th/μm对照组OP组OT组Tb.Sp/μm对照组OP组OT组基点171.56±6.97169.24±8.81☆172.34±10.24☆203.75±9.67204.17±9.25☆203.41±8.74☆第4周167.80±11.24163.02±14.50168.36±12.17205.20±5.18228.34±10.65207.11±9.95第8周165.24±10.84156.68±11.20162.08±8.24208.36±7.74256.14±8.20*217.04±7.22#第10周162.47±11.23136.54±9.14*159.87±7.88#209.89±8.14279.34±15.47*230.53±7.77#第12周163.40±12.54133.28±8.67*152.20±10.33*#216.47±9.28319.08±11.14*259.66±8.23*#
注:各时间点与对照组比较,*P<0.05; 各时间点与OP组比较,#P<0.05;各时间点与基点(0周)比较,☆P>0.05
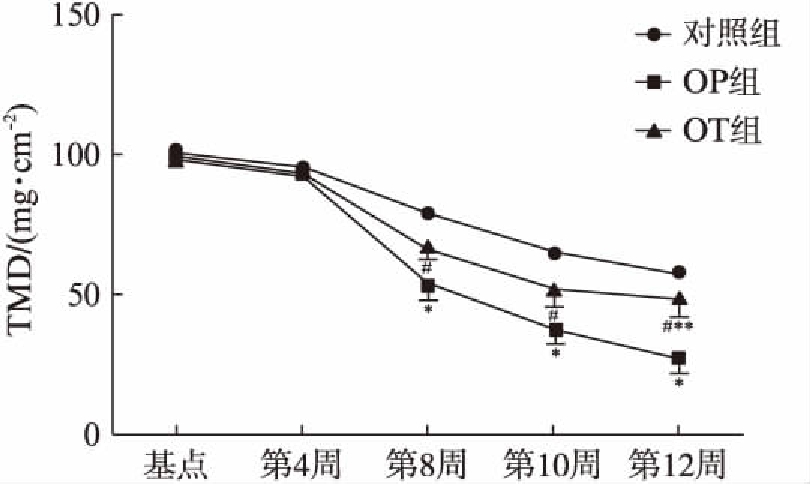
图2 3组实验兔术后各时间点TMD变化趋势图
Fig.2 Average TMD over time in the three rabbit groups
各时间点与对照组比较,*P<0.05;各时间点与OP组比较,#P<0.05; 各时间点与基点(0周)比较,**P<0.05
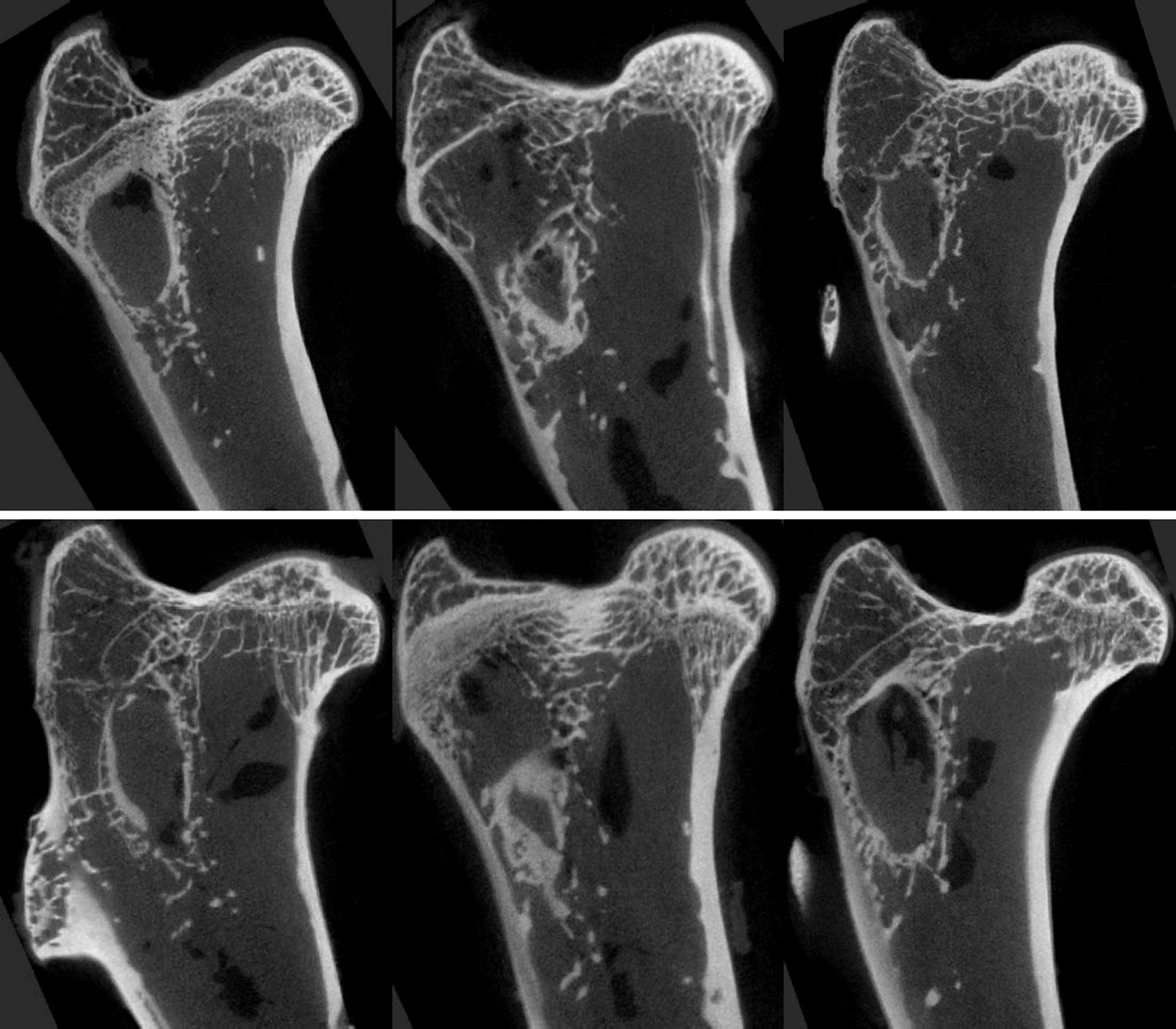
图3 3组实验兔术后不同时间点股骨上段标本二维显微CT图
Fig.3 2D micro-CT images of the proximal femurs in three groups
A为对照组假手术后第12周,显示骨质衰败相对较轻,骨小梁微结构仍存在;B、C、D为OP组OVX术后第4、8、12周,显示随时间推进松质骨结构持续衰败,小梁结构减少,小梁间隙增宽;E、F为OT组OVX术后第4、12周,显示骨松质小梁结构退化较OP组明显较轻微
2.3 实验兔体质量测定
3组实验兔各时间点体质量测量结果见表2。OT组实验兔体质量各时间点有轻微差异,但3组间基点及各实验节点实验兔体质量变化无统计学意义(P>0.05)。
表2 3组实验兔术后各时间点体质量变化情况
Tab.2 Weight changes of the rabbits in three groups at different time points after operation
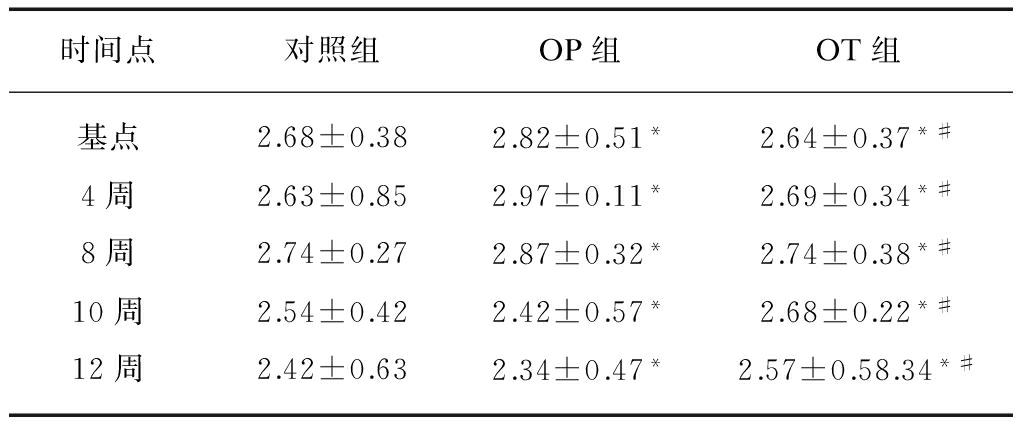
时间点对照组OP组OT组基点2.68±0.382.82±0.51*2.64±0.37*#4周2.63±0.852.97±0.11*2.69±0.34*#8周2.74±0.272.87±0.32*2.74±0.38*#10周2.54±0.422.42±0.57*2.68±0.22*#12周2.42±0.632.34±0.47*2.57±0.58.34*#
注:各时间点与对照组比较,*P>0.05;各时间点与OP组比较,#P>0.05
OVX大鼠模型当前已成为研究绝经后OP的经典动物模型,但相较于OVX兔模型仍存在一定的局限性。例如,大鼠终生维持活跃骨重建,骨骺闭合迟缓,不能达到真正骨骼成熟,缺乏骨Haversian系统,雌激素缺失后期不出现成骨细胞功能损害,且骨架小不适于影像学研究[15]。新西兰大白兔为中等大小的动物,骨骼转化率快,短期内即可观察到骨组织的变化,成年兔有完整Haversian系统,与人类相似[11],为成熟的实验用动物之一。兔OP建模操作简单、费用低廉,重复性佳,因扫描骨体积较大,尤其适于OP的影像学动态评估[15]。
本次实验选取体质量、年龄相仿的实验兔随机分为3组,可排除加龄导致的骨代谢差异性影响。Micro-CT是一种全面、立体、精确、无创测量骨微结构的新技术,能准确描述松质骨三维空间结构,早期发现骨微结构变化。研究[16]证明,Micro-CT评估OP骨小梁强度的能力明显较双能X线骨密度仪敏感、精确。3组实验兔初期(基点0周时)骨质保持相对稳定,术后后随时间推进明显出现骨衰败特征。骨微结构参数(BV/TV、Tb.N、Tb.Th、Tb.Sp和SMI)的变化趋势与TMD变化趋势相一致,对照组假手术后早期TMD和其他骨微结构参数无显著变化,直至术后12周骨质较基点明显衰败,差别有统计学意义,可能与加龄导致雌激素水平降低有关。与对照组比较,OP组TMD自OVX术后第8周起出现明显下降趋势,证明OP模型成功建立,其他骨微结构参数BV/TV、Tb.N、Tb.Th均随时间逐渐降低,而Tb.Sp和SMI均随时间逐渐升高,反映OP进展过程中伴随有骨小梁变薄、穿孔、断裂等显微变化,直至发生微骨折,连接结构破坏,表现为骨小梁稀疏,骨量减少,小梁间隙增宽,骨小梁从板状向杆转变,SMI增加。而OT组TMD、BV/TV、Tb.N值自术后第8周起各时间点均较OP组明显增高,而Tb.Th从第10周开始较OP组增加,SMI、Tb.Sp值自术后第8周起各时间点均较OP组明显降低。表明OT干预能减缓OP骨质衰败的病理生理过程,并且TMD和骨微结构参数BV/TV、Tb.N能较Tb.Th更早反映这一病理变化过程。
OT主要生理功能是促进分娩期子宫收缩与哺乳期排乳,其在人体终生持续分泌,并受卵巢激素水平和增龄因素的影响[17]。研究[18]发现OT对骨代谢存在直接调节作用,并证明OT参与调节妊娠期母体的骨重建,成骨细胞和破骨细胞表面均存在催产素受体。Elabd等[10]证明了OT是间充质干细胞成骨/成脂分化的主要调节因子之一。他们通过OT干预多能脂肪分化干细胞和骨髓干细胞,发现OT及其同聚体可以促进骨髓间充质干细胞向成骨细胞分化,并同时抑制其向成脂分化,提示OT在骨髓干细胞成骨(成脂)分化过程发挥重要作用。文献报道,绝经后妇女骨丢失增加,同时伴有血浆催产素水平的降低,证明催产素与绝经后OP发生相关。研究[19]表明,通过调控外周OT受体,可以促进提升成骨细胞作用,骨的生成和骨量增加。由于OT降低了血循环中RANKL水平、提高骨保护素(osteop-rotegerin, OPG)水平,进而降低了RANKL/OPG值,从而间接地促进了成骨细胞生成过程,因此,OT有望成为治疗OP的重要潜在药物。
本次实验存在的不足之处:各时间点实验兔数量相对较少,实验兔个体间差异导致的骨代谢水平不同可能会增加实验误差。本次研究未建立独立的OT干预健康假手术实验兔组,故而其他影响OP发展的相关因素无法完全排除,在下一步的实验中将改进。OT注射引起的副作用,例如兔自由活动度减低、进食量变化、呼吸换气比值均未观察考量。但是,3组实验兔在实验过程中均未发现明确的进食和精神异常状况。实验兔血浆雌激素水平未监测,故而雌激素水平与骨质、骨微结构间变化关系无法评估。
OP实验兔模型中骨TMD值与骨微结构参数的降低趋势一致,Micro-CT可准确、无创地探测到OP后骨质衰败特征。实验兔早期在体OT治疗可以有效地缓解骨微结构衰败进程,OT有望成为未来临床治疗OP的一种有效、副作用较少的替代性治疗药物。
【参考文献】
[1] Rachner TD, Khosla S, Hofbauer LC.Osteoporosis:now and the future[J].Lancet, 2011,377(9773):1276-1287.
[2] Compston J.Osteoporosis: social and economic impact[J].Radiol Clin North Am, 2010,48(3):477-482.
[3] Anthony BA, Link DC.Regulation of hematopoietic stem cells by bone marrow stromal cells[J].Trends Immunol, 2014,35(1):32-37.
[4] Honig S, Chang G.Osteoporosis:an update[J].Bull NYU Hosp Jt Dis, 2012,70(3):140-144.
[5] Jones GN, Moschidou D, Lay K, et al.Upregulating CXCR4 in human fetal mesenchymal stem cells enhances engraftment and bone mechanics in a mouse model of osteogenesis imperfecta[J].Stem Cells Transl Med, 2012,1(1):70-78.
[6] Maes C, Kobayashi T, Selig MK, et al.Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels[J].Dev Cell, 2010,19(2):329-344.
[7] Beranger GE, Pisani DF, Castel J, et al.Oxytocin reverses ovariectomy-induced osteopenia and body fat gain[J].Endocrinology, 2014,155(4):1340-1352.
[8] Waarsing JH, Day JS, Verhaar JA,et al.Bone loss dynamics result in trabecular alignment in aging and ovariectomized rats[J].J Orthop Res, 2006,24(5):926-935.
[9] Brouwers JE, Lambers FM, Gasser JA, et al.Bone degeneration and recovery after early and late bisphosphonate treatment of ovariectomized wistar rats assessed by in vivo micro-computed tomography[J].Calcif Tissue Int, 2008,82(3):202-211.
[10] Elabd C, Basillais A, Beaupied H, et al.Oxytocin controls differentiation of human mesenchymal stem cells and reverses osteoporosis[J].Stem Cells,2008,26(9):2399-2407.
[11] Baofeng L, Zhi Y, Bei C, et al.Characterization of a rabbit osteoporosis model induced by ovariectomy and glucocorticoid[J].Acta Orthop, 2010,81(3):396-401.
[12] Perilli E, Le V, Ma B, et al.Detecting early bone changes using in vivo micro-CT in ovariectomized, zoledronic acid-treated, and sham-operated rats[J].Osteoporos Int,2010,21(8):1371-1382.
[13] 徐铮,李冠武,汤光宇,等.显微CT对兔骨质疏松模型的实验研究[J].同济大学学报:医学版,2011,32(6):34-38.
[14] Colli VC, Okamoto R, Spritzer PM,et al.Oxytocin promotes bone formation during the alveolar healing process in old acyclic female rats[J].Archi Oral Biol,2012,57(9):1290-1297.
[15] Castaneda S, Calvo E, Largo R, et al.Character-ization of a new experimental model of osteoporosis in rabbits[J].J Bone Mine Metab, 2008,26(1):53-59.
[16] Mittra E, Rubin C, Gruber B, et al.Evaluation of trabecular mechanical and microstructural properties in human calcaneal bone of advanced age using mechan-ical testing, microCT, and DXA[J].J Biomech, 2008,41(2):368-375.
[17] Forsling ML.Diurnal rhythms in neurohypophysial function[J].Exp Physiol, 2000,85:179S-186S.
[18] Yeung DK, Griffith JF, Antonio GE, et al.Osteoporosis is associated with increased marrow fat content and decreased marrow fat unsaturation:a proton MR spectroscopy study[J].J Magn Reson Ima-ging, 2010,22(2):279-285.
[19] 李冠武,汤光宇,刘勇,等.磁共振波谱成像联合显微CT动态评估快速诱导兔骨质疏松模型骨质量[J].中华内分泌代谢杂志,2011,27(9):770-774.
Effect of oxytocin on dynamic changes of bone mass in rabbit osteoporosis model
【Abstract】Objective To investigate the effect of oxytocin (OT) on dynamic changes of bone mass and bone microstructure in a rabbit osteoporosis (OP) model.Methods Sixty 20-week-old female New Zealand rabbits were randomly assigned into OT, OP and sham groups with 20 animals in each group.Rabbits in OT and OP groups were subjected to bilateral ovariectomy (OVX), and animals in sham group received sham operation.The rats were injected with vehicle daily for two weeks after operation.Rabbits in OT group were subcutaneously injected with OT 1mg/(kg·d) from wk 2 after OVX for 8 wks or till sacrifice; and rabbits in OP and sham groups received subcutaneous injection of normal saline.The left proximal femurs of the rabbits were examined with micro-CT at wks 0, 4, 8, 10, and 12 after operation.Differences in micro-CT structural parameters among the groups were analyzed using two-way ANOVA and Bonferroni post-hoc test.Results The tissue mineral density (TMD), Tb.N, and Tb.Th values in OP group decreased significantly, while SMI, Tb.Sp values increased significantly from wk 8 compared with those in control group.The TMD value of OT group did not decreased significantly until wk 12, while BV/TV, Tb.N values increased from wk 8 compared with those of OP group.The SMI and Tb.Sp values decreased significantly from wk 8 compared with that of OP group.Conclusion Early intervention of oxytocin can attenuate bone degeneration in rabbits with osteoporosis.Micro-CT can dynamically assess the pathological changes of the bone degeneration of osteoporosis.
【Key words】osteoporosis; micro-CT; tissue mineral density; oxytocin
doi:10.16118/j.1008-0392.2015.05.005
收稿日期:2015-04-21
基金项目:国家自然科学基金(81071134,81371517)
【中图分类号】R 58
【文献标志码】A
【文章编号】1008-0392(2015)05-0023-06