表1 CFTR蛋白在卵巢癌及良性卵巢肿瘤组织中的表达
Tab.1 Expression of CFTR protein in ovarian tumor tissue chips and benign ovariantumor samples
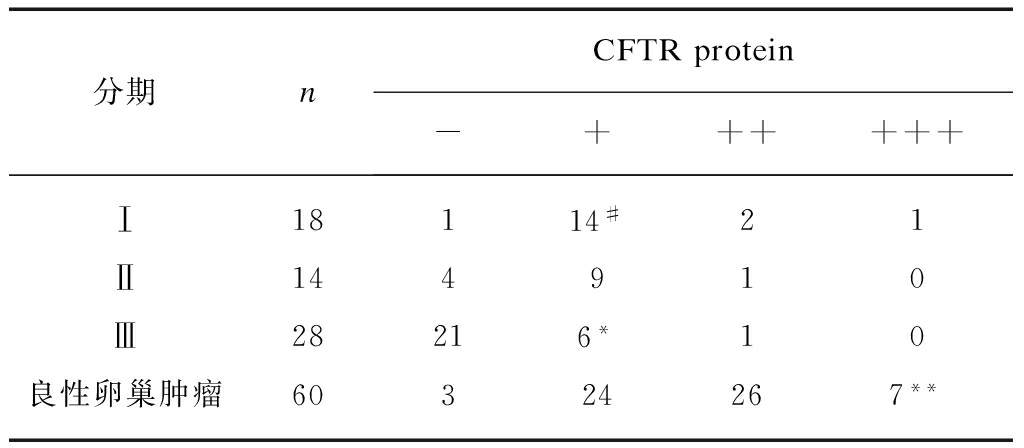
分期nCFTRprotein-++++++Ⅰ18114#21Ⅱ144910Ⅲ28216*10良性卵巢肿瘤60324267**
·基础研究·
(1.上海交通大学附属第一人民医院妇产科,上海 200080;2.同济大学附属同济医院生殖医学科,上海 200065)
【摘要】目的 分析囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator, CFTR)在人肿瘤组织中的表达特征,探讨其临床应用价值。方法 采用甲基化特异性PCR检测上皮性卵巢癌组织中CFTR甲基化发生率;采用免疫组织化学法检测卵巢癌组织标本及良性肿瘤组织中CFTR蛋白的表达,分析其表达与临床病理分级的关系及CFTR对卵巢癌细胞侵袭能力的影响。结果 卵巢癌中 CFTR甲基化发生率大于50%,同时其蛋白表达明显降低,且卵巢癌中CFTR的表达与卵巢癌的病理分级呈正相关性。CFTR去甲基化处理后,细胞凋亡增加。结论 CFTR在卵巢癌中发挥抑癌作用,可能成为新的肿瘤标志物用于卵巢癌的早期诊断及对病情进展的检测。
【关键词】囊性纤维化跨膜传导调节因子;甲基化;免疫组织化学;上皮性卵巢肿瘤
卵巢癌是妇科常见恶性肿瘤之一,也是妇科肿瘤中病死率最高的疾病。卵巢癌细胞具有较强的增殖及转移潜力,目前不仅缺少有效的早期筛查手段,而且对其恶性生物学行为机制尚不明确。近年来,表观遗传改变在上皮性卵巢癌发生、发展中的作用越来越受到重视,其中DNA甲基化是表观遗传学机制研究最为深入的内容[1- 3]。目前已知的卵巢上皮性癌特异性DNA甲基化状态异常的基因多达数十个。
囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)是一种cAMP激活的氯离子通道,分布于具有分泌功能的上皮细胞中,介导跨上皮的离子转运及分泌,并调控其他转运通路[4]。研究[4]分析了200例卵巢上皮性癌组织多基因的甲基化状态,发现CFTR甲基化频率大于50%(显著高于Rassf1α及 BRCA1),且表达水平明显低于正常卵巢上皮组织。文献[5-6]报道,CFTR基因改变可伴有上皮细胞癌变,其可作为抑癌或癌基因参与不同类型肿瘤的发生,如Ⅰ型子宫内膜癌中检测到高表达的CFTR,而高分化小肝癌中存在CFTR甲基化引起的表达缺失。因此,推测CFTR甲基化及表达降低是卵巢上皮癌的发生发展机制之一。本研究通过检测CFTR甲基化发生及其在上皮性卵巢癌组织及细胞中的表达,分析其与卵巢癌病理分期和分型的关系,探索其可能的作用机制。
1.1 标本来源
标本来源于2007年1月至2013年12月上海交通大学附属第一人民医院妇产科收治的卵巢肿瘤手术治疗患者,并签署知情同意书。共选取60例卵巢癌患者的肿瘤组织标本,患者年龄22~79岁,平均(54.2±14.5)岁。手术-病理分期(FIGO 2000年的标准)结果如下:Ⅰ期18例,Ⅱ期14例,Ⅲ期28例;浆液性卵巢癌36例,黏液性卵巢癌6例;子宫内膜样癌12例;透明细胞癌6例。60例良性卵巢肿瘤患者组织作为对照。
1.2 CFTR基因的甲基化检测
采用甲基化特异性PCR(MS-PCR)方法,使用两对引物(引物设计软件:Methyl Primer Express v1.0)检测CFTR基因的甲基化情况,并行亚硫酸氢盐修饰后测序验证。甲基化酶SssI转化后的人类胎盘组织DNA作为阳性对照,健康成人淋巴细胞DNA作为阴性对照,去离子水作为空白对照。
反应体系:ddH2O 19.5μl,10×PCR 缓冲液2.5μl,dNTP Mix 0.5μl,PCR Primer 0.5μl /0.5μl,Template(即DNA)1μl,rTaq 0.5μl,总体积25μl。反应条件:94℃ 5min,40个循环;94℃,30s;58℃,30s;72℃,30s;72℃,10min。
1.3 免疫组化检测
石蜡切片脱蜡,水化;PBS漂洗3次,每次3min;抗原微波修复。加入50μl新配置的0.3%H2O2甲醇,作为过氧化物酶阻断剂,室温孵育10min,以阻断内源性过氧化物酶的活性,PBS漂洗3次,每次3min。加入50μl正常非免疫动物血清,室温孵育10min以减少非特异性着色。加入50μl一抗CFTR(BS1525)抗体(美国Bioworld公司),4℃过夜,PBS漂洗3次,每次3min。加入50 μl抗兔生物素化二抗[妙通(上海)生物科技有限公司],室温孵育10min,PBS漂洗3次,每次3min。加入1滴或50 μl链酶菌抗生物素-过氧化物酶溶液,室温孵育10min,PBS漂洗3次,每次3min。按照兔抗体免疫组化试剂盒[妙通(上海)生物科技有限公司]步骤操作:加入适量DAB,显色5~10min,40倍显微镜 (YS100,日本Nikon公司)下观察染色强度。苏木精复染,返蓝,酒精梯度脱水,二甲苯透明,中性树胶封片,光镜 (Axioplan2,德国Zeiss公司)下观察细胞着色比例。PBS代替一抗作为空白对照,正常子宫内膜作为阴性对照[7]。
检测结果判定:组织呈现黄色和棕黄色为阳性信号,细胞阳性反应为胞浆或胞膜有棕黄色颗粒,根据组织显色情况和细胞显色比例进行综合评分。a:按组织显色情况评分,无显色,计0分;呈浅黄色或黄色,计1分;呈棕黄色,计2分;呈棕褐色,计3分。b:按细胞着色比例分级,着色<30%,计0分;着色30%~50%,计1分;着色50%~75%,计2分;着色>75%,计3分。根据(a+b)/2计算标本积分。按积分高低分为:0分为阴性(-),0.5~1分为弱阳性(+),1.5~2分为中等阳性(++),2.5~3分为强阳性(+++)[7]。
1.4 细胞培养系统
人卵巢癌细胞系HO-8910、SKOV-3、A2780种植于含10%胎牛血清的含酚红的DMEM/F12培养基中,置于37℃、5%CO2的培养箱中培养。按细胞培养常规更换培养液,待细胞长至 70%~80%融合度时,胰酶消化传代。实验用细胞均处于对数生长期。
1.5 CFTR通路阻断操作
采用5-杂氮-2′-脱氧胞苷(终浓度为10×10-6 mol/L)去甲基化,使细胞的CFTR表达增加。使用不同浓度的CFTR通路阻断剂CFTRinh-172降低卵巢癌细胞CFTR表达。
1.6 细胞凋亡的检测
采用流式细胞仪检测细胞凋亡(AnncxinV-PI 染色)。每孔接种 5×105个细胞于6孔板中,2ml 培养基培养过夜,用不含 EDTA 的胰酶消化细胞。两次离心后,加入300μl的 l×结合缓冲液重悬细胞沉淀。Annexin V-FITC 及PI 标记,暗室温孵育15min。 同时设置3个仪器调试管,体积为 300μl:(1) Mock组细胞,不加 PI 和 Annexinv-FITC;(2) Mock-PI 组细胞,加 PI 染液5μl,不加 AnnexinV-FITC;(3) Mock-FITC 组细胞,加5μl 的 Annexinv-FITC,不加稀释的PI。每个样品补加 200μl的 1×结合缓冲液至 500μl 终体积,轻轻混匀后上机进行流式细胞仪检测。
1.7 统计学处理
应用SPSS 13.0软件分析。计数资料采用秩和检验,其中多组比较用Kruskal-Wallis检验,两两比较用Mann-Whitney检验。P<0.05为差异有统计学意义。
2.1 卵巢上皮性癌组织中CFTR基因甲基化发生频率
对60例卵巢癌和60例正常卵巢组织进行的肿瘤相关基因的DNA甲基化分析(DNA MS-PCR),结果发现了2个高甲基化基因,而正常卵巢组织中未检测到上述基因的甲基化。其中CFTR甲基化发生率为50.45%,卵巢癌敏感基因BRCA1甲基化发生率为40.89%。
2.2 CFTR蛋白在卵巢上皮细胞的胞膜和胞质中的表达
在卵巢良性肿瘤中,CFTR呈中等到强表达,而在上皮性卵巢癌中表达水平明显降低,差异具有统计学意义。在上皮性卵巢癌中,CFTR蛋白表达与不同组织学分型无相关性(表1、图1)。CFTR在早期卵巢癌(Ⅰ期和Ⅱ期)中表达明显降低,但仍显著高于晚期(Ⅲ期)。
表1 CFTR蛋白在卵巢癌及良性卵巢肿瘤组织中的表达
Tab.1 Expression of CFTR protein in ovarian tumor tissue chips and benign ovariantumor samples

分期nCFTRprotein-++++++Ⅰ18114#21Ⅱ144910Ⅲ28216*10良性卵巢肿瘤60324267**
与卵巢癌组(Ⅰ期、Ⅱ期、Ⅲ期)相比,**P<0.01;与卵巢癌Ⅰ期、Ⅱ期相比,*P<0.5;与卵巢癌Ⅱ期相比,#P>0.05
2.3 上皮性卵巢癌细胞株SKOV3中CFTR甲基化状态
进一步BSP克隆测序法验证上皮性卵巢癌细胞株SKOV3中CFTR甲基化状态,结果提示,SKOV3细胞中CFTR呈高甲基化状态(图2)。
2.4 去甲基化及细胞凋亡
在上皮性卵巢癌细胞中,CFTR发挥抑癌基因的作用,促进卵巢癌细胞凋亡,抑制其增殖。5-Aza-dC去甲基化处理卵巢癌细胞,部分恢复CFTR的表达,从而增强其抑癌作用,促进细胞凋亡;CFTRinh-172则阻断CFTR的表达,从而降低其抑癌作用,加速卵巢癌增殖,故其细胞凋亡率明显下降(图3)。
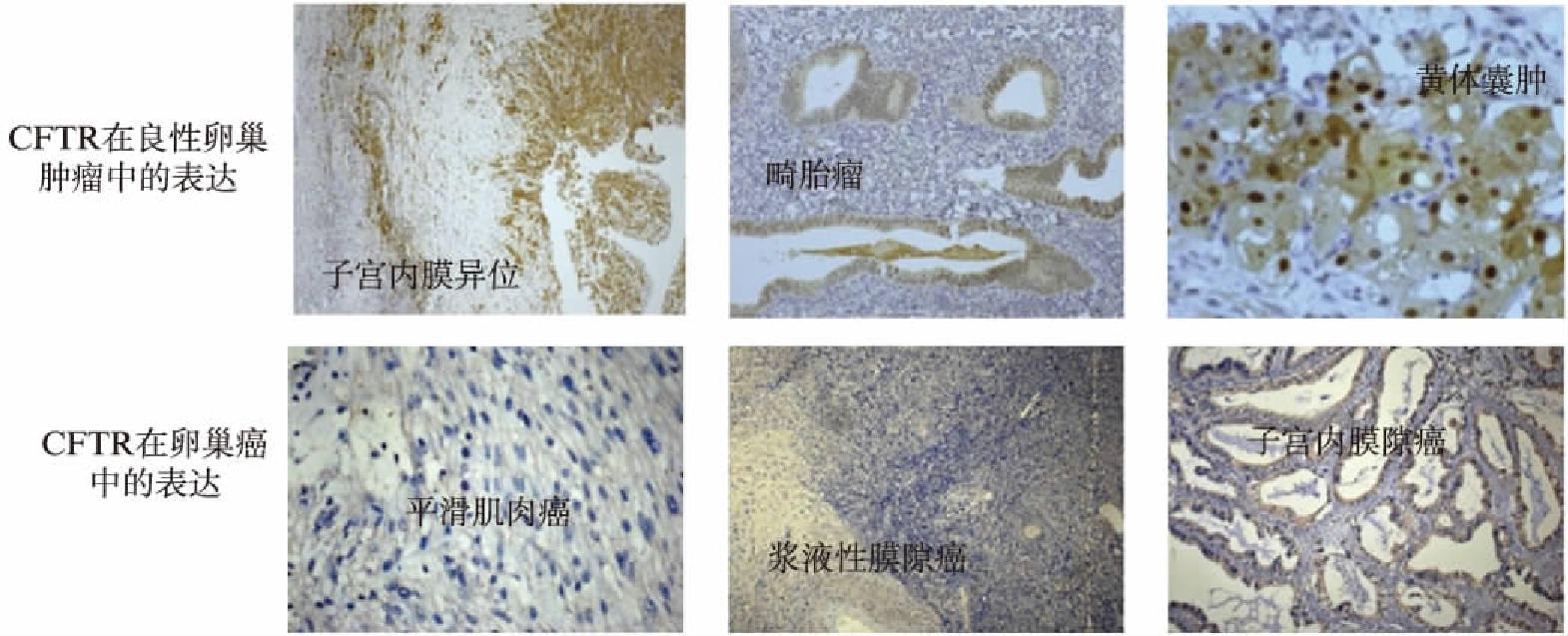
图1 CFTR蛋白在卵巢癌及良性卵巢组织中的表达
Fig.1 Expression of CFTR protein in ovarian tumor tissue chips and benign ovarian tumor samples
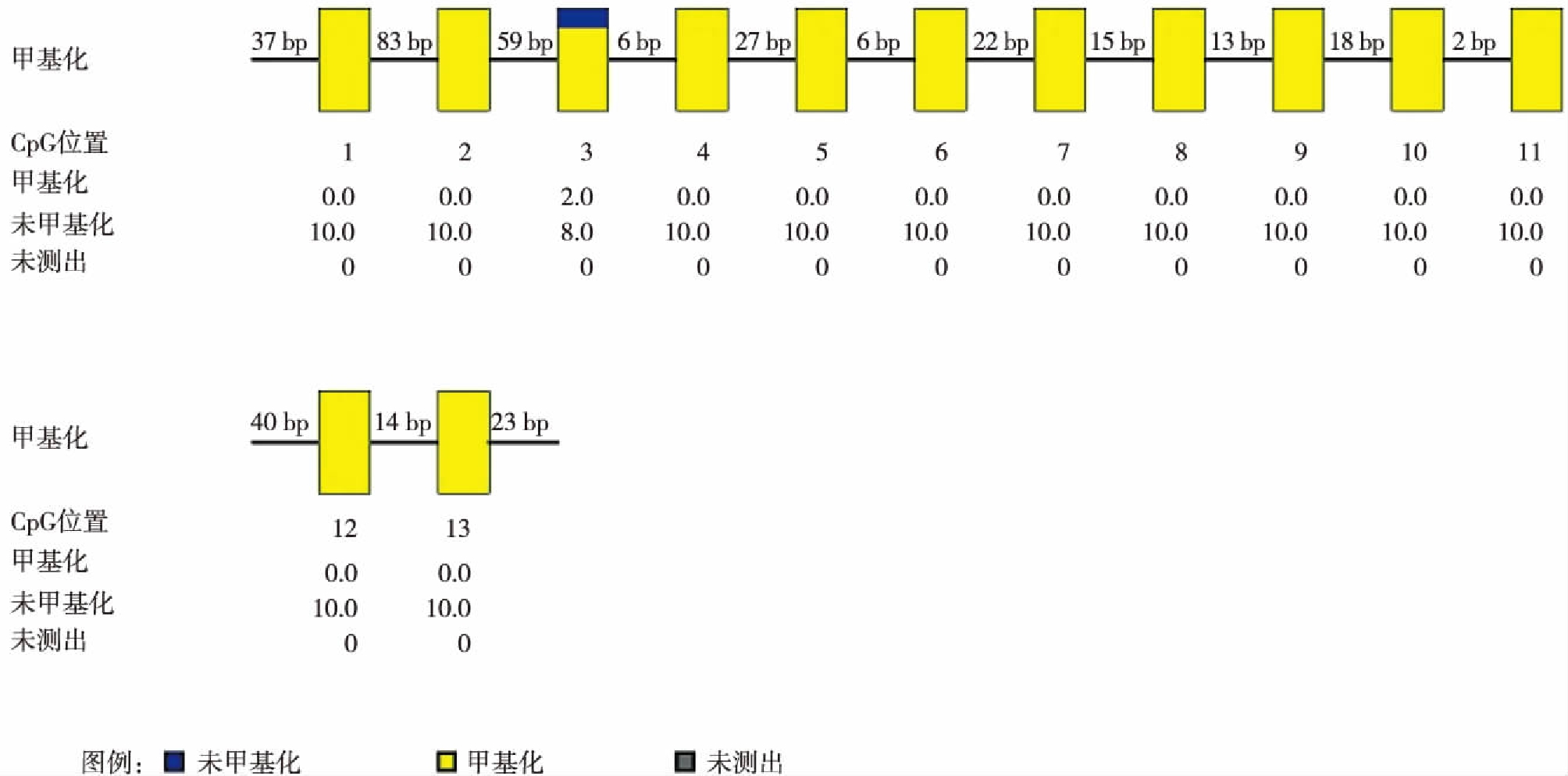
图2 卵巢癌细胞株SKOV3中CFTR甲基化状态
Fig.2 The methylation of CFTR in epithelial ovarian cancer cell line SKOV3
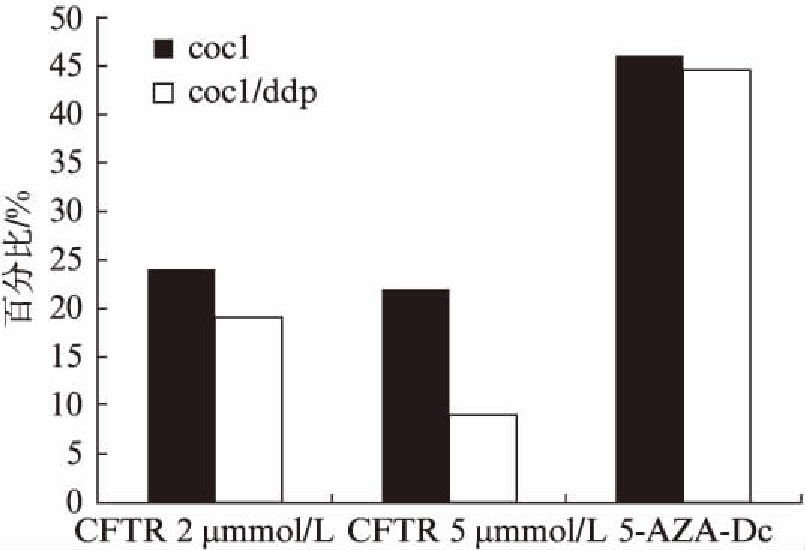
图3 CFTR 表达与细胞凋亡
Fig.3 The expression of CFTR and cell apoptosis
卵巢癌是女性生殖器官常见的三大恶性肿瘤之一,恶性度高,早期诊断困难,多数患者就诊时已属晚期,病死率居妇科恶性肿瘤首位。卵巢癌细胞具有高的增殖及转移潜力,然而对其恶性生物学行为机制尚不明确。
癌症包括卵巢癌是一受累于广泛的表观遗传缺陷和遗传缺陷的复杂疾病[1]。其中DNA甲基化是研究最为深入的表观遗传学机制[2],其在诊断和治疗的临床实践中有着重要的应用前景,且已得到了充分的重视。在肿瘤细胞中,一些原本在正常细胞中处于低甲基化状态的基因会发生高甲基化的状态而转录失活,参与肿瘤性转化。受累的基因包括抑癌基因、DNA修复基因、细胞周期控制基因和抗凋亡基因等。对肿瘤临床样品(组织和体液性)中这类基因的DNA甲基化状态分析在肿瘤临床诊断中的巨大应用前景已得到广泛重视,开发以包括DNA甲基化在内的新的生物标志物以提高诊断和分期的准确性及提出更合理的分型标准是当今研究的热点[5]。已发现的卵巢癌特异性DNA甲基化状态异常的基因多达数十个[6]。本研究通过对卵巢癌组织标本进行甲基化分析,并与正常卵巢组织对比后,发现了高甲基化的抑癌基因BRCA1和CFTR。
CFTR是一种独特的氯离子通道,尽管称为氯离子通道,但在结构上却明显地不同于其他氯离子通道,属于一种ATP结合盒转运体(ATP—binding Cassette transporter, ABC)家族。近年来,多项研究发现,氯离子通道在多种肿瘤中表达异常,并且氯通道可能在肿瘤细胞的增殖、侵袭及转移等恶性生物学行为中起着重要作用。自20世纪 80年代末CFTR基因被克隆以来,它一直是离子通道研究中的一个热点。CFTR氯离子通道是所有氯通道中唯一以疾病命名的通道,在结构上属于 ABC家族,正常情况下在多种腺体组织,如鼻腔、肺部、消化道的纤毛细胞的质膜上表达[7],其生理功能除了运输氯离子调节细胞内外电荷平衡外,在一定程度上还参与其他一些重要物质,如![]() 的运输,因此对于机体的生理功能发挥具有重要作用。CFTR的基因突变易影响蛋白质功能,从而导致囊性纤维化(cystic fibrosis,CF)的形成(CFTR也就是由于这种疾病而命名),该疾病的症状和并发症包括气管相关疾病、胰腺衰竭、胎粪性肠梗阻、男性不育和汗液中盐浓度升高等,且在早期肝癌细胞[11]、膀胱癌中[8]检测到CFTR的异常甲基化。
的运输,因此对于机体的生理功能发挥具有重要作用。CFTR的基因突变易影响蛋白质功能,从而导致囊性纤维化(cystic fibrosis,CF)的形成(CFTR也就是由于这种疾病而命名),该疾病的症状和并发症包括气管相关疾病、胰腺衰竭、胎粪性肠梗阻、男性不育和汗液中盐浓度升高等,且在早期肝癌细胞[11]、膀胱癌中[8]检测到CFTR的异常甲基化。
文献[6-8]报道,CFTR基因改变可伴有上皮细胞癌变,其可作为抑癌或癌基因参与不同类型肿瘤的发生,如Ⅰ型子宫内膜癌中检测到高表达的CFTR[9],而高分化小肝癌中存在CFTR甲基化引起的表达缺失,肠癌和胰腺癌亦伴有CFTR的甲基化。本研究中发现卵巢癌中高甲基化(>50%)使CFTR蛋白表达降低,且随着病理级别的升高,CFTR表达明显下降,故推测CFTR在卵巢癌的发生及进展中扮演抑癌基因的角色。
目前,CFTR与肿瘤细胞恶性生物学行为的关系尚不清楚。本研究的细胞实验结果提示,CFTR能够促进卵巢癌细胞的凋亡。自噬性细胞死亡是除凋亡以外的另一种细胞程序性死亡的形式,可从细胞周期、凋亡相关及血管生成等多个层面影响肿瘤的发生发展,并抑制或协同促进凋亡。Beclin1为自噬基因,其表达缺失可降低自噬活性。Beclin1的表达下调可能与卵巢癌的发生、进展和临床预后有关。ROS作为一个信号分子参与细胞的自噬性死亡。据报道,基因敲除或功能缺陷的CFTR可以通过ROS-TG2通路下调自噬基因Beclin1,而导致细胞增殖及肿瘤发生。故认为,甲基化可能通过下调细胞自噬活性,促进卵巢癌细胞的增殖,转移,并抑制凋亡[9-11]。本研究通过观察自噬体的形成,检测自噬标志蛋白LC3,探索CFTR调节卵巢癌细胞生物学行为的机制。
总之,上皮性卵巢癌中存在CFTR高甲基化,CFTR甲基化状态与卵巢癌的发生和病理分级具有相关性,通过抑制卵巢癌细胞增殖、促进凋亡发挥其抑癌作用。
【参考文献】
[1] Hanahan D, Weinberg RA.The hallmarks of cancer[J].Cell, 2000,100(1):57-70.
[2] Baylin SB, Ohm JE.Epigenetic gene silencing in cancer-a mechanism for early oncogenic pathway addiction[J].Nat Rev Cancer, 2006,6(2):107-116.
[3] Ting AH, McGarvey KM, Baylin SB.The cancer epigenome—components and functional correlates[J].Genes Dev, 2006, 20(23):3215-3231.
[4] Wang YQ, Zhang JR, Li SD, et al.The aberrant methylaton of BRCA1 in chemosensitivity unrelative to the phosphatidylinositol3’-kinase (PI3K)-AKT pathway in human ovarian cancer cells[J].Cancer Sci, 2010,101(7):1618-1623.
[5] 郭遂群,邢福祺,庞战军,等.基因芯片筛选的CFTR基因作为雌激素依赖型子宫内膜癌预后标志物的研究[J].广东医学,2007,28(3):369-371.
[5] Moribe T, Iizuka N, Miura T, et al.Methylation of multiple genes as molecular markers for diagnosis of a small, well-differentiated hepatocellular carcinoma [J].Cancer, 2009,125(2):388-397.
[7] 刘亭威,康健.中国人囊性纤维化临床特点分析[J].中国全科医学,2012,15:2807-2810.
[8] Mehta A.Cystic fibrosis as a bowel cancer syndrome and the potential role of CK2[J].Mol Cell Biochem, 2008,316(1-2):169-175.
[9] Luciani A, Villella VR, Esposito S, et al.Defective CFTR induces aggresome formation and lung inflamm-ation in cystic fibrosis through ROS-mediated autop-hagy inhibition[J].Nat Cell Biol, 2010,12(9):863-875.
[10] 唐波,秦岭,邓冰清,等.高磷诱导内皮细胞凋亡的代谢组学以及MAPK通路研究[J].同济大学学报:医学版,2014,35(4):35-40.
[11] Lu Z, Luo RZ, Lu Y.The tumor suppressor gene ARHI regulates autophagy and tumor dormancy in human ovarian cancer cells[J].Clin Invest, 2008,118(12):3917-3929.
Expression of cystic fibrosis transmembrane conductance regulator in human epithelium ovarian cancer
【Abstract】Objective To investigate the expression of cystic fibrosis transmembrane conductance regulator CFTR in human ovarian tumor tissues and its clinical significance.Methods Immunohistochemistry was employed to detect the expression of CFTR protein in 60 ovarian tumor tissue chips and benign ovarian tumor samples.The relationship between the expression of CFTR protein and clinicopathoiogical characteristics was analyzed.Results There was higher methylation of CFTR occurring in ovarian cancer, accompanying with the lower expression of CFTR protein in the tumor tissues than that in non-tumor tissues (P<0.01).Furthermore, the expression of CFTR was related to the pathological grades of ovarian cancer. The expression of CFTR in ovarian cancer tissues was lower in the late stage than that in early stage (P<0.05).While there was no significant difference between stage Ⅰ and stage Ⅱ.After treated with 5-Aza-dC the apoptosis of ovarian cancer cells was increased.Conclusion There is high methylation and low expression of CFTR protein in ovarian tumor tissues, which indicates that CFTR might be a tumor suppressor gene in tumor progression.
【Key words】cystic fibrosis transmembrane conductance regulator;methylation;immunohistoche-mistry
doi:10.16118/j.1008-0392.2015.05.004
收稿日期:2015-05-05
基金项目:国家自然科学基金(81302254);上海市卫生局课题(20124114)
【中图分类号】R 71
【文献标志码】A
【文章编号】1008-0392(2015)05-0018-05