·基础研究·
(同济大学附属第十人民医院心内科,上海 200072)
【摘要】目的 通过建立大鼠压力负荷诱导舒张性心力衰竭模型,探索新型肌肉因子irisin与舒张性心力衰竭(diastolic dysfunction,DHF)之间的联系,为临床应用提供依据。方法 采用腹主动脉缩窄(abdominalaortic constriction,AAC)的手术方式建立压力负荷诱导大鼠DHF的疾病模型。20只SD大鼠随机分入AAC手术组(n=10)和假手术(sham)组(n=10)。造模12周后测量心超、心室内压力、解剖结构评估造模效果。EILSA检测irisin两组间血清水平表达差异;利用Real-time PCR、Western印迹法、免疫组化染色分析irisin的剪切前体Ⅲ型纤维蛋白结构域5(FNDC5)在两组间表达差异,寻找irisin的分泌来源。结果 成功建立AAC-DHF的SD大鼠疾病模型。造模12周时,AAC组大鼠血清irisin水平逐渐升高,第12周时显著高于Sham组[(135.2± 28.9) ng/ml vs (64.9±34.0) ng/ml,P<0.001]。Real-time PCR结果显示,FNDC5在AAC组的心脏组织(11.8±2.4 vs 1.88±1.2,P<0.001)和肌肉组织中表达较高(15.1±1.6 vs 1.25±1.4,P<0.001)。Western印迹法显示,AAC组FNDC5在心脏表达高于Sham组(P=0.021)。IHC染色显示,FNDC5主要表达于AAC组骨骼肌筋膜和心肌实质。结论 大鼠AAC模型证实血清irisin水平在DHF的情况下升高,其来源可能是由心肌和骨骼肌共同分泌的。
【关键词】irisin;舒张性心力衰竭;腹主动脉缩窄模型
心力衰竭作为心血管疾病发生发展的终末阶段,严重影响心血管疾病患者的生存与生活质量,造成巨大医疗负担[1]。与收缩性心衰相比,舒张性心衰(diastolic heart failure,DHF)发生在正常心输出量和正常射血分数的情况下[2],故临床重视不足,早期诊断困难,尚缺乏针对DHF的血清学标志物可辅助心功能的诊断。
研究[3-4]发现,低强度运动可促进患者骨骼肌细胞膜上的Ⅲ型纤维蛋白结构域5(fibronectin Ⅲ domain containing protein 5,FNDC5)剪切为细胞因子irisin,后者可在循环中被稳定检测。近期的研究[4-6]已证实irisin与心血管疾病间的关系密切,但尚缺乏疾病模型论证其临床发现。本研究建立AAC-DHF大鼠疾病模型,动态观察建模过程中irisin血清学变化,分析其与DHF之间的关系,并为其临床应用提供依据。
1.1 模型建立
20只雄性SD大鼠体质量180~200g,随机分为2组。手术组:采用腹主动脉缩窄(Abdominal aortic constriction,AAC)模型[7-9],10只为ACC组;10只为Sham组。ACC组用0.25%戊巴比妥麻醉后开腹,分离脏器与腹主动脉周围脂肪,暴露腹主动脉0.5~1cm,置直径0.3mm垫针,结扎腹主动脉后抽出垫针,关腹。Sham组的手术过程同AAC组,但不结扎腹主动脉。2组SD大鼠均持续腹主动脉结扎造模12周。造模期间予以正常饮水、饮食。
1.2 试剂
ELISA(EK-67-52)试剂盒购自Phoenix公司;反转录(PrimeScript RT reagent Kit)试剂盒购自TaKaRa公司;Real-Time PCR(Perfect Q-PCR Kit)试剂盒购自KAPA公司;FNDC5一抗(ab174833)试剂盒购自Abcam公司。
1.3 建模效果评估
1.3.1 超声心动图 于复旦大学生命工程实验室小动物机能实验中心进行超声心动图。主要测量指标有:舒张末左室后壁厚度(left ventricular posterior wall,LVPWd)、舒张末左室前壁厚度(left interventricular anterior wall,LVAWd)、左室舒张末期内径(left ventricular end diastolic dimension,LVIDd)、左室收缩末期内径(left ventricular end systolic dimension,LVIDs)、左室短轴缩短率(fraction shortening,FS)、左室射血分数(ejection fraction,EF)。
1.3.2 血流动力学参数测定 使用小动物机能实验平台,经大鼠主动脉内测定大鼠血压、心室内压力、最大左室压力下降速率(-dp/dt)、最大左室压力上升速率(+dp/dt),解剖测定心脏重量指数及左心重量指数。
1.4 血清ELISA检测
尾静脉采集血样,4℃,离心半径9.4cm, 1000r/min,离心10min,分离上层血清,采用大鼠irisin ELISA试剂盒检测irisin,具体操作步骤见说明书。
1.5 Real-Time PCR
使用TRIzol提取总RNA,总RNA逆转为cDNA的按反转录试剂盒使用说明进行操作,使用Real-Time PCR试剂盒检测FNDC5表达水平,详见试剂说明书。以GAPDH为内参。引物序列如下。FNDC5上游引物序列:5′-GCTGGGCTGCGT-GTGCT-3′,下游引物序列:5′-CATCCTTCTTCT-GCTGAGAG-3′;GAPDH的上游引物序列:5′-CCTGCCAAGTATGATGACATCA-3′,下游引物序列:5′-AGCCCAGGATGCCCTTTAGT-3′。
1.6 Western印迹法
RIPA裂解液(RIPA、 PMSF、 Cocktail、磷酸酶抑制剂的混合液)冰上裂解组织,充分裂解后,4℃,离心半径9.5cm,12000r/min,离心5min,吸取上清液。蛋白定量后加入6×上样缓冲液煮沸。10%SDS-PAGE胶孔中加入等量蛋白,电泳,转膜。5%脱脂牛奶封闭后FNDC5一抗1∶800孵育过夜。TBST洗膜3次,1∶1000孵育二抗,成像系统Odyssey曝光成像。
1.7 免疫组化
取大鼠全心,去除上部心房及右室、骨骼肌,4%多聚甲醛固定,常规石蜡包埋切片后行FNDC5蛋白免疫组化染色,200倍光学显微镜下观察摄片。
1.8 统计学处理
实验数据均使用SPSS 20.0分析,连续变量以![]() 表示。两组间样本比较使用独立样本t检验,多组间样本比较采用方差分析或秩和检验。P<0.05为差异有统计学意义。
表示。两组间样本比较使用独立样本t检验,多组间样本比较采用方差分析或秩和检验。P<0.05为差异有统计学意义。
2.1 AAC组与Sham组基本情况比较
实验中共有20只SD大鼠,两组大鼠术后均未出现相关手术并发症,全部存活至第12周造模结束。术前,AAC组大鼠平均体质量(115±1.67) g,Sham组大鼠平均体质量(115±1.06) g,两者差异无统计学意义。术后12周,AAC组大鼠体质量为(547±8.89) g,Sham组大鼠体质量为(548±8.46) g,差异无统计学意义(P>0.05)。两组大鼠术后饮水量较前有所增加,2周后恢复正常饮水量。
2.2 建模效果评价
两组大鼠心超结果如图1所示。AAC组大鼠LVIDs值大于Sham组(P<0.05),LVPWd值大于Sham组(P<0.05),AAC组大鼠FS值明显延长(P<0.05)。
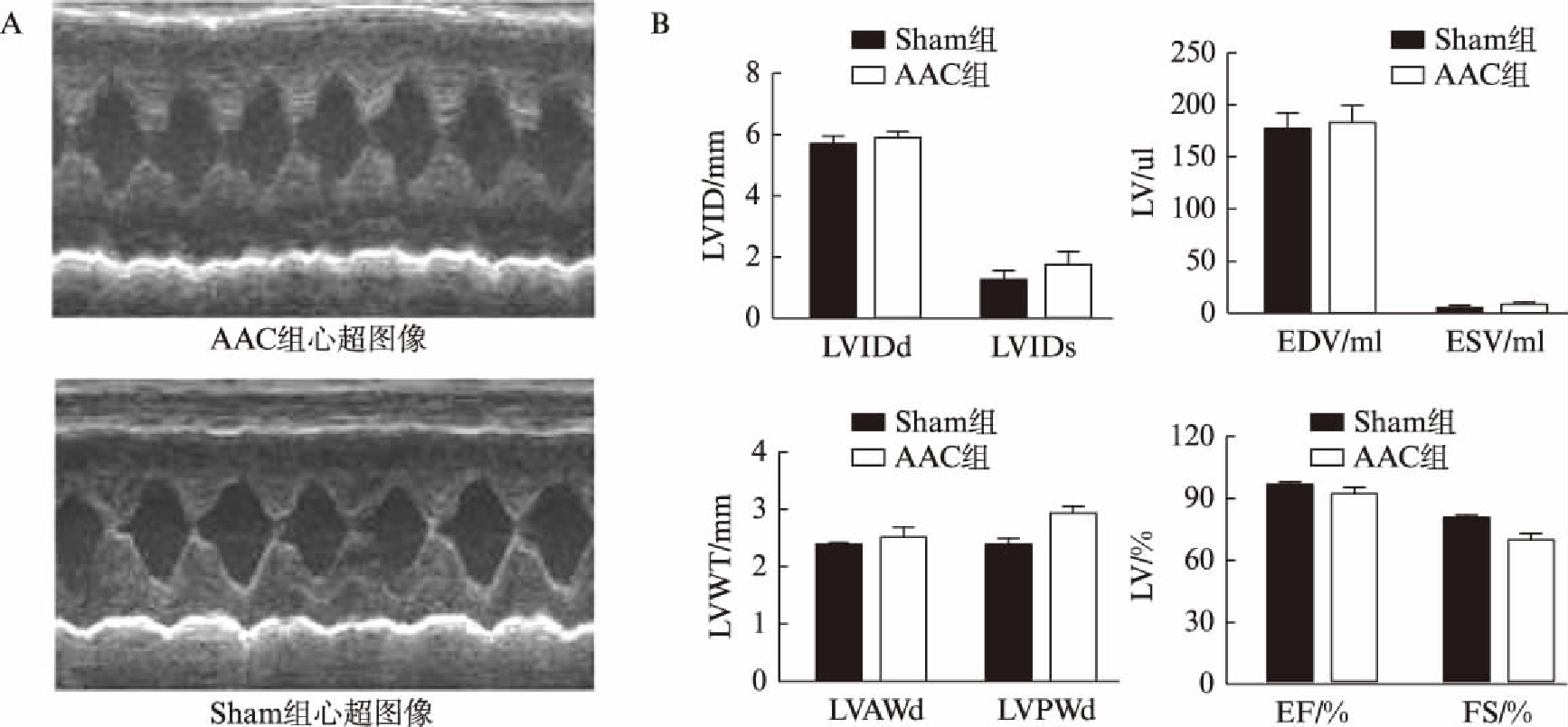
图1 两组大鼠心超结果
Fig.1 Echocardiographic results of rats in two groups
A:心超图像;B:心超测量心室结构
2.3 两组大鼠心脏结构差异比较
造模12周时,两组大鼠心内导管测量结果显示AAC组的动脉血压值、+dp/dt值、-dp/dt值明显高于Sham组(P<0.05)。两组大鼠处死后观察解剖学改变,AAC组大鼠的心脏总重量、左心室重量、心脏重量指数和左心重量指数均大于Sham组(P<0.05),见表1。
表1 两组大鼠心脏解剖参数比较
Tab.1 Comparison of cardiac anatomic parameters in two groups
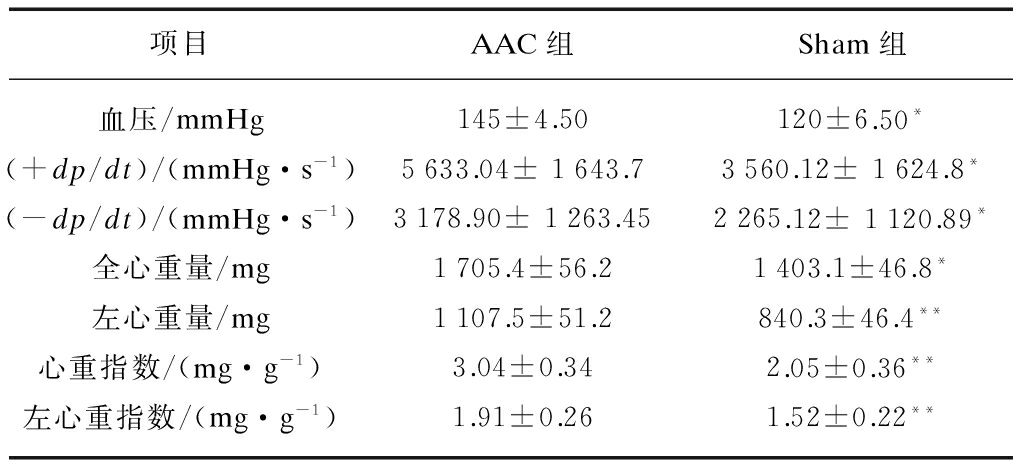
项目AAC组Sham组血压/mmHg145±4.50120±6.50*(+dp/dt)/(mmHg·s-1)5633.04±1643.73560.12±1624.8*(-dp/dt)/(mmHg·s-1)3178.90±1263.452265.12±1120.89*全心重量/mg1705.4±56.21403.1±46.8*左心重量/mg1107.5±51.2840.3±46.4**心重指数/(mg·g-1)3.04±0.342.05±0.36**左心重指数/(mg·g-1)1.91±0.261.52±0.22**
*P<0.05,**P<0.01
2.4 两组大鼠血清irisin变化情况
在两组大鼠给予手术后第12周,AAC组大鼠血清irisin水平升高,显著高于Sham组[(135.2±28.9)ng/ml vs (64.9±34.0)ng/ml, P<0.01]。在腹主动脉结扎后第5周左右,AAC大鼠的血清irisin水平开始出现上升趋势,而Sham组的血清irisin水平在12周内处于平稳状态,未见明显升高或降低(图2)。
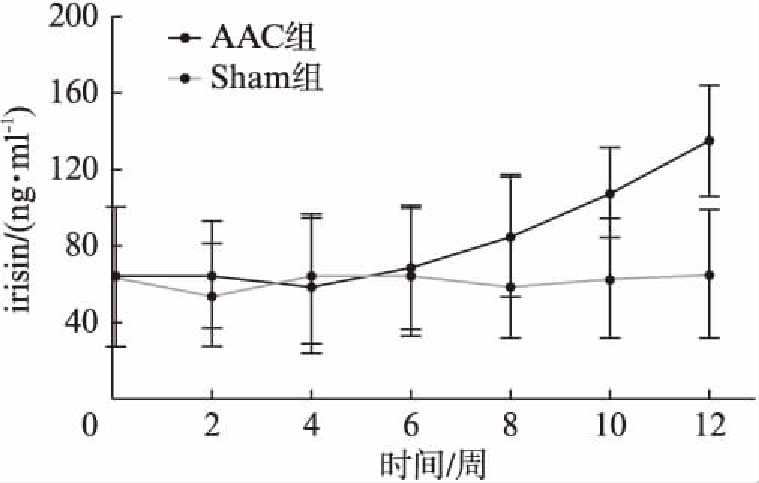
图2 两组大鼠术后12周血清irisin水平动态变化
Fig.2 Dynamic changes of serum irisin levels in two groups in 12 weeks after operation
2.5 FNDC5/irisin在AAC大鼠的心脏、骨骼肌中表达
与Sham组相比,irisin/FNDC5在AAC大鼠的心脏组织(11.8±2.4 vs 1.88±1.2,P<0.001)和肌肉组织(15.1±1.6 vs 1.25±1.4,P<0.001)中表达升高,见图3A。Western 印迹法结果显示,AAC大鼠心脏中irisin/FNDC5蛋白表达水平是Sham组(2.01±0.12)倍(P=0.021),但这种差异在两组大鼠骨骼肌中并不显著,见图3B。AAC大鼠的心脏、骨骼肌中irisin/FNDC5的染色阳性面积是Sham组的数2.37、5.62倍(P=0.003,P<0.001),irisin染色阳性率显著高于Sham组,见图3C。骨骼肌横纵断面的光学显微镜(200×)下观察显示,irisin/FNDC5主要集中于骨骼肌肌筋膜表面表达。
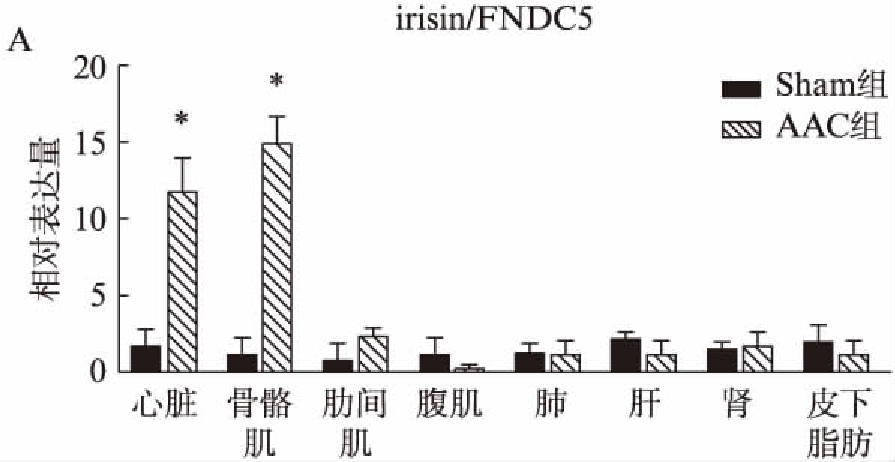
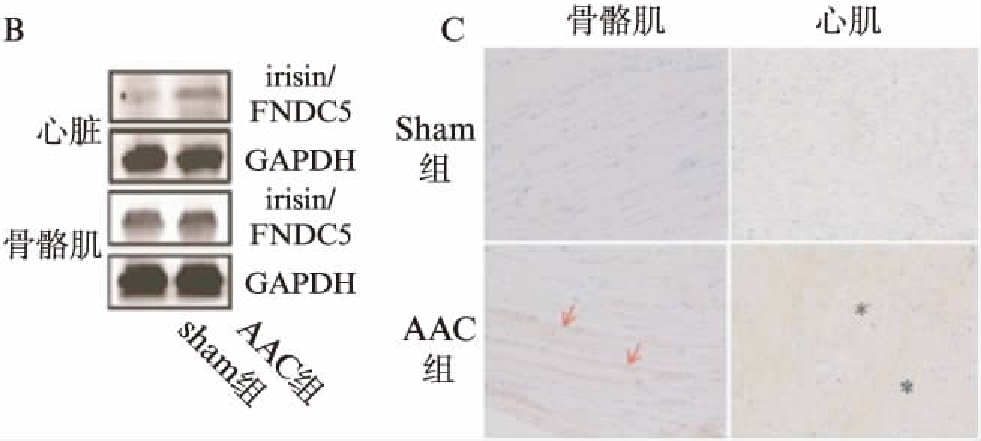
图3 FNDC5/irisin在两组大鼠的心脏、骨骼肌中表达情况
Fig.3 Expression of FNDC5/irisin in heart and skeletal muscle of two groups
通过近12周的造模,结果观察手术组的大鼠血压、心肌厚度、+dp/dt值、-dp/dt值明显高于Sham组,说明成功建立DHF的大鼠模型。AAC组血清irisin水平手术后逐渐升高,与假手术对照组比,其水平差异具有明显统计学意义。两组RNA表达、蛋白表达以及免疫组化结果均证实irisin/FNDC5水平在AAC组大鼠的心脏和骨骼肌中的表达明显增高,且心肌中的irisin/FNDC5表达水平高于骨骼肌。
在临床中,由长期后负荷升高所导致的DHF占了整个疾病病因的大部分[10]。后负荷增加致使舒张末期外周血管压力增加,心肌病理性肥厚而导致左心室顺应性降低,严重影响舒张早期的心室充盈能力。irisin作为一种新发现的细胞因子,已被证实可由肌细胞分泌[11]并参与肌肉收缩的能量代谢[12]。一项针对心衰患者的运动干预研究显示,在低强度有氧运动的心衰患者中,可观察到血清irisin水平增高,而不参加有氧运动的心衰患者中未见irisin水平的变化,并且血清irisin水平较高的患者有着更好的氧利用能力,提示irisin可能与心肌能量代谢存在某种联系[3]。但目前的研究证据尚不充分。
本研究利用大鼠腹主动脉缩窄模型,建立了一个在压力负荷下缓慢形成的心室肥厚的病理生理状态,通过对手术组和Sham组血清irisin水平变化趋势的观察来探讨irisin水平的升高或降低是否与心脏舒张功能状态相关。本研究观察到irisin水平随着造模时间的增加而升高,通过RNA表达水平、蛋白水平和免疫组织化学染色说明Irisin的剪切前体FNDC5蛋白水平在手术组心肌、骨骼肌中显著高于Sham组。在DHF的病理生理过程中,无论心肌肥厚还是充盈受限,均导致心肌细胞耗氧增加,自身供能不足,心肌细胞的正常生理活动发生障碍,进而导致心力衰竭等终末事件[13-14],推测irisin可能是由心肌分泌的一种保护因子以加强自身能量代谢。
通过动物模型的动态观察,本研究发现irisin作为一种新肌肉因子在DHF的疾病进程中进行性升高并且可能是由心肌和骨骼肌共同分泌的。虽然其在DHF中具体生物学作用尚有待进一步的研究阐明,但本研究提示Irisin/FNDC5与心脏舒张功能关系密切,可为临床应用提供指导。
大鼠AAC模型证实血清irisin水平在DHF 的情况下升高,其来源可能是由心肌和骨骼肌共同分泌的。
【参考文献】
[1] 周裔忠,祝善俊,于林君.舒张性心力衰竭诊断与治疗的进展[J].中华心血管病杂志,2004,32(5):478-480.
[2] 中华医学会心血管病学分会.中国心力衰竭诊断和治疗指南2014[J].中华心血管病杂志,2014,42(2):98-122.
[3] Lecker SH, Zavin A, Cao P, et al.Expression of the irisin precursor FNDC5 in skeletal muscle correlates with aerobic exercise performance in patients with heart failure[J].Circ Heart Fail, 2012,5(6):812-818.
[4] Huh JY, Panagiotou G, Mougios V, et al.FNDC5 and irisin in humans:Ⅰ.Predictors of circulating concentrations in serum and plasma and Ⅱ.mRNA expression and circulating concentrations in response to weight loss and exercise[J].Metabolism, 2012, 61(12):1725-1738.
[5] Bostrom P, Wu J, Jedrychowski MP, et al.A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature, 2012,481:463-468.
[6] Aydin S, Aydin S, Kobat MA, et al.Decreased saliva/serum irisin concentrations in the acute myocardial infarction promising for being a new candidate biomarker for diagnosis of this pathology[J].Peptides, 2014,56:141-145.
[7] 王瑞芳,何昆仑,杨泉,等.压力负荷诱导的大鼠舒张性心力衰竭模型的建立[J].中华保健医学杂志,2009,11(2):92-95.
[8] 钟明,张供,张运,等.舒张性心力衰竭动物模型的建立及超声心动图监测[J].中国医学影像技术,2001,17(2):130-132.
[9] Desjardins S, Mueller RW, Cauchy MJ.A pressure overload model of congestive heart failure in rats[J].Cardiovasc Res, 1988,22(10):696-702.
[10] Lam CS, Lyass A, Kraigher-Krainer E, et al.Cardiac dysfunction and noncardiac dysfunction as precursors of heart failure with reduced and preserved ejection fraction in the community[J].Circulation, 2011,124:24-30.
[11] Kelly DP.Medicine Irisin, light my fire[J].Science, 2012,336(6077):42-43.
[12] Xu X, Ying Z, Cai M, et al.Exercise ameliorates high-fat diet-induced metabolic and vascular dysfunc-tion, and increases adipocyte progenitor cell population in brown adipose tissue[J].Am J Physiol Integr Comp Physiol, 2011,300(5):R1115-1125.
[13] Redfield MM.Understanding “diastolic” heart failure[J].N Engl J Med, 2004,350(19):1930-1931.
[14] 陈维杰,李微,李瑾.老年心力衰竭的临床特点研究[J].同济大学学报:医学版,2011,32(6):77-80.
Expression of myokine irisin in experimental model of diastolic heart failure
【Abstract】Objective To establish an after-load pressure induced rat model of heart diastolic dysfunction and to investigate its relationship with new myokine irisin.Methods The abdominal aortic constriction (AAC) was used to establish an animal model of pressure over-load induced diastolic dysfunction in rat.Twenty Sprague-Dawley (SD) rats were divided into AAC group (n=10) and sham group (n=10).Echocardiography, interventricular pressure, heart structure analysis were used to confirm the model.Q-PCR, Western blot and immunohistochemistry assays (IHC) were used to analyze the expression level of splice-precursor (FNDC5) of irisin.Results ELISA analysis showed that irisin level were significant higher in AAC group than that in sham group [(135.2±28.9) ng/ml vs (47.5±16.0) ng/ml, P<0.001].Q-PCR results showed that FNDC5mRNA relative expression level was higher in hypertrophic myocardium (11.8±2.4 vs 1.88±1.2,P<0.001) and skeletal muscle (15.1±1.6 vs 1.25±1.4,P<0.001) of AAC group than those of sham group.Western blotting results showed FNDC5 protein expression in myocardium of AAC group was higher than that of sham group (P=0.021).IHC result showed that the AAC rat had a significant higher FNDC5 protein IHC staining in skeletal muscle and cardiac muscle compared with sham group.Conclusion The SD rat model of AAC-DHF confirms that serum irisin level is increased in pressure-induced left ventricular diastolic dysfunction, and irisin may be produced by myocardium and skeletal muscle.
【Key words】irisin; diastolic heart failure; abdominal aortic constriction model
doi:10.16118/j.1008-0392.2015.05.003
收稿日期:2015-06-01
基金项目:国家自然科学基金(81070107)
【中图分类号】R 541.6
【文献标志码】A
【文章编号】1008-0392(2015)05-0013-05