·基础研究·
转录因子诱导人脐带间充质干细胞转分化为视网膜色素上皮样细胞的研究
王 丽1,2,3,范文斌1,2,3,吕立夏1,2,3,李 鹏1,2,3,田海滨1,2,3,徐国彤1,2,3
(1.同济大学医学院眼科研究所,上海 200092;2.同济大学医学院再生医学系,上海 200092;3.同济大学医学院干细胞研究中心,上海 200092)
【摘要】目的 探讨采用关键转录因子将人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)转分化为视网膜色素上皮(retinal pigment epithelium,RPE)样细胞的方法。方法 通过流式细胞技术鉴定hUC-MSCs的表面标记分子;通过诱导hUC-MSCs分化成为脂肪、骨和软骨细胞确定其多系分化能力;采用慢病毒包装系统获得分别含有11个转录因子Sox2、Pax6、Rax、Six6、Nr2e1、Otx2、Lhx2、Crx、Mitf-A、Klf4和c-Myc的病毒,并通过感染hUC-MSCs来诱导hUC-MSCs向RPE样细胞分化。结果 hUC-MSCs表达CD29、CD44、CD73、CD90和CD105,但不表达CD11b、CD34, CD45和HLA-DR等分子标记,在成脂、成骨、成软骨分化培养基中可分化为脂肪、骨和软骨细胞。视网膜及RPE发育相关的关键转录因子能够将hUC-MSCs直接转分化为RPE样的细胞,并表达ZO-1、RPE65、Bestrophin-1(Best-1)、CK8/18、Cralbp、Mertk、Tyrosinase(Tyr)、PEDF等RPE细胞的特征分子。结论 视网膜及RPE发育相关的关键转录因子可直接将hUC-MSCs分化为RPE样细胞。
【关键词】人脐带间充质干细胞;视网膜色素上皮细胞;视网膜变性疾病
视网膜变性疾病(retinal degeneration, RD)以视网膜色素变性(retinitis pigmentosa, RP)和年龄相关性黄斑变性(age-related macular degeneration, AMD)两类最具代表性。这些疾病都以视网膜光感受器细胞和RPE功能丧失而引起视功能损害为共同表现。近年来,随着干细胞研究的深入和干细胞技术的发展,基于干细胞的细胞移植治疗为RD患者带来了新的希望[1]。hUC-MSCs具有很强的增殖及自我更新能力,且能够分化为骨、软骨、脂肪细胞、内皮细胞和心肌细胞等多种类型的细胞[2-3],因而hUC-MSCs有望广泛应用于临床。研究[4]表明,hUC-MSCs被移植到遗传性RD模型RCS大鼠视网膜下腔后,表现出很强的神经保护作用,但未发现hUC-MSCs分化为视网膜细胞。最近的研究[5]发现,在皮肤成纤维细胞中过表达眼区转录因子(eye field transcription factors,EFTFs)可有效诱导RPE细胞的产生。在此基础上,本研究采用不同的转录因子,探讨将hUC-MSCs转分化为RPE样细胞,从而高表达RPE细胞特异性的标志基因。
1 材料与方法
1.1 材料
hUC-MSCs来源于华东干细胞库。DMEM/F12培养基、TRIzol、胎牛血清(FBS)、胰岛素转铁蛋白复合物(ITS)和胰蛋白酶购自Gibco公司;地塞米松、胰岛素、3-异丁基1-甲基-黄嘌呤、吲哚美辛、 β-甘油磷酸、抗坏血酸、油红、甲苯胺蓝和茜素红购自Sigma公司;人重组骨形成蛋白-2(recombinant human bone morphogenetic protein, rhBMP-2)购自HumanZyme公司;细胞培养皿和细胞培养板购自Corning公司。荧光标记的抗Isotype control、CD105、CD90、CD73、CD44、CD29、CD11b、CD34、CD45和HLA-DR购自BD公司;抗RPE65、Bestrophin-1、ZO-1和Cralbp抗体购自Proteintech公司;Sox2、c-Myc和Klf4质粒购自Addgene公司;限制性内切酶和T4连接酶购自NEB公司;反转录试剂盒购自TaKaRa公司;Q-PCR试剂盒购自天根生化科技(北京)有限公司;引物由上海生物工程有限公司合成,序列见表1。
表1 Q-PCR引物序列
Tab.1 Primers for Q-PCR

基因正向引物序列反向引物序列c-MycCTGAGGAGGAACAAG-AAGATGAGGAGGACCAGTGGGCTG-TGAGGKlf4AGGAGCCCAAGCCAA-AGAGGCATCCACAGCCGTCC-CAGTCSox2CGGCAACCAGAAAA-ACAGCCCGACAAAAGTTTCCA-CTCGOtx2TGCTGGCTCAACTTC-CTACTATATCCCTGGGTGGA-AAGAGCrxCACCAGGCTGTGCC-CTACCTTCCAGCTCCTCCA-GTTGPax6TCACCATGGCAAATA-ACCTGCAGCATGCAGGAGTA-TGAGGRaxGGCAAGGTCAACCTA-CCAGACTTCATGGAGGACAC-TTCCAGLhx2GCACCACCAGCTTCG-GACCAACCAGACCTGGAGGA-CCCGCSix6ACCCCTACGCAGGTG-GGCAATGAAGTGGCCGCCTT-GCTGGMitf-AACCGACAGAAGAAAC-TGGAGCGACCCGTGGATGGAA-TAAGGNr2e1ATCAAGTGGGCTAAG-AGTGTGCAGCCAGTAGAGTGT-TAGCATC
(续表1)
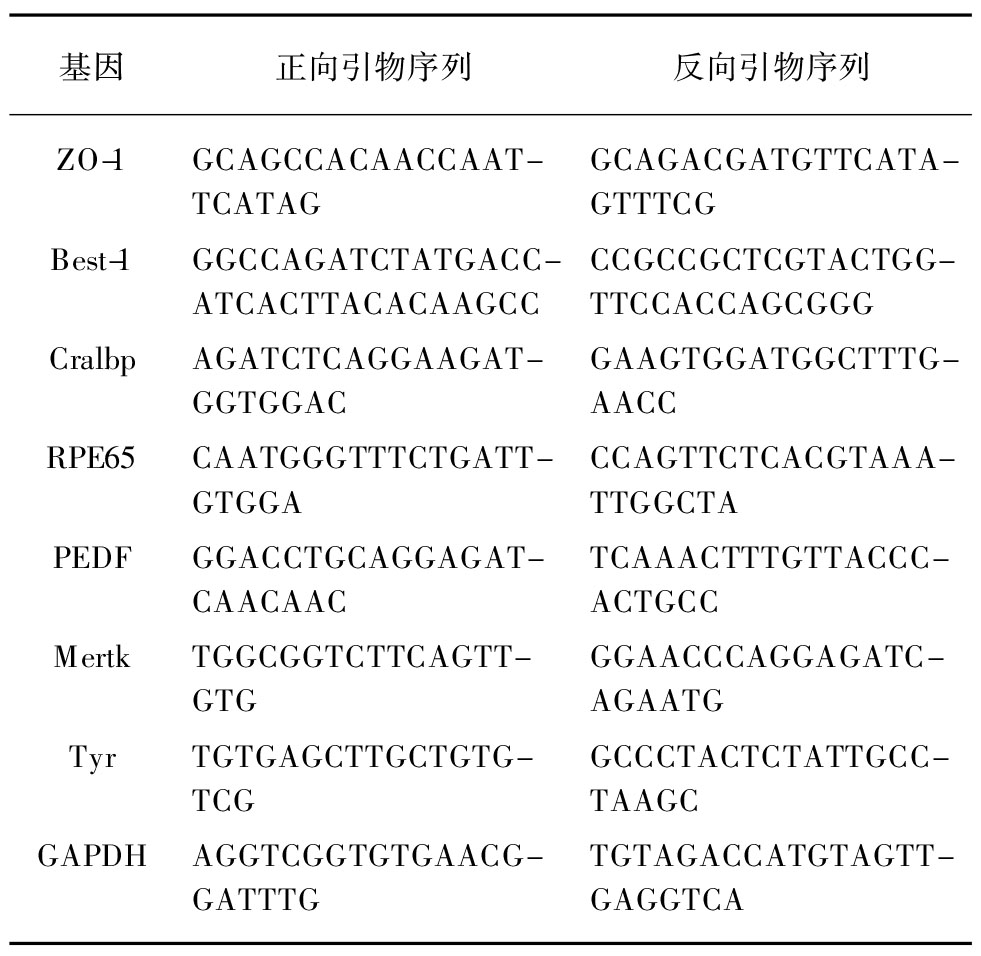
基因正向引物序列反向引物序列ZO-1GCAGCCACAACCAAT-TCATAGGCAGACGATGTTCATA-GTTTCGBest-1GGCCAGATCTAT-GACC-ATCACTTACA-CAAGCCCCGCCGCTCGTACTGG-TTCCACCAGCGGGCralbpAGATCTCAGGAAGAT-GGTGGACGAAGTGGATGGCTTTG-AACCRPE65CAATGGGTTTCT-GATT-GTGGACCAGTTCTCACGTAAA-TTGGCTAPEDFGGACCTGCAGGAGAT-CAACAACTCAAACTTTGTTACCC-ACTGCCMertkTGGCGGTCTTCAGTT-GTGGGAACCCAGGAGATC-AGAATGTyrTGTGAGCTTGCTGTG-TCGGCCCTACTCTATTGCC-TAAGCGAPDHAGGTCGGTGTGAACG-GATTTGTGTAGACCATGTAGTT-GAGGTCA
1.2 方法
1.2.1 细胞培养及流式细胞技术鉴定hUC-MSCs表面标记分子 将hUC-MSCs培养在DMEM/F12培养液并添加10% FBS、100U/ml青霉素、100mg/ml链霉素,于37℃、5%CO2条件下培养。当细胞达到80%融合时,采用胰酶消化细胞,收集并离心。同适量的抗体冰上孵育30min,采用流式细胞仪进行分析。
1.2.2 hUC-MSCs成脂、成软骨和成骨分化能力的鉴定 将细胞接种于6孔板中(1×105/孔),加入成脂诱导培养基(DMEM/F12,含10% FBS、 10-7 mol/L地塞米松、10μg/ml胰岛素、100μmol/L 3-异丁基1-甲基-黄嘌呤、100μmol/L吲哚美辛),每2d换1次培养基。28d以后,细胞用4%的多聚甲醛固定,油红染色。软骨分化时,将1×106细胞接种于3.5cm的细菌培养皿里。细胞形成悬球,用成软骨培养基(DMEM/F12含10% FBS、10μg/L转化生长因子β1、50mg/L抗坏血酸和50g/L ITS)诱导28d后,将获得的细胞悬球用多聚甲醛固定后冰冻切片,用甲苯胺蓝染色鉴定软骨细胞的形成。成骨分化时加入成骨诱导培养基(DMEM/F12,含10% FBS、10mmol/L β-甘油磷酸、50μmol/L抗坏血酸和20ng/ml BMP-2),每2d换1次培养液。7d以后,用碱性磷酸酶(Alkaline phosphatase, AKP)染色检测成骨能力;21d以后,采用茜素红染色进一步鉴定成骨细胞。
1.2.3 慢病毒载体的构建 从人胚胎干细胞(embryonic stem cell, ESC)分化产物中提取mRNA为模板,采用PCR方法扩增出8个与视网膜发育及RPE细胞分化相关的转录调控因子Pax6、Rax、Six6、Nr2e1、Otx2、Lhx2、Crx和Mitf-A;另外购得3种在成熟RPE细胞中高表达的转录调控因子质粒Sox2、c-Myc和Klf4。将基因连接入载体pMXs中,从而构建了11个视网膜及RPE发育相关的关键转录因子的慢病毒载体。
1.2.4 慢病毒的包装 HEK293T细胞接种到10cm的细胞培养皿中,用DMEM(含4.5g/L葡萄糖)添加10% FBS、100U/ml青霉素、100mg/ml链霉素培养细胞,达到70%融合时,将10μg连接有转录因子的载体质粒、7.5μg包装质粒pMXs-VSVG、3μg包装质粒pMXs-G/P用LipofectAMINE2000 转染进HEK293细胞中,4h以后换新鲜培养液继续培养。60h后,收集培液上清液,并用0.45μm PVDF膜过滤,-80℃冻存备用。
1.2.5 hUC-MSCs转分化 hUC-MSCs接种到10cm的细胞培养皿中,当细胞密度达到30%~50%时进行病毒感染。感染时撤掉培养液,等比例加入含有11个转录因子病毒的病毒液,每种转录因子病毒液各加入2ml,并加入终浓度为8μg/ml polyb-rene;12h后撤掉病毒液,换成新鲜培养液。此后每天换液并观察细胞形态的变化。
1.2.6 Q-PCR检测转入的转录因子和RPE细胞特异性基因的表达 细胞经TRIzol裂解后提取总RNA,用PrimeScript®RT Master Mix进行反转录获得cDNA。Q-PCR反应试剂盒采用SuperReal-PreMix Plus 并经Bio-Rad CFX Manager 2.1 Detec-tion system 检测,Gapdh作为内参。
1.2.7 免疫荧光检测感染细胞中RPE细胞特异蛋白表达 细胞接种于预置在培养皿中的玻片上,待细胞贴壁达到80%融合后,取出玻片。经4%多聚甲醛固定、0.1% TritonX-100透膜后,用抗人ZO-1、RPE65、Bestrophin-1、Cralbp等一抗以及相应种属来源的带CY3标记的二抗孵育;细胞核用DAPI染色,荧光显微镜下观察。
1.2.8 Western 印迹法检测转染细胞中RPE细胞特异蛋白的表达 用RIPA裂解液裂解细胞,提取蛋白样品,进行SDS-PAGE电泳。用抗人RPE65、Bestrophin-1、ZO-1、Cralbp等一抗体以及相应种属来源HRP标记的二抗检测相关蛋白的表达。以β-actin作为对照内参。
1.3 统计学处理
采用SPSS 19.0统计学软件进行分析,所有数据均采用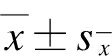 表示,进行单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
表示,进行单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 hUC-MSCs的鉴定
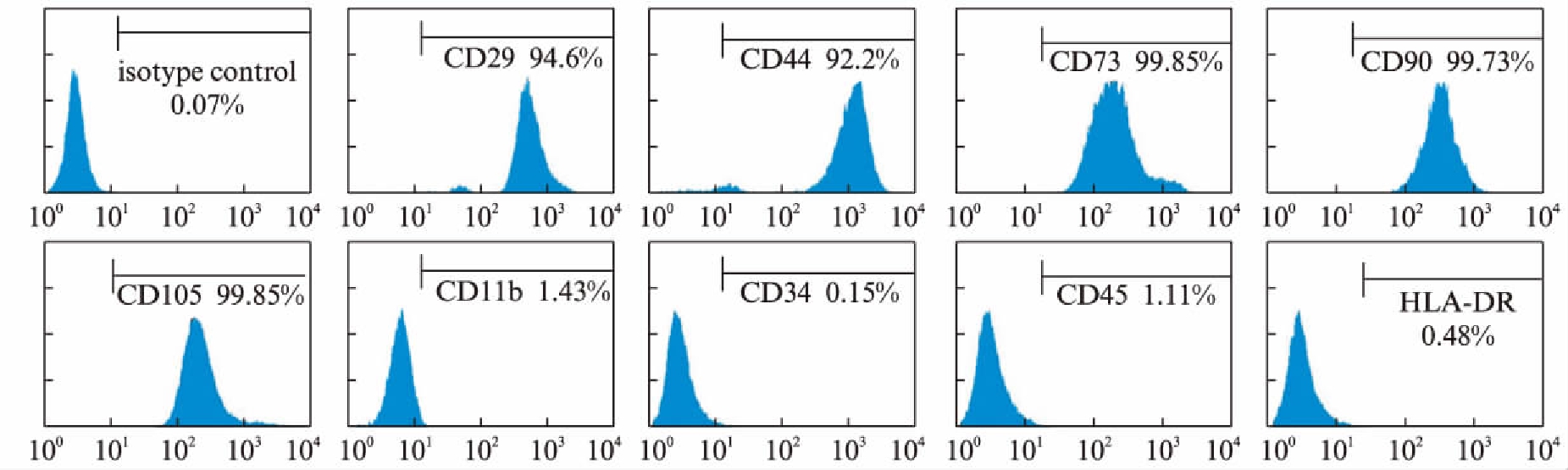
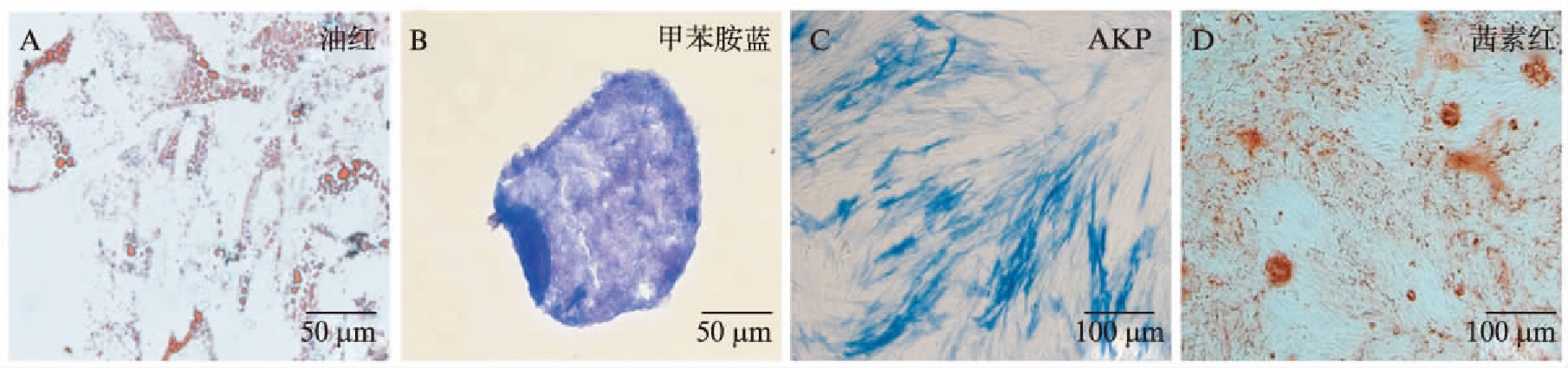
hUC-MSCs细胞呈成纤维细胞样形态,经流式细胞技术鉴定,hUC-MSCs表达CD29、CD44、CD73、CD90和CD105等MSC表面标记分子,但是不表达CD11b、CD34、CD45等血细胞表面标记分子和HLA-DR(图1)。hUC-MSCs在成脂诱导分化4周后,细胞中出现许多细小的脂滴,能被油红染成红色,说明hUC-MSCs能够被诱导分化为脂肪细胞(图2A)。hUC-MSCs成软骨培养细胞会相互聚集成球,培养28d以后,甲苯胺蓝染色呈蓝紫色(图2B)。hUC-MSCs在成骨培养7d后,细胞高表达AKP,染色呈蓝色(图2C),成骨培养21d后,能形成钙结节组织,茜素红染色后呈红色(图2D),表明其具有成骨分化能力。以上结果显示,hUC-MSCs具有MSC的基本特征及多系分化潜能。
2.2 慢病毒载体的构建
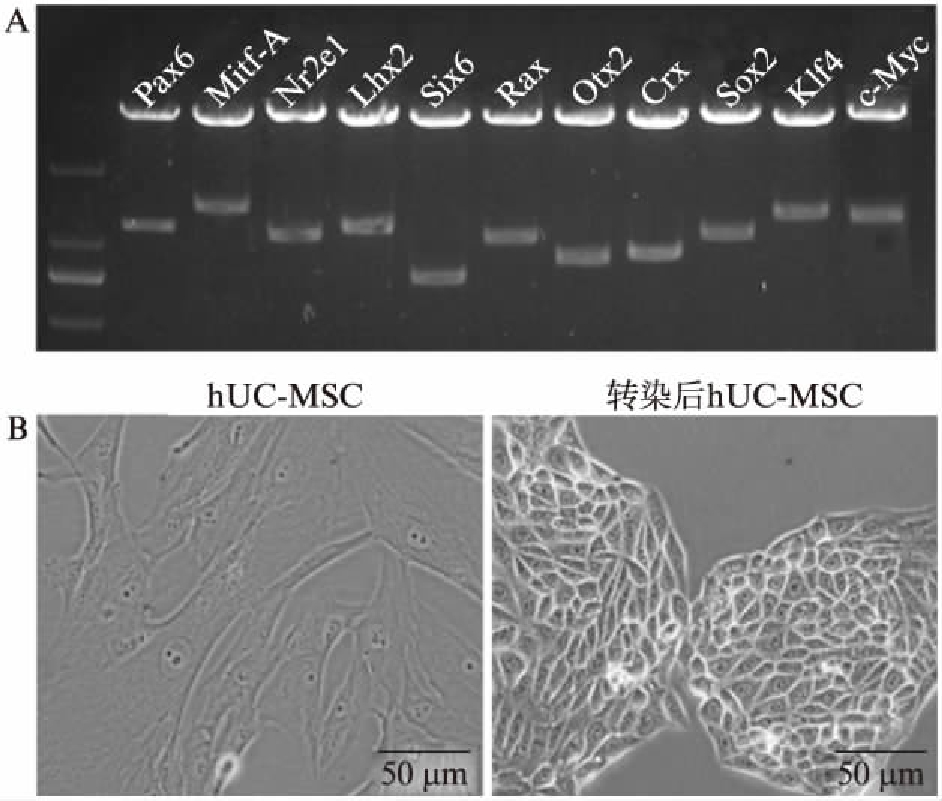
利用PCR的方法获得了Pax6、Rax、Six6、Nr2e1、Otx2、Lhx2、Crx和Mitf-A共8种与视网膜发育和RPE分化相关的转录调控因子的完整编码序列的DNA片段,并将它们与Sox2、Klf4和c-Myc的DNA片段分别克隆到酶切后的载体pMXs中。经双酶切鉴定(图3A),确认构建了11种不同转录因子的载体质粒。用lipofectAMINE2000进行病毒包装后,转染hUC-MSCs。病毒感染7d后,hUC-MSCs中出现了RPE细胞形态样的克隆,呈上皮样,多边形,有清晰可见的细胞间连接(图3B)。
2.3 转染后细胞表达RPE细胞相关特异性基因及蛋白
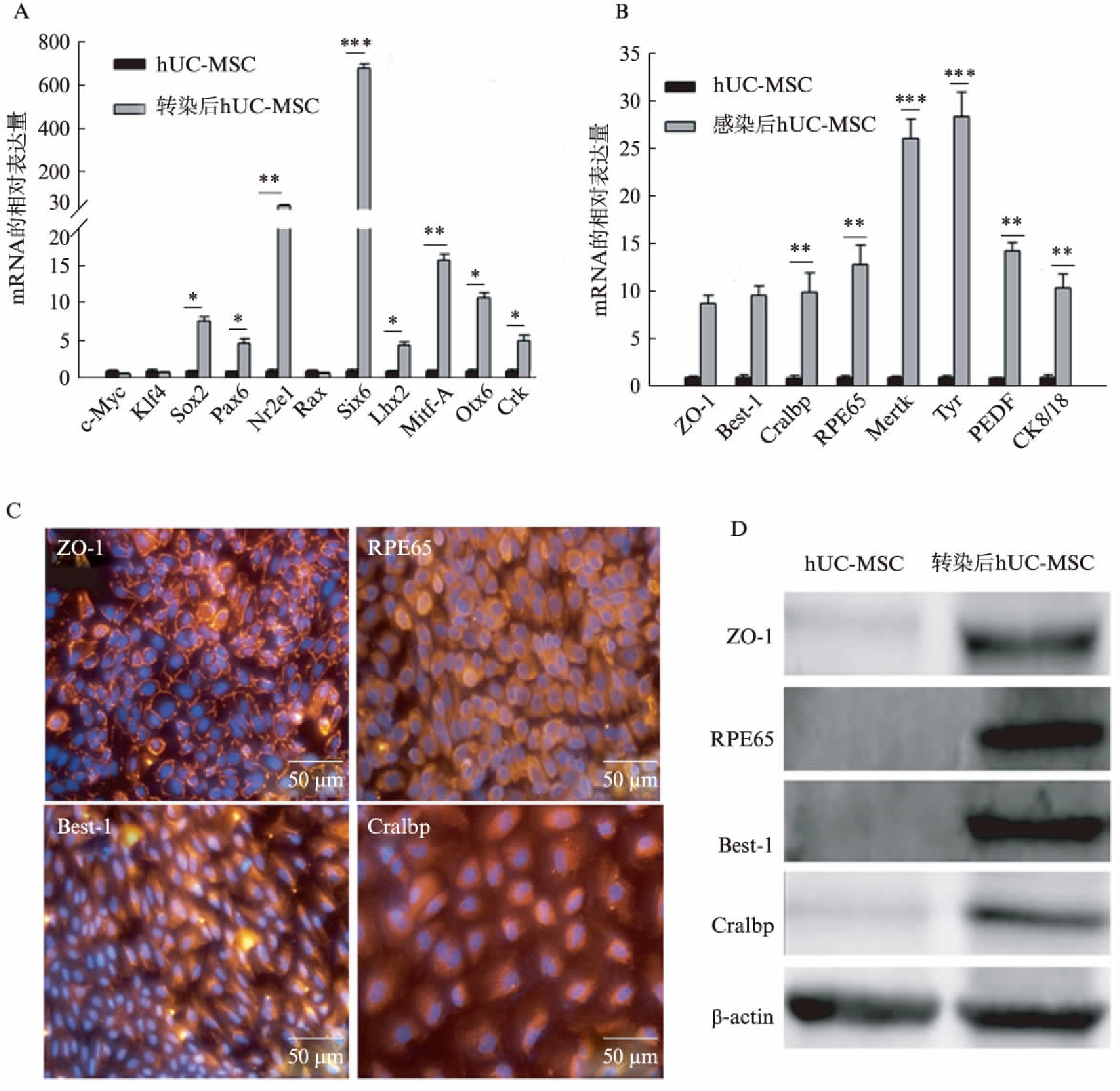
Q-PCR检测结果发现,与hUC-MSCs相比,转染后的细胞高表达转录调控因子Sox2、Pax6、Nr2e1、Six6、Lhx2、Mitf-A、Otx2和Crx(图4A),说明这8种转录因子可能与hUC-MSCs转分化为RPE相关。转染后细胞中的ZO-1、Bestrophin-1、Cralbp、RPE65、Mertk、Tyrosinase、PEDF、CK8/18等一系列直接与视黄醛代谢、黑色素合成以及吞噬相关的RPE细胞特异性基因表达量显著性升高(图4B)。免疫荧光染色结果证明,转染后的细胞呈ZO-1、RPE65、Bestrophin-1和Cralbp染色阳性(图4C)。Western印迹法检测进一步验证了免疫荧光的结果,RPE细胞特异性蛋白在hUC-MSCs中几乎不表达,而在转染后的细胞中显著升高(图4D)。结果证明8种转录因子组合能够使hUC-MSCs转分化为RPE样的细胞。
3 讨 论
近年来,随着人们对干细胞研究的深入,以干细胞移植为手段来治疗视网膜变性疾病给人们带来了新的希望。该治疗策略的主要依据是RP及AMD的内层神经元环路仍然保持完整,因此,有可能通过干细胞移植再生修复光感受器细胞和(或)RPE细胞以恢复视功能。研究[6]表明,视网膜细胞、成体干细胞及ESC和诱导性多能干细胞(induced pluripotent stem cells, iPSC)来源的细胞均可作为供体细胞用于治疗RD。视网膜组织细胞作为已分化细胞,不仅材料获得困难,而且治疗效果也不理想。ESC和iPSC来源的供体细胞已分别在美国和日本进行初步的临床试验,但其成瘤性的安全隐患及治疗效果仍在深入研究确认中。其中,ESC来源的细胞更有伦理和免疫排斥的障碍。相比之下,hUC-MSCs作为间充质干细胞,来源广泛,易于获得,且具有多向分化能力和强大的旁分泌作用,可以成为治疗RD的优质供体细胞[7-9]。理论上讲,hUC-MSCs作为成体干细胞,安全性应该不存在问题,也没有伦理上的争议。
细胞(干细胞)移植治疗的机制主要包括直接的细胞替代和分泌细胞因子所产生的间接作用。在RD晚期阶段,当宿主视网膜的光感受器细胞或RPE细胞已经衰亡时,移植的供体细胞能否分化为并替代受损伤的视网膜细胞则是干细胞移植治疗RD的重要问题。研究[10-11]表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植到体内后具有分化为光感受器细胞和RPE细胞的能力。本研究将大鼠BMSCs移植到碘酸钠诱导的大鼠RD模型中,发现BMSCs能够整合到RPE细胞层。将BMSCs移植到视网膜机械损伤的小鼠玻璃体腔后,供体细胞能在视网膜中整合并向视网膜神经细胞分化[12]。但也有报道将人BMSCs移植到RCS大鼠视网膜下腔后,虽然能明显减慢光感受器细胞凋亡速度并抑制外核层的丢失,但未发现BMSCs分化为光感受器细胞或RPE细胞[8];将小鼠BMSCs移植到RCS大鼠视网膜下腔也具有明显的神经保护作用,BMSCs能在视网膜下腔存活,但也未见整合及分化成光感受器细胞[13]。将UC-MSCs移植到RCS大鼠,虽然起到很强的光感受器细胞保护功能,但未发现UC-MSCs能够分化成神经元细胞[4]。以上研究结果的差异可能与MSC的异质性及各实验室所用的不同动物模型有关。但至少说明直接移植MSCs,细胞在受体视网膜中不易转分化为RPE细胞或其他视网膜细胞。
胚胎发育早期阶段,眼区转录因子Rax、Pax6、Six3、six6和Lhx2等决定着视网膜的早期发育[14-15]。Rax突变可导致胚胎无眼;Pax6基因突变导致RPE转分化为神经视网膜;而Six3发生突变可导致神经视网膜转分化为RPE细胞;Lhx2调节Mitf和Vsx2的表达,该基因缺失,眼睛发育停滞在视泡阶段。此外,其他与眼发育相关的转录因子Sox2和Otx2在眼睛发育的早期阶段就已出现,它们可以调节Rax的表达。Mitf和Otx2是视杯发育阶段RPE分化成熟的关键转录因子。缺失Mitf会导致RPE细胞分化成熟受阻,出现小眼或无眼症状。Yamanaka因子中的c-Myc和Klf4在成熟RPE细胞中高表达,可能与RPE细胞发育相关[16]。研究表明,将8个转录因子c-Myc、Klf4、Nrl、Crx、Rax、Pax6、Mitf和Otx2转入人皮肤成纤维细胞中可将细胞转分化为RPE细胞,但RPE细胞特异性的基因RPE65及Tyr表达量较弱,而本研究采用11个转录因子的组合转染hUC-MSCs,则可获得高表达RPE细胞特异性基因的细胞克隆。此结果说明本研究采用的转录因子组合更易将间质细胞转分化为RPE样细胞。另一方面,hUC-MSCs可能干性更强,更利于转分化为RPE样细胞。然而,本研究采用了11个转录因子感染hUC-MSCs时,只有8个转录因子表达量显著升高,仍需要进一步的实验验证其他转录因子的组合是否能更有效地将hUC-MSCs转分化为RPE样细胞。
综上所述,hUC-MSCs能够在体外被直接转分化成RPE样细胞,表明hUC-MSCs有可能会作为供体细胞治疗RD。同时,hUC-MSCs的收集具有无创性、无伦理争议等优点,并且已成为脐血库或干细胞库常规收集的一类储备细胞,与其他干细胞相比,hUC-MSCs离临床应用可能更近。相信随着hUC-MSCs分化为成熟的RPE细胞技术的完善和成熟,将会为细胞移植治疗RD提供合适的供体细胞。
【参考文献】
[1] Chacko DM, Rogers JA, Turner JE, et al.Survival and differentiation of cultured retinal progenitors transplanted in the subretinal space of the rat[J].Biochem Biophys Res Commun, 2000,268(3):842-846.
[2] 裴艳,徐亚伟,侯磊,等.兔脂肪来源干细胞表面标记及向心肌样细胞分化[J].同济大学学报:医学版,2006,27(6):34-37.
[3] Huang C, Zhang J, Ao M,et al.Combination of retinal pigment epithelium cell-conditioned medium and photoreceptor outer segments stimulate mesenchymal stem cell differentiation toward a functional retinal pigment epithelium cell phenotype[J].J Cell Biochem,2012,113(2):590-598.
[4] Lund RD, Wang S, Lu B, et al.Cells isolated from umbilical cord tissue rescue photoreceptors and visual functions in a rodent model of retinal disease[J].Stem Cells, 2007,25:602-611.
[5] Zhang K, Liu GH, Yi F,et al.Direct conversion of human fibroblasts into retinal pigment epithelium-like cells by defined factors[J].Protein Cell, 2014,5(1):48- 58.
[6] 李睿,崔红平.干细胞移植治疗眼科疾病的研究进展[J].同济大学学报:医学版,2011,32(3):105-110.
[7] Mitchell KE, Weiss ML, Mitchell BM, et al.Matrix cells from Wharton’s jelly form neurons and glia[J].Stem Cells,2003,21(1):50-60.
[8] Lu B, Wang S, Girman S, et al.Human adult bone marrow-derived somatic cells rescue vision in a rodent model of retinal degeneration[J].Exp Eye Res, 2010,91(3):449-455.
[9] Inoue Y, Iriyama A, Ueno S, et al.Subretinal transplantation of bone marrow mesenchymal stem cells delays retinal degeneration in the RCS rat model of retinal degeneration[J].Exp Eye Res,2007,85(2):234-241.
[10] Gong L, Wu Q, Song B, et al.Differentiation of rat mesenchymal stem cells transplanted into the subretinal space of sodium iodate-injected rats[J].Clin Experiment Ophthalmol, 2008,36(7):666-671.
[11] Guan Y, Cui L, Qu Z, et al.Subretinal transplantation of rat MSCs and erythropoietin gene modified rat MSCs for protecting and rescuing degenerative retina in rats[J].Curr Mol Med, 2013,13(9):1419-1431.
[12] Tomita M, Adachi Y, Yamada H, et al.Bone marrow-derived stem cells can differentiate into retinal cells in injured rat retina[J].Stem Cells, 2002,20(4):279-283.
[13] 李鹏,李宗义,王丽,等.诱导人脐带间充质干细胞分化为视网膜色素上皮样细胞的研究[J].中华细胞与干细胞杂志:电子版,2014,4(1):44-51.
[14] Dortch-Carnes J, Tosini G.Melatonin receptor agonist-induced reduction of SNP-released nitric oxide and cGMP production in isolated human non-pigmented ciliary epithelial cells[J].Exp Eye Res, 2013,107:1-10.
[15] Fuhrmann S.Eye morphogenesis and patterning of the optic vesicle[J].Curr Top Dev Biol,2010,93:61-84.
[16] Salero E, Blenkinsop TA, Corneo B, et al.Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives[J].Cell Stem Cell, 2012,10(1):88-95.
Transdifferentiation of human umbilical cord mesenchymal stem cells into retinal pigment epithelial like cells
WANG Li1,2,3, FAN Wen-bin1,2,3, LV Li-xia1,2,3, LI Peng1,2,3, TIAN Hai-bin1,2,3, XU Guo-tong1,2,3
(1.Tongji Eye Institute, Medical College, Tongji University, Shanghai 200092, China; 2.Dept.of Regenerative Medicine, Medical College, Tongji University, Shanghai 200092, China; 3.Stem Cell Research Center, Medical College, Tongji University, Shanghai 200092, China)
【Abstract】Objective To investigate the transdifferentiation of human umbilical cord mesenchymal stem cells (hUC-MSCc) into retinal pigment epithelial (RPE) cells.Methods MSC specific markers were identified by flow cytometry in hUC-MSCs, and adipogenesis, osteogenesis and chondrogenesis were confirmed by culturing hUC-MSCsin differentiation media.Sox2, Pax6, Rax, Six6, Nr2e1, Otx2, Lhx2, Crx, Mitf-A, Klf4 and c-Myc were co-infected into hUC-MSCs by lentivirus-mediated system.The hUC-MSCs derived RPE-like cells were characterized by detecting the expressions of specific markers by real-time quantitative-polymerase chain reaction (Q-PCR), immunostaining and Western blot.Results hUC-MSCs were positive for CD29, CD44, CD73, CD90, CD105 and negative for CD11b, CD34, CD45, HLA-DR.After induction, hUC-MSCs were differentiate into adipocytes, osteoblasts and chondrocytes.Retina and RPE development related transcription factors directly transdifferentiated hUC-MSCs into RPE-like cells which expressed RPE specific markers ZO-1, RPE65, Bestrophin-1, CK8/18, Cralbp, Mertk, Tyrosinase and PEDF.Conclusion hUC-MSCs could be directly transdifferentiated into RPE-like cells by key transcription factors.
【Key words】human umbilical cord mesenchymal stem cells; retinal pigment epithelial cells; retinal degenerativedisease
doi:10.16118/j.1008-0392.2015.05.001
收稿日期:2015-04-30
基金项目:国家“九七三”重点基础研究发展计划(2013CB967501);国家自然科学基金(C120111)
作者简介:王 丽(1986—),女,博士研究生.E-mail:1210620@tongji.edu.cn
通信作者:徐国彤.E-mail:gtxu@tongji.edu.cn
【中图分类号】R 774
【文献标志码】A
【文章编号】1008-0392(2015)05-0001-07


 c markers in transfected hUC-MSCs
c markers in transfected hUC-MSCs