表1 3组血清uPA含量比较
Tab.1 Serum uPA levels among three groups (ng·ml-1)

组别nx±sQ1Q3对照组1020.5460±0.130.5250.593化疗前1071.2156±0.251.1281.22756个疗程后1071.0710±0.261.0281.0955
·临床研究·
【摘要】目的 探讨上皮性卵巢癌患者化疗前及化疗后血清中纤溶酶原激活剂(uPA)含量的变化与预后的相关性。方法 107例卵巢恶性肿瘤患者行手术初治后,采用酶联免疫吸附试验(ELISA)检测化疗前及化疗后血清中uPA的含量。102例相同年龄段的正常健康妇女作为对照。结果 卵巢癌患者化疗前及化疗后血清中uPA的含量均明显高于正常对照组,差异有统计学意义(P<0.05)。卵巢癌患者化疗前血清中uPA的水平高于化疗后,两者的差异有统计学意义(P<0.05)。单因素生存分析中,化疗前uPA水平、化疗后uPA水平、FIGO分期、残余瘤灶直径大小和有无淋巴结转移是影响卵巢癌患者无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)的相关因素(P<0.05)。Cox比例风险模型分析显示,化疗前uPA水平和有无淋巴结转移与预后明显相关(P<0.05)。结论 卵巢癌患者化疗前后血清中uPA水平高于正常人群,且其水平高低与FIGO分期、淋巴结转移及残存瘤灶大小高度相关。化疗前血清中uPA含量可作为评价患者PFS和OS的独立预后因子。
【关键词】上皮性卵巢癌; 纤溶酶原激活剂; 血清; 预后
卵巢上皮癌是妇科肿瘤中威胁妇女死亡的重要原因。由于其发生的隐匿性,仅有15%的早期卵巢恶性肿瘤可以被及时诊断[1]。大多数患者被诊断时都处于疾病的进展期,因此其生存率只有20%~25%[2]。恶性肿瘤的侵袭和转移是导致肿瘤复发及患者死亡的主要原因,尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)是降解细胞外基质(extracellular matrix, ECM)中最重要的蛋白酶水解类,其不仅能降解ECM和基底膜成分,还能通过细胞内信号通路影响肿瘤的细胞增殖和血管生成过程。有研究认为uPA可能在卵巢癌的早期扩散中起重要作用。同时多篇报道[3-6]提示uPA含量的高低与肿瘤的浸润、转移及预后密切相关。这说明uPA系统可望成为卵巢癌的一个新的标志物。本研究检测行肿瘤细胞减灭术的上皮性卵巢癌患者在化疗前及化疗6疗程后血清中uPA含量,探讨其临床病理等因素的关系及其是否能作为独立的预后因子。
1.1 一般资料
血清标本均来自于2008年1月至2010年5月同济大学附属同济医院妇科卵巢癌住院患者,共107例,年龄40~69岁,平均年龄(55.3±7.3)岁。选取同期行妇科体检的健康妇女共102名作为对照组,年龄40~68岁,平均年龄(54.4±6.6)岁。卵巢癌患者初治均直接采取肿瘤细胞减灭术且术前均未行新辅助化疗,患者术后均接受紫杉醇和铂类联合化疗,每隔3周1次,至少6次。所有上皮性卵巢癌患者的组织标本均由病理学检查确诊,其中浆液性癌89例,非浆液性癌18例(黏液性癌5例,透明细胞样癌7例,子宫内膜样癌6例);患者的临床分期按国际妇产科联盟(FIGO,2006年)标准,107例中Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期50例;组织学分级: 高分化(G1)21例,中低分化(G2、G3)86例。淋巴结转移: 术后证实有淋巴结转32移例,无淋巴结转移75例;残余瘤灶直径<1cm 61例,直径≥1cm 46例。全部病例均随访至2013年12月,至随访截止日期,107例上皮性卵巢癌患者中53例死亡,54例生存。收集卵巢癌患者化疗前及6次化疗后的血清。对照组研究对象均无高血压、糖尿病及肝肾功能疾病史,采血期间均排除服用避孕药及激素类药物,2周内均未接受抗凝及溶栓治疗。
1.2 标本收集
收集卵巢癌患者术后化疗前、化疗6个疗程后以及健康妇女的空腹外周静脉血4ml,标本注入干试管内,4h内在室温下离心半径3cm,3000r/min,离心10min,取上清液,-80℃保存待测。
1.3 血清UPA含量的检测
采用酶联免疫吸附反应(enzyme-linked immunosorbent assay, ELISA)方法检测血清中uPA的含量。uPA ELISA试剂盒购自武汉博士德生物有限公司,所有操作按试剂盒说明书进行。酶联仪为Bio-Rad 680购自美国Bio-Rad公司。
1.4 标准曲线的建立及结果判断
以标准品uPA的浓度的作X轴,及其相应的D450值作Y轴,在Excel工作表中绘制标准品线性回归曲线,即Y=0.001X+0.115 R2=0.981。
1.5 统计学处理
用SPSS 18.0统计软件进行分析,均数比较采用t检验。生存分析中,用Kaplan-Meier法计算累计生存率并绘制生存曲线,Log-Rank法进行单因素分析,比较不同因素间无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)的差异。采用Cox风险比例回归模型进行影响PFS和OS的多因素分析。全部检验均为双侧检验,P<0.05为差异有统计学意义。
2.1 化疗前、后uPA含量的变化
卵巢癌患者化疗前、化疗6个疗程后血清中uPA值与对照组相比差异有统计学意义(P均<0.001);化疗6个疗程后血清uPA含量较化疗前明显下降(P<0.001),见表1。
表1 3组血清uPA含量比较
Tab.1 Serum uPA levels among three groups (ng·ml-1)

组别nx±sQ1Q3对照组1020.5460±0.130.5250.593化疗前1071.2156±0.251.1281.22756个疗程后1071.0710±0.261.0281.0955
2.2 化疗前、后uPA含量与临床病理等因素的关系
Ⅲ~Ⅳ期卵巢癌患者化疗前及化疗6个疗程后血清uPA含量明显高于Ⅰ~Ⅱ期,差异有统计学意义(P均<0.001);有淋巴结转移患者化疗前、后血清uPA含量明显高于无淋巴结转移者(P<0.001,P<0.01);残余瘤灶直径≥1cm患者化疗前、后血清uPA含量均明显高于残留肿瘤直径<1cm患者(P<0.001,P<0.01);患者化疗前、后血清uPA含量与病理类型、组织学分级均无明显相关性(P均>0.05),见表 2。
2.3 化疗前、后血清uPA含量与预后的关系
2.3.1 单因素生存分析 纳入单因素分析的指标包括化疗前uPA含量、化疗6个疗程后uPA含量、FIGO分期、有无淋巴结、残余肿瘤直径、组织学分级以及病理学类型。结果显示: 化疗前uPA含量≥1.28ng/ml(P<0.001,χ2=19.321,见图1A;P<0.001,χ2=19.148,见图1B)、化疗6个疗程后,uPA含量≥1.09ng/ml(P=0.008,χ2=7.027,见图2A;P=0.012,χ2=6.351,见图2B)、Ⅲ~Ⅳ期卵巢癌患者(P<0.01,χ2=11.747;P<0.001,χ2=13.319)、有淋巴结转移(P<0.001,χ2=18.429;P<0.001,χ2=19.463)、残余瘤灶直径≥1cm(P=0.014,χ2=6.017;P=0.035,χ2=4.434)的患者PFS和OS均较短。而中低分化卵巢癌的PFS和OS与高分化患者相比差异无统计学意义(P=0.733,P=0.662),浆液性卵巢癌患者与非浆液性卵巢癌患者的PFS和OS差异无统计学意义(P=0.732,P=0.983)。
表2 上皮性卵巢癌化疗前后血清中uPA 含量与临床病理及其他因素的关系
Tab.2 Correlations of serum uPA levels with clinicopathological characteristics of ovarian cancer patients
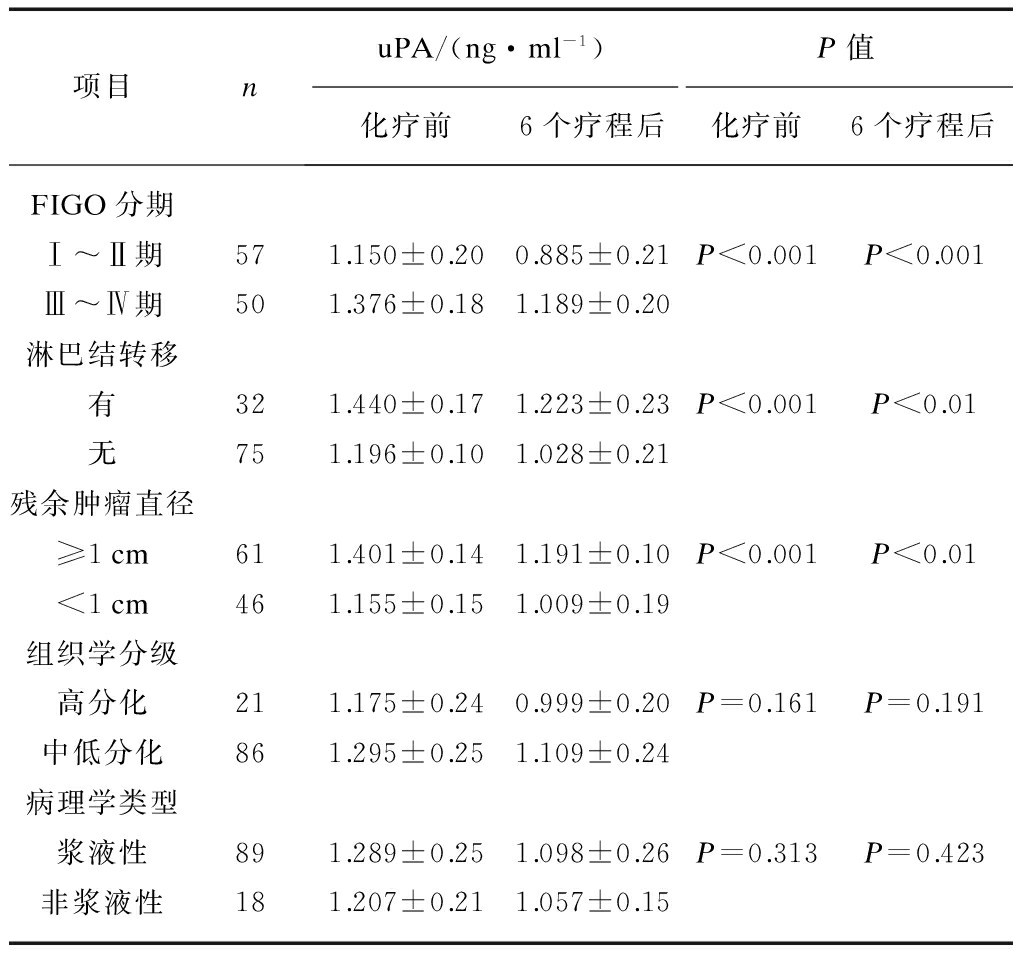
项目nuPA/(ng·ml-1)P值化疗前6个疗程后化疗前6个疗程后FIGO分期Ⅰ~Ⅱ期571.150±0.200.885±0.21P<0.001P<0.001Ⅲ~Ⅳ期501.376±0.181.189±0.20淋巴结转移有321.440±0.171.223±0.23P<0.001P<0.01无751.196±0.101.028±0.21残余肿瘤直径≥1cm611.401±0.141.191±0.10P<0.001P<0.01<1cm461.155±0.151.009±0.19组织学分级高分化211.175±0.240.999±0.20P=0.161P=0.191中低分化861.295±0.251.109±0.24病理学类型浆液性891.289±0.251.098±0.26P=0.313P=0.423非浆液性181.207±0.211.057±0.15
2.3.2 多因素生存分析 将单因素分析中显示与PFS和OS相关的因素纳入COX比例风险模型进行多因素分析。结果显示: 化疗前uPA阳性(uPA≥1.28ng/ml)和阴性(uPA<1.28ng/ml)患者的PFS平均值分别是22.80±5.2个月和40.38±3.4个月,差异有统计学意义(P<0.05,HR=2.714)。化疗前uPA阳性和阴性患者的OS平均值分别为34.52±4.8个月和46.85±3.1个月,差异有统计学意义(P<0.05,HR=2.894)。卵巢癌有淋巴结转移患者和无转移患者的PFS平均值分别为20.57±6.2个月和37.16±4.1个月,OS分别为31.93±3.8个月和45.26±1.5个月,差异均有统计学意义(P均<0.05)。而化疗6个疗程后uPA阳性(uPA≥1.09ng/ml)和阴性(uPA<1.09ng/ml)患者的PFS平均值分别为26.96±5.7个月和37.54±7.2个月,差异无统计学意义(P>0.05);OS平均值分别为38.06±6.2个月和44.32±5.4个月,差异无统计学意义(P>0.05)。FIGO分期Ⅰ/Ⅱ与Ⅲ/Ⅳ期患者比较PFS及OS差异无统计学意义(P>0.05),卵巢癌残余瘤灶直径≥1cm和<1cm的患者比较,PFS及OS差异无统计学意义(P>0.05),见表3。
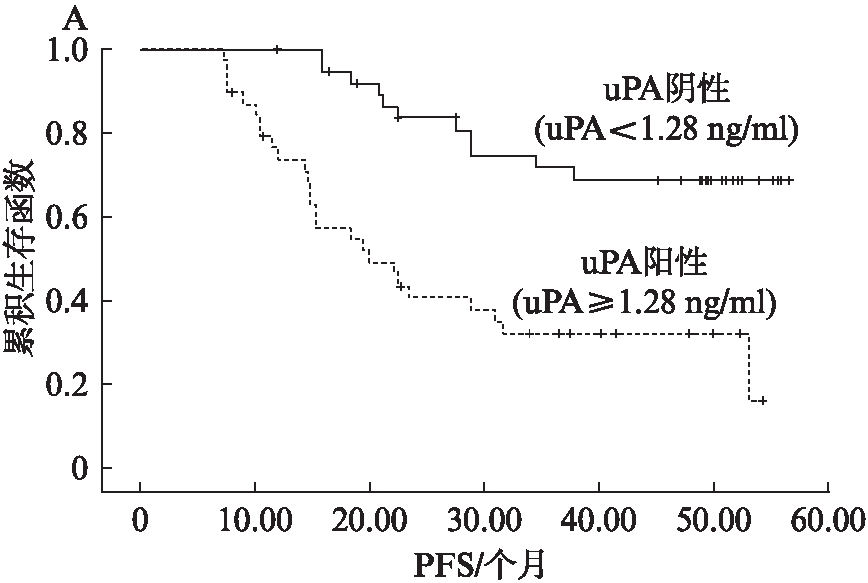
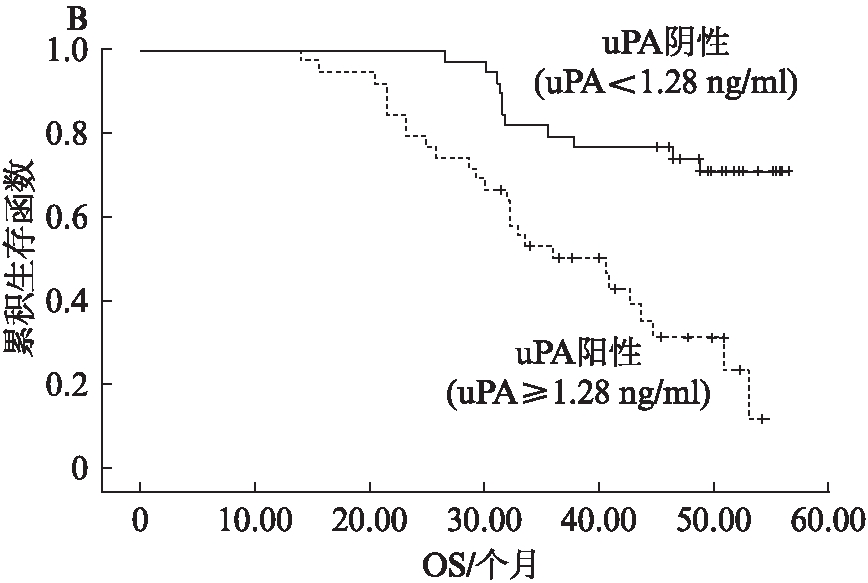
图1 化疗前uPA含量对PFS、OS的影响
Fig.1 Association of serum uPA before chemotherapy
with PFS and OS
A: PFS;B: OS
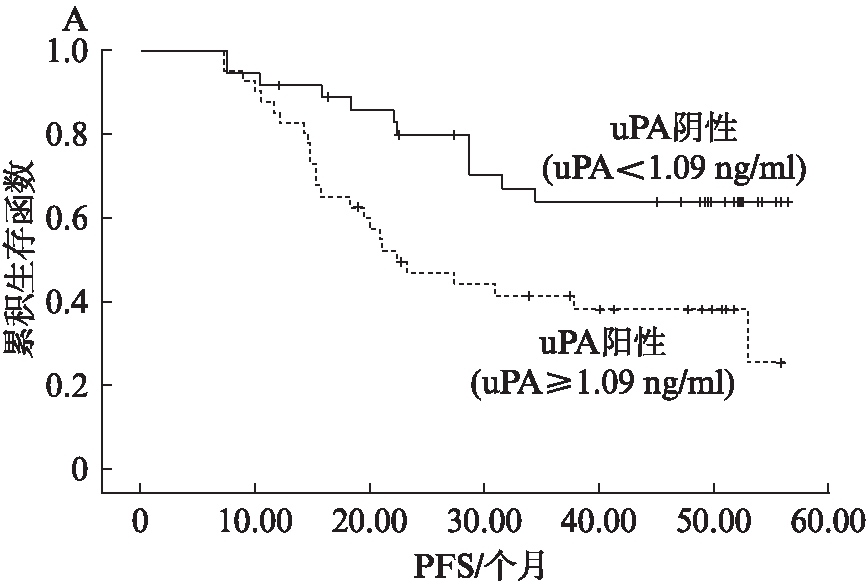
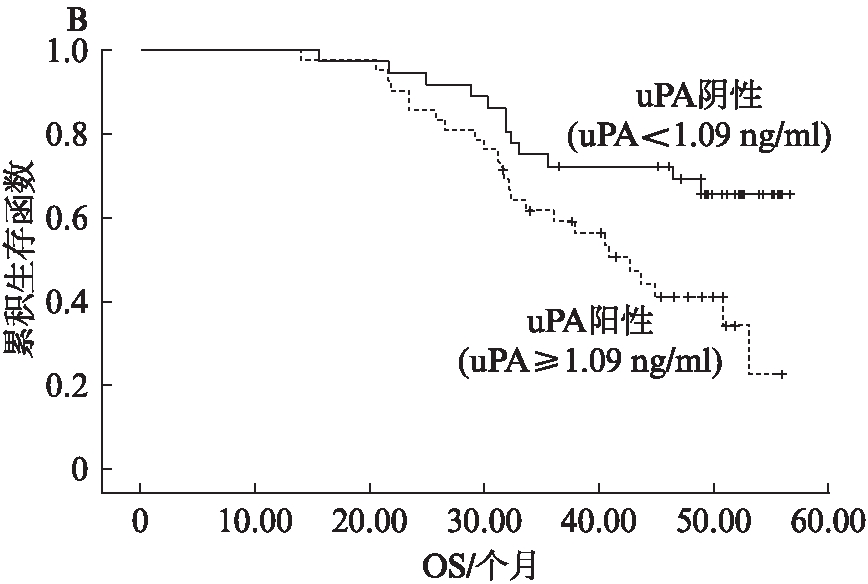
图2 化疗后uPA含量对PFS、OS的影响
Fig.2 Association of serum uPA after chemotherapy with PFS and OS
A: PFS;B: OS
表3 影响行肿瘤细胞减灭术后卵巢癌患者PFS和OS的相关因素分析
Tab.3 Risk factors of PFS and OS of patients after ovarian cancer debulking surgery
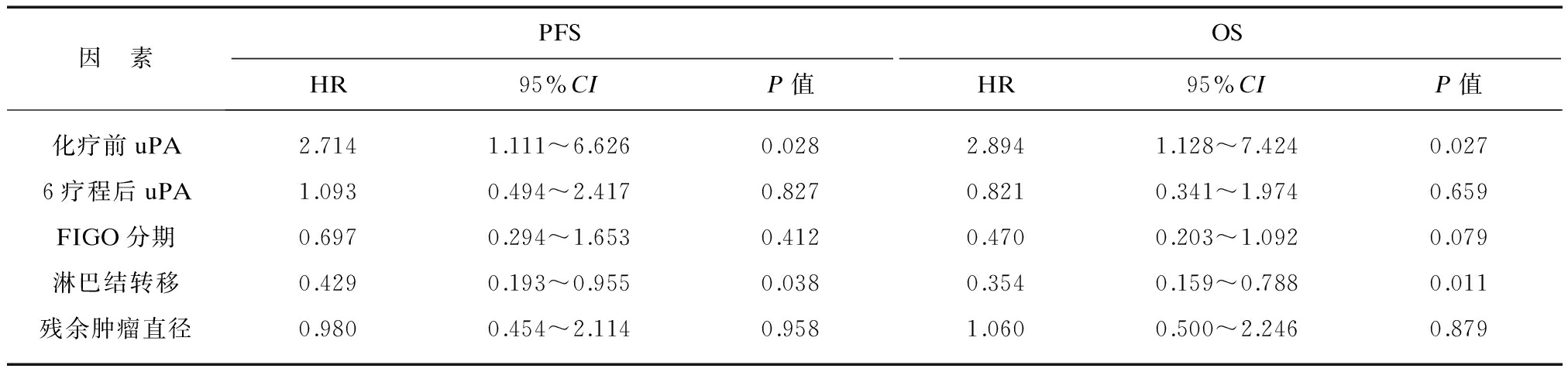
因 素PFSOSHR95%CIP值HR95%CIP值化疗前uPA2.7141.111~6.6260.0282.8941.128~7.4240.0276疗程后uPA1.0930.494~2.4170.8270.8210.341~1.9740.659FIGO分期0.6970.294~1.6530.4120.4700.203~1.0920.079淋巴结转移0.4290.193~0.9550.0380.3540.159~0.7880.011残余肿瘤直径0.9800.454~2.1140.9581.0600.500~2.2460.879
基底膜的破坏,ECM的降解或ECM成分的改变是肿瘤细胞浸润、转移等恶性生物学行为发生的前提条件,因此各种蛋白水解酶的含量可以用来衡量肿瘤细胞浸润转移能力的强弱。纤溶酶和基质金属蛋白酶(matrix metalloproteinase, MMP)系统是ECM中最重要的蛋白酶系统,uPA不仅能直接激活纤溶酶促进ECM中大多数蛋白的降解,还能激活MMP系统,加强胶原、弹性蛋白等的降解。在肿瘤的侵袭转移过程中,uPA系统介导的基质纤维蛋白降解过程起着核心作用。脉管系统是肿瘤生长和转移过程中必不可少的一部分,肿瘤细胞也可通过脉管系统向全身转移。ECM中存储着多种类型细胞如巨噬细胞、成纤维细胞、内皮细胞等分泌的生长因子,纤溶酶原被uPA激活降解ECM的同时,这些生长因子被释放,当它们与其相应的受体结合后,能够启动Ras-Raf-Mek-Erk信号传导通路,从而刺激肿瘤的血管生成。除此之外,它们还可以促进uPA的表达,因此这些生长因子能够与uPA系统相互作用,共同促进肿瘤的浸润与转移。uPA在人类各种恶性肿瘤[3-6]中的表达水平远远高于其相应的正常组织,且uPA的表达水平与肿瘤的侵袭能力呈正相关,uPA的表达水平越高,患者预后越差,生存期越短。
本研究结果显示: 化疗前及化疗6个疗程后外周血中uPA的含量明显高于正常对照组,同一卵巢癌患者化疗前血清中uPA的含量与化疗6个疗程后也有显著性差异。提示术后且无论是否有残存病灶,患者体内仍有肿瘤细胞存在,因此患者血清中uPA的含量尚未恢复到正常水平。在Ⅲ~Ⅳ期上皮性卵巢癌患者化疗前后血清中uPA的含量明显均高于Ⅰ~Ⅱ期,说明卵巢癌患者的临床期别越高,外周血uPA的水平越高。术后有残存病灶、有淋巴结转移的患者化疗前及化疗6个疗程后血清中uPA的浓度也高于无残存病灶、无淋巴结转移的患者。这些结果均提示uPA的含量与肿瘤本身的恶性程度相关。Cai等[7],van der Burg等[8]的研究结果与本研究结果相似: 均提示化疗前及化疗后uPA的浓度与细胞分化程度、病理类型差异无统计学意义。因此,uPA的浓度是否与EOC组织学类型及分化程度相关,有待于进一步的研究证实。
有关uPA的表达与卵巢恶性肿瘤患者预后的相关性,尚无一致报道。Konecny等[9]用ELISA法检测了103例上皮性卵巢癌中uPA的表达水平,提示采用单因素分析时uPA水平是影响患者OS的危险因素。Hoffmann等[10]对98例卵巢癌患者的研究结果也表明uPA可作为预后的预测指标。但Kuhn等[11]对FIGOⅢC卵巢癌患者的预后进行了单因素及多因素生存分析,发现uPA不是一个独立的预后因子。本研究显示,采用单因素分析时,化疗前uPA水平和化疗6疗程后uPA水平都是影响PFS和OS的因素。但纳入多因素的COX模型分析后,仅化疗前uPA水平与预后相关,提示其可作为评估上皮性卵巢癌预后的独立指标。化疗后患者uPA含量并非患者PFS及OS的独立危险因素,这一结果是否因卵巢癌患者经过规范化化疗后病情暂时缓解,或随访时间尚短不足以显示差别,有待于进一步探究。另外,Chen等[12]检测了同一批患者血清治疗过程中血浆纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor 1, PAI-1)水平,发现卵巢癌患者PAI-1水平较对照组高,且化疗前患者血清中PAI-1的水平与患者预后相关,虽然PAI-1为uPA的抑制剂,但对两者的相关性进行研究发现其表达水平并无明显相关性。因此,推测两者在卵巢癌发生发展中的作用机制及其对卵巢癌患者预后的影响并不能单纯用两者相互拮抗的机制来解释。其具体作用机理需进一步研究。
综上所述,本研究显示已行肿瘤细胞减灭术的卵巢癌患者化疗前血清中的uPA含量可作为评估患者预后的独立因子。卵巢癌的浸润转移过程是一个非常复杂的生物学行为,其中不仅包括纤溶蛋白酶的调控机制,还涉及多种细胞因子与肿瘤转移基因的作用,因此其预后也牵涉到多方面,且uPA在肿瘤中的作用机制尚未完全清楚,有关研究也主要集中在体外实验,所以有关uPA与卵巢癌预后的关系仍需更深入的研究。
【参考文献】
[1] Wu L, Dai ZY, Qian YH, et al. Diagnostic value of serum human epididymis protein 4 (HE4) in ovarian carcinoma: a systematic review and mata-analysis[J]. Int J Gynecol Cancer, 2012,22(7): 1106-1112.
[2] Visintin l, Feng Z, Longton G, et al. Diagnostic markers for early detection of ovarian cancer[J]. Clin Cancer Res, 2008,14(4): 1065-1072.
[3] Hasui Y, Marutsuka K, Asada Y, et al. Prognostic value of urokinase-type plasminogen activator in patients with superficial bladder cancer[J].Urology,1996,47: 34-37.
[4] Hofmann R, Lehmer A, Buresch M, et al. Clinical relevance of urokinase plasminogen activator, its receptor, and its inhibitor in patients with renal cell carcinoma[J]. Cancer,1996,78: 487-492.
[5] Dorn J, Harbeck N, Kates R, et al. Impact of expression differences of kallikrein-related peptidases and of uPA and PAI-1 betweeen primary tumor and omentum metastasis in epithelial ovarian cancer[J]. Ann Oncol,2011,22(4): 877-883.
[6] Harbeck N, Schmitt M, Meisner C, et al. Ten-year analysis of the prospective multicentre Chemo-N0 trial validates American Society of Clinical Oncology (ASCO)-recommended biomarkers uPA and PAI-1 for therapy decision making in node-negative breast cancer patients[J]. Eur J Cancer, 2013,49(8): 1825-1835.
[7] Cai Z, Li YF, Liu FY, et al. Expression and clinical significance of uPA and PAI-1 in epithelial ovarian cancer[J]. Ai Zheng,2007,26(3): 312-317.
[8] van der Burg ME, Henzen-Logmans SC, Berns EM, et al. Expression of urokinase-type plasminogen activator and its inhibitor PAI-1 in benign, borderline, malignant primary and metastatic ovarian tumors[J]. Int J Cancer, 1996,69(6): 475-479.
[9] Konecny G, Untch M, Pihan A, et a. l Association of urokinase-type plasminogen activator and its inhibitor with disease progression and prognosis in ovarian cancer[J]. Clin Cancer Res, 2001,7(6): 1743-1749.
[10] Hoffmann G, Pollow K,Weikel W, et al. Urokinase and plasminogen activator-inhibitor (PAI-1) status in primary ovarian carcinomas and ovarianmetastases compared to benign ovarian tumors as a function of histopathological parameters[J]. Clin Chem Lab Med, 1999,37(1): 47-54.
[11] Kuhn W, Schmalfeldt B, Reuning U, et al. Prognostic significance of urokinase(uPA) and its inhibitor PAI-1 for survival in advanced ovarian carcinoma stage FIGOⅢC.[J] Br J Cancer, 1999,79(11-12): 1746- 1751.
[12] Chen ST, Tai HF, Tong XW, et al. Variation and prognostic value of serum plasminogen activator inhibitor-1 before and after chemotherapy in patients with epithelial ovarian cancer[J]. J Obstet Gynaecol Res, 40(9): 2058-2065.
Variation and prognostic value of serum uPA before and after chemotherapy in patients with epithelial ovarian carcinoma
【Abstract】Objective To investigate variation and prognostic value of serum urokinase-type plasminigen activator (uPA) before and after chemotherapy in patients with epithelial ovarian carcinoma. Methods One hundred and seven patients with ovarian carcinoma receive chemotherapy after cytoreductive surgery. Serum uPA levels were measured by enzyme-linked immunosorbent assay (ELISA) before chemotherapy and after 6 cycles of chemotherapy. One hundred and two health subjects served as controls. Results Serum uPA levels of patients were significantly higher than that of healthy women before and after chemotherapy (bothP<0.05); while uPA levels in patients before chemotherapy was significantly higher than those after the chemotherapy. Kaplan-Meier analysis indicated the serum uPA level before and after chemotherapy, FIGO stage, residual tumor size and lymph node metastasis were all associated with progression-free survival (PFS) and overall survival (OS) of ovarian carcinoma patients. Multivariate Cox regression analysis revealed that the serum uPA level and lymph node metastasis were independent prognostic factors for both PFS and OS (all P<0.05). Conclusion Patients with epithelial ovarian carcinoma have high serum uPA levels both before and after chemotherapy. Pre-chemotherapy uPA level might be used for prognosis of ovarian carcinoma patients.
【Key words】ovarian carcinoma; urokinase-type plasminogen activator; serum; prognosis
doi:10.16118/j.1008-0392.2015.04.016
收稿日期:2015-01-19
基金项目:国家自然科学基金(81101967)
【中图分类号】R 737.31
【文献标志码】A
【文章编号】1008-0392(2015)04-0080-06