·临床研究·
【摘要】目的 探讨糖尿病患者EMPs、EPCs与不同程度冠状动脉粥样硬化病变及糖代谢异常的关系。方法 117例糖尿病患者,根据临床症状、心肌标记物水平以及冠状动脉造影及冠脉内血管超生(IVUS)结果,将患者分为急性冠脉综合症组(A组,n=45)、稳定型心绞痛组(B组,n=27)、冠状动脉病变组(狭窄<50%,C组,n=45)。采用流式细胞术检测3组患者外周血中CD144+/Annexin V+的内皮微颗粒以及CD34+/CD39+内皮祖细胞的水平,并检测血脂、血糖、糖化血红蛋白、炎性指标、心肌标记物、肝肾功能等各项指标。结果 3组相比,年龄、性别、血压、吸烟、体质量指数、血脂等组间差异均无统计学意义。超敏C反应蛋白、CK-MB、HsTnT均在A组中较高,与其余两组相比差异有统计学意义(P<0.001)。3组之间空腹血糖、餐后血糖及糖化血红蛋白差异无统计学意义。外周血的CD144+/Annexin V+EMPs水平3组间差异有统计学意义,其中A组显著高于B组(P<0.05),且A、B组CD144+/Annexin V+EMPs水平显著高于C组(P<0.05),EMPs水平与糖化血红蛋白不相关。A、B组外周血CD34+/CD39+EPCs水平显著低于C组(P<0.05),而A、B组间无差异,且EPCs水平与糖化血红蛋白呈负相关。结论 糖尿病患者冠脉病变加重是导致外周血CD144+/Annexin V+EMPs水平升高的主导损伤因素。糖代谢异常对内皮功能的损伤主要是通过损伤内皮修复功能因素实现的。
【关键词】内皮微颗粒; 内皮祖细胞; 冠心病; 急性冠脉综合征; 稳定性心绞痛; 内皮功能
血管内皮系统是重要的血管屏障,是感知血流中物理性及化学性改变的主要感受器[1]。内皮系统的自我平衡被打乱将会破坏血管内皮原有的生理功能,从而发生血管内皮功能受损[2]。而内皮功能障碍贯穿于动脉粥样硬化以及斑块不稳定的始终。近年来内皮微颗粒(endothelial micropa rticles, EMP)作为评价内皮功能的新的临床指标成为研究热点。大量临床研究发现许多血管相关性疾病,如糖尿病、代谢综合征、冠状动脉粥样硬化性疾病等外周血中EMPs都增高[3]。李莹等[4]的研究也证实EMP与冠心病患者斑块不稳定的临床指标有着良好的相关性,也有研究[5]证实在糖尿病患者冠状动脉病变EMP的水平也相应升高。同时,来源于骨髓的内皮祖细胞(endothelial progenitor cells, EPCs)在某些生理或病理因素刺激下,从骨髓动员到外周血,维持血管的稳定性,并参与血管修复或形成,被视为一种内皮修复的指标。
基于以上背景,本研究依据冠状动脉造影及冠脉内血管超生(IVUS)和临床资料将患者分组,分别测定其外周血循环的CD144+/Annexin V+的内皮微颗粒以及CD34+/CD39+内皮祖细胞的水平,研究糖代谢异常的冠心病患者中,EMPs、EPCs在内皮功能的损伤和修复过程中的作用,探讨EMPs、EPCs与不同程度冠状动脉粥样硬化病变以及糖代谢异常的关系。
1.1 一般资料
选取糖尿病患者117例,根据冠状动脉造影及冠脉内血管超声(intravenous ultrasound, IVUS)和临床资料,研究对象分为A组: 急性冠脉综合征(n=45)、B组: 稳定型心绞痛组(n=27)、C组: 冠状动脉病变(狭窄<50%)组(n=45)。所有患者排除酮症酸中毒、高渗性昏迷、乳酸酸中毒、感染急性期、自身免疫性疾病、恶性肿瘤、严重心、肝、肾等脏器疾病。
1.2 仪器与试剂
标记微颗粒以及细胞的抗体均购自美国BD Biosciences公司。已知浓度的绝对计数微球购自美国Beckman Coulter公司。FACs CaliburTM流式细胞仪购自Becton Dickinson公司。1.1μm的标准微球购自美国Sigma公司。
1.3 方法
1.3.1 血浆EMP水平的测定 取患者外周血2ml置于柠檬酸钠盐抗凝管中,离心半径15cm,160r/min,离心10min,获得富血小板血浆,再进行离心半径7cm,1000r/min,离心6min,获得贫血小板血浆。取贫血小板血浆样本50μl,加入5μl异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的Annexin V抗体和10μl藻红蛋白荧光(P-phycoerythrin, PE)标记的抗CD144抗体充分混匀。在室温下避光孵育25min后,样本内加入50μl已知浓度的绝对计数微球,再加入1000ml PBS缓冲液,混匀后用流式细胞仪进行检测。样本检测前以直径1.1μm的标准微球作为内参,帮助EMPs定门。门内收集到的微颗粒进一步在525nm和575nm的光电倍增管进行异硫氰酸荧光素(FITC)和PE强度分析[6]。在流式细胞仪上读取5000个绝对计数微球后停止计数,依据绝对计数微球的浓度换算得出循环EMPs的浓度。
1.3.2 EPCs水平测定 取患者的外周血2ml置于肝素抗凝管中,从管中取100μl全血与10μl FITC标记的抗CD34抗体和10μl PE标记的抗CD39抗体充分混匀,或同等数量的同型对照抗体,在室温下避光孵育20min。在管中加入3ml红细胞裂解液,充分混匀后继续在室温下避光裂解20min。离心半径15cm,160r/min,离心5min,倒去上清液,再加入3ml红细胞裂解液,重复上述离心后倒去上清液,管中剩下单个核细胞,加入2ml生理盐水,混匀后用流式细胞仪进行检测,计数5000个细胞后停止,读出CD34+CD39+EPCs的百分比。EPCs定义为CD34+CD39+EPCs,患者外周血循环的EPCs数量的计算公式为: 流式细胞仪上读出的CD34+CD39+EPCs的百分比×患者外周血中(淋巴细胞绝对数+单核细胞绝对数)。
1.4 统计学处理
资料采用SPSS 17.0软件包进行统计学分析。循环的CD144+/Annexin V+EMPs水平以![]() 表示,其余计量资料均以
表示,其余计量资料均以![]() ±s表示,两组间人群基本资料比较采用t检验,如计量资料不符合正态分布,两组间均数比较采用Mann-Whitney U秩和检验,对有相关趋势的变量进行Pearson相关分析,对不符合正态分布的资料做Spearman相关分析,P<0.05为差异有显著性意义。
±s表示,两组间人群基本资料比较采用t检验,如计量资料不符合正态分布,两组间均数比较采用Mann-Whitney U秩和检验,对有相关趋势的变量进行Pearson相关分析,对不符合正态分布的资料做Spearman相关分析,P<0.05为差异有显著性意义。
2.1 患者基本临床资料比较
3组患者年龄、性别、血压、吸烟、体质量指数(body mass index, BMI)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)3组间差异均无统计学意义(P>0.001)。超敏C反应蛋白(hs-CRP)、CK-MB、HsTnT均在A组中较高,与B、C组相比,差异有统计学意义(P<0.001),且A组显著高于B组(P<0.001)。3组之间空腹血糖(FBG)、餐后2h血糖(2hPG)、糖化血红蛋白(HbA1c)差异均无统计学意义,见表1。
表1 3组患者一般资料对比
Tab.1 General information of patients in three groups
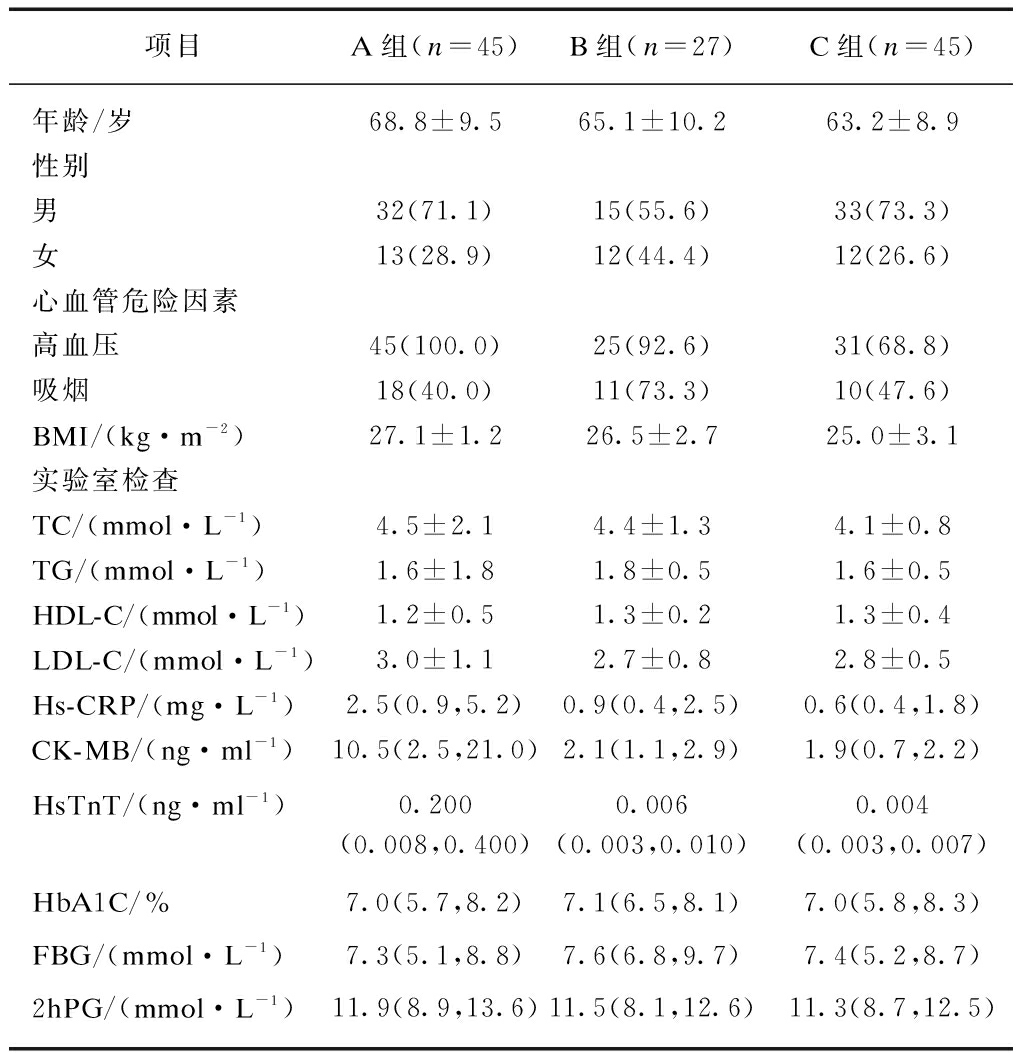
项目A组(n=45)B组(n=27)C组(n=45)年龄/岁68.8±9.565.1±10.263.2±8.9性别男32(71.1)15(55.6)33(73.3)女13(28.9)12(44.4)12(26.6)心血管危险因素高血压45(100.0)25(92.6)31(68.8)吸烟18(40.0)11(73.3)10(47.6)BMI/(kg·m-2)27.1±1.226.5±2.725.0±3.1实验室检查TC/(mmol·L-1)4.5±2.14.4±1.34.1±0.8TG/(mmol·L-1)1.6±1.81.8±0.51.6±0.5HDL-C/(mmol·L-1)1.2±0.51.3±0.21.3±0.4LDL-C/(mmol·L-1)3.0±1.12.7±0.82.8±0.5Hs-CRP/(mg·L-1)2.5(0.9,5.2)0.9(0.4,2.5)0.6(0.4,1.8)CK-MB/(ng·ml-1)10.5(2.5,21.0)2.1(1.1,2.9)1.9(0.7,2.2)HsTnT/(ng·ml-1)0.200(0.008,0.400)0.006(0.003,0.010)0.004(0.003,0.007)HbA1C/%7.0(5.7,8.2)7.1(6.5,8.1)7.0(5.8,8.3)FBG/(mmol·L-1)7.3(5.1,8.8)7.6(6.8,9.7)7.4(5.2,8.7)2hPG/(mmol·L-1)11.9(8.9,13.6)11.5(8.1,12.6)11.3(8.7,12.5)
2.2 患者CD144+/Annexin V+EMPs水平
结果显示,外周血的CD144+/Annexin V+EMPs水平3组间有统计学差异,其中A组显著高于B组(P<0.05),且A、B组CD144+/Annexin V+EMPs水平显著高于C组(P<0.05),EMPs水平与糖化血红蛋白不相关(P>0.05),见图1、图2。
2.3 患者CD34+/CD39+EPCs水平
结果显示,三组进行组间比较,A、B组外周血CD34+/CD39+EPCs水平显著低于C组(P<0.05),而A、B组间外周血CD34+/CD39+EPCs水平差异无统计学意义(P>0.05),且EPCs水平与糖化血红蛋白呈负相关(P<0.05,r=-0.365),见图3。
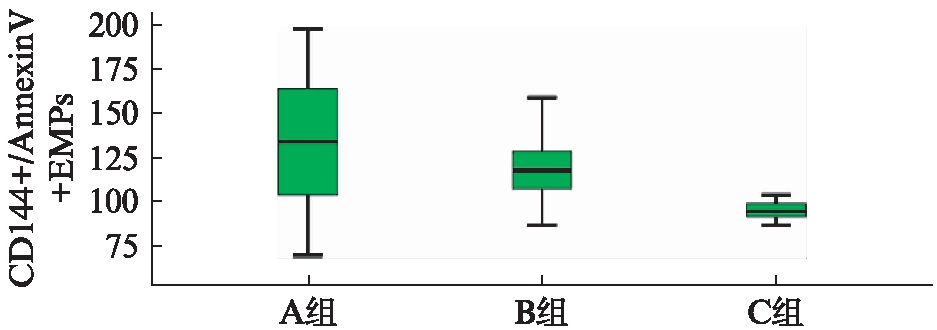
图1 3组患者外周血CD144+/Annexin V+EMPs的水平
Fig.1 CD144+/Annexin V+EMPs level in peripheral blood of three groups
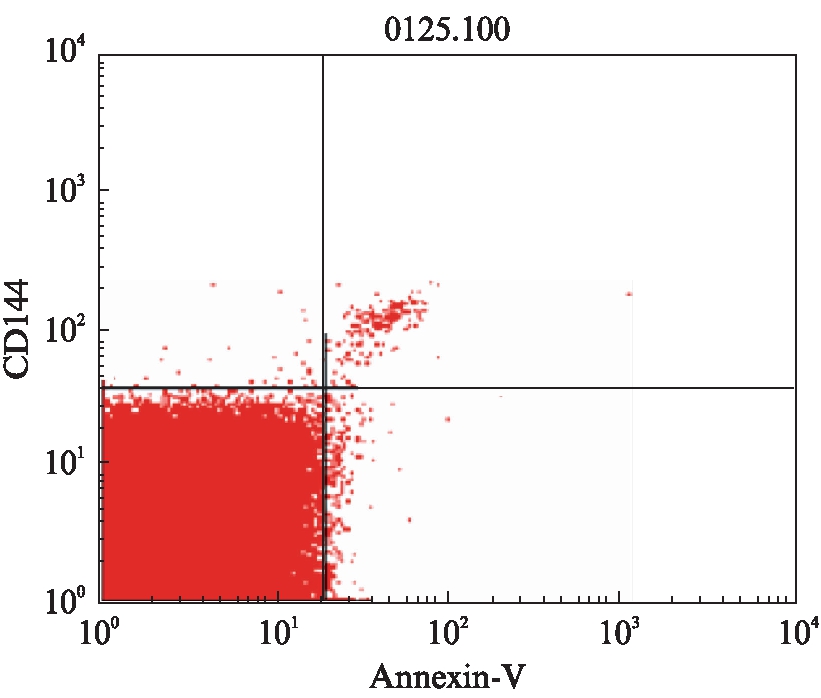
A组

B组

C组 图2 3组CD144+Annexin V+EMPs的流式细胞图 Fig.2 Flow cytometry results of CD144+Annexin V+EMPs in three groups FITC荧光(Annexin V-FITC)定为X轴,将PE荧光(CD144-PE)定为Y轴,R3区域即为CD144+Annexin V+EMPs数量(右上)。
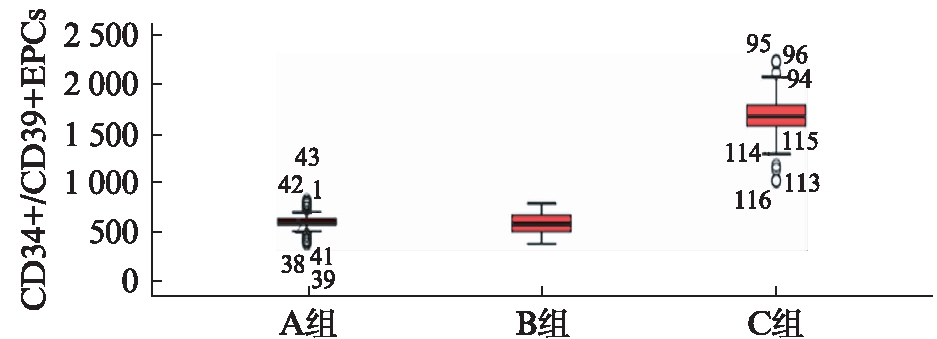
图3 3组患者外周血CD34+/CD39+EPCs的水平
Fig.3 CD34+/CD39+EPCs level in peripheral blood of three groups
1990年,Hamilton首次提出内皮微颗粒的概念。随后对内皮微颗粒的研究,指出内皮微颗粒是在内皮细胞在受到多种因素刺激激活或者损伤时,细胞膜脂质双分子层脂质的非对称分布受到破坏,细胞内钙离子快速上升,激活翻转酶,使主要由磷脂酰胺酸组成的带负电荷的细胞膜内层外翻,发生细胞骨架重构,随后发生膜出泡反应以及EMP的脱落。这些内皮微颗粒携带所有来源的内皮细胞的表面标志物,已经发现EMP所表达的抗原有CD31、CD51、CD54、CD61E、CD105、CD144或CD146。本研究采用CD144+/Annexin V+标记EMPs,其中CD144是只在内皮细胞表达的一种黏附分子,具有维持内皮黏附连接的作用。而Annexin V是发生凋亡的标志性分子,研究[4]表明,二者标志的EMPs对评价ACS具有良好的临床价值[4]。
本实验结果显示,A、B组外周血中CD144+/Annexin V+EMPs水平显著高于C组,且A组外周血中CD144+/Annexin V+EMPs水平显著高于B组,由此可见,冠状动脉粥样硬化引起的内皮损伤加重是导致外周血CD144+/Annexin V+EMPs水平升高的主导损伤因素,从而推测CD144+/Annexin V+EMPs可作为ACS患者急性缺血时内皮功能损伤的特异性指标。
Asahara等[7]首先从外周血中分离出能分化为血管内皮细胞祖细胞(endothelial progenitor cells, EPCs)。EPCs来源于骨髓,是血管内皮细胞的前体。在某些生理或病理条件刺激下,EPCs可以从骨髓动员到外周血,分化为成熟的内皮细胞,维持血管壁的稳定性,并参与血管的修复或形成。研究显示,内皮祖细胞在心脑血管疾病、外周血管疾病、肿瘤血管形成以及创伤愈合等方面均发挥重要作用,损伤性刺激、外源性细胞因子和药物治疗可以增强EPCs的动员[8-10]。目前主要采用流式细胞仪来确定细胞表面抗原CD34、CD133、KDR,对EPCs进行鉴定[11-12]。
本研究结果显示,冠脉病变<50%以及无冠脉病变的患者外周血CD34+/CD39+EPCs水平显著高于合并急性冠脉综合征以及稳定性心绞痛患者外周血CD34+/CD39+EPCs水平,提示内皮修复功能的增强是减弱粥样硬化造成的血管壁损伤的重要保证。
糖尿病目前已成为严重威胁人类健康的疾病之一。同时,糖尿病也是心血管疾病重要的危险因素,糖尿病患者患心血管疾病的风险是无糖尿病者的2倍[13-14]。内皮细胞受损发生在糖尿病早期,也是糖尿病并发血管疾病的始动因素。有研究显示,患有急性冠脉综合征患者合并糖尿病可以独立于其他危险因素,增加了患者两倍的长期(1年)以及短期(30d)死亡率[15]。内皮微颗粒水平是糖尿病患者ACS后30d以及6个月死亡率的独立预测因子,但是具体机制不详[15]。也有研究[16]提示,EMP水平与内皮依赖性血管功能以及血管事件相关,且糖尿病仍然是事件复发的独立预测因子。Tushizen等[17]通过实验证实高血糖可以使EMPs水平升高。
本研究选取的研究对象全部为2型糖尿病患者,根据冠脉病变程度进行分组,结果发现,冠状动脉病变严重的患者外周血EMPs水平均高于冠脉病变相对较轻的患者,然而即便对于冠状动脉病变最严重的ACS患者而言,患者外周血EMPs水平与糖化血红蛋白水平不相关。这一结果表明冠状动脉粥样硬化造成的内皮功能的损伤掩盖了由于糖代谢异常对内皮的损伤,粥样硬化病变的严重程度对内皮功能的损伤占主导因素。
Krankel等[18]、王洪祥等[19]研究表明高血糖可以抑制EPCs的迁移和整合能力,是EPCs的增值减弱,凋亡增加。本研究中,冠脉病变较明显的A、B组EPCs水平显著下降,且二组EPCs与糖化血红蛋白呈负相关,由此说明,糖尿病患者内皮受损严重,修复潜能降低,而糖代谢异常对内皮功能的损伤主要是通过损伤内皮功能的修复因素实现的。
综上所述,冠状动脉粥样硬化的发生及斑块的不稳定是导致外周血CD144+/Annexin V+EMPs水平升高的主导损伤因素。而与冠脉病变相对较重的患者相比,病变较轻的患者外周血EPCs水平显著升高,提示内皮修复功能因素的增强是减轻冠脉病变的重要保证。糖尿病患者外周血EPCs水平与糖化血红蛋白水平呈负相关,提示糖代谢异常对内皮功能的损伤主要是通过损伤内皮修复功能因素实现的。本研究虽取得了初步的结果,但仍需要大样本、多中心、前瞻性研究进一步证实,并且此结果尚需体外实验加以证实。关于对EMP如何量化,来进一步预测冠脉斑块稳定性以及有关EPCs对内皮保护性能力的研究,仍需进一步探讨。
【参考文献】
[1] Burger D, Touyz RM. Cellular biomarkers of endothelial health: Microparticles, endothelial proge-nitor cells, and circulating endothelial cells[J]. J Am Soc Hypertens, 2012,6(2): 85-99.
[2] Endemann DH. Endothelial dysfunction[J]. J Am Soc Nephrol, 2004,15(8): 1983-1992.
[3] Chironi G, Simon A, Hugel B,et al. Circulating leukocyte-derived microparticles predict subclinical atherosclerosis burden in asymptomatic subjects[J]. Arterioscler Thromb Vascular Biol, 2006;26(12): 2775-2780.
[4] 李莹,夏金盈,陆英,等.冠状动脉性心脏病患者外周血中CD144+/annexin v+内皮微颗粒水平的变化[J].上海医学,2012;35(1): 53-57.
[5] Chen Y, Feng B, Li X, et al. Plasma endothelial microparticles and their correlation with the presence of hypertension and arterial stiffness in patients with type 2 diabetes[J]. J Clin Hypertens(Greenwich), 2012,14(7): 455-460.
[6] Koga H, Sugiyama S, Kugiyama K, et al. Elevated levels of ve-cadherin-positive endothelial microparticles in patients with type 2 diabetes mellitus and coronary artery disease[J]. J Am Coll Cardiol, 2005,45(10): 1622-1630.
[7] Asahara T, Murohara T, Sullivan A,et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997,275(5302): 964-967.
[8] Kuliczkowski W, Derzhko R, Prajs I, et al. Endothelial progenitor cells and left ventricle function in patients with acute myocardial infarction: Potential therapeutic considerations[J]. Am J Ther, 2012,19(1): 44-50.
[9] Foresta C, Schipilliti M, De Toni L, et al. Blood levels, apoptosis, and homing of the endothelial progenitor cells after skin burns and escharectomy[J]. J Trauma, 2011,70(2): 459-465.
[10] Smadja DM, Godier A, Susen S, et al. Endothelial progenitor cells are selectively mobilised immediately after coronary artery bypass grafting or valve surgery[J]. Thromb Haemost, 2009,101(5): 983-985.
[11] Fadini GP, Coracina A, Baesso I, et al. Peripheral blood CD34+kdr+endothelial progenitor cells are determinants of subclinical atherosclerosis in a middle-aged general population[J]. Stroke, 2006,37(9): 2277-2282.
[12] Liu P, Zhou B, Gu D, et al. Endothelial progenitor cell therapy in atherosclerosis: a double-edged sword?[J]Ageing Res Rev, 2009,8(2): 83-93.
[13] Garcia MJ, McNamara PM, Gordon T, et al. Morbidity and mortality in diabetics in the Framingham population. Sixteen year follow-up study[J]. Diabetes, 1974,23(2): 105-111.
[14] Wei M, Gaskill SP, Haffner SM, et al. Effects of diabetes and level of glycemia on all-cause and cardiovascular mortality. The San Antonio Heart Study[J]. Diabetes Care, 1998,21(7): 1167-1172.
[15] Donahoe SM, Stewart GC, McCabe CH, et al. Diabetes and mortality following acute coronary syndromes[J]. JAMA, 2007,298(7): 765-775.
[16] Fichtlscherer S, Breuer S, Zeiher AM. Prognostic value of systemic endothelial dysfunction in patients with acute coronary syndromes: Further evidence for the existence of the “vulnerable” patient[J]. Circulation, 2004,110(14): 1926-1932.
[17] Tushuizen ME, Nieuwland R, Rustemeijer C, et al. Elevated endothelial microparticles following consecu-tive meals are associated with vascular endothelial dysfunction in type 2 diabetes[J]. Diabetes Care, 2007,30(3): 728-730.
[18] Krankel N, Adams V, Linke A, et al. Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells[J]. Arterioscler Thro-mb Vasc Biol, 2005,25(4): 698-703.
[19] 王红祥,赵湜,李宾公,等.高糖对糖尿病患者内皮祖细胞增殖凋亡的影响及其机制探讨[J].中国病理生理杂志,2007,23(11): 2210-2213.
Plasma EMPs and EPCs levels in diabetic patients with coronary atherosclerotic lesions
【Abstract】Objective To investigate plasma EMPs and EPCs levels in diabetic patients with different degree of coronary atherosclerotic lesions. Methods One hundred and seventeen diabetic patients with different degree of coronary atherosclerotic lesions were enrolled in the study. Patients were classified into 3 categories based on clinical symptoms, cardiac marker levels, coronary angiography and coronary intravenous ultrasound (IVUS): acute coronary syndrome(group A,n=45), stable angina(group B, n=27) and coronary artery disease(stenosis <50%)(group C, n=45). CD144+/Annexin V+endothelial microparticles(EMPs) and CD34+/CD39+ endothelial progenitor cells(EPCs) in peripheral blood were detected by flow cytometry; and blood lipid, glucose, glycosylated hemoglobin, inflammatory markers, cardiac markers, liver and renal function, and other indicators were also measured. Results There were no significant differences in age, sex, blood pressure, smoking, body mass index and blood lipid among three groups. High sensitivity C-reactive protein, CK-MB and HsTnT levels were significantly higher in group A than those in other two groups(P<0.001). There were not significant differences in fasting blood glucose, postprandial blood glucose and glycosylated hemoglobin among 3 groups. The CD144+/Annexin V+ EMPs levels in peripheral blood of group A was significantly higher than those of group B(P<0.05), and EPCs levels in group A and B was significantly higher than those in group C(P<0.05). EMPs levels were not correlated with glycosylated hemoglobin levels. The levels of peripheral blood CD34+/CD39+EPCs in group A and B were significantly lower than those in group C(P<0.05), but there were no differences between group A and B. The levels of EPCs and the levels of glycosylated hemoglobin were negatively correlated. Conclusion Aggravating coronary lesions is a leading cause of elevated peripheral blood CD144+/Annexin V+ EMPs. Abnormal glucose metabolism in diabetic patients may injury endothelial repair factors and result in aggravation of coronary lesions.
【Key words】endothelial microparticles; endothelial progenitor cells; coronary heart disease; acute coronary syndrome; stable angina; endothelial function
doi:10.16118/j.1008-0392.2015.04.010
收稿日期:2015-03-23
基金项目:上海市科委攻关项目(10411968000);上海市浦东新区科委课题(PKJd2013-Y19)
【中图分类号】R 543
【文献标志码】A
【文章编号】1008-0392(2015)04-0047-06