表1 引物序列
Tab. 1 Sequences of primers

基因名称上游引物下游引物GAPDH5'-GGACTCATGACC-ACAGTCCA-3'5'-CCAGTAGAGGC-AGG-GATGAT-3'MMP-15'-GCTCAGGATGAC-ATTGATGG-3'5'-GATGGGCTGGAC-AG-GATTT-3'MMP-25'-AAGAGTGCATGA-ACCAACCA-3'5'-TCAGGTATTGCA-TGTGCTAGG-3'
·基础研究·
【摘要】目的 探讨硝苯地平(Nifedipine)对人牙龈成纤维细胞(gingival fibroblasts, GFs)基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)和基质金属蛋白酶-2(MMP-2)mRNA表达的影响。方法 取牙周手术切除的健康牙龈组织,组织块法分离及培养获得GFs,免疫细胞化学法对GFs进行鉴定。对GFs进行药物刺激,分为硝苯地平组(1μg/ml)、LPS组(1μg/ml)、硝苯地平+LPS组(分别为1μg/ml),同时设空白对照组。实时定量PCR检测各组24、48h时MMP-1和MMP-2 mRNA的表达水平。结果 组织块法获得的GFs生长状态良好;免疫细胞化学显示,GFs抗波形丝蛋白染色阳性,抗角蛋白染色阴性。与空白对照组相比,硝苯地平组刺激48h后MMP-1、MMP-2 mRNA表达减少(P<0.05);硝苯地平+LPS组MMP-1 mRNA表达明显增加(P<0.05),MMP-2 mRNA表达无明显变化。结论 硝苯地平可能通过影响GFs MMP-1和MMP-2基因的表达而影响牙龈增生。
【关键词】牙龈成纤维细胞; 硝苯地平; 脂多糖; 基质金属蛋白酶
硝苯地平(nifedipine)作为一种钙通道阻滞剂,被广泛应用于心绞痛、高血压等心血管疾病的治疗,其不良反应之一是牙龈增生[1-2],但其引起牙龈增生的机制目前尚不清楚。增生的牙龈组织以纤维化和不同程度的炎症浸润为特点[3]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类Ca2+、Zn2+依赖酶,在细胞外基质代谢调节、纤维化等过程中起重要作用[4]。炎症作为牙龈增生的促进因素之一,其中细菌脂多糖(lipopolysaccharide, LPS)可能发挥重要作用。本研究以硝苯地平刺激人牙龈成纤维细胞,体外模拟炎症环境,观察硝苯地平对GFs MMP-1和MMP-2基因表达的影响,初步探讨硝苯地平在体外正常及炎症环境下诱导牙龈增生的机制。
1.1 主要试剂和仪器
DMEM高糖培养基购自美国Hyclone公司;2.5g/L胰蛋白酶、胎牛血清(FBS)购自美国Gibco公司;分散酶(dispaseⅡ)购自日本Roche公司;硝苯地平、LPS购自美国Sigma公司;小鼠抗人单克隆Vimentin抗体、广谱角蛋白抗体购自中国凯基公司;CO2恒温细胞培养箱购自日本Sanyo公司;低温高速离心机购自中国Eppendorf公司;倒置相差显微镜购自日本Nikon公司;LightCycler 96实时荧光定量PCR仪购自日本Roche公司。
1.2 人牙龈成纤维细胞原代培养
1.2.1 标本采集及处理 选择来同济大学附属口腔医院牙周科就诊、无高血压及其他系统性疾病、未曾服用致药物性牙龈增生的相关药物、需进行牙周手术治疗的患者。经患者知情同意后,采集冠延长术切除的牙龈组织,置于含双抗的PBS液中。将组织清洗3次,剪切标本为2mm×3mm×3mm的小块,加入2.5g/L分散酶,4℃消化,16~18h后进行原代培养。
1.2.2 人牙龈成纤维细胞原代培养 用组织镊分离上皮与结缔组织,取分离出的结缔组织,用PBS清洗后接种于T25培养瓶,加入适量含100ml/L FBS的DMEM培养基,置5% CO2、37℃培养箱培养。4h后翻瓶。培养13~14d后细胞铺满瓶底约90%,以1∶1传至10cm培养皿培养。自第2代起,当细胞达80%~90%融合时,以1∶3或1∶4传代至10cm培养皿培养。第4~7代细胞用于后续实验研究。
1.3 人牙龈成纤维细胞鉴定
取生长良好的GFs,做盖玻片细胞爬片,多聚甲醛固定30min,PBS洗3次,每次5min;1ml/L Triton X-100处理15min,PBS洗3次,每次5min;滴加30ml/L过氧化氢以阻断内源性过氧化物酶;5%BSA封闭20min后滴加小鼠抗人单克隆Vimentin抗体和CK抗体(1∶200),阴性对照组滴加PBS。玻片置湿盒内,4℃过夜。次日取出玻片,室温静置1h,加二抗,室温孵育30min,滴加DBA显色液,苏木素复染,脱水、透明,晾干后中性树胶封片,倒置相差显微镜拍照。
1.4 实时定量PCR检测GFs MMP-1和MMP-2 mRNA的表达
1.4.1 样本制备及实验分组 取生长良好的GFs,0.5g/L胰酶消化后计数,用含100ml/L FBS的培养基调整细胞浓度为1×105/ml,分别接种于6孔板,每孔2ml。待细胞融合约70%时,更换为基础培养基(含20ml/L FBS)。继续培养24h后,分别加入不同药物进行刺激: 硝苯地平组(1μg/ml),LPS组(1μg/ml),硝苯地平+LPS组(分别为1μg/ml),以上溶液均以基础培养基配制,以不含任何药物的基础培养基为空白对照组。药物分别作用24、48h后,吸去培养液,每孔加入TRIzol 1ml,冰上裂解10min,收集混合液于1.5ml EP管,-80℃冻存备用。
硝苯地平药液配制: 硝苯地平以无水乙醇为溶剂配成10-2 mol/L的原液,-20℃避光保存。使用时以培养基稀释成1μg/ml的工作液,4℃避光保存,1周内使用。
脂多糖药液配制: 将1mg LPS完全溶解于1ml生理盐水中,获得1mg/ml LPS原液,-20℃保存。使用时用培养基稀释成1μg/ml 的工作液,4℃避光保存,1周内使用。
1.4.2 MMP-1、MMP-2基因表达的实时定量PCR检测 TRIzol法提取细胞总RNA,每个样本取1μg RNA,使用Roche反转录试剂盒合成cDNA,进行实时定量PCR反应。反应条件如下: 95℃,预变性600s;变性95℃,10s;退火60℃,10s;延伸72℃,20s;PCR反应40个循环;溶解曲线分析95℃,10s;65℃,60s;97℃,1s。用软件Primer Premier 6设计引物,见表1。
表1 引物序列
Tab. 1 Sequences of primers

基因名称上游引物下游引物GAPDH5'-GGACTCATGACC-ACAGTCCA-3'5'-CCAGTAGAGGC-AGG-GATGAT-3'MMP-15'-GCTCAGGATGAC-ATTGATGG-3'5'-GATGGGCTGGAC-AG-GATTT-3'MMP-25'-AAGAGTGCATGA-ACCAACCA-3'5'-TCAGGTATTGCA-TGTGCTAGG-3'
1.5 统计学处理
采用SPSS 13.0软件对数据进行方差分析,多重比较用LDS-t检验,P<0.05为差异有统计学意义。
2.1 GFs体外细胞培养
采用组织块法进行GFs原代培养,5~6d后有细胞从组织块周围爬出,13~14d待细胞大量融合后进行传代。倒置显微镜下观察,细胞呈长梭形或星形。原代培养的细胞以组织块为中心生长,传代后的细胞呈放射状或漩涡状走形,排列紧密,见图1。

图1 人牙龈成纤维细胞培养
Fig.1 The culture of GFs(×100)
A: 原代HGFs;B: 第4代HGFs
2.2 GFs细胞鉴定结果
本实验所获得的GFs抗波形丝蛋白染色阳性,抗角蛋白染色阴性,证明细胞为中胚层来源,见图2。
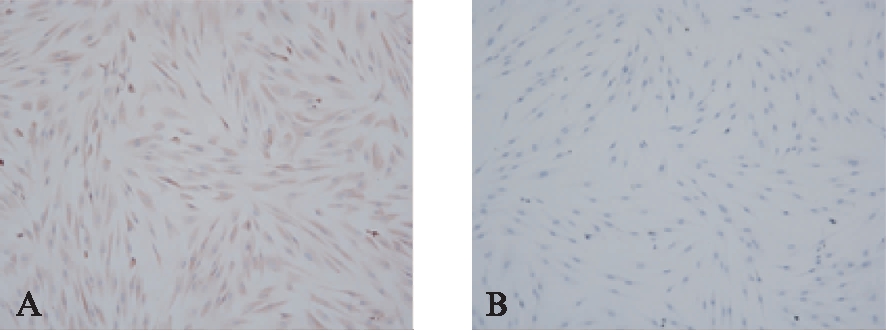
图2 人牙龈成纤维细胞免疫细胞化学鉴定结果
Fig.2 The result of immunocytochemistry for GFs(×100)
A: 细胞抗波形丝蛋白染色阳性;B: 细胞抗角蛋白染色阴性
2.3 硝苯地平对GFs MMP-1、MMP-2 mRNA表达的影响
与对照组相比,硝苯地平作用24h时,MMP-1 mRNA表达量无明显变化,48h时MMP-1 mRNA表达明显减少(P<0.05);LPS组及硝苯地平+LPS组,MMP-1 mRNA的表达量随时间延长而减少,但均比对照组表达增加(P<0.05),见图3。
与对照组相比,硝苯地平组MMP-2 mRNA表达减少,且48h时差异有统计学意义(P<0.05);硝苯地平+LPS组MMP-2 mRNA表达减少,但差异无统计学意义(P>0.05),见图4。

图3 硝苯地平对GFs MMP-1 mRNA表达的影响
Fig.3 The effect of nifedipine on the mRNA expression of MMP-1
与对照组相比,*P<0.05
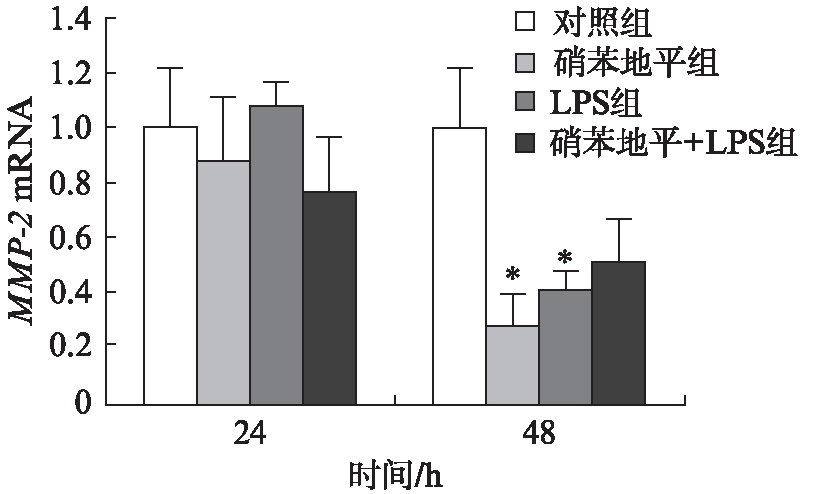
图4 硝苯地平对GFs MMP-2 mRNA表达的影响
Fig.4 The effect of nifedipine on the mRNA expression of MMP-2 与对照组相比,*P<0.05
药物性牙龈增生(drug-induced gingival overgrowth, DIGO)是指长期服用某种药物而引起的牙龈组织过度生长和体积增大。组织病理学发现: 硝苯地平引起的牙龈增生以细胞外基质增多,特别是Ⅰ型胶原和不同程度的炎症浸润为特点[5-6]。研究认为,胶原的过度堆积可能与MMP及其抑制剂之间的失衡而引起胶原合成增加或降解减少有关。但硝苯地平引起牙龈增生的分子机制目前尚不清楚,故本实验将硝苯地平作用于牙龈成纤维细胞,并加入LPS作为炎症刺激,观察正常及炎症环境下,硝苯地平对牙龈成纤维细胞MMP-1和MMP-2基因表达的影响,初步探讨硝苯地平诱导牙龈增生的分子机制。
MMPs是一类Ca2+、Zn2+依赖酶,在细胞外基质的代谢调节、纤维化等过程中起重要作用[4]。迄今为止发现的MMPs至少有28种[7-8],根据其结构和作用底物的特性分为6大类: 胶原酶、明胶酶、基质溶解酶、膜型金属蛋白酶、细胞溶解素及其他MMPs类。其中,MMP-1是一种胶原酶,由成纤维细胞、吞噬细胞、内皮细胞和上皮细胞等合成和分泌,可降解细胞外基质中最为丰富的蛋白即胶原,如Ⅰ、Ⅱ、Ⅲ、Ⅶ、Ⅹ型胶原和蛋白多糖的核心蛋白等;MMP-2是一种明胶酶,由成纤维细胞、多形核中性粒细胞、巨噬细胞等产生,主要降解Ⅳ、Ⅴ、Ⅶ型胶原、明胶、纤维连结蛋白、蛋白多糖、弹性蛋白[9-10]。鉴于MMP-1和MMP-2均可由成纤维细胞合成和分泌,且在细胞外基质的降解中发挥重要作用,因此,本实验选择MMP-1和MMP-2为检测指标。
有学者认为DIGO的发生与药物浓度密切相关,牙周的局部药物浓度可能决定了药物对牙龈成纤维细胞的作用。有研究[11]表明牙龈增生患者龈沟液中的药物浓度远高于血药浓度,因此本研究选择1μg/ml的药物浓度用于实验研究,较接近药物的局部浓度。本实验发现: 在硝苯地平作用下,MMP-1 mRNA的表达量24h时无明显变化,而48h时明显减少(P<0.05);MMP-2 mRNA的表达量也明显减少(P<0.05),表明硝苯地平可能通过减少MMP-1和MMP-2基因的表达,使胶原降解减少,而参与细胞外基质的堆积。已有的研究也表明硝苯地平可减少MMPs的分泌。Maita等[12]将硝苯地平与正常牙龈成纤维细胞共同培养后发现,10μmol/L浓度的硝苯地平可以明显降低MMP-1蛋白的表达量。
许多研究[13-14]表明,菌斑引起的炎症与DIGO的发生以及严重程度有关。LPS作为革兰阴性菌的主要毒力因子,可以激活多种靶细胞而参与各种炎症介质及细胞因子的产生,而可能会改变细胞对药物产生的应答。本实验模拟炎症状态下硝苯地平的作用情况,将硝苯地平与LPS共同作用于牙龈成纤维细胞,发现: 与对照组相比,MMP-1 mRNA的表达量明显增加,且24h时更加显著(P<0.05),MMP-2表达无明显变化。说明炎症因子可参与调节MMPs的表达,一定程度上逆转硝苯地平对MMPs表达的抑制作用,但具体机制有待进一步研究。
【参考文献】
[1] Kaur G, Verhamme KM, Dieleman JP. et al. Association between calcium channel blockers and gingival hyperplasia[J]. J Clin Periodontol, 2010,37(7): 625-630.
[2] Ikawa K, Ikawa M, Shimauchi H, et al. Treatment of gingival overgrowth induced by manidipine administ-ration[J]. J Periodontol, 2002,73(1): 115-122.
[3] Trackman PC, Kantarci A. Connective tissue metabo-lism and gingival overgrowth[J]. Crit Rev Oral Biol Med, 2004,15(3): 165-175.
[4] Stamenkovic I. Extracellular matrix remodelling: the role of matrix metalloproteinases[J]. J Pathol, 2003,200(4): 448-464.
[5] Kataoka M1, Kido J, Shinohara Y, et al. Drug-induced gingival overgrowth—a review[J].Biol Pharm Bull, 2005,28(10): 1817-1821.
[6] Nakib N, Ashrafi SS. Drug-induced gingival overgro-wth[J]. Dis Mon, 2011,57(4): 225-230.
[7] 林居红.基质金属蛋白酶与龋病关系研究进展[J].重庆医学,2008,37(5): 449-450.
[8] Ravanti L, Kähäri VM. Matrix metalloproteinases in wound repair(review)[J]. Int J Mol Med, 2000,45(6): 391-407.
[9] 彭文军,轩东英,赵红宇,等.基质金属蛋白酶组织抑制因子-1基因多态性与慢性牙周炎相关性研究[J].实用口腔医学杂志,2009,25(4): 531-535.
[10] 葛志华,张莹,杨宁,等.野黄芩苷对内毒素介导人牙周膜细胞表达MMP-1和MMP-2蛋白的影响[J].牙体牙髓牙周病学杂志,2010,20(10): 561-564.
[11] Shimizu Y, Kataoka M, Seto H, et al. Nifedipine induces gingival epithelial hyperplasia inrats through inhibition of apoptosis[J]. J Periodontol, 2002,73(8): 861-867.
[12] Maita E, Sato M, Yamaki K. Effect of tranilast on matrix metalloproteinase-1 secretion from human gingival fibroblasts in vitro[J]. J Periodontol, 2004,75(8): 1054-1060.
[13] Sakagami G, Sato E, Sugita Y, et al. Effects of nifedipine and interleukin-1a on the expression of collagen, matrix metalloproteinase-1, and tissue inhibi-tor of metalloproteinase-1 in human gingival fibroblasts[J]. J Periodontal Res, 2006, 41(4): 266-272.
[14] Miranda J, Brunet L, Roset P, et al. Prevalence and risk of gingival enlargement in patients treated with nifedipine[J]. J Periodontol, 2001,72(5): 605- 611.
Effects of nifedipine on expression of matrix metalloproteinase-1 and matrix metalloproteinase-2 in human gingival fibroblasts
【Abstract】Objective To investigate the effects of nifedipine on the expression of matrix metalloproteinase-1(MMP-1) and matrix metalloproteinase-2(MMP-2) in human gingival fibroblasts (GFs)in vitro. Methods The gingival tissue specimens obtained from periodontal surgery were cultured in vitro. GFs were identified by immunocytochemistry. The expression levels of MMP-1 and MMP-2 mRNA in GFs were detected by quantitative Real-Time PCR after cells stimulated by nifedipine(1μg/ml), LPS (1μg/ml) and nifedipine (1μg/ml)+LPS(1μg/ml). Results GFs cultured in vitro showed vimentin positive and keratin negative signal. The mRNA expression of MMP-1 and MMP-2 were significantly down-regulated after 48h treatment of nifedipine. The mRNA expression of MMP-1 was significantly up-regulated after GFs were treated with nifedipine+LPS, whereas there were no significant changes in MMP-2 expression. Conclusion These results suggest that nifedipine may be involved in proliferation of gingival fibroblasts through inhibition of MMP-1 and MMP-2 expression.
【Key words】gingival fibroblasts; nifedipine; lipopolysaccharide;matrix metalloproteinase
doi:10.16118/j.1008-0392.2015.04.007
收稿日期:2015-04-08
基金项目:国家自然科学基金(81170951);上海市科委员医学引导项目(10411964600)
【中图分类号】R 78
【文献标志码】A
【文章编号】1008-0392(2015)04-0033-05