·临床研究·
2型糖尿病肾脏病变患者骨代谢变化的研究
王 琳, 张克勤, 雷 涛
(同济大学附属同济医院内分泌科,上海 200065)
【摘要】目的 探讨2型糖尿病肾脏病变患者骨代谢标志物的变化及与肾功能变化相关性。方法 筛选2型糖尿病肾脏病变患者150例,根据肾小球滤过率(glomerular filtration rate,GFR)1~5期分为DN1~5组,每组患者各30例,检测患者血生化及骨代谢标志物指标。结果 25羟维生素D3(25-OH-D3)随着GFR水平下降而逐渐减低,PTH、BGP、P1NP、CTX水平逐渐升高。Spearman相关分析提示,25-OH-D3与GFR呈正相关,相关系数为 0.357外,CTX、P1NP、BGP、PTH均与GFR呈负相关,相关系数分别为-0.363、-0.526、-0.568、-0.610。进一步校正性别、年龄等因素后,BGP、25-OH-D3、PTH、P1NP、CTX仍与GFR具有相关性,其中以P1NP相关性最强,其次为PTH。结论 糖尿病肾脏病变患者骨代谢呈高转化状态,25羟维生素D与患者肾功能下降程度呈正相关,CTX、P1NP、BGP、PTH均与患者肾功能下降程度呈负相关,P1NP、PTH与患者肾功能下降相关性最强。
【关键词】2型糖尿病; 糖尿病肾脏病变; 骨代谢标志物
糖尿病肾病是由糖尿病引起的肾脏损伤(diabetic nephropathy, DN)。2007年美国肾脏病基金会(NKF)制定了肾脏病生存质量指导指南,简称NKF/KDOQI。该指南建议用(diabetic kidney disease, DKD)取代DN,即糖尿病肾脏病变。糖尿病引起的肾脏损伤,可导致钙磷代谢紊乱、1-α羟化酶功能下降、甲状旁腺功能亢进,从而导致骨代谢异常。骨代谢标志物以其检测快速、灵敏等优点,比骨密度能更早地发现患者骨骼代谢异常,从而进行早期干预,减少今后骨折风险并评估干预措施效果,目前越来越引起人们的关注。但糖尿病肾脏病变患者在不同阶段骨代谢指标如何变化,哪些与肾功能变化密切相关,在临床上应该如何更经济、有效地利用骨代谢指标已达到早发现、早诊断的目标呢?本文即探讨在糖尿病肾脏病变不同阶段,骨代谢标志物的变化及与肾小球滤过率(GFR)相关性的研究,来了解该类患者骨代谢变化的规律。
1 资料与方法
1.1 一般资料
2014年2月至2015年1月于同济大学附属同济医院住院及门诊的2型糖尿病(T2DM)患者150例,150例均根据2007年美国ADA制定的糖尿病诊断标准确诊为糖尿病患者,同时合并大量蛋白尿或糖尿病视网膜病变。其中男65例,女85例,年龄(69.87±9.195)岁。病程(14.15±8.369)年。所有患者均无长期卧床史,无酮症酸中毒,无肝脏疾病,无甲状腺功能异常、库欣综合征、原发性甲状旁腺功能亢进症等其他内分泌代谢疾病及骨转移癌、多发性骨髓瘤、先天性骨病等其他影响钙、磷代谢的疾病,未长期服用激素或其他各种影响骨代谢药物,未进行过血液透析或肾移植。150例患者按照2014年版糖尿病肾病防治专家共识[1]推荐的改良MDRD公式预估肾小球滤过率分为5组,(1) DN1组30例(男/女: 13/17): 糖尿病肾脏病变分期1期组,即肾小球滤过率(GFR)≥90ml min-1·1.73m-2;(2) DN2组30例(男/女: 13/17): 糖尿病肾脏病变分期2期组,即肾小球滤过率(GFR)60~89ml·min-1·1.73m-2;(3) DN3组30例(男/女: 16/14): 糖尿病肾脏病变分期3期组,即肾小球滤过率(GFR)30~59ml·min-1·1.73m-2;(4) DN4组30例(男/女: 11/19): 糖尿病肾脏病变分期4期组,肾小球滤过率15~29ml·min-1·1.73m-2;(5) DN5组30例(男/女: 14/16): 糖尿病肾脏病变分期5期组,即肾小球滤过率(GFR)<15ml·min-1·1.73m-2。
min-1·1.73m-2;(2) DN2组30例(男/女: 13/17): 糖尿病肾脏病变分期2期组,即肾小球滤过率(GFR)60~89ml·min-1·1.73m-2;(3) DN3组30例(男/女: 16/14): 糖尿病肾脏病变分期3期组,即肾小球滤过率(GFR)30~59ml·min-1·1.73m-2;(4) DN4组30例(男/女: 11/19): 糖尿病肾脏病变分期4期组,肾小球滤过率15~29ml·min-1·1.73m-2;(5) DN5组30例(男/女: 14/16): 糖尿病肾脏病变分期5期组,即肾小球滤过率(GFR)<15ml·min-1·1.73m-2。
1.2 方法
1.2.1 一般情况采集 采集每位患者的病史,测量身高、体质量、计算体质量指数(BMI)。BMI=体质量(kg)/身高(m2)。
1.2.2 生化及免疫检测 空腹采集静脉血,测定空腹血糖(FBG)、糖化血红蛋白(HbA1c),血钙(Ca)、血磷(P)、血肌酐(Cr)、血尿素氮(BUN)、血清白蛋白(ALB)、血甲状旁腺激素(PTH)、血25羟基维生素D(25-OH-D3)、抗酒石酸酸性磷酸酶(TRACP)、Ⅰ型胶原C端肽(CTX)、血清骨性碱性磷酸酶(BAP)、骨钙素(BGP)、总Ⅰ型胶原氨基端延长肽(T-PINP)。留取清晨单次尿,测定尿微量白蛋白(MA)、尿肌酐(Cr)。HbA1c采用高效液相色谱法测定,血P采用磷钼酸法,血Ca采用偶氮胂Ⅲ法,FBG采用己糖激酶法,血Cr改用苦味酸法,血BUN采用酶法,血ALB采用溴甲酚绿法,尿微量白蛋白采用特定蛋白法,尿Cr采用苦味酸法,上述生化指标检测均应用贝克曼全自动生化分析仪AU5800测定。BGP、T-PINP采用罗氏公司电化学发光法测定。CTX、TRAP、25-OH-D3、BAP采用英国IDS公司酶联免疫法方法测定。
1.3 统计学处理
连续变量数据以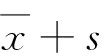 表示,组间差异比较采用方差分析,相关性估计采用Spearman相关分析,关联分析采用多元线性回归,P<0.05为有显著差异,P<0.01为有极显著差异,所有数据采用SPSS 20.0软件分析。
表示,组间差异比较采用方差分析,相关性估计采用Spearman相关分析,关联分析采用多元线性回归,P<0.05为有显著差异,P<0.01为有极显著差异,所有数据采用SPSS 20.0软件分析。
2 结 果
2.1 2型糖尿病肾脏病变各组一般资料比较
2型糖尿病肾脏病变各组基线数据: 年龄、性别构成、BMI各组相比无显著性差异(P>0.05)。各组之间,病程各组之间稍有差异,以DN1组病程最短,为(11.81+8.63)年,DN4组病程最长,为(15.72+7.70)年,但各组之间无统计学差异。
2.2 2型糖尿病肾脏病变各组血生化指标比较,见表1
各组HbA1c差异不大,无统计学意义。经人血白蛋白校正后,DN4组、5组血钙明显下降,与DN2组、3组相比,具有统计学差异。血磷水平以DN2组最低,但DN1、2组相比无统计学差异,随着肾功能恶化,血磷水平逐渐升高,DN4组、5组与其余各组比较均具有统计学差异,DN4组、5组之间无统计学差异。
2.3 2型糖尿病肾脏病变各组骨代谢指标比较,见表2
随着GFR下降,从DN1组到5组,各组25-OH-D3水平逐渐降低,其中DN5组维生素D水平与1组、2组、3组相比均具有统计学差异(P<0.01)。从DN1组到5组,PTH水平逐渐升高,DN4组与5组PTH水平明显高于DN1组、2组、3组三组,差异均具有统计学意义(P<0.01),但DN4组与5组之间相比无显著性差异。BAP在DN1、2、3、4各组变化不明显,DN5组水平稍高于各组,但差异均无统计学意义。TRACP水平各组无明显变化,差异无统计学意义。CTX DN4组、5组明显高于1、2、3各组,且差异具有统计学意义(P<0.01),DN4、5两组间相比无显著性差异。P1NP在DN1、2、3各组变化不大,DN4组、5组水平明显升高,其中DN5组与1、2、3各组相比差异具有统计学意义(P<0.01)。BGP从DN1组依次到5组水平逐渐升高,DN4组、5组明显高于1、2、3各组,差异具有统计学意义(P<0.01),DN4组、5组之间无显著性差异。
表1 2型糖尿病肾脏病变各组病程及血生化指标
Tab.1 Course of disease and blood biochemistry markers of type 2 diabetic kidney disease
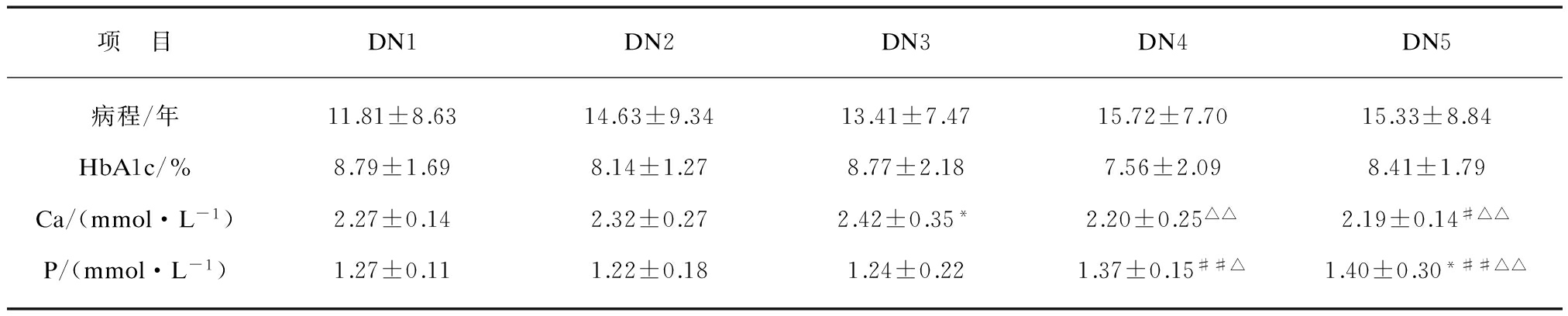
项 目DN1DN2DN3DN4DN5病程/年11.81±8.6314.63±9.3413.41±7.4715.72±7.7015.33±8.84HbA1c/%8.79±1.698.14±1.278.77±2.187.56±2.098.41±1.79Ca/(mmol·L-1)2.27±0.142.32±0.272.42±0.35*2.20±0.25△△2.19±0.14#△△P/(mmol·L-1)1.27±0.111.22±0.181.24±0.221.37±0.15##△1.40±0.30*##△△
注: 与DN1组比较,*P<0.05,**P<0.01;与DN2组比较,#P<0.05,##P<0.01;与DN3组比较,△P<0.05,△△P<0.01;与DN4组比较,▲P<0.05,▲▲P<0.01;下同
表2 2型糖尿病肾脏病变各组骨代谢指标比较
Tab.2 Comparison of bone metabolism markers of type 2 diabetic kidney disease
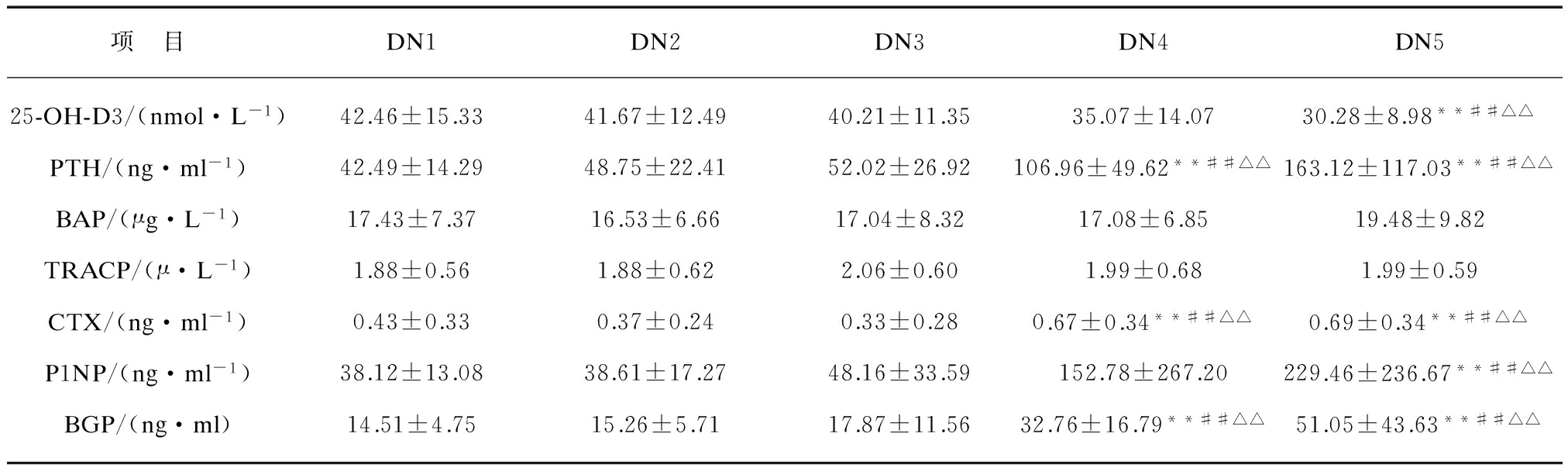
项 目DN1DN2DN3DN4DN525-OH-D3/(nmol·L-1)42.46±15.3341.67±12.4940.21±11.3535.07±14.0730.28±8.98**##△△PTH/(ng·ml-1)42.49±14.2948.75±22.4152.02±26.92106.96±49.62**##△△163.12±117.03**##△△BAP/(μg·L-1)17.43±7.3716.53±6.6617.04±8.3217.08±6.8519.48±9.82TRACP/(μ·L-1)1.88±0.561.88±0.622.06±0.601.99±0.681.99±0.59CTX/(ng·ml-1)0.43±0.330.37±0.240.33±0.280.67±0.34**##△△0.69±0.34**##△△P1NP/(ng·ml-1)38.12±13.0838.61±17.2748.16±33.59152.78±267.20229.46±236.67**##△△BGP/(ng·ml)14.51±4.7515.26±5.7117.87±11.5632.76±16.79**##△△51.05±43.63**##△△
2.4 2型糖尿病肾脏病变各阶段患者GFR与各指标间的相关性分析
Spearman相关分析,见表3。分别以2型糖尿病肾脏病变患者GFR及按GFR所分的DN1、2、3、4、5各组为因变量,BAP、TRACP、CTX、25-OH-D3、P1NP、BGP、PTH等为自变量,进行多元线性回归,结果发现CTX、25-OH-D3、P1NP、BGP、PTH均与GFR及分组相关,其中除25-OH-D3与GFR呈正相关,相关系数为0.357外,CTX、P1NP、BGP、PTH均与GFR呈负相关,相关系数分别为-0.363、 -0.526、-0.568、-0.610。为进一步排除患者性别、年龄的影响,在校正性别、年龄等因素后,分别对上述指标进行多因素回归分析,分析结果见表4。BGP、25-OH-D3、PTH、P1NP、CTX仍与GFR具有相关性,其中以P1NP相关性最强,其次为PTH。
表3 2型糖尿病肾脏病变患者GFR与骨代谢指标相关性分析
Tab.3 Correlation analysis between GFR and bone metabolism markers of type 2 diabetic kidney disease
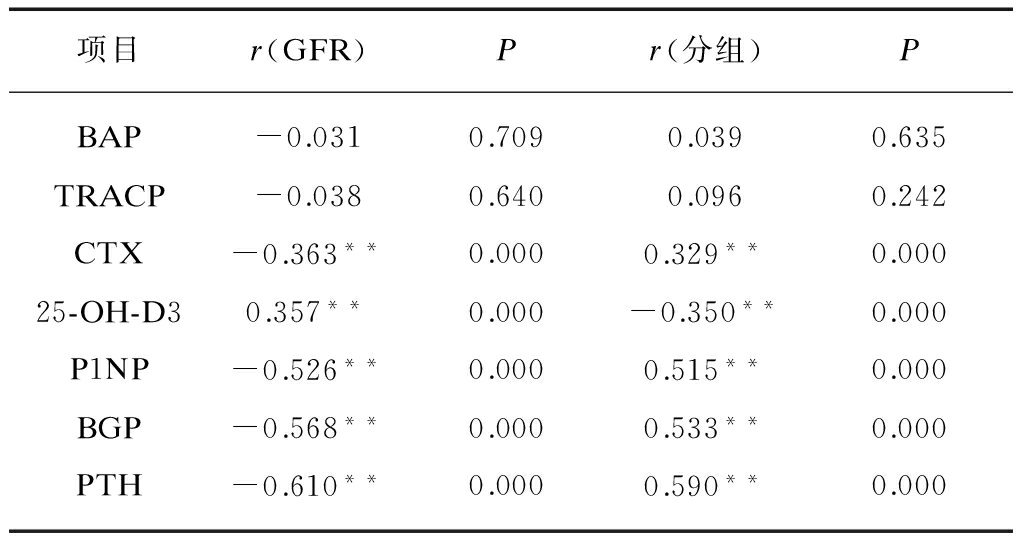
项目r(GFR)Pr(分组)PBAP-0.0310.7090.0390.635TRACP-0.0380.6400.0960.242CTX-0.363**0.0000.329**0.00025-OH-D30.357**0.000-0.350**0.000P1NP-0.526**0.0000.515**0.000BGP-0.568**0.0000.533**0.000PTH-0.610**0.0000.590**0.000
注: *P<0.05,**P<0.01
表4 2型糖尿病肾脏病变患者GFR与骨代谢指标回归分析
Tab.4 Medical regression analysis between GFR and bone metabolism markers of type 2 diabetic kidney disease
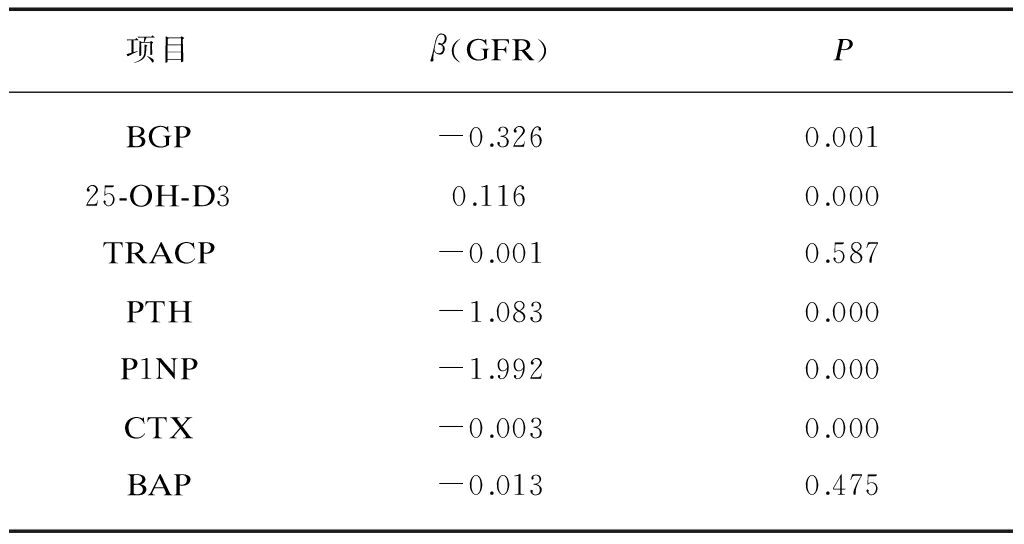
项目β(GFR)PBGP-0.3260.00125-OH-D30.1160.000TRACP-0.0010.587PTH-1.0830.000P1NP-1.9920.000CTX-0.0030.000BAP-0.0130.475
3 讨 论
2型糖尿病与骨质疏松的关系,目前研究较多,但结果并不一致[2]。糖尿病肾脏病变是糖尿病最主要的微血管并发症之一,是目前引起终末期肾病(end-stage renal disease,ESRD)的主要原因。2009至2012年我国2型糖尿病患者的糖尿病肾病患病率在社区患者中为30%~50%[3],在住院患者中为40%左右[4]。糖尿病肾脏病变中肾功能的改变是其重要表现,反映肾功能的主要指标是GFR。既往大多数文章多以尿蛋白排泄量来进行糖尿病肾脏病变分组,探讨骨转换情况[5-6]。但目前已有研究显示,部分糖尿病患者无尿白蛋白排泄异常,但已经存在GFR下降[7-8],提示尿白蛋白阴性者也有存在肾病,故本研究以GFR下降程度进行分组来探讨骨代谢变化情况可能更为准确。
本研究中,随着糖尿病肾脏病变肾功能的恶化,4、5期患者的血钙明显下降,血磷明显升高,25-OH-D3水平亦逐渐下降,5期患者的25-OH-D3水平明显低于其余各组。在校正性别、年龄等因素后,进行多因素回归分析中,25-OH-D3与GFR呈正相关。其原因可能与肾功能恶化,尿钙排出增多,血钙降低,肾脏1-α羟化酶缺乏或功能受限,使1,25羟基维生素D生成减少,另外,维生素D水平下降还可能因糖尿病肾脏病变肾功能下降,尿蛋白排出增多,维生素D结合蛋白减少有关。维生素D水平下降,导致肠钙吸收减少,进一步引起血钙降低。同时,随着肾小球滤过率逐渐下降,尿磷排泄障碍,出现血磷升高,钙磷代谢失衡。维生素D除了可以促进小肠粘膜对钙、磷的吸收,使肾小管对钙、磷的重吸收增加;还与糖脂代谢、胰岛素抵抗及肾脏损害相关。糖尿病肾损伤的重要介质之一是血管紧张素Ⅱ,血管紧张素Ⅱ本身在肾细胞能诱导许多前炎症因子、前纤维蛋白生成因子、生长因子、细胞因子、趋化因子的生成。局部血管紧张素Ⅱ的增加可加重足突细胞损害。维生素D可以降低肾素基因启动因子的活性,直接抑制肾素的表达, 从而降低RAS系统活性;同时,糖尿病肾脏病变伴有的低血钙和继发性甲状旁腺功能亢进也会引起肾素高表达,维生素D可通过调节钙磷代谢,升高血钙浓度,纠正甲状旁腺功能亢进,抑制肾素高表达,从而减少血管紧张素的形成。
PTH随着肾功能的恶化,GFR的降低,其水平逐渐升高,4、5期组患者PTH水平明显高于其余三组,差异具有统计学意义(P<0.01)。PTH受血钙、血磷的影响,在本研究中,4、5期患者血钙明显降低,血磷明显升高,维生素D减少,从而刺激PTH增高,导致继发性甲状旁腺功能亢进症。另外,随着糖尿病肾脏病变的进展,GFR逐渐下降,肾脏排泄PTH能力下降,从而导致PTH升高。PTH具有促进骨形成与骨吸收,增加骨转换的作用。随着糖尿病肾脏病变的进展,PTH、血钙、磷代谢紊乱加重,进而引起骨结构、骨转化的异常,导致骨密度下降。本研究中,在排除患者性别、年龄的影响后进行多因素回归分析中发现,PTH与GFR具有明显负相关,其相关程度仅次于P1NP,因此,PTH可作为分析糖尿病肾脏病变肾功能损害的一个较敏感的指标。
本研究结果提示,BGP水平从肾功能1期到5期逐渐升高,4、5期组患者BGP水平明显高于其余各组,差异具有统计学意义(P<0.01)。血清BGP是成骨细胞产生并分泌的,其生理功能一般认为与骨转换有关,主要维持骨的正常矿化速度、抑制异常的羟磷灰石结晶形成、抑制生长软骨的矿化速率。Delmas认为,当骨形成与骨吸收偶联时,BGP是反应骨转换的指标,当骨形成与骨吸收解偶联时,BGP是反应骨形成的特异指标,可直接反映骨形成的速率,因此在骨质疏松中常用BGP作为反映骨形成的特异性指标。本研究在进行多因素回归分析中发现,BGP与GFR呈负相关,在排除年龄、性别等影响后仍具有相关性,其原因可能与肾功能下降,排泄物质能力减低,从而导致BGP升高。
P1NP在血清中的含量反映成骨细胞合成骨胶原的能力,血P1NP值升高提示Ⅰ型胶原的合成速率加快,骨转换活跃。与BGP相比,PINP是骨形成更为特异和敏感的指标。在本研究中,糖尿病肾脏病变4、5期患者P1NP水平明显升高,在进行多因素回归分析中,提示P1NP与GFR呈负相关,即便在排除年龄、性别因素影响后,与BGP、25-OH-D3、PTH、CTX等指标比较,P1NP与GFR相关性最强。CTX是Ⅰ型胶原C端交联肽是交联物的一部分,在胶原分解时产生,CTX中有骨Ⅰ型胶原分子间交联物的重要区段和近似交联物的残基,且不被肾脏降解,尿液置-20°C环境7d,反复冻融5次,结果不受影响,故CTX因其稳定性,目前被推荐成为成为理想的骨吸收标记物[9]。本研究中,CTX水平在糖尿病肾脏病变4、5期组明显升高,排除年龄、性别因素后分析与GFR呈负相关。本研究结果表明,随着糖尿病肾脏病变肾功能的恶化,骨形成与骨吸收均增加,骨转换呈现为高转换状态,糖尿病肾脏病变导致的骨质疏松主要由于骨吸收骨流失过快所致,进一步支持糖尿病肾脏病变导致骨质疏松为继发性骨质疏松。
综上所述,糖尿病肾脏病变是骨质疏松的重要危险因素,糖尿病肾脏病变引起骨转换活跃,P1NP、PTH、CTX、25-OH-D3、BGP可为糖尿病肾脏病变引起骨质疏松的敏感指标,为临床提供指导。病例有限,仍需进一步研究。
【参考文献】
[1] 糖尿病肾病防治专家共识(2014年版)[J].中华糖尿病杂志,2014,6(11): 792-801.
[2] 王永兰,王文杏,宣淼,等.LRP5基因多态性与绝经后妇女2型糖尿病伴骨质疏松症的相关性研究[J].同济大学学报: 医学版,2014,35(6): 79-84.
[3] 徐山荣,钟一红,陈波,等.上海市郊区2型糖尿病患者肾脏疾病及其危险因素研究[J].中华内科杂志,2012,51: 18-23.
[4] 汪珊珊,陈东,陈明卫,等.代谢综合征对2型糖尿病患者糖尿病肾病的影响分析[J].中国慢性病预防与控制,2011,5: 509-511.
[5] 高明,王涤非,林奕辰,等.糖尿病肾病患者骨密度及骨代谢标志物的临床研究[J].中国骨质疏松杂志,2014,20(2): 166-170.
[6] 杨娟,谈敏,胡群力.绝经后妇女2型糖尿病肾病患者骨代谢指标变化分析[J].中国医学创新,2014,11(26): 10-12.
[7] de Boer IH, Rue TC, Hall YN,et al.Temporaltrends in the prevalence of diabetic kidney disease in the united states [J]. JAMA, 2011,305: 2532-2539.
[8] Dwyer JP, Parving HH, Hunisicker LG, et al. Renal dysfunction in the presence of normoalbunminuria in type 2 diabetes: results from the demand study[J]. Cardiorenal Med, 2012,2: 1-10.
[9] Wheater G, Elshahaly M, Tuck SP, et al. The clinical utility of bone marker measurements in osteoporosis[J]. Journal of Translational Medicine,2013,11: 201.
Changes of bone metabolism in patients with type 2 diabetic kidney disease
WANG Lin, ZHANG Ke-qin, LEI Tao
(Dept. of Endocrinology, Tongji Hospital, Tongji University, Shanghai 200065, China)
【Abstract】Objective To investigate the changes of bone metabolism in patients with type 2 diabetic kidney disease. Methods One hundred and fifty patients with type 2 diabetic kidney disease were classified as DN 1-5 groups according to glomerular filtration rate stage 1-5, with 30 cases in each group. Blood biochemistry and bone metabolism markers of patients were measured. Results Spearman correlation analysis showed that 25-OH-D3 level was decreased and PTH, BGP, PINP and CTX were increased with the decreasing of GFR. 25-OH-D3 was positively correlated with GFR (r= 0.357, P<0.05); CTX, P1NP, BGP and PTH were negatively correlated with GFR (r=0.363, -0.526, -0.568, -0.610, P<0.05 or P<0.01). BGP, 25-OH-D3, PTH, P1NP, CTX were still correlated with GFR after correcting the impact of sex and age of patients. Conclusion Patients with type 2 diabetic kidney disease present a high conversion state of bone metabolism, the changes of bone metabolic markers are correlated with the decrease of kidney function.
【Key words】type 2 diabetes mellitus; diabetic kidney disease; bone metabolism markers
doi:10.16118/j.1008-0392.2015.03.012
收稿日期:2015-03-22
基金项目:国家自然科学基金(81170802)
作者简介:王 琳(1983—),女,硕士研究生.E-mail: linlinellen@163.com
【中图分类号】R 587.1
【文献标志码】A
【文章编号】1008-0392(2015)03-0054-05
 min-1·1.73m-2;(2) DN2组30例(男/女: 13/17): 糖尿病肾脏病变分期2期组,即肾小球滤过率(GFR)60~89ml·min-1·1.73m-2;(3) DN3组30例(男/女: 16/14): 糖尿病肾脏病变分期3期组,即肾小球滤过率(GFR)30~59ml·min-1·1.73m-2;(4) DN4组30例(男/女: 11/19): 糖尿病肾脏病变分期4期组,肾小球滤过率15~29ml·min-1·1.73m-2;(5) DN5组30例(男/女: 14/16): 糖尿病肾脏病变分期5期组,即肾小球滤过率(GFR)<15ml·min-1·1.73m-2。
min-1·1.73m-2;(2) DN2组30例(男/女: 13/17): 糖尿病肾脏病变分期2期组,即肾小球滤过率(GFR)60~89ml·min-1·1.73m-2;(3) DN3组30例(男/女: 16/14): 糖尿病肾脏病变分期3期组,即肾小球滤过率(GFR)30~59ml·min-1·1.73m-2;(4) DN4组30例(男/女: 11/19): 糖尿病肾脏病变分期4期组,肾小球滤过率15~29ml·min-1·1.73m-2;(5) DN5组30例(男/女: 14/16): 糖尿病肾脏病变分期5期组,即肾小球滤过率(GFR)<15ml·min-1·1.73m-2。


