·基础研究·
【摘要】目的 腹腔脂肪型丝氨酸蛋白酶抑制剂(visceral adipose tissue-derived serine protease inhibitor, vaspin)是新发现的脂肪因子,对代谢性疾病具有改善作用。该研究旨在研究vaspin对体外培养的THP-1细胞泡沫化的影响。方法 100nM佛波酯孵育THP-1巨噬细胞48h后分为对照组,氧化低密度脂蛋白组(ox-LDL浓度50μg/ml,48h),vaspin干预组(vaspin终浓度100ng/ml,预孵24h);采用油红0染色法检测vaspin对THP-1细胞泡沫化的影响;Real-time PCR和Western blot法检测vaspin对THP-1细胞中酰基辅酶A胆固醇酰基转移酶-1(acy1-coenzyme A: cholesterol acyltrasferase-1,ACAT-1)、ATP结合盒转运体A1(ATP binding casstte transporterA1,ABCA1)及细胞清道夫受体-A1(scavenger receptor-A1, SR-A1)mRNA及蛋白表达水平的影响。结果 与ox-LDL组比较,ox-LDL+vaspin组巨噬细胞泡沫化程度明显下降(P<0.05);ox-LDL+vaspin组ACAT-1和SR-A1 mRNA及蛋白表达水平明显降低(P<0.05),而ABCA1 mRNA及蛋白表达水平明显升高(P<0.05)。结论 vaspin 能够抑制巨噬细胞向泡沫细胞的转化,发挥抗动脉粥样硬化(atherosclerosis, As)的作用。
【关键词】腹腔脂肪型丝氨酸蛋白酶抑制剂; 巨噬细胞; 泡沫细胞; 酰基辅酶A胆固醇酰基转移酶-1; ATP结合盒转运体A1; 细胞清道夫受体-A1
腹腔脂肪型丝氨酸蛋白酶抑制剂(vaspin)是2005年,从2型糖尿病肥胖大鼠模型中分离出的一种新型的脂肪因子,属于丝氨酸蛋白酶抑制剂家族。许多研究结果显示,vaspin在代谢综合征的发生发展中发挥着重要作用,vaspin表达上调可以改善胰岛素抵抗,并抑制炎症及动脉粥样硬化进展[1-3]。
动脉粥样硬化(atherosclerosis, As)是一种慢性炎症性疾病,巨噬细胞吞噬氧化低密度脂蛋白(oxygenized-low density lipoprotein, ox-LDL)从而转换成泡沫细胞是As形成的重要原因[4]。
Vaspin对巨噬细胞转化为泡沫细胞中作用尚未明确。本实验用vaspin作用于单核巨噬细胞THP-1,研究其能否通过巨噬细胞内与胆固醇代谢相关的ATP结合盒转运体A1(ATP binding casstte transporterA1, ABCA-1)、酰基辅酶A胆固醇酰基转移酶-1(acyl-coenzyme A: cholesterolacyhrasferase-1, ACAT-1)及细胞清道夫受体-A1(scavenger receptor-A1,SR-A1)基因的表达从而抑制巨噬细胞向泡沫细胞的转化。
1.1 细胞
人单核巨噬细胞THP-1购自中国科学院上海生物研究所细胞库。
1.2 试剂
重组人腹腔脂肪型丝氨酸蛋白酶抑制剂蛋白购自韩国Adipogen公司;ox-LDL购自北京生物技术公司;胎牛血清、胰蛋白酶、DMSO及RPMI 1640培养基均购自美国Gibco公司;PMA购自美国Sigma公司;兔抗人ACAT-1、ABCA1及SR-A1多克隆抗体购自美国SentaCrus公司;逆转录试剂盒和荧光定量试剂盒购自日本Takara公司;RNA提取试剂盒购自上海飞捷生物技术公司。
1.3 细胞培养
将THP-1细胞接种于6孔板内![]() 个/孔,并用含有PMA的RPMI 1640培养基置于37℃,5% CO2培养箱内培养48h,待细胞贴壁后,弃去培养基,加入饥饿液置于37℃,5%CO2培养箱内培养16h后;ox-LDL+vaspin组加入vaspin预孵24h,之后,ox-LDL组及ox-LDL+vaspin组分别加入相同浓度的ox-LDL刺激48h。处理完成后,细胞收集用于提取RNA及蛋白。
个/孔,并用含有PMA的RPMI 1640培养基置于37℃,5% CO2培养箱内培养48h,待细胞贴壁后,弃去培养基,加入饥饿液置于37℃,5%CO2培养箱内培养16h后;ox-LDL+vaspin组加入vaspin预孵24h,之后,ox-LDL组及ox-LDL+vaspin组分别加入相同浓度的ox-LDL刺激48h。处理完成后,细胞收集用于提取RNA及蛋白。
1.4 vaspin对THP-1泡沫化影响的检测
采用油红O染色法。将各组贴壁的THP-1细胞用PBS洗涤3次,置于4℃,10%甲醛中固定 10min;PBS洗涤3次,于60%异丙醇中放置 5min;过滤后的油红0染色10min;于60%异丙醇分化 5min;PBS洗涤,照相。
1.5 vaspin对THP-1细胞中ACAT-1、ABCA1及SR-A1基因mRNA水平影响的检测
采用Real-time PCR法。ACAT-1基因引物forward: 5′-GGAACACAGCATGTCAGTGCAA-3′,re-verse: 5′-TGTCACTCCAGGGCGTACAATC-3′;ABC-A1基因引物: forward: 5′-AGCTAAGTCCCTGCA-CCACGA-3′,reve-rse: 5′-TGTACAATCACCGACCT-TGACCA-3′;SR-A1基因引物: forward;5′-GACT-CTGGAATATCCCAGGACAACA-3′,reve-rse: 5′-CTGAGGTTTGCTGCATCGACA-3′;内参β-actin基因引物: forward: 5′-CCAAATGCAAACTGGATGA-TGAC-3′,reverse: 5′-CTCTTGTTGATTTGGGCAC-AGAC-3′。引物由赛百胜生物工程(上海)有限公司合成。收集各组细胞,提取总RNA,经逆转录试剂盒将RNA逆转录为cDNA,以cDNA为模板进行实时定量PCR扩增。反应条件为: 94℃预变性5min;95℃放置30s,60℃放置30s,72℃延伸1min,共40个循环。
1.6 vaspin对THP-1细胞中ACAT-1、ABCA1及SR-A1蛋白表达影响的检测
采用Western blot法检测。收集各组细胞,用预冷的PBS洗涤3次,加入细胞裂解液裂解30min,将6孔板置于冰上提取细胞蛋白,提取后用BCA法测定蛋白浓度。取20μg蛋白,经8%SDS-PAGE胶分离后,电转至NC膜,以5%BSA于4SDS℃封闭1h;分别加入兔抗人ACAT-1、ABCA1及SR-A1多克隆抗体(均1∶500稀释),4℃湿盒中孵育过夜;复温1h后,PBST洗膜3次,每次10min,加入HRP标记的二抗(1∶500稀释),37℃避光孵育1h,避光洗膜3次,每次10min,ECL发光试剂盒发光显影,凝胶成像。
1.7 统计学分析
应用SPSS 14.0软件进行统计学分析,实验数据均以均数±标准差表示,各组数据进行正态性和方差齐性检验,两样本的均数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2.1 vaspin能够抑制巨噬细胞的吞脂
油红O染色结果显示,对照组及ox-LDL组可见较多的油红O染色阳性脂滴,结果以脂滴面积占细胞总面积的百分比表示,图中结果显示vaspin预处理后,巨噬细胞中的脂滴形成明显减少(P<0.05),见图1。
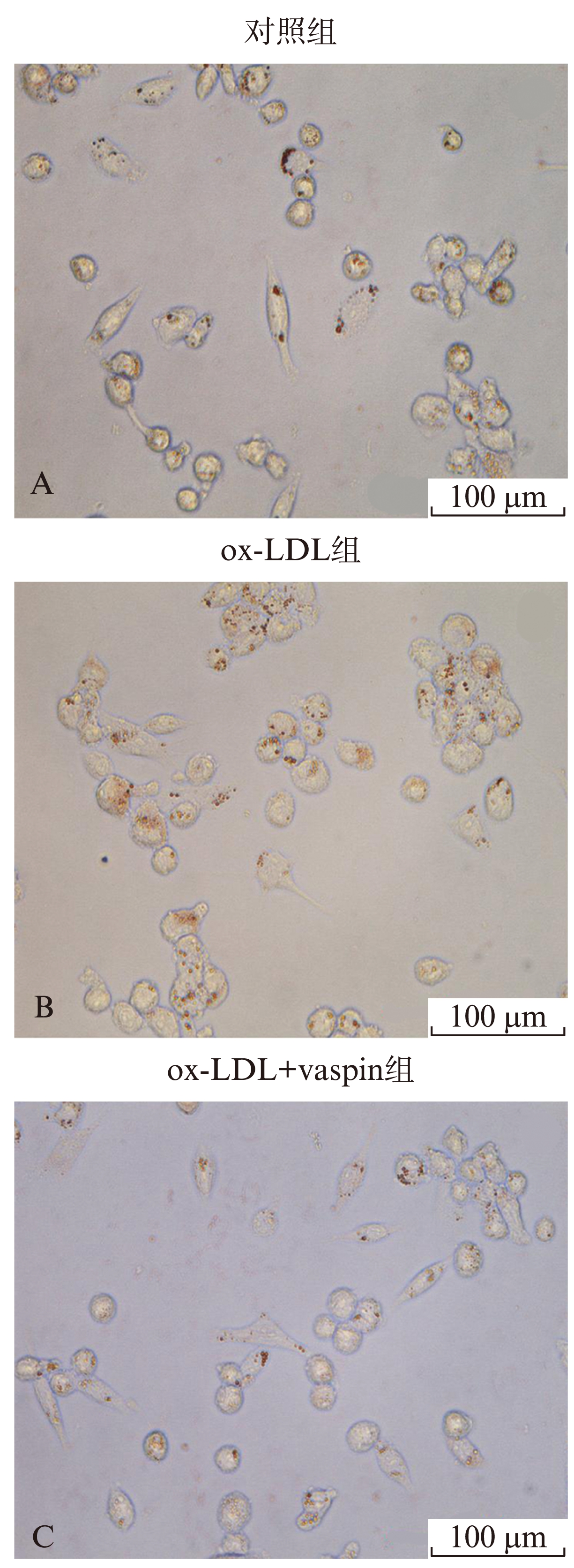
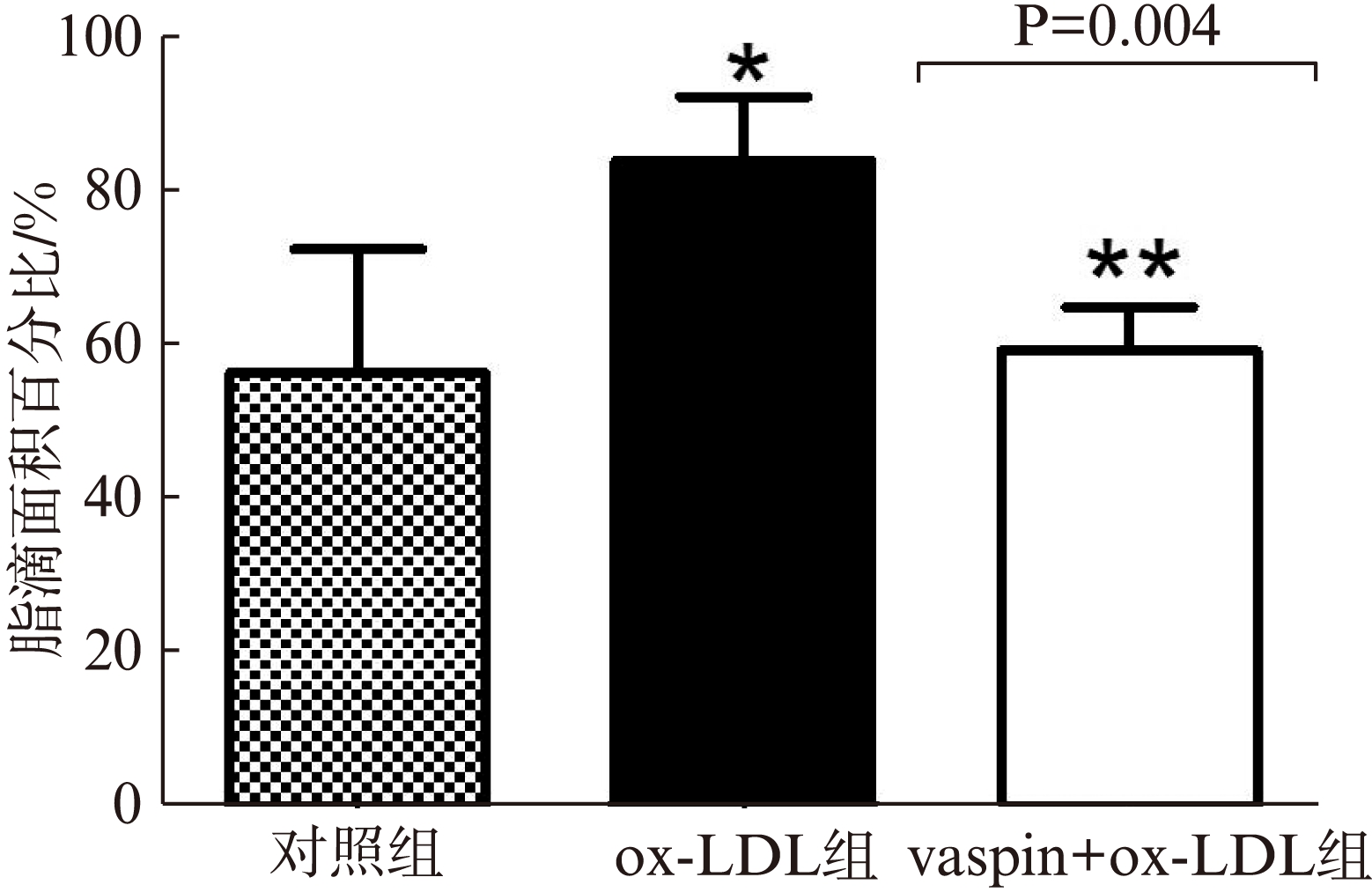
图1 Vaspin对巨噬细胞泡沫化的影响(油红O染色,×200)
Fig.1 Effect of vaspin on the bubbing of macrophages(oil red O staining,×200)
2.2 vaspin对THP-1细胞中ACAT-1、ABCA1及SR-A1基因mRNA水平的影响
Real-time PCR结果显示,ox-LDL组较对照组ACAT-1及SR-A1基因mRNA水平明显升高(P值都<0.05),而ABCA1表达水平降低(P<0.05);vaspin预处理组较ox-LDL组ACAT-1及SR-A1基因mRNA水平明显降低(P分别<0.05),而ABCA1表达水平升高(P<0.05),见图2。
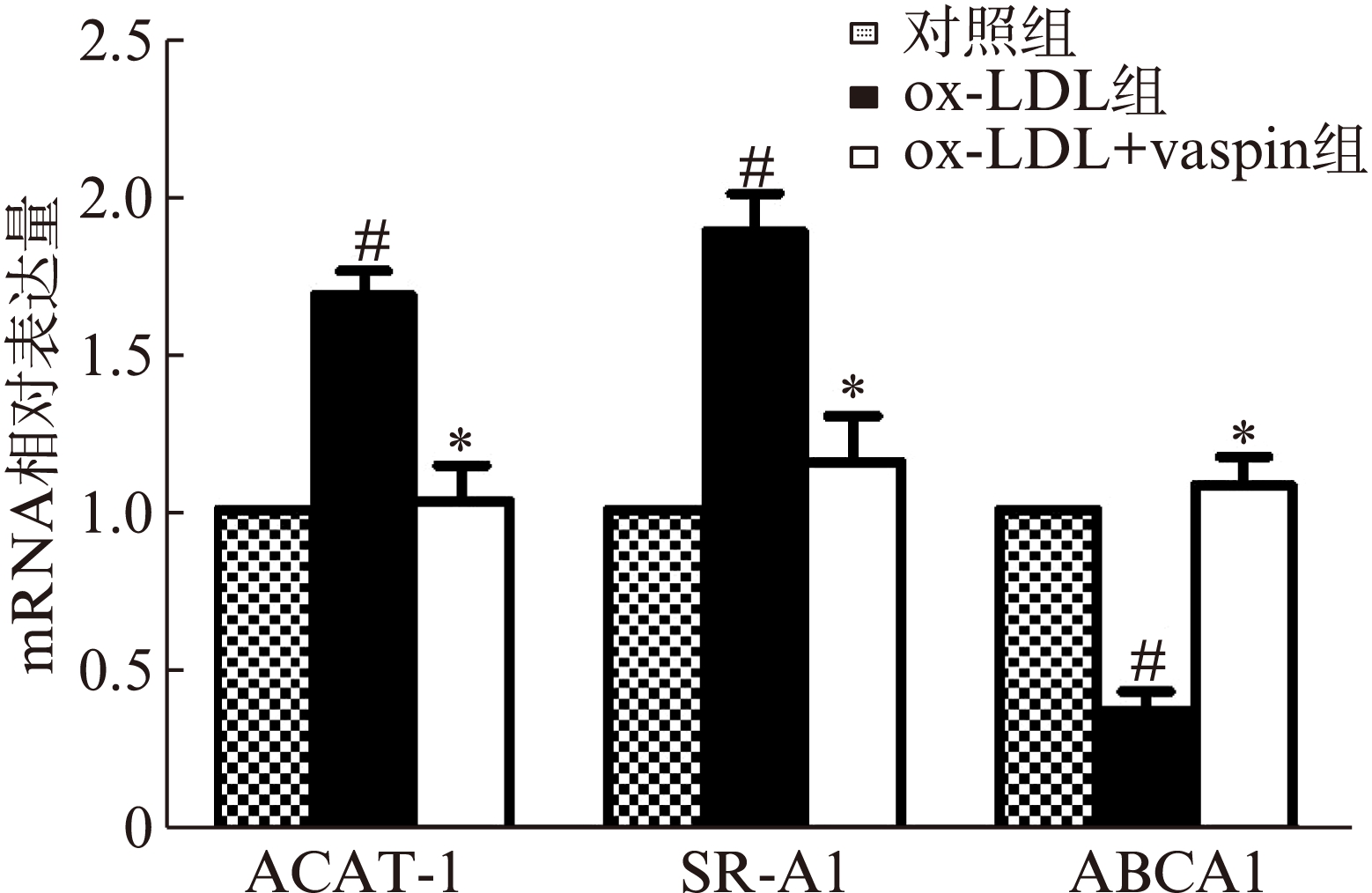
图2 三组THP-1细胞中ACTA-1、SR-A1和ABCA1基因mRNA水平
Fig.2 Levels of ACTA-1,SR-A1 and ABCA1 mRNAs in the THP-1 cells of three groups
2.3 vaspin对THP-1细胞中ACAT-1、ABCA1及SR-A1蛋白表达的影响
Western blot结果显示,ox-LDL组较对照组ACAT-1及SR-A1蛋白表达水平明显升高(P分别<0.05),而ABCA1表达水平降低(P<0.05);vaspin预处理组较ox-LDL组ACAT-1及SR-A1蛋白表达水平明显降低(P<0.05),而ABCA1表达水平升高(P<0.05),见图3。
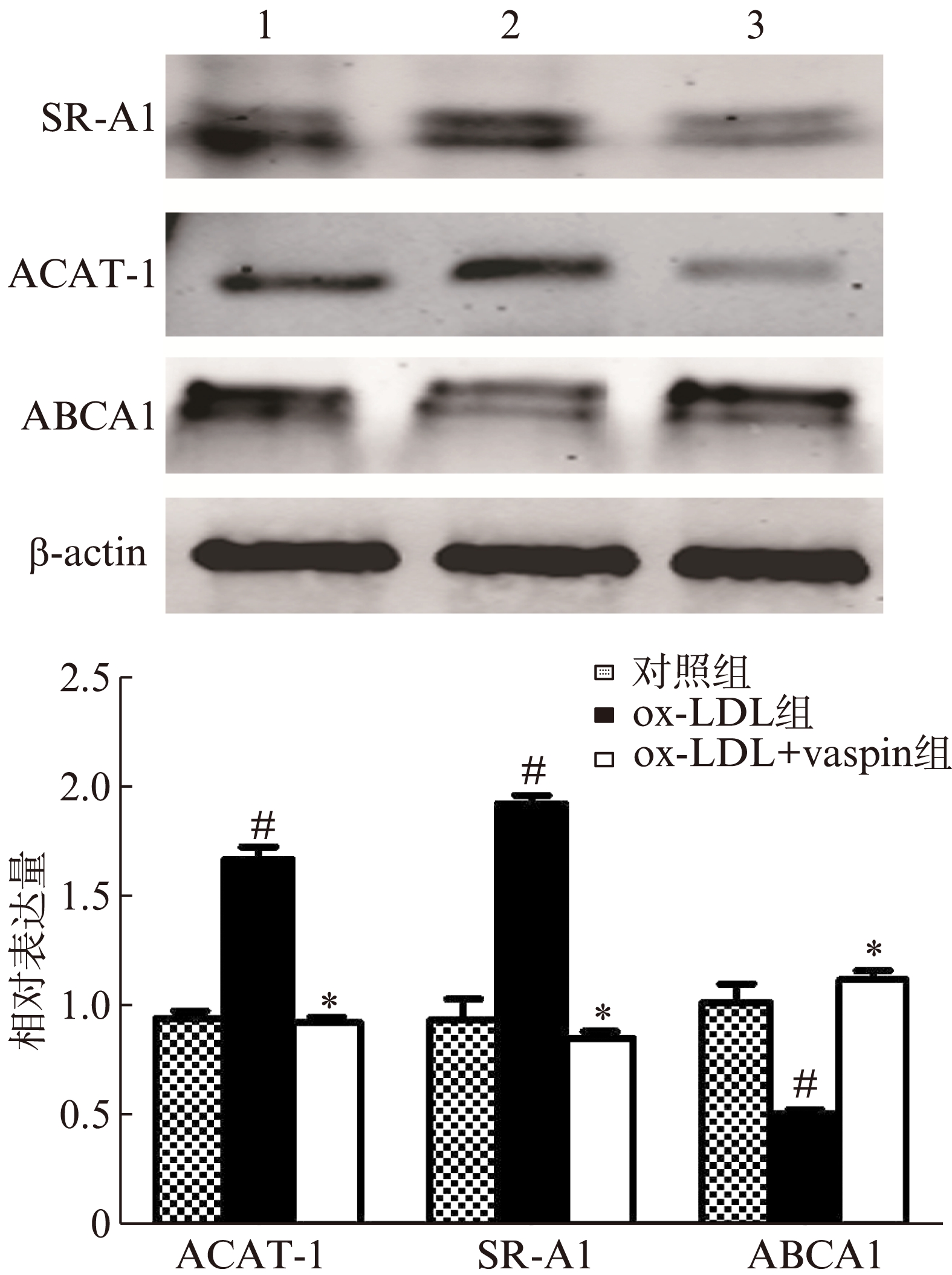
图3 三组THP-1细胞中ACTA-1、SR-A1和ABCA1的蛋白表达水平
Fig.3 Expressions levels of ACTA-1, SR-A1 and ABCA1 proteins in the THP-1 cells of three groups
研究表明在颈动脉硬化的患者,有症状者较无症状者血清vaspin浓度降低[5],主动脉周围脂肪组织中vaspin水平与大动脉硬化呈正相关。此外,在希腊人和现研究中发现冠心病患者的vaspin血清浓度较正常人低,且与冠心病严重程度相关[6]。
巨噬细胞转变的泡沫细胞是As形成的早期标志,巨噬细胞能吞噬ox-LDL以及被自身细胞核金属离子修饰的LDL,表现出一定的泡沫化倾向。通过清道夫受体,CD36受体或其他受体的作用,大量吞噬ox-LDL的巨噬细胞进一步促成泡沫细胞的形成[7]。
ABCA1利用ATP为能量来源将细胞内磷脂和游离胆固醇转运至载脂蛋白A-1,启动胆固醇逆向转运,清除多余脂质尤其是细胞内胆固醇的过程中发挥重要作用。而ABCA1的降低导致血浆HDL的降低,引起造成脂质的堆积,促进泡沫细胞形成[8-9]。实验发现与ox-LDL组相比vaspin+ox-LDL组油红O染色阳性细胞显著减少,而ABCA1的基因和蛋白表达都显著增加(P<0.05),表面vaspin可能通过胆固醇逆转运而抑制巨噬细胞泡沫化。
SR-A是一种跨膜糖蛋白受体,主要表达于巨噬细胞、血管平滑肌细胞和内皮细胞,促进AS的发生、发展。由于不受细胞内胆固醇的负反馈调节,能无限制摄取ox-LDL,高表达SR-A,促使使巨噬细胞转变为泡沫细胞[10]。胆固醇在ACAT1的作用下生成胆固醇酯,由于胆固醇酯是高度非极性分子,主要以脂滴的形式储存于胞质中,其表达过高使胆固醇酯合成增多,泡沫细胞内脂质堆积[11]。本研究发现vaspin+ox-LDL跟ox-LDL组SR-A和ACAT1在基因和蛋白表达都显著减少(P<0.05),提示vaspin通过减少胆固醇积聚来抑制巨噬细胞泡沫化。
综上所述,vaspin通过调节SR-A、ACAT1和ABCA1的表达水平降低巨噬细胞内胆固醇水平,抑制巨噬细胞泡沫化。同时,对于vaspin对AS的影响有待于进一步的研究和证实。
【参考文献】
[1] 吕煜焱,徐亚伟.新型脂肪因子Vaspin研究进展[J].同济大学学报: 医学版,2013,(5): 116-120.
[2] Motal MC, Klaus DA, Lebherz-Eichinger D, et al. Increased plasma vaspin concentration in patients with sepsis: an exploratory examination[J]. Biochem Med: Zagreb, 2015,25(1): 90-96.
[3] Spiroglou SG, Kostopoulos CG, Varakis JN, et al. Adipokines in periaortic and epicardial adipose tissue: differential expression and relation to atherosclerosis[J]. J Atheroscler Thromb, 2010,17(2): 115-130.
[4] Ji KT, Qian L, Nan JL, et al. Ox-LDL induces dysfunction of endothelial progenitor cells via activation of NF-kappaB[J]. Biomed Res Int, 2015,2015,175291.
[5] 刘兴华,彭文辉,李海玲,等.高糖诱导人THP1细胞Toll样受体4信号通路变化及匹伐他汀的拮抗作用[J].同济大学学报: 医学版,2011,(4): 23-27.
[6] Kadoglou NP, Gkontopoulos A, Kapelouzou A, et al. Serum levels of vaspin and visfatin in patients with coronary artery disease-Kozani study[J]. Clin Chim Acta, 2011,412(1-2): 48-52.
[7] Guan S, Wang B, Li W, et al. Effects of berberine on expression of LOX-1 and SR-BI in human macrophage-derived foam cells induced by ox-LDL[J]. Am J Chin Med, 2010,38(6): 1161-1169.
[8] Zhao Y, Pennings M, Hildebrand RB, et al. Enhanced foam cell formation, atherosclerotic lesion develop-ment, and inflammation by combined deletion of ABCA1 and SR-BI in Bone marrow-derived cells in LDL receptor knockout mice on western-type diet[J]. Circ Res, 2010,107(12): e20-e31.
[9] Zhao TT, Peng R, Shen L, et al. Soluble epoxide hydrolase inhibitor t-AUCB ameliorates ox-LDL induced conversion of macrophages into foam cells through activating the PPARgamma-ABCA1 pathway[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2012,40(3): 248-252.
[10] Shang W, Yu X, Wang H, et al. Fibroblast growth factor 21 enhances cholesterol efflux in THP-1 macrophage-derived foam cells[J]. Mol Med Rep. 2015,11(1): 503-508.
[11] Liang Y, Yang X, Ma L, et al. Homocysteine-mediated cholesterol efflux via ABCA1 and ACAT1 DNA methylation in THP-1 monocyte-derived foam cells[J]. Acta Biochim Biophys Sin(Shanghai), 2013,45(3): 220-228.
Inhibitory effects of vaspin on bubbling of macrophages THP-1 in vitro
【Abstract】Objective To investigate the effect of vaspin on bubbling of macrophages THP-1 in vitro. Methods Human THP-1 macrophages were induced by phorbol-12-myristate 13-acetate(PMA,100nmol/L) for 48h,then cells were divided into three groups: control group, ox-LDL group(at a final concentration of 50μg/ml for 48h), ox-LDL+vaspin group(vaspin at a final concentration of 100ng/ml, pretreated for 24h). The effect of vaspin on bubbling of THP-1 cells was analyzed by Oil Red 0 staining. The expressions of mRNAs and proteins of ACAT-1,ABCA1 and SR-A1 were detected by real-time PCR and Western blotting, respectively. Results As compared with ox-LDL group, the bubbling level in ox-LDL+vaspin group was decreased significantly. The mRNA and protein expression levels of ACAT-1 and SR-A1 in ox-LDL+vaspin group significantly decreased, while those of ABCA1 mRNA and protein increased significantly(P<0.05). Conclusion Vaspin inhibits the transformation of macrophages to foam cells, thus playing an anti-atherosclerosis role.
【Key words】vaspin; macrophages; foam cells; acy1-coenzyme; ATP binding cassette transporter A1; acyl-coenzyme A: cholesterolacyltrasferase-1(ACAT-1); scavenger receptor-A1(SR-A1)
doi:10.16118/j.1008-0392.2015.03.007
收稿日期:2015-03-17
【中图分类号】R 541.4
【文献标志码】A
【文章编号】1008-0392(2015)03-0031-04