·基础研究·
胆囊结石与胆囊黏膜细胞IL-1β成熟分泌的相关性研究
胡 海1, 黄安华1, 何 敏2, 陈炳官1, 戴亚蕾2
(1. 同济大学附属东方医院微创肝胆外科,上海 200120; 2. 同济大学医学院免疫学教研室,上海 200092)
【摘要】目的 探讨胆囊结石与胆囊组织IL-1 表达及其成熟分泌的相关性。方法 收集胆结石胆囊及其胆汁样本21例,其中胆固醇结石4例、色素结石7例、混合结石10例,采用PCR检测细菌感染情况,ELISA检测胆汁中IL-1
表达及其成熟分泌的相关性。方法 收集胆结石胆囊及其胆汁样本21例,其中胆固醇结石4例、色素结石7例、混合结石10例,采用PCR检测细菌感染情况,ELISA检测胆汁中IL-1 ,蛋白印迹杂交方法检测IL-1
,蛋白印迹杂交方法检测IL-1 蛋白表达,免疫组化检测胆囊黏膜IL-1
蛋白表达,免疫组化检测胆囊黏膜IL-1 表达,并分析临床相关性。结果 在排除伴有细菌感染的情况下,结石患者胆汁IL-1
表达,并分析临床相关性。结果 在排除伴有细菌感染的情况下,结石患者胆汁IL-1 含量在1.93~11.80ng/ml,混合结石组胆汁IL-1
含量在1.93~11.80ng/ml,混合结石组胆汁IL-1 (4.753±2.651)显著高于胆固醇结石组(2.640±0.167)和色素结石组(2.762±1.081)(P<0.05);免疫组化、蛋白印迹杂交检测表明胆囊黏膜pro-IL-1
(4.753±2.651)显著高于胆固醇结石组(2.640±0.167)和色素结石组(2.762±1.081)(P<0.05);免疫组化、蛋白印迹杂交检测表明胆囊黏膜pro-IL-1 、IL-1
、IL-1 高表达,推测是胆汁IL-1
高表达,推测是胆汁IL-1 重要来源之一、并示胆结石患者胆囊黏膜有炎症小体激活。结论 胆结石患者在非细菌感染情况下,胆汁IL-1
重要来源之一、并示胆结石患者胆囊黏膜有炎症小体激活。结论 胆结石患者在非细菌感染情况下,胆汁IL-1 增加可能与胆囊黏膜细胞炎症小体的激活密切相关。
增加可能与胆囊黏膜细胞炎症小体的激活密切相关。
【关键词】胆结石; 白介素-1 ; 炎症小体
; 炎症小体
胆石症发病机制复杂。有大量研究显示胆结石的发生发展与胆道感染密切相关[1]。近30年,随着社会条件的改善、人们生活水平的提高,肠道寄生虫的感染得到很好的控制,胆石症的发病率并没有降低反而呈逐年上升趋势,提示胆结石的发生可能存在非感染因素。前期研究结果显示,胆结石和胆囊息肉患者的胆囊黏膜巨噬细胞吞噬脂质后形成的泡沫细胞显著增加[2],提示巨噬细胞活化在胆结石发生发展中起重要作用。本研究旨在前期研究基础上,进一步探讨诱导巨噬细胞活化的相关因子IL-1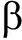 产生与胆石症发生的相关性。
产生与胆石症发生的相关性。
1 材料与方法
1.1 一般资料
收集2014年2月至2014年4月间在同济大学附属东方医院确诊的胆石病并因胆石症行胆囊切除的标本21例,其中男性10例,女性11例,年龄在 18~83岁(53.0±18.9)岁。收集的标本包括结石、胆汁和部分胆囊黏膜组织。
1.2 主要试剂
细菌基因组DNA提取试剂盒和PCR扩增细菌16S rDNA鉴定试剂盒购自宝生物工程有限公司,IL-1β检测试剂盒购自R&D公司,RIPA蛋白裂解液购自碧云天生物技术公司,IL-1β前体抗体购自Santa公司,成熟IL-1β抗体购自Epitomics公司,SABC免疫组化检测试剂盒、DAB显色试剂盒均购自博士德公司。
1.3 标本采集与处理
胆囊从患者体内取出后,立即收集胆汁于无菌的15ml试管中,经14000r/min,离心20min,离心半径12cm后,取上清液分装于2ml eppendorf管中,冻存-80℃冰箱,待后续检测,而胆汁中沉淀物溶于100 l RNase A中,保存-80℃冰箱用于做细菌16S rDNA鉴定。胆结石颗粒收集于50ml试管中,风干后室温干燥保存用于结石性质鉴定。胆石症患者的胆囊黏膜层从胆囊内侧仔细剥离,迅速浸泡于RIPA蛋白裂解液中,-80℃冰箱保存用于组织蛋白提取。还有一部分胆囊组织经生理盐水反复冲洗,切成约1cm2×1cm2×0.5 cm3大小的组织标本后立即浸入中性甲醛液中固定24h,流水洗涤30min,再经75%乙醇、85%乙醇、95%乙醇、100%乙醇脱水,二甲苯透明,随后浸蜡4h后定向包埋,制备厚度为3~5μm的石蜡组织切片用于组织化学染色。
l RNase A中,保存-80℃冰箱用于做细菌16S rDNA鉴定。胆结石颗粒收集于50ml试管中,风干后室温干燥保存用于结石性质鉴定。胆石症患者的胆囊黏膜层从胆囊内侧仔细剥离,迅速浸泡于RIPA蛋白裂解液中,-80℃冰箱保存用于组织蛋白提取。还有一部分胆囊组织经生理盐水反复冲洗,切成约1cm2×1cm2×0.5 cm3大小的组织标本后立即浸入中性甲醛液中固定24h,流水洗涤30min,再经75%乙醇、85%乙醇、95%乙醇、100%乙醇脱水,二甲苯透明,随后浸蜡4h后定向包埋,制备厚度为3~5μm的石蜡组织切片用于组织化学染色。
1.4 胆汁中IL-1β含量测定
采用酶联免疫吸附方法(ELISA)检测胆汁中IL-1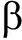 含量。按试剂盒提供的说明书进行。每个样品做3个复孔,根据标准曲线,计算样品中细胞因子IL-1β的浓度。
含量。按试剂盒提供的说明书进行。每个样品做3个复孔,根据标准曲线,计算样品中细胞因子IL-1β的浓度。
1.5 胆汁中细菌16SrDNA鉴定
胆汁细菌感染按细菌基因组DNA试剂盒说明书提取细菌总DNA,DNA经电泳鉴定后行PCR扩增细菌16S rRNA保守片段,其上游引物为5′-GAG CGG ATA ACA ATT TCA CAC AGG-3′,下游引物为5′-CGC CAG GGT TTT CCC AGT CAC GAC -3′,PCR产物长度因菌种不同各有差异,一般为 500bp左右。PCR反应条件为94℃5min;94℃ 1min,50~55℃ 1 min,72℃1.5min,扩增30个循环,72℃ 5min。反应产物使用1%琼脂糖凝胶进行电泳分析,每次实验设有阴性和阳性对照。
1.6 免疫组织化学染色
将石蜡组织切片脱蜡后经3% H2O2灭活内源性酶和热修复抗原后,用5%BSA封闭20min,再滴加一抗4℃湿盒过夜,室温复温1h,PBS清洗后滴加生物素偶联二抗37℃孵化30min,再加SABC 37℃孵育20min,经新鲜配制的DAB显色液显色,在镜下控制显色时间,最后经苏木精轻度复染胞核,梯度乙醇脱水,二甲苯透明,中性树胶封片,风干后在显微镜下观察并照片。
1.7 印迹杂交检测IL-1β蛋白表达
将浸泡于裂解液RIPA中的胆囊黏膜组织通过匀浆后,离心提取总蛋白,于99℃煮10min,使蛋白变性,取适量样品,进行SDS-PAGE电泳。转膜后,用WB封闭液封闭1h,再先后与一抗和二抗孵育,最后滴加显色液,用生物发光成像分析仪检测蛋白条带。
1.8 统计学处理
各组间差异性用χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 临床特征及结石性质
依据患者术前B超检查、术中所见、术后所获取的结石,按胆结石外表性质,将21例患者结石分为3组,其中胆固醇结石组4例,胆色素结石组7例,混合结石组10例。结石性质与患者性别关系见表1。
表1 按结石性质分组情况
Tab.1 Number of cases with different types of gallstone
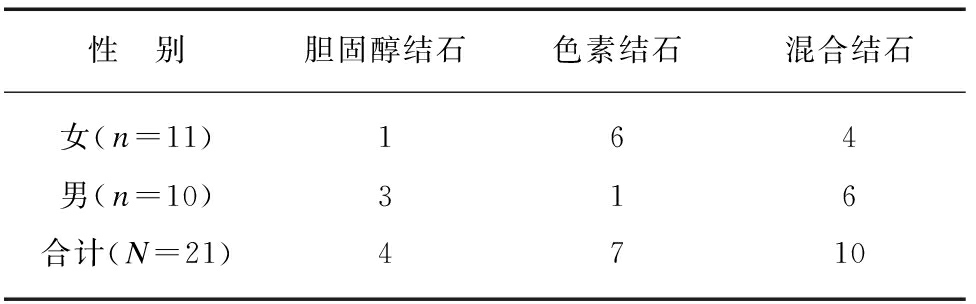
性 别胆固醇结石色素结石混合结石女(n=11)164男(n=10)316合计(N=21)4710
2.2 胆石症患者伴细菌感染情况
21例胆汁样本细菌检测结果显示,仅1例(编号17)伴细菌感染,见图1,该患者为男性色素结石,提示本组胆石症发生多为非感染因素所致。为探讨非细菌感染所致胆石症与炎症相关性,该例未纳入后续研究。
2.3 胆石症患者胆汁IL-1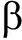
炎症因子如TNF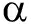 、IL-1
、IL-1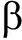 、IL-6等是诱导炎症产生的重要因素。在排除细菌感染因素后,采用ELISA检测了胆汁中IL-1β含量,结果显示结石患者胆汁中IL-1β含量波动在1.93~11.80ng/ml之间(3.78±2.24)ng/ml,表明可能有炎症反应存在;而且混合结石组胆汁IL-1
、IL-6等是诱导炎症产生的重要因素。在排除细菌感染因素后,采用ELISA检测了胆汁中IL-1β含量,结果显示结石患者胆汁中IL-1β含量波动在1.93~11.80ng/ml之间(3.78±2.24)ng/ml,表明可能有炎症反应存在;而且混合结石组胆汁IL-1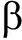 明显高于胆固醇结石组和色素结石组,见表2,提示多因素诱导的结石与炎症因子IL-1
明显高于胆固醇结石组和色素结石组,见表2,提示多因素诱导的结石与炎症因子IL-1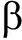 上调密切相关。
上调密切相关。
表2 结石患者胆汁中IL-1β含量变化
Tab.2 IL-1β levels in bile from patients with gallstone (ng·ml-1)
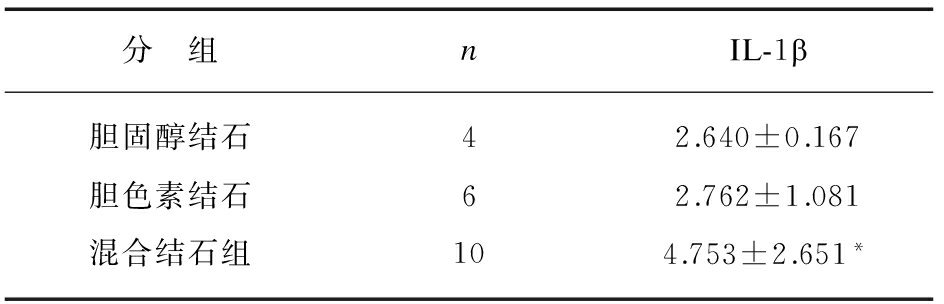
分 组nIL-1b胆固醇结石42.640±0.167胆色素结石62.762±1.081混合结石组104.753±2.651*
P=0.041,vs.胆固醇结石组
2.4 胆石症患者胆囊上皮组织IL-1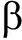 表达
表达
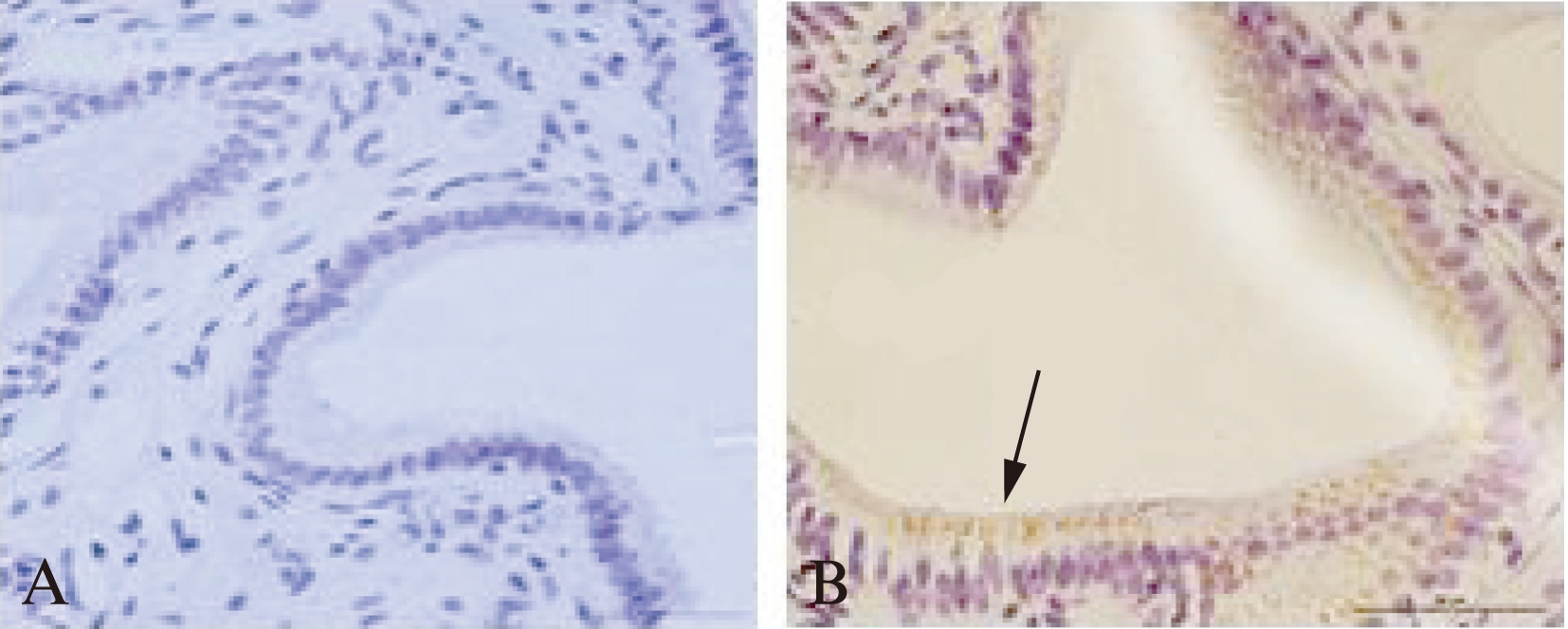
在正常情况下人体组织[3]和小鼠胆囊上皮细胞[4]不表达或极少量表达IL-1β。本实验在无细菌感染情况下,胆石症患者胆汁中均检测到不同浓度IL-1β,见表2,推测其来源可能与胆囊黏膜合成分泌有关。为证实胆囊黏膜上皮细胞参与IL-1β合成分泌,应用免疫组化检测了20例胆囊组织IL-1β表达,结果显示所有胆囊上皮细胞均有IL-1β表达,并呈颗粒聚集现象,偏向分布于胆囊上皮细胞顶侧,见图2,提示胆囊上皮细胞内有IL-1β蛋白合成。
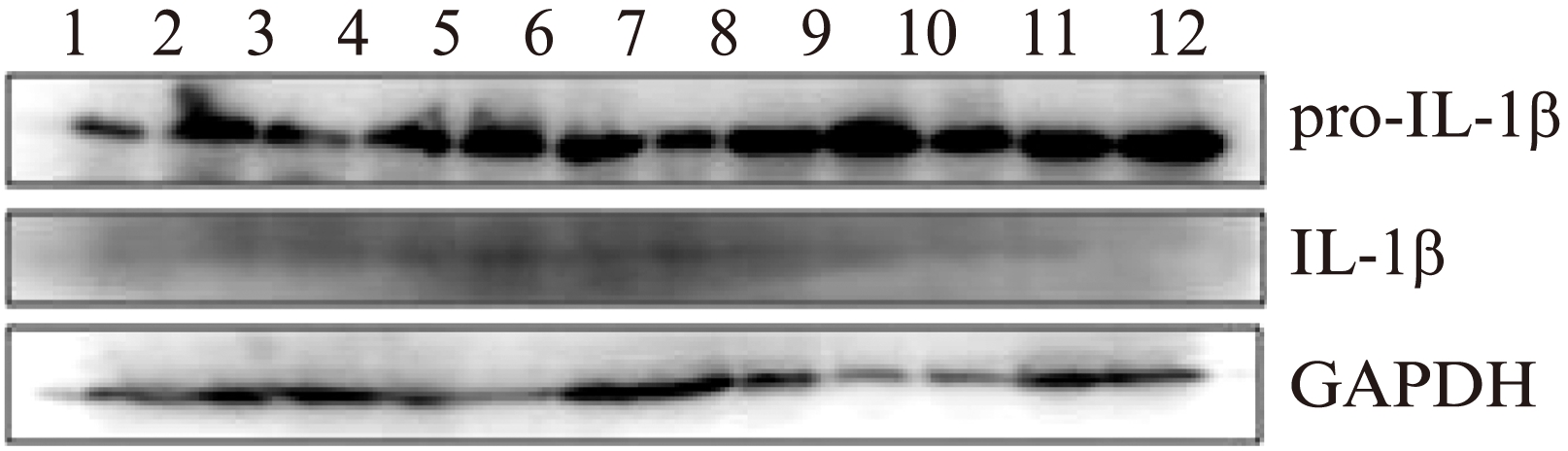
为进一步证实胆囊黏膜上皮细胞是胆汁中IL-1β重要来源,本实验应用Western blotting检测了其中12个样本的胆囊黏膜IL-1β前体及成熟IL-1β蛋白表达。结果如图3所示,每个样本均见IL-1β前体条带;成熟IL-1β条带虽不明显但也隐约可见,这是因为成熟的IL-1β从上皮细胞分泌到细胞外进入胆汁中而组织中能检到的IL-1β量很少。证实了胆石症患者胆囊黏膜上皮细胞已被诱导活化、合成分泌IL-1β。
3 讨 论
有关炎症在胆石症发病中的作用研究已有几十年,但两者因果关系并不清楚。目前对胆石症的研究大多集中在肝脏脂质代谢异常方面,忽略了胆囊本身的局部作用。某些情况下,胆汁中胆固醇持续过饱和但并未形成胆石。可见过饱和胆固醇是形成结石的必要条件但并非充分条件,而胆囊中某种因素则是促成胆石症的重要原因。早年认为胆道伴细菌或寄生虫感染是胆结石发病的主要诱因,但近年随着生活水平的提高,胆石症发病率仍逐年增高,提示可能存在非感染性因素。本文对临床非细菌感染样本进行分析,结果促炎因子IL-1β在胆结石患者胆囊上皮细胞中合成显著增加,提示IL-1β可能是诱发胆囊炎症发生的重要启动因素。
IL-1β是IL-1家族中一种重要的促炎因子,在免疫应答和炎症反应中扮演重要角色。IL-1β成熟分泌是炎症的标志性事件,与很多疾病的发生密切相关。动脉粥样硬化早期IL-1β能减少脂质转运体ABCA1和ABCG1表达,增强胞内脂质存留,从而促进巨噬细胞泡沫化[5-6],影响脂蛋白代谢和血管壁功能[7]。本课题组前期研究表明,胆固醇结石和胆固醇息肉患者的胆囊黏膜中存在大量泡沫细胞,推测已被诱导活化的巨噬细胞分泌炎症因子,从而诱发了炎症[2]。已知在正常情况下,人体组织[3]和小鼠胆囊上皮细胞[4]不表达或极少量表达IL-1β。本组胆结石患者不但胆囊黏膜中高表达IL-1β,胆汁中亦检测到IL-1β存在,提示胆结石患者胆囊黏膜已启动炎症反应。
已有研究表明,IL-1β成熟分泌依赖于一个多蛋白复合平台即炎症小体的激活。目前报道,有4种炎症小体激活平台如NPRP1、NLRP3、IPAF和AIM-2。这些炎症小体能通过识别细菌或病毒的不同结构而被激活。但NLRP3的激活除细菌、病毒外[8],还能被体内自身产生的“危险信号”激活,这些“危险信号”包括ATP[9]、尿酸盐[10]、葡萄糖[11]、β淀粉样蛋白[12]、氧化型低密度脂蛋白[13]等;另外,铝佐剂[14]、硅石、木棉[15]、胆固醇结晶[16]等晶体分子也能引起NLRP3激活。本实验推测,胆汁胆固醇相对饱和对胆囊上皮细胞的作用可能是导致炎症小体活化的重要因素;IL-1β成熟分泌增加并引起胆汁IL-1β上调,提示胆囊黏膜内已有炎症小体处于激活状态。
本实验结果显示,非细菌性炎症反应在胆石症发生中起重要作用;IL-1β产生是促进胆囊炎症反应的关键分子,胆囊上皮细胞可能是胆汁IL-1β的重要来源之一。以上结果为进一步揭示胆囊非细菌性炎症的发生提供了有力的证据。
【参考文献】
[1] 徐侠,宫爱霞,方立峰.胆石病的成因及发病机制研究进展[J].现代实用医学,2012,24: 477-480.
[2] 何敏,黄安华,周智辉,等.泡沫细胞形成与胆固醇结石及胆囊息肉形成的相关性研究[J].同济大学学报: 医学版,2014,35(3): 5-9.
[3] Gómez-V zquez ME, Hern
zquez ME, Hern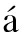 ndez-Salazar E, Novelo-Ota
ndez-Salazar E, Novelo-Ota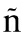 ez JD, et al. Effect of endovenous morphine vs. ketorolac on proinflammatory cytokines during postoperative analgesia in laparoscopic cholecystectomy [J]. Cir Cir, 2012,80(1): 56-62.
ez JD, et al. Effect of endovenous morphine vs. ketorolac on proinflammatory cytokines during postoperative analgesia in laparoscopic cholecystectomy [J]. Cir Cir, 2012,80(1): 56-62.
[4] Savard CE, Blinman TA, Choi HS, et al.Expression of cytokine and chemokine mRNA and secretion of tumor necrosis factor-alpha by gallbladder epithelial cells: response to bacterial lipopolysaccharides[J]. BMC Gastroenterol, 2002,2: 23.
[5] Persson J, Nilsson J, Lindholm MW. Interlukin-1 beta and tumor necrosis factor-alpha impede neutral lipid turnover in macrophage-derived foam cells [J]. BMC Immunol, 2008,9: 70.
[6] Chen M, Li W, Wang N, et al. ROS and NF-kappaB but not LXR mediate IL-1beta signaling for the downregulation of ATP-binding cassette transporter A1[J]. Am J Physiol Cell Physiol, 2007,292(4): C1493-1501.
[7] Hansson GK, Libby P. The immune response in artherosclerosis: a double-edged sword [J]. Nat Rev Immunol, 2006,6(7): 508-519.
[8] Kanneganti TD, Ozoren N, Body-Malapel M, et al.Bacterial RNA and small antiviral compounds activate caspase-1 through cryopyrin/Nalp3[J]. Nature, 2006,440(7081): 233-236.
[9] Mariathasan S, Weiss DS, Newton K, et al. Cryopyrin activates the inflammasome in response to toxins and ATP[J]. Nature, 2006,440(7081): 228- 232.
[10] Martinon F, Petrilli V, Mayor A, et al. Gout associated uric acid crystals activate the NALP3 inflammasome[J]. Nature, 2006,440(7081): 237- 241.
[11] Zhou R, Tardivel A, Thorens B, et al.Thioredoxin-interacting protein links oxidative stress to inflammasome activat ion[J]. Nat Immunol, 2010,11(2): 136-140.
[12] Halle A, Hornung V, Petzold GC, et al. The NALP3 inflammasome is involved in the innate immune response to amyloid-beta[J]. Nat Immunol, 2008,9(8): 857-865.
[13] Weiwei Liu, Yanlin Yin, Zihui Zhou, et al. OxLDL-induced IL-1beta secretion promoting foam cells formation was mainly via CD36 mediated ROS production leading to NLRP3 inflammasome activation[J]. Inflammation Research, 2014,63(1): 33-43.
[14] Eisenbarth SC, Colegio OR, O’Connor W, et al . Crucial role f or the Nalp3 inflammasome in the immune-stimulatory properties of aluminium adjuvants[J]. Nature, 2008,453(7198): 1122-1126.
[15] Dostert C, Petrilli V, Van Bruggen R, et al. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica[J]. Science, 2008,320(5876): 674-677.
[16] Mayor A, Mart inon F, De Smedt T, et al. A crucial function of SGT1 and HSP90 in inflammasome activity links mammalian and plant innate immune responses[J]. Nat Immunol, 2007,8(5): 497-503.
Associated of IL-1β expression in gallbladder mucosawith cholecystolithiasis
HU Hai1, HUANG An-hua1, HE Min2, CHEN Bing-guan1, DAI Ya-lei2
(1. Dept. of Mini-invasive Surgery, East Hospital, Tongji University, Shanghai 200120, China;2. Dept. of Immunology, Medical College, Tongji University, Shanghai 200092, China)
【Abstract】Objective To investigate relations between IL-1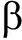 expression in gallbladder mucosa and cholecystolithiasis. Methods The gallbladder and gallstone samples were collected from 21 patients undergoing cholecystectomy, including 4 cases with cholesterol gallstone, 7 cases with pigment gallstone and 10 cases with combined gallstone. Bacterial infection in the bile samples was detected by PCR. The levels of IL-1
expression in gallbladder mucosa and cholecystolithiasis. Methods The gallbladder and gallstone samples were collected from 21 patients undergoing cholecystectomy, including 4 cases with cholesterol gallstone, 7 cases with pigment gallstone and 10 cases with combined gallstone. Bacterial infection in the bile samples was detected by PCR. The levels of IL-1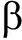 in bile samples were measured by ELISA. IL-1
in bile samples were measured by ELISA. IL-1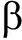 expression in the gallbladder mucosa was detected by Western blotting and Immunohistochemistry. Results The levels of IL-1
expression in the gallbladder mucosa was detected by Western blotting and Immunohistochemistry. Results The levels of IL-1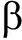 in the bile without bacterial infection were ranging from 1.93 to 11.80ng/ml. The IL-1
in the bile without bacterial infection were ranging from 1.93 to 11.80ng/ml. The IL-1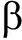 level in combined gallstone group(4.753±2.651) was significantly higher than that in cholesterol gallstone group(2.640±0.167) and pigment gallstone group(2.762±1.081) (P<0.05). Furthermore, high expression levels of pro-IL-1
level in combined gallstone group(4.753±2.651) was significantly higher than that in cholesterol gallstone group(2.640±0.167) and pigment gallstone group(2.762±1.081) (P<0.05). Furthermore, high expression levels of pro-IL-1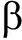 and IL-1
and IL-1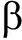 in gallbladder mucosa were detected. Conclusion In the cases without bacterial infection, elevated IL-1
in gallbladder mucosa were detected. Conclusion In the cases without bacterial infection, elevated IL-1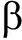 in bile with cholecystolithiasis may be associated with inflammsome activation in gallbladder mucosa.
in bile with cholecystolithiasis may be associated with inflammsome activation in gallbladder mucosa.
【Key words】cholecystolithiasis; IL-1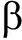 ; inflammasome
; inflammasome
doi:10.16118/j.1008-0392.2015.03.003
收稿日期:2015-04-10
基金项目:国家教育部博士点基金(20130072110023);浦东新区科委创新基金(PKJ2012-Y61)
作者简介:胡 海(1968—),男,主任医师,博士.E-mail: huhailc@sina.com
通信作者:戴亚蕾.E-mail: daiyl@tongji.edu.cn
【中图分类号】R 575.6
【文献标志码】A
【文章编号】1008-0392(2015)03-0010-05
 表达及其成熟分泌的相关性。方法 收集胆结石胆囊及其胆汁样本21例,其中胆固醇结石4例、色素结石7例、混合结石10例,采用PCR检测细菌感染情况,ELISA检测胆汁中IL-1
表达及其成熟分泌的相关性。方法 收集胆结石胆囊及其胆汁样本21例,其中胆固醇结石4例、色素结石7例、混合结石10例,采用PCR检测细菌感染情况,ELISA检测胆汁中IL-1 ,蛋白印迹杂交方法检测IL-1
,蛋白印迹杂交方法检测IL-1 蛋白表达,免疫组化检测胆囊黏膜IL-1
蛋白表达,免疫组化检测胆囊黏膜IL-1 表达,并分析临床相关性。结果 在排除伴有细菌感染的情况下,结石患者胆汁IL-1
表达,并分析临床相关性。结果 在排除伴有细菌感染的情况下,结石患者胆汁IL-1 含量在1.93~11.80ng/ml,混合结石组胆汁IL-1
含量在1.93~11.80ng/ml,混合结石组胆汁IL-1 (4.753±2.651)显著高于胆固醇结石组(2.640±0.167)和色素结石组(2.762±1.081)(P<0.05);免疫组化、蛋白印迹杂交检测表明胆囊黏膜pro-IL-1
(4.753±2.651)显著高于胆固醇结石组(2.640±0.167)和色素结石组(2.762±1.081)(P<0.05);免疫组化、蛋白印迹杂交检测表明胆囊黏膜pro-IL-1 、IL-1
、IL-1 高表达,推测是胆汁IL-1
高表达,推测是胆汁IL-1 重要来源之一、并示胆结石患者胆囊黏膜有炎症小体激活。结论 胆结石患者在非细菌感染情况下,胆汁IL-1
重要来源之一、并示胆结石患者胆囊黏膜有炎症小体激活。结论 胆结石患者在非细菌感染情况下,胆汁IL-1 增加可能与胆囊黏膜细胞炎症小体的激活密切相关。
增加可能与胆囊黏膜细胞炎症小体的激活密切相关。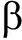 产生与胆石症发生的相关性。
产生与胆石症发生的相关性。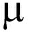 l RNase A中,保存-80℃冰箱用于做细菌16S rDNA鉴定。胆结石颗粒收集于50ml试管中,风干后室温干燥保存用于结石性质鉴定。胆石症患者的胆囊黏膜层从胆囊内侧仔细剥离,迅速浸泡于RIPA蛋白裂解液中,-80℃冰箱保存用于组织蛋白提取。还有一部分胆囊组织经生理盐水反复冲洗,切成约1cm
l RNase A中,保存-80℃冰箱用于做细菌16S rDNA鉴定。胆结石颗粒收集于50ml试管中,风干后室温干燥保存用于结石性质鉴定。胆石症患者的胆囊黏膜层从胆囊内侧仔细剥离,迅速浸泡于RIPA蛋白裂解液中,-80℃冰箱保存用于组织蛋白提取。还有一部分胆囊组织经生理盐水反复冲洗,切成约1cm

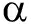 、IL-1
、IL-1
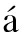 zquez ME, Hern
zquez ME, Hern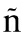 ez JD, et al. Effect of endovenous morphine vs. ketorolac on proinflammatory cytokines during postoperative analgesia in laparoscopic cholecystectomy [J]. Cir Cir, 2012,80(1): 56-62.
ez JD, et al. Effect of endovenous morphine vs. ketorolac on proinflammatory cytokines during postoperative analgesia in laparoscopic cholecystectomy [J]. Cir Cir, 2012,80(1): 56-62.