·基础研究·
【摘要】目的 比较体表渗透法、电穿孔法、脂质体转染试剂LipofectamineTM2000以及纳米材料聚乙烯亚胺(PEI)4种不同的方法用于日本血吸虫机械脱尾童虫体外转染siRNA的转染效率,以期筛选理想的转染方法。 方法 选用携带有红色荧光标记的化学合成siRNA,并且据根不同转染方法说明步骤优化体外转染条件,分别转染日本血吸虫机械脱尾童虫。在一定的时间内利用荧光显微镜观察虫体转染情况并计阳性虫数,并应用反转录聚合酶链反应(RT-PCR)技术检测转入靶基因的mRNA表达情况。结果 经过体外转染条件的优化,电穿孔和纳米材料介导的siRNA转染效率达到了90%以上。应用RT-PCR验证,4种方法中,电穿孔转染法和纳米材料转染的siRNA对靶基因有显著的抑制效应(P<0.05),电穿孔法转染抑制率达(45±9.63)%,纳米材料转染抑制率达(37±6.17)%。结论 除了常规的电穿孔法,纳米材料作为新型的转染载体,能够有效地传递siRNA进入血吸虫童虫体内,干扰目的基因的表达,这将为日本血吸虫功能基因学的研究提供高效的转染工具。
【关键词】日本血吸虫; 机械脱尾童虫; siRNA; 转染效率
血吸虫病(Schistosomiasis)是由于血吸虫寄生于人体引起的热带病,这是严重危害人类健康的寄生虫病之一。它主要流行于全球75个国家和地区,分布在亚洲、非洲和拉丁美洲。据统计,目前全球仍约有2.5亿人和大量的家畜感染血吸虫病[1]。其中危害最为严重的血吸虫包括日本血吸虫、曼氏血吸虫和埃及血吸虫,在我国流行的为日本血吸虫(Schistosoma japonicum)。血吸虫具有复杂的生活史,其基因表达具有期特异性,以适应其复杂的生长时期转换和宿主转换;然而,血吸虫生长发育及其期特异基因表达的调控机制尚不清楚。近年来,RNA干扰(RNAi)已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的治疗领域[2]。一些功能基因,在活体动物实验验证其功能之前,首先要在体外个体水平上进行功能性研究,这就需要将功能siRNA导入目的活体。常用的转染方法有浸泡法、慢病毒法、电穿孔法、脂质体法等[3]。浸泡法需要高剂量siRNA试剂,成本比较高。病毒转染,虽适用于大多数细胞类型,但该方法对操作的安全性要求较高,且质粒构建及病毒的包装、收集和浓缩等过程比较繁琐。物理介导方法中最常用的是电穿孔法,该方法适用范围比较广,需要特殊的电转仪器,但造成的细胞机械损伤很高,不同的细胞类型转染所需要的电转参数也不同[4]。商品化的脂质体转染试剂用于细胞系的转染效果比较好,但在血吸虫的虫体中转染效率比较低。因此,选取转染效率高、细胞毒性小、操作简便的转染试剂,对于血吸虫的基因功能研究至关重要。本实验将新型纳米材料-阳离子聚合物聚乙烯亚胺(polyethyl-enimine,PEI)介导siRNA转染技术引入到日本血吸虫机械脱尾童虫的转染中,为建立高效、方便的血吸虫转染方法打下了基础,进而为血吸虫的功能基因学研究提供有效的分析工具。
1.1 虫株
日本血吸虫(中国大陆株)尾蚴由中国疾病预防控制中心寄生虫病预防控制所钉螺室提供。
1.2 主要试剂与仪器
根据Basch的配方[5]制备M169培养基,高压过滤器过滤,-20℃保存备用;胎牛血清购自Gibco公司,用时按照10%添加;胆固醇及荧光标记siRNA及阴性对照小RNA购自广州锐博生物公司;阳离子脂质体lipofectamineTM2000(Lipo2000);聚乙烯亚胺(PEI)[6]由同济大学纳米学院林超教授课题组制备,去离子蒸馏水稀释至1mg/ml的工作液;Genepluser XceU电转仪(Bio-Rad);倒置荧光显微镜(Nikon公司)。
1.3 机械童虫培养
由钉螺室提供的新鲜尾蚴,经贴片法收集尾蚴,置4℃备用。根据John等[1]的机械转变方法处理收集好的尾蚴。尾蚴经机械断尾方法转变为机械童虫(Schistosomula)[7],在37℃培养箱内孵育3h,即可用于转染,完成转染后的机械童虫转移至6孔板中,置2ml的M169培养液中体外继续培养,每孔约1000条童虫,加入100U/ml抗生素(青霉素/链霉素),转染前2d无血清培养(37℃、5%CO2培养箱);每隔1d进行半量更新培养液,置换培养基前,将新鲜培养基置CO2培养箱内预温 0.5h。
1.4 转染方法
1.4.1 体表渗透法 转染前,将机械童虫以500条/孔接种于24孔板中,添加无血清新鲜的M169培养基496μl,向培养孔中缓慢加入4μl(8μg)siRNA试剂,缓缓晃动培养板使其均匀,并加入100U双抗生素(青霉素/链霉素,另设未加siRNA的空白组和加入无关的siRNA作为对照组。继续在5%CO2、37℃培养箱中培养12h,后用倒置相差荧光显微镜观察细胞转染率。24h后半量更换新鲜培养液,48h后收集虫体做后续验证。
1.4.2 脂质体lipo2000转染 转染前将机械童虫以500条/孔接种24孔板中,添加无血清新鲜的M169培养基450μl,取EP管分装30μl的培养基,分别加入8μl LipofectamineTM2000转染试剂,逐滴缓慢加入4μl(8μg) siRNA试剂(实验组,阴性对照组),充分混匀,室温静置20min,使其形成转染复合物。将50μl转染复合物缓慢逐滴加入培养孔中,并加入100U双抗生素(青霉素/链霉素),另设空白对照一组。继续在5%CO2、37℃培养箱中培养12h,后用倒置相差荧光显微镜观察细胞转染率。24h后半量更换新鲜培养液,48h后收集虫体做后续验证。
1.4.3 电穿孔转染法 根据机械童虫操作方法,将收集到的尾蚴断尾处理成为童虫,培养基清洗童虫重复3次,离心半径10cm,3000r/min,离心3min,去尽培养基,加入预热好的200μl M169培养基,轻柔地吹打均匀,分别吸取50μl液体至准备好的无菌4mm的电击杯中,缓慢逐滴加入4μl(8μg)siRNA,另设阴性对照siRNA组和空白对照组,电穿孔的参数设置为: 电压125V,时间20ms,方波电击一次;电穿孔后,将电击杯内虫体溶液以1000条/孔接种于24孔板中,添加无血清新鲜的M169培养基450μl,并加入100U双抗生素(青霉素/链霉素),继续在5%CO2、37℃培养箱中培养12h,后用倒置相差荧光显微镜观察细胞转染率。24h后半量更换新鲜培养液,48h后收集虫体做后续验证。
1.4.4 纳米材料聚乙烯亚胺(PEI)转染法 转染前,将机械童虫以500条/孔接种24孔板中,添加无血清新鲜的M169培养基450μl,取EP管分装30μl的培养基,按照N/P(Nitrogen/Phosphate,载体氨基氮/DNA磷酸基)为1/15,逐滴缓慢加入,使其充分混匀,室温静置15min,制备成转染复合物(实验组,阴性对照组),另设2孔未加纳米材料的空白组做对照。将50μl转染复合物缓慢逐滴加入培养孔中,并加入100U/ml双抗生素(青霉素/链霉素)。继续在5%CO2、37℃培养箱中培养12h,后用倒置相差荧光显微镜观察细胞转染率。24h后半量更换新鲜培养液,48h后收集虫体做后续验证。
1.5 转染效率的测定
4种不同的方法转染日本血吸虫机械童12h后,新鲜培养基清洗虫体3次,然后用荧光显微镜观察各孔荧光标记的阳性虫体数量,每孔随机观察3个视野,计数发红色荧光的虫体占全部虫体的百分率即为转染效率,计算各种方法在相同条件下的平均转染率。转染效率的计算方法如下: 转染效率=发荧光的虫体/相同视野下的虫体数量×100%。
1.6 实时定量PCR检测靶基因表达情况
将各转染48h后的虫体收集在1.5ml的EP管中。离心半径10cm,3000r/min,离心5min,弃培养基,用0.1%PBS洗涤虫体2次后,每管加入200μl TRIZOL试剂(Invitrogen),根据TRIZOL操作说明抽提总RNA。纯化后的RNA按照MV-MLV(TAKARA) RT-PCRSystem反应体系要求,进行反转录反应。反应完成后的cDNA样品保存于-20℃备用。根据目的靶基因(未发表)设计引物,通过Real-Time PCR验证转染的siRNA对其靶基因的抑制效果。
1.7 统计学处理
应用SPSS 11.0软件进行统计分析,计量资料采用![]() 表示,数据比较采用单因素方差分析,组间两两比较采用Q检验。以P<0.05为差异有统计学意义。
表示,数据比较采用单因素方差分析,组间两两比较采用Q检验。以P<0.05为差异有统计学意义。
2.1 转染效率比较
将日本血吸虫机械童虫转染24h后在相差荧光显微镜4倍放大下观察,图1为显微镜下拍摄的转染后的虫体,带有红色荧光的表示转染成功的虫体。空白对照组孔在荧光相差显微镜下未见有红色荧光。
在同一培养孔中,计算三个不同视野下的阳性虫体个数,计算转染效率。4种不同方法的转染效率分别为: 浸泡法27%,lipo2000 30.6%,电穿孔91%,纳米材料PEI 89%,见图2。实验结果表明: 浸泡法和脂质体lipo2000转染效率较低,电穿孔法和纳米材料具有相对较高的转染效率。
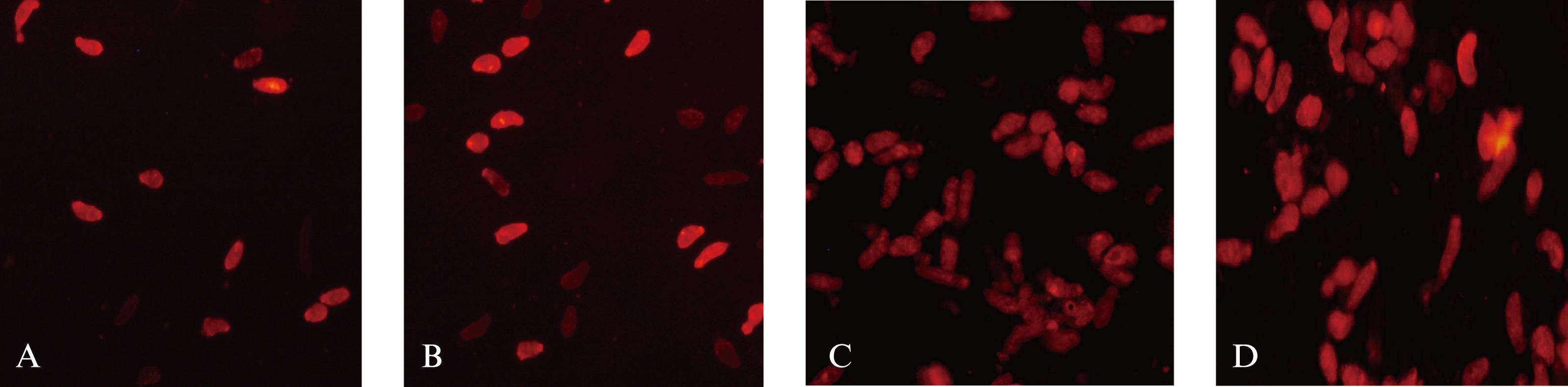
图1 4种方法转染日本血吸虫机械童虫siRNA 12h倒置相差显微镜下的照片(×4)
Fig.1 Inverted fluorescence microscopic views of mechanical schistosomula 12h after siRNA transfection by 4 different methods(×4)
A: 体表渗透法转染siRNA 12h后;B: lipo2000转染siRNA 12h后;C: 点穿孔法转染siRNA 12h后;D: PEI转染siRNA 12h后
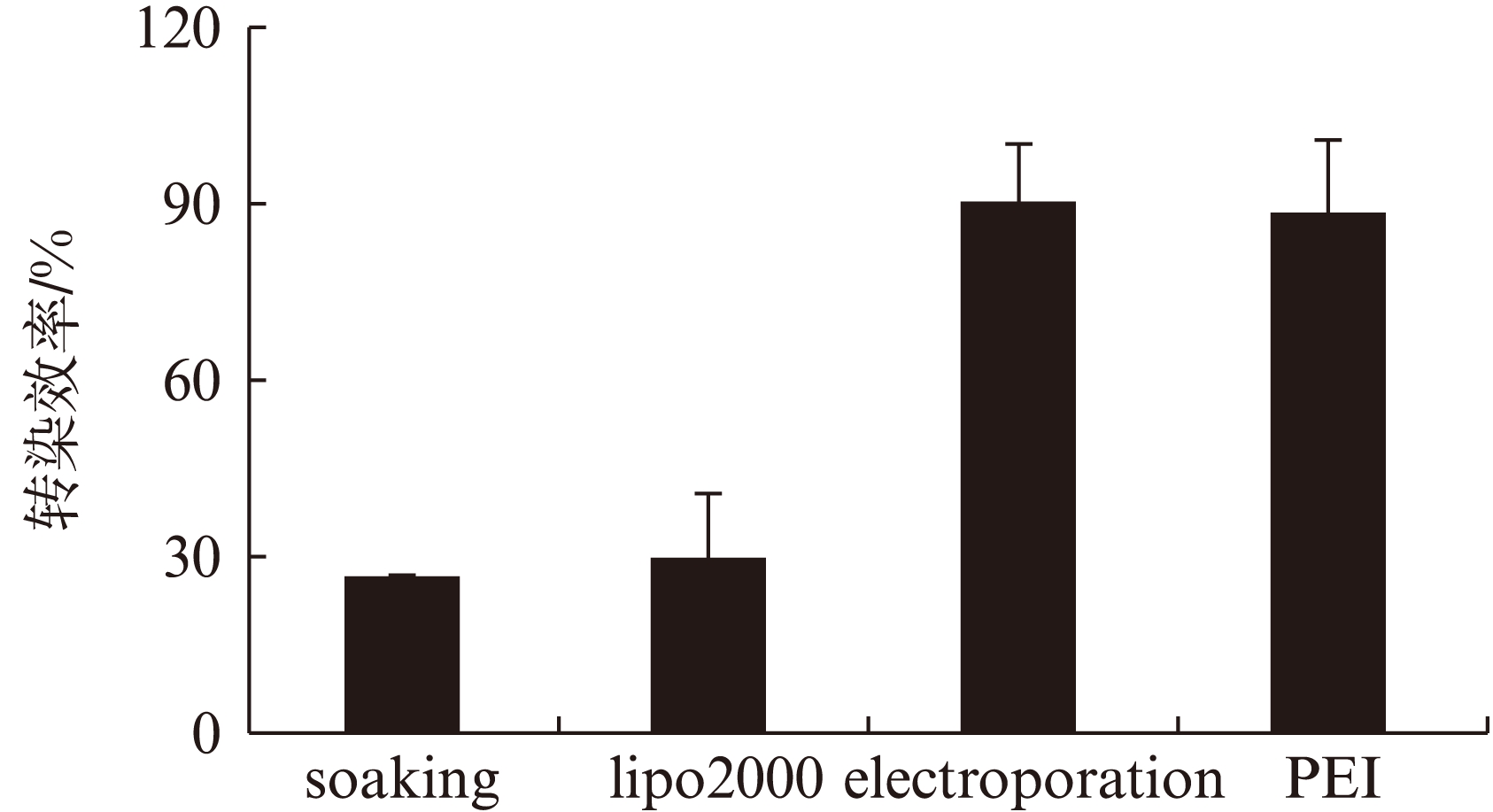
图2 4种方法转染siRNA后12h的转染效率
Fig.2 Transfection efficiency by four methods 12h after transfection
2.2 转染siRNA后对靶基因mRNA的抑制
转染siRNA 48h后,收集虫体,0.05% PBS溶液洗涤3次,TRIZOL法抽提总RNA,随后反转录为cDNA。实时荧光定量Real-Time PCR,检测siRNA对应的血吸虫内源性基因mRNA的表达情况,内参基因选取日本血吸虫GAPDH的表达量做为参照,实验组相对于阴性对照(NC)组对靶基因的表达有明显抑制效应的是电穿孔转染法和纳米材料PEI转染法。实验结果显示电穿孔法实验组相对于阴性对照组抑制率为(45±9.63)%(P=0.008),纳米材料PEI转染法的实验组抑制率达到(37±6.17)%(P=0.006)。结果见图3。
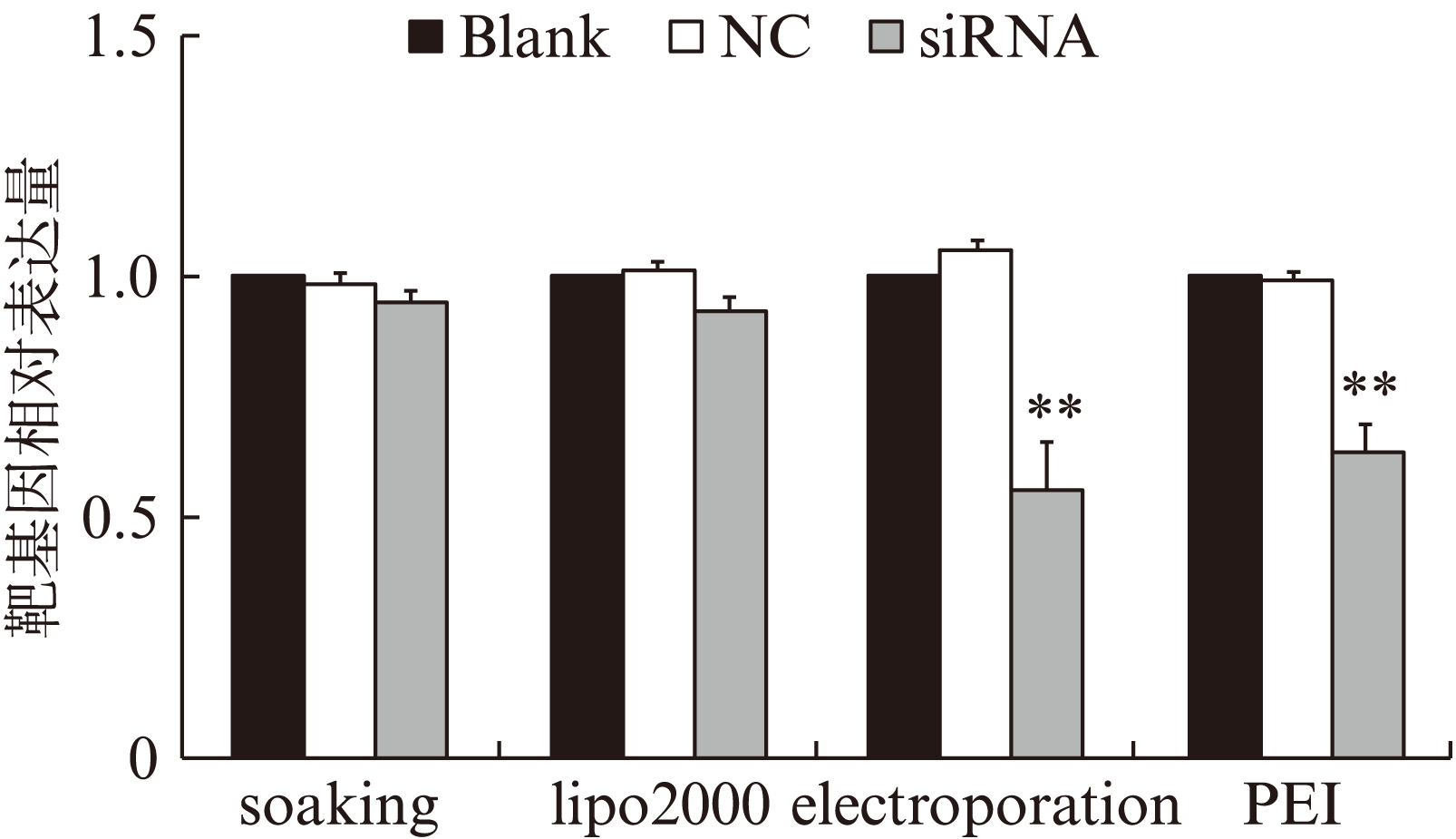
图3 RT-PCR检测靶基因的相对表达量
Fig.3 The relative expression of target gene detected by RT-PCR
目前,RNA干扰技术已成为生物学功能研究中的常规工具,探索一种最佳的转染方法是关键的一个环节[8]。本研究以日本血吸虫机械童虫为研究对象,对比研究了4种转染方法在日本血吸虫机械童虫中的转染效率和效果,主要参考了国内学者程国峰等[9]运用化学合成日本血吸虫抱雌沟蛋白的siRNA分子后,通过体表渗透法成功地沉默了抱雌沟蛋白的表达,并表明此干扰特征是剂量依赖型的。我们的研究也表明,虽然体表渗透法对血吸虫没有任何损伤和毒性,但大剂量的加入siRNA的成本是比较高的,且转染效率相对较低。Skelly等[10]为了进一步提高siRNA干扰效果,以曼氏血吸虫组织蛋白酶B1为目的靶基因,比较了体表渗透法和电穿孔转染法,以探索最优的曼氏血吸虫siRNA干扰条件,验证表明电穿孔法比体表渗透法能更好地导入siRNA分子,基因沉默效果相对更优。本研究的电穿孔法所设置的参数参照的是曼氏血吸虫电转染条件[11],结果表明电穿孔法转染效率相对较高,可达到90%,但此法对虫体不可避免地造成了机械损伤。另外,对比了脂质体转染法和新型纳米材料试剂转染法,结果表明,脂质体试剂在血吸虫中的转染效率和效果并不理想,很有可能是血吸虫的生理屏障阻碍了脂质体大分子的融入。纳米材料在优化的浓度下,转染效率相对较高,但在高剂量情况下,对虫体有一定的毒性,所以需要优化一个合适的转染剂量,以期在减少毒性的前提下,提高转染效率。
影响转染效率的因素很多,包括物种类别、转染时间、siRNA的稳定性、转染试剂与siRNA的比例等。日本血吸虫的生理结构决定了其转染的困难和限制,至今没有稳定的细胞系可供体外研究,机械童虫为体外转染提供了一个相对稳定的平台,血吸虫的韧密的体被是阻止大分子和带电荷分子进入体内的最大屏障。实验室对14d童虫也做过体外的对比转染,结果显示,转染效率比机械童虫低很多,最高只能达到20%,这很大可能与血吸虫逐渐增厚的体被有关,也有可能是通过物理操作制备的机械童虫有局部损伤,siRNA更容易被转入体内。PEI与siRNA的质量比为10∶1~15∶1时,可以达到相对高效低毒,转染后3h就可弃去转染液更换培养液,不会影响转染效率。日本血吸虫的转染时间适宜于48h后检测,更长时间的转染如果不进行二次转染,对血吸虫的转染效果并不一定会增强,反而可能因为体内某些基因的代偿作用而有所减弱。
【参考文献】
[1] 蔡兴雁,李静惠,施文钧,等.日本血吸虫虫卵特异性蛋白的基因克隆及多态性分析[J].同济大学学报: 医学版,2010,31(1): 17-22.
[2] 罗荣,赵江平,胡超,等.干扰日本血吸虫凋亡抑制因子最佳siRNA分子的筛选[J].中国人兽共患病学报,2013,29(9): 846-849.
[3] Pedersen CD, Fang JJ, Pedersen AE. A comparative study of transfection methods for RNA interference in Bone marrow-derived murine dendritic cells[J]. Scandinavian Journal of Immunology, 2009,70(5): 447-456.
[4] Krautz-Peterson G, Radwanska M, Ndegwa D, et al. Optimizing gene suppression in schistosomes using RNA interference[J]. Mol Biochem Parasitol, 2007,153(2): 194-202.
[5] 汪章勋,赵静,邹膺,等.用于遗传操作的日本血吸虫童虫体外培养方法的研究[J].中国热带医学,2012,12(2): 171-173.
[6] Xia W, Wang P, Lin C, et al. Bioreducible polyethylenimine-delivered siRNA targeting human telomerase reverse transcriptase inhibits HepG2 cell growth in vitro and in vivo[J]. J Control Release, 2012,157(3): 427-436.
[7] Milligan JN, Jolly ER. Cercarial transformation and in vitro cultivation of Schistosoma mansoni schistosomules[J]. J Visualized Exp, 2011(54)2011,16(54): 3191.
[8] Ruedel A, Bosserhoff AK. Transfection Methods. Laboratory methods in cell biology[J]. Biochem Cell Culture, 2012,112: 163-182.
[9] Cheng G, Fu Z, Lin J, et al. In vitro and in vivo evaluation of small interference RNA-mediated gynaecophoral canal protein silencing in Schistosoma japonicum[J]. J Gene Med, 2009,11(5): 412- 421.
[10] Skelly PJ, Dadara A, Harn DA. Suppression of cathepsin b expression in Schistosoma mansoni by RNA interference[J]. Inter J Parasitol, 2003,33(4): 363-369.
[11] Ndegwa D, Krautz-peterson G, Skelly PJ. Protocols for gene silencing in schistosomes [J]. Exp Parasitol, 2007,117: 284-291.
Efficiency of siRNA transfection into Schistosoma japonicumschistosomula in vitro with different methods
【Abstract】Objective To compare the efficiency of siRNA transfection toschistosoma japonicum schistosomula in vitro by different methods. Four methods are soaking, electroporation, liposome transfection reagents(LipofectamineTM2000) and nano-materials polyethyleneimine(PEI). Methods “Mechanical schistosomula”were prepared by mechanical transformation of Schistosoma japonicum cercaria. Chemical-synthesized siRNA with red fluorescent tags was transfected to mechanical-transformed shistosomula by 4 different methods: soaking, electroporation, LipofctamineTM2000 and nano-polyethyleneimine(nano-PEI), respectively. The transfection efficiency was observed by fluorescence microscope, the mRNA expression of target genes was detected by reverse transcription polymerase chain reaction(RT-PCR). Results The transfection efficiency was more than 90% mediated by electroporation and nano-PEI under optimal transfection conditions in vitro. Target genes had a significant inhibitory effect (P<0.05) with a inhibited rate of (45±9.63)% for electroporation and(37±6.17)% for nano-PEI. Conclusion In addition to the commonly used electroporation, nano-PEI as a new type of transfection vector can effectively transfect the target gene in mechanical-transformed shistosomula of Schistosoma japonicum.
【Key words】Schistosoma japonicum; mechanical schistosoma; siRNA; transfection efficiency
doi:10.16118/j.1008-0392.2015.03.001
收稿日期:2014-12-23
基金项目:国家“973”重点基础研究发展计划(2007CB513100)
【中图分类号】R 73
【文献标志码】A
【文章编号】1008-0392(2015)03-0001-05