
图1 文献检索过程及要求
Fig.1 Literature retrieval process and requirements
·临床研究·
【摘要】目的 探讨促红细胞生成素(erythropoietin, EPO)对于慢性心动能不全(chronic heart failure, CHF)合并贫血患者的临床疗效及其安全性。方法 检索Embase、Medline至2013年7月为止的针对EPO与CHF进行临床疗效评估的相关文献。选择比较EPO与安慰剂或空白对照在CHF合并贫血患者的治疗效果的所有随机临床研究。结果 总共有750例CHF合并贫血的患者接受EPO治疗3个月至1年并跟踪随访,这些患者包含在9个随机对照研究中。EPO的治疗可以显著降低CHF患者的住院周期(RR=0.47,CI: 0.32~0.70;P=0.0002)。CHF患者使用EPO治疗后虽不能降低其死亡风险 (RR=0.68,CI: 0.38~1.19;P=0.18),但也没有出现死亡率的升高。此外,CHF合并贫血的患者使用EPO治疗后可以显著改善血红蛋白(Hb),红细胞压积(HCT),脑利钠肽(BNP),运动能力,肾功能,心功能(NYHA)和左心室射血分数(LEVF)。结论 在CHF患者中,EPO治疗后有益作用明显,并没有出现死亡率的升高或更多不良事件的发生。这些结果支持在CHF合并贫血的患者中使用EPO进行治疗。
【关键词】贫血; 慢性心功能不全; 促红细胞生成素; 死亡率
贫血在慢性心功能不全(chronic heart failure, CHF)患者中是常见的合并症,其在疾病的病理生理过程中具有重要作用[1-4]。根据世界卫生组织公布的观测研究的初步数据显示,在CHF患者中,33%的患者合并有贫血。贫血在CHF患者是普遍的,其发病率有增加趋势,其发病机制比较复杂,肾功能不全,炎症,血容量的改变,药物这些都是常见的病因[5]。更重要的是,贫血已被认为在死亡和住院的CHF患者中增加舒张功能不全和左心室(left ventricular, LV)功能不全的风险的独立因素,这可能会导致这些患者预后不良和死亡率的上升[6-8]。
先前的一些研究报道: 在CHF患者中使用促红细胞生成素(erythropoietin, EPO)纠正贫血可以显著改善心功能和肾功能,并降低这些患者的住院率及利尿剂的使用率[9-10]。EPO是一个165个氨基酸组成的糖蛋白激素,由肾脏针对低氧分泌,通过刺激骨髓造血和释放红细胞促进血液中红细胞计数的增加,从而改善血液携氧能力。此外,EPO除了造血及心血管保护作用外还有其他生物学作用[11]。
然而,大多数针对CHF和贫血的并得出运动耐量或功能改善的研究,都是非对照研究或未设立空白对照的研究。因此,这些研究在提供EPO使用安全性及临床效果的相关数据方面作用有限。同时,这些研究的样本量较少。本研究使用meta 分析的方法分析筛选出的关于CHF合并贫血的相关研究,从而对EPO的安全性及临床效用提供参考。
1.1 文献筛选
检索EMBASE(www.embase.com) and MEDLINE(www.ncbi.nlm.nih.gov/pubmed)这两个数据库系统的至2013年7月为止的针对EPO与CHF进行临床疗效评估的相关研究,没有语言限制。检索词包括“心脏功能不全”或“充血性心脏衰竭”或“慢性心功能不全”或“CHF”结合“重组促红细胞生成素”或“达依泊汀”或“促红细胞生成素”或“红细胞生成”。在计算机根据关键词检索出的标题和摘要进行进一步筛选,以排除明显不相关的研究。其余文章的全文已仔细阅读,以确定它是否包含感兴趣的主题信息。还筛选检索到的文章引用的参考文献,以识别任何额外的相关研究。综述文章的参考文献进行了检索,以确定没有遗漏的文献。
具体文献检索过程及要求见图1。根据标题和摘要对561篇文献进行了审查;其在547篇被放弃因为以下原因之一: 他们不是关于EPO和心功能不全的,他们不是临床研究,或他们不是关于人体的研究。剩余的14篇文献被仔细阅读。如果心脏衰竭的类型是不是CHF(即收缩期心功能不全)[12],或者没有确切的死亡率和住院率无法统计[13-16],这些文献被排除在外。最后,9篇文献被纳入meta分析。

图1 文献检索过程及要求
Fig.1 Literature retrieval process and requirements
1.2 数据提取和质量评估
独立评估从数据库中检索到的所有文献的资料,并通过使用一个统一的数据表格提取各研究的相关数据。包含在数据表格中的项目如下: 研究名称(连同第一作者的姓名和出版年份),期刊名称,位置,研究设计,研究对象(病例组和对照),入选标准,排除标准,随访等。根据美国预防工作小组(USPTF)提供的指南对每个研究的质量进行评估。主要从以下几个特点进行了评估: 随访时间(6个月以上);随访质量(失访率);贫血的定义;研究结果的规范;以研究样本为代表的人群;临床和人口统计学变量的完整规范;样本选择的解释;明确的纳入和排除标准。以上标准如果满足5条的研究被评为较差,满足5~6条的被评为良,满足7条以上的被评为好。
1.3 统计学处理
为了比较RR和95%CI,在本研究中使用了研究特定的最大调整RR和95%CI。使用Cochran’s Q 和I2统计检验研究间的异质性。在效果分析中I2评估变异的百分比主要由于异质性而不是偶然性。固定效应模型被提出,如果异质性的P值<0.10或I2>50%。否则,将使用随机效应模型。改造了RR为自然对数刻度,然后计算出SEs。使用REVMAN 5.2软件进行了统计学分析。
2.1 文献检索,研究特点与质量评价
在排除重复研究后,本研究对561篇可能相关的研究进行了审查,并最终9篇临床研究文献符合纳入标准,可用于分析。在这9项研究中,有3项为随机、双盲、对照、多中心研究[17-19],3项为随机、双盲、对照、单中心研究[20-22],2项随机、单盲、单中心研究[23-24],1项随机、非盲、单中心研究[10]。并根据各项研究的自身设计排除了包括继发性贫血、血肌酐>300mg/ml、合并单纯数张性心力衰竭、新发的心肌梗死、严重的肾衰竭和消化道出血等其他疾病在内的患者。这些研究总共包括750位CHF合并贫血同时接受EPO治疗3个月至1年的患者,从2001年到2011年。根据不同血红蛋白(hemoglobin, Hb)[14-18,20]和红细胞压积(hematocrit, HCT )[19]作为贫血入选标准。5项研究中所用的是红细胞生成素,而其他4项研究中使用阿法达贝泊汀。研究均在欧洲进行。所有9项研究的质量分数都是相等的。
在EPO治疗组的398位CHF患者中,50位住院(12.6%);而在对照组的330位CHF患者中,82位住院(24.8%)。由此,我们可以看出经过EPO的治疗,CHF患者住院危险度显著减少(RR=0.47,CI: 0.32~0.70;P=0.0002),(见图2)。对于结果,在被纳入研究的住院率之间没有显著的差异(I2=9%,P=0.36),也没有表现出明显的偏倚迹象。其中8项研究有CHF患者死亡率的数据。在EPO治疗组的398位CHF患者中,23位死亡(5.8%);但是在对照组有29位死亡(8.8%)。这一结果虽无统计学意义(RR=0.68,CI: 0.38~1.19;P=0.18),(见图3),但却提示EPO的使用没有增加死亡率,反而有降低死亡率的趋势,如果继续增加样本量可能会有更加确切的结果。
本研究发现,EPO的使用可以显著改善贫血。与对照组比较CHF患者使用EPO治疗后可以显著改善运动能力(运动时间、运动距离及氧分压)。在使用EPO治疗后,CHF患者的脑利钠肽(Brain natriuretic peptide, BNP)和肌酐显著下降。此外,EPO可以显著改善CHF患者的纽约心脏病协会(NYHA)分级,延缓左室射血分数(left ventricular ejection fraction, LVEF)的恶化。
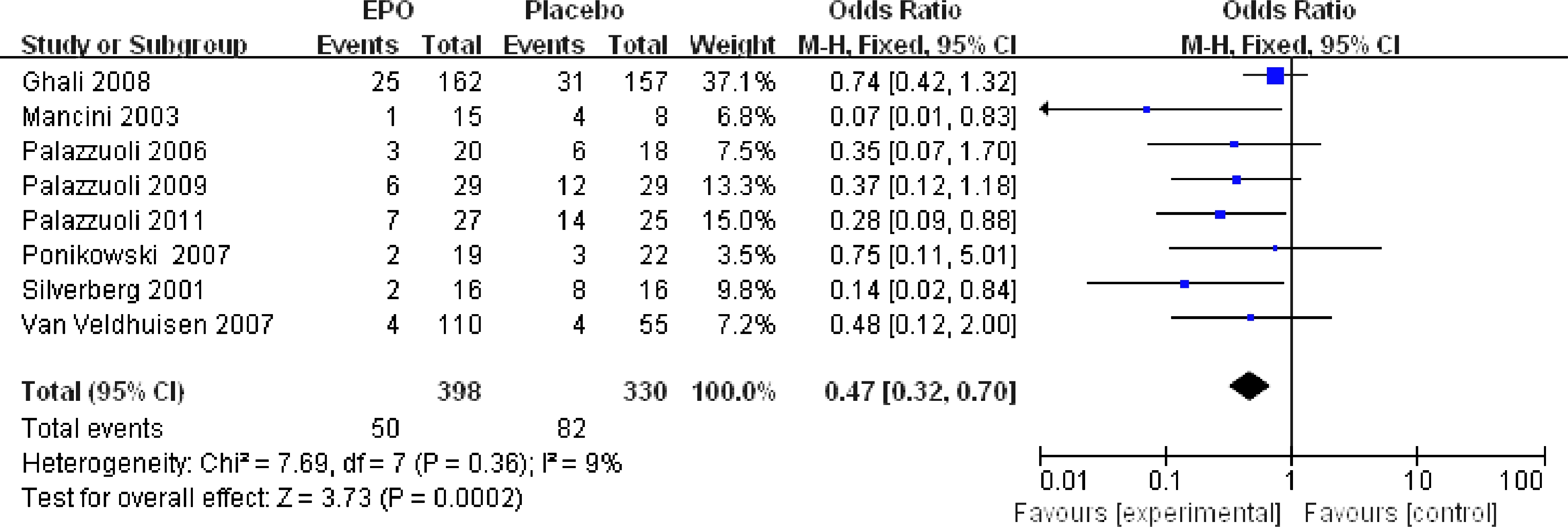
图2 EPO治疗后CHF患者住院危险度
Fig.2 Risk of hospitalization after EPO treatment
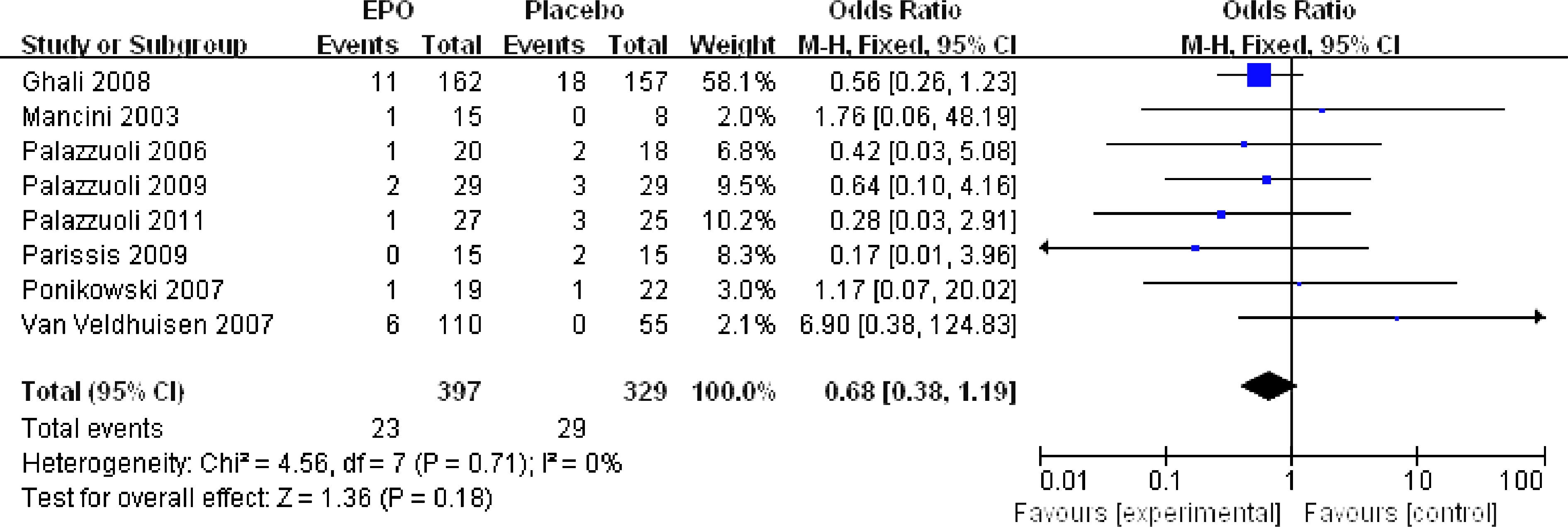
图3 EPO治疗后院内死亡率的比较
Fig.3 Comparison of Hospital mortality in patients treated with EPO versus placebo
现已明确EPO受体不仅在造血细胞中,而且在非造血细胞中也有表达;所以,除了针对红细胞贫血患者具有治疗作用,EPO在治疗的非造血器官的病理状态,如大脑,心脏,血管等具有潜在作用。进一步的研究表明,EPO介导的心脏保护作用,主要是通过降低凋亡,增加血管生成,动员内皮祖细胞,并通过磷酸化和激活例如JAK1/2,STAT3,STAT5,和 PI3K信号转导通路诱导血管生成[25]。
在CHF患者中合并贫血的患者比不合并贫血的患者具有更高的住院率。由Van der Meer等[26]进行的meta分析研究发现: 在650例CHF患者中使用EPO治疗与对照组相比,住院率可以显著减少41%。本研究也有类似的结果。另外的由516例心功能不全患者参与的随机对照研究也有类似的结论[27]。
在针对CHF患者的meta分析结果中,患者的贫血明显改善。大多数的患者贫血改善连同Hb和HCT的增加;然而,更显著的改善在1年后可见,EPO的使用可以略微降低CHF患者的死亡风险。这可能部分由于EPO改善了CHF患者的氧合和贫血造成的氧化应激,这也可能是由于药物的直接影响。另一项包括了150000 位CHF患者的meta分析[28]发现,在6个月至5年的随访期间中低血红蛋白水平可以增加将近1倍的死亡率,不论CHF发生的原因。但是,其他研究有不同的结果[25]。这可能是由于患者对EPO敏感性的不同,这导致药物剂量的提高,从而增加了心血管事件和死亡率。在目前的研究中,接受EPO治疗的患者的运动能力显著改善。本研究结果进一步证实了以前的一些研究提出的皮下注射EPO可以提高合并贫血的CHF患者的运动能力,生活质量和LVEF[29]。
BNP能够反映心室舒张情况,并被认为是评估CHF的发生和发展的指标,因为高BNP水平是心衰的临床预后不良的独立预测因素。因为贫血引起的神经内分泌代谢可能会导致直接的心肌毒性,心肌肥大,水钠潴留;现证明CHF合并贫血的患者细胞因子和BNP表达增加。研究发现经过EPO治疗后,患者BNP水平明显下降。这可能是由于EPO显著改善贫血引起的心动过速和心搏量增加,以及交感神经和肾素-血管紧张素-醛固酮系统的过度激活;从而通过心脏供氧的增加改善心功能引起BNP的降低[3,30]。此外,本研究发现EPO的治疗可以通过降低肌酐来改善肾功能。因为在CHF中,肾功能不全是主要的影响预后的因素之一,纠正贫血保护肾功能是EPO在CHF的治疗中的又一重要贡献。在这种情况下,EPO可以显著引起NYHA分级的降低和LEVF的改善,而没有任何其他负面影响。
CHF合并贫血的患者在使用EPO治疗后可以显著改善住院率、Hb、HCT、BNP、死亡率、运动能力、肾功能、NYHA心功能分级和LEVF。这些结果支持更大样本量的研究EPO治疗在CHF合并贫血患者的安全性和潜在有利作用。
【参考文献】
[1] Tang YD, Katz SD. Anemia in chronic heart failure prevalence, etiology, clinical correlates, and treatment options[J]. Circulation, 2006,113(20): 2454- 2461.
[2] Felker GM, Adams KF, Gattis WA, et al. Anemia as a risk factor and therapeutic target in heart failure[J]. J Am Coll Cardiol, 2004,44(5): 959-966.
[3] van der Meer P, Voors AA, Lipsic E, et al. Erythropoietin in cardiovascular diseases[J]. Eur Heart J, 2004,25(4): 285-291.
[4] Anand I, McMurray JV, Whitmore J, et al. Anemia and its relationship to clinical outcome in heart failure[J]. Circulation, 2004,110(2): 149-154.
[5] Westenbrink BD, Visser FW, Voors AA, et al. Anaemia in chronic heart failure is not only related to impaired renal function and blunted erythropoietin production, but to fluid retention as well[J]. Eur Heart, 2007(28): 166-171.
[6] Felker GM, Gattis WA, Leimberger JD, et al. Usefulness of anemia as a predictor of death and rehospitalization in patients with decompensated heart failure[J]. Am J Cardiol, 2003,92(5): 625-628.
[7] Kosiborod M, Smith GL, Radford MJ, et al. The prognostic importance of anemia in patients with heart failure[J]. Am J Med, 2003,114(2): 112-119.
[8] Mozaffarian D, Nye R, Levy WC. Anemia predicts mortality in severe heart failure: the prospective randomized amlodipine survival evaluation (PRAISE)[J]. J American Coll Cardiol, 2003,41(11): 1933- 1939.
[9] Silverberg DS, Wexler D, Blum M, et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations[J]. J Am Coll Cardiol, 2000, 35(7): 1737-1744.
[10] Silverberg DS, Wexler D, Sheps D, et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneous erythropoietin and intravenous iron: a randomized controlled study[J]. J Am Coll Cardiol, 2001,37(7): 1775-1780.
[11] Ruifrok WP, de Boer RA, Westenbrink BD, et al. Erythropoietin in cardiac disease: new features of an old drug[J]. Eur J Pharmacol, 2008,585(2): 270-277.
[12] Swedberg K, Young JB, Anand IS, et al. Treatment of anemia with darbepoetin alfa in systolic heart failure[J]. N Engl J Med, 2013,368(13): 1210-1219.
[13] Cleland JG, Sullivan JT, Ball S, et al. Once-monthly administration of darbepoetin alfa for the treatment of patients with chronic heart failure and anemi
A: a pharmacokinetic and pharmacodynamic investigation[J]. J Cardiovasc Pharmacol, 2005,46(2): 155-161.
[14] Kourea K, Parissis JT, Farmakis D, et al. Effects of darbepoetin-alpha on quality of life and emotional stress in anemic patients with chronic heart failure[J]. Eur J Cardiovasc Prev Rehabil, 2008,15(3): 365-369.
[15] Cosyns B, Velez-Roa S, Droogmans S, et al. Effects of eythropoietin administration on mitral regurgitation and left ventricular remodeling in heart failure patients[J]. Int J Cardiol, 2010,138(3): 306-307.
[16] Parissis JT, Kourea K, Panou F, et al. Effects of darbepoetin α on right and left ventricular systolic and diastolic function in anemic patients with chronic heart failure secondary to ischemic or idiopathic dilated cardiomyopathy[J]. Am Heart J, 2008,155(4): 751. e1-751. e7.
[17] Ponikowski P, Anker SD, Szachniewicz J, et al. Effect of darbepoetin alfa on exercise tolerance in anemic patients with symptomatic chronic heart failure: a randomized, double-blind, placebo-controlled trial[J]. J Am College of Cardiol, 2007,49(7): 753- 762.
[18] van Veldhuisen DJ, Dickstein K, Cohen-Solal A, et al. Randomized, double-blind, placebo-controlled study to evaluate the effect of two dosing regimens of darbepoetin alfa in patients with heart failure and anaemia[J]. Eur Heart J, 2007,28(18): 2208-2216.
[19] Ghali JK, Anand IS, Abraham WT, et al. Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia[J]. Circulation, 2008,117(4): 526-535.
[20] Palazzuoli A, Silverberg D, Iovine F, et al. Erythropoietin improves anemia exercise tolerance and renal function and reduces B-type natriuretic peptide and hospitalization in patients with heart failure and anemia[J]. Am Heart J, 2006, 152(6): 1096. e9-1096. e15.
[21] Palazzuoli A, Silverberg DS, Calabrò A, et al. Beta-erythropoietin effects on ventricular remodeling, left and right systolic function, pulmonary pressure, and hospitalizations in patients affected with heart failure and anemia[J]. J Cardiovasc Pharmacol, 2009,53: 462-467.
[22] Palazzuoli A, Quatrini I, Calabrò A, et al. Anemia correction by erythropoietin reduces BNP levels, hospitalization rate, and NYHA class in patients with cardio-renal anemia syndrome[J]. Clin Exp Med, 2011,11(1): 43-48.
[23] Mancini DM, Katz SD, Lang CC, et al. Effect of erythropoietin on exercise capacity in patients with moderate to severe chronic heart failure[J]. Circulation, 2003,107(2): 294-299.
[24] Parissis JT, Kourea K, Andreadou I, et al. Effects of Darbepoetin Alfa on plasma mediators of oxidative and nitrosative stress in anemic patients with chronic heart failure secondary to ischemic or idiopathic dilated cardiomyopathy[J]. Am J Cardiol, 2009,103(8): 1134-1138.
[25] Chateauvieux S, Grigorakaki C, Morceau F, et al. Erythropoietin, erythropoiesis and beyond[J]. Biochem Pharmacol, 2011,82: 1291-1303.
[26] Van der Meer P, Groenveld H F, Januzzi J L, et al. Erythropoietin treatment in patients with chronic heart failure: a meta-analysis[J]. Heart, 2009,95(16): 1309-1314.
[27] Klapholz M, Abraham WT, Ghali JK, et al. The safety and tolerability of darbepoetin alfa in patients with anaemia and symptomatic heart failure[J]. Euro J Heart Failure, 2009,11(11): 1071-1077.
[28] Groenveld HF, Januzzi JL, Damman K, et al. Anemia and mortality in heart failure patients a systematic review and meta-analysis[J]. J Am Coll Cardiol, 2008,52: 818-827.
[29] Weiss G, Goodnough LT. Anemia of chronic disease[J]. N Engl J Med, 2005,352: 1011-1023.
[30] Anand IS, Chandrashekhar Y, Ferrari R, et al. Pathogenesis of oedema in chronic severe anaemi
A: studies of body water and sodium, renal function, haemodynamic variables, and plasma hormones[J]. Bri Heart J, 1993,70(4): 357-362.
Efficacy and safety of erythropoietin in treatment of chronic heart failure complicated with anemi
A: a meta analysis
【Abstract】Objective To review the efficacy and safety of erythropoietin (EPO) in treatment of chronic heart failure (CHF) complicated with anemia by meta analysis.Methods EMBASE and MEDLINE database systems were retrieved for literatures on clinical efficacy of EPO in CHF patient complicated with anemia from their inception to July 2013. Randomized clinical trials on efficacy of EPO treatment versus placebo or conventional management for anemia patients with CHF were included. Results Nine randomized controlled studies involving 750 CHF patients with anemia receiving EPO treatment for 3 months to 1 year were identified. The study showed that EPO treatment significantly reduced the risk of hospitalization of patients with CHF (RR=0.47,CI: 0.32~0.70;P=0.0002).There was no reduction or elevation of mortality risk with EPO treatment for CHF patients (RR=0.68,CI: 0.38 to 1.19;P=0.18). In addition, EPO therapy significantly improved hemoglobin (Hb), hematocrit (HCT), brain natriuretic peptide (BNP), exercise capacity, renal function, cardiac function (NYHA) and left ventricular ejection fraction (LEVF) in CHF patients with anemia. Conclusion EPO treatment is beneficial for CHF patients complicated with anemia, without increased mortality or adverse events.
【Key words】anemia; chronic heart failure; erythropoietin; mortality
doi:10.16118/j.1008-0392.2015.02.028
收稿日期:2014-06-11
【中图分类号】R 541.6
【文献标志码】A
【文章编号】1008-0392(2015)02-0119-06