·临床研究·
【摘要】目的 探讨血清胱抑素C预测急性冠脉综合征(acute coronary syndrome, ACS)患者冠状动脉血管严重程度的价值。方法 ACS患者195例作为观察组,行冠状动脉造影检查将ACS病例按照血管病变数分为单支病变组91例、双支病变组67例和多支病变组37例。选取同期有ACS类似症状,但经冠脉造影检查排除冠心病的39例作为对照组。检测所有患者入院24h内血清Cys C水平。比较各组中Cys C值的差异性,判断其与ACS患者冠脉血管严重程度的相关性。结果 ACS患者单支病变组、双支病变组和多支病变组血清Cys C值差异有统计学意义(1.27±0.30mg/Lvs1.34±0.44mg/Lvs1.51±0.59mg/L,P<0.05);Cys C高四分位组的Gensini积分显著大于低四分位组(50.00±37.37vs30.24±22.25,P<0.05);通过箱式图可以看出随着血管病变支数的增加,Cys C的中位数有增加的趋势。两者的Spearman等级相关系数为0.1576,P=0.0278;多因素有序logistic预测模型显示血清Cys C水平预测血管病变数的的OR值为2.09(95%CI1.1382~3.8295,P<0.05)。结论 血清Cys C水平与ACS患者冠脉血管严重程度相关。
【关键词】血清胱抑素C; 急性冠脉综合征; 冠脉血管病变数; 冠脉病变严重程度
急性冠脉综合征(acute coronary syndrome, ACS)患者冠脉血管的病变数常决定了患者心肌缺血或坏死的范围和严重程度,并会对其预后产生重要影响。如何在早期对ACS患者病变的严重程度做出预判,及早选择一种有效而又安全的治疗策略对于改善预后显得尤为重要。
胱抑素C(cystatin, Cys C)是一种半胱氨酸蛋白酶抑制剂,其影响动脉粥样硬化和心肌重塑进程。以往的研究提示Cys C是反映肾功能损害的理想指标[1],但其与冠状动脉病变严重程度相关性研究的报道较少,且无一致性结果[2-3]。本研究比较了血清Cys C在ACS患者不同血管病变支数及严重程度间的差异性,以探讨Cys C 预测ACS患者冠状动脉血管病变严重程度的价值。
1.1 一般资料
研究对象为2012年7月至2013年6月于上海交通大学附属第六人民医院确诊为ACS,并接受冠状动脉造影以及行PCI术治疗的患者共195例。其中急性ST段抬高型心肌梗死(ST segment elevation myocardial infarction)77例,非ST段抬高型心肌梗死(non-ST elevation myocardial infarction)35例,不稳定型心绞痛(unstable angina)83例。入选标准: (1) 符合ACS诊断[4](包括STEMI、NSTEMI和UA)且在住院期间行冠脉造影患者;(2) 年龄≤90岁。排除标准: (1) 严重肝功能不全(合并黄疸、门脉高压、腹水、肝性脑病);(2) 严重肾功能不全[eG]FR低于30ml/(min·1.73m-2)];(3) 急性脑血管意外;(4) 急性感染;(5) 晚期肿瘤。
冠脉血管病变数计算方法: 任何三支冠脉主干中的一支血管狭窄>50%被认为有意义病变。左主干狭窄>50%可计算为双支病变。如存在中间支狭窄>50%可单独计算为一支血管病变。分支血管病变归于主支病变计算。计算有意义病变血管数的总和。
按照冠脉造影结果,将ACS分为单支病变组(91例),双支病变组(67例)和多支病变组(37例)。选取同期有ACS类似症状,但经冠脉造影检查排除冠心病的患者39例作为对照组。
ACS中男性151例(77.44%),女性44例(22.56%),年龄34~89岁,平均年龄(62.92±11.23)岁,合并高血压患者123例(63.08%),合并糖尿病患者59例(30.26%)。
对照组男性20例(51.28%),女性19例(48.72%),年龄42~79岁,平均年龄(63.59±9.14)岁,合并高血压患者23例(58.97%),合并糖尿病患者6例(15.38%)。
1.2 方法
对于所有入组患者24h内进行血清Cys C、LDL-C、血肌酐指标检测,记录患者临床资料。用颗粒增强透射免疫比浊法测定血清Cys C水平。正常值≤1.0mg/L。根据Cockcroft-Gault公式计算估计血肌酐清除率(eGFR)。
1.2.1 冠状动脉血管病变严重程度的评价 根据改良Gensini积分[5]进行评估: (1) 根据对冠状动脉狭窄程度评估积分: ≤25%狭窄计1分;26%~49%狭窄计2分;50%~74%狭窄计4分;75%~89%狭窄计8分;90%~99%狭窄计16分;100%狭窄计32分。(2) 根据病变部位不同,求出单处病变积分与系数乘积: 左主干病变×5;前降支近段×2.5;前降支中段×1.5;回旋支开口处×3.5;回旋支近段× 2.5;回旋支中段×1.5;左室后侧支×0.5;前降支远段、第一对角支、第二对角支、回旋支远段、钝缘支、右冠状动脉近段、中段、远段、后降支均×1。(3) 以上积分求和,为每位患者的Gensini总积分。
1.2.2 血清胱抑素C的分组 将所有入院患者(234例)的Cys C水平按照四分位法分成4个亚组: Q1组Cys C值<1.1mg/L(45例),Q2组1.1mg/L ≤Cys C值<1.2mg/L(35例),Q3组1.2mg/L≤Cys C值<1.5mg/L(88例),Q4组Cys C值≥1.5mg/L(66例)。
1.2.3 eGFR的分组 将所有入院患者(234例)的eGFR水平按照肾功能损害程度分为3个亚组: q1组为中重度肾功能不全组: 30ml/min≤eGFR值<60ml/min(44例),q2组为轻中度肾功能不全组: 60ml/min≤eGFR值<90ml/min(94例),q3组为肾功能水平基本正常组(96例)。
1.3 统计学处理
定量资料采用![]() ±s表示。统计分析采用STATA 12.0软件。组间方差齐性时,组间比较采用t检验,否则采用t检验;等级资料采用中位数(四分位间距)描述,组间比较采用Wilcoxon秩和检验;定量资料计算Pearson相关系数。采用逐步向前(stepwise forward)法建立多因素logistic回归模型(multivariate logistic regression model),纳入标准P≤0.05,剔除标准P>0.05。当结局变量为二分类时建立非条件(unconditional)logistic回归模型,当结局变量为有序分类变量时,建立有序(ordinal) logistic 回归模型。所有假设检验P值取双侧。差异性检验水准设为5%、方差齐性检验水准设为10%。
±s表示。统计分析采用STATA 12.0软件。组间方差齐性时,组间比较采用t检验,否则采用t检验;等级资料采用中位数(四分位间距)描述,组间比较采用Wilcoxon秩和检验;定量资料计算Pearson相关系数。采用逐步向前(stepwise forward)法建立多因素logistic回归模型(multivariate logistic regression model),纳入标准P≤0.05,剔除标准P>0.05。当结局变量为二分类时建立非条件(unconditional)logistic回归模型,当结局变量为有序分类变量时,建立有序(ordinal) logistic 回归模型。所有假设检验P值取双侧。差异性检验水准设为5%、方差齐性检验水准设为10%。
2.1 基线资料比较
ACS组和对照组在性别构成及糖尿病患病率有统计学差异(P<0.05),而年龄及高血压患病率无统计学差异(P>0.05),见表1。
表1 ACS组和对照组基线资料比较
Tab.1 Comparison of baseline data between ACS group and the control group
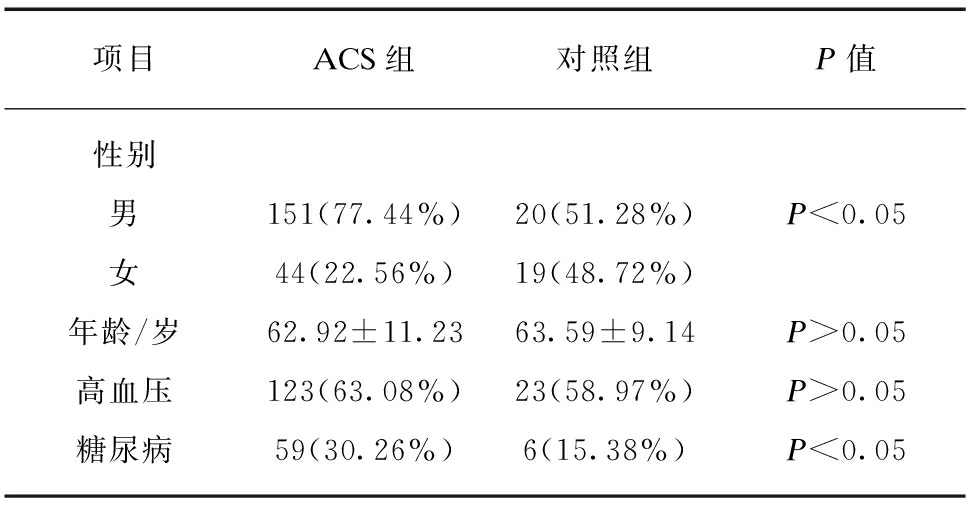
项目ACS组对照组P值性别男151(77.44%)20(51.28%)P<0.05女44(22.56%)19(48.72%)年龄/岁62.92±11.2363.59±9.14P>0.05高血压123(63.08%)23(58.97%)P>0.05糖尿病59(30.26%)6(15.38%)P<0.05
2.2 组间指标比较
将对照组作为参考数值,用有序Logistic回归比较单支病变组、双支病变组及多支病变组各变量的差异性。性别构成在对照组和ACS组中差异明显,但在不同血管病变数的亚组中无明显差异(P均>0.05)。血LDL-C水平在各亚组和对照组均有明显差异(P均<0.05),Cys C值在各亚组和对照组均有明显差异(P均<0.05),见表2。
表2 冠脉病变数各组间变量的比较
Tab.2 Comparison of variables among different groups
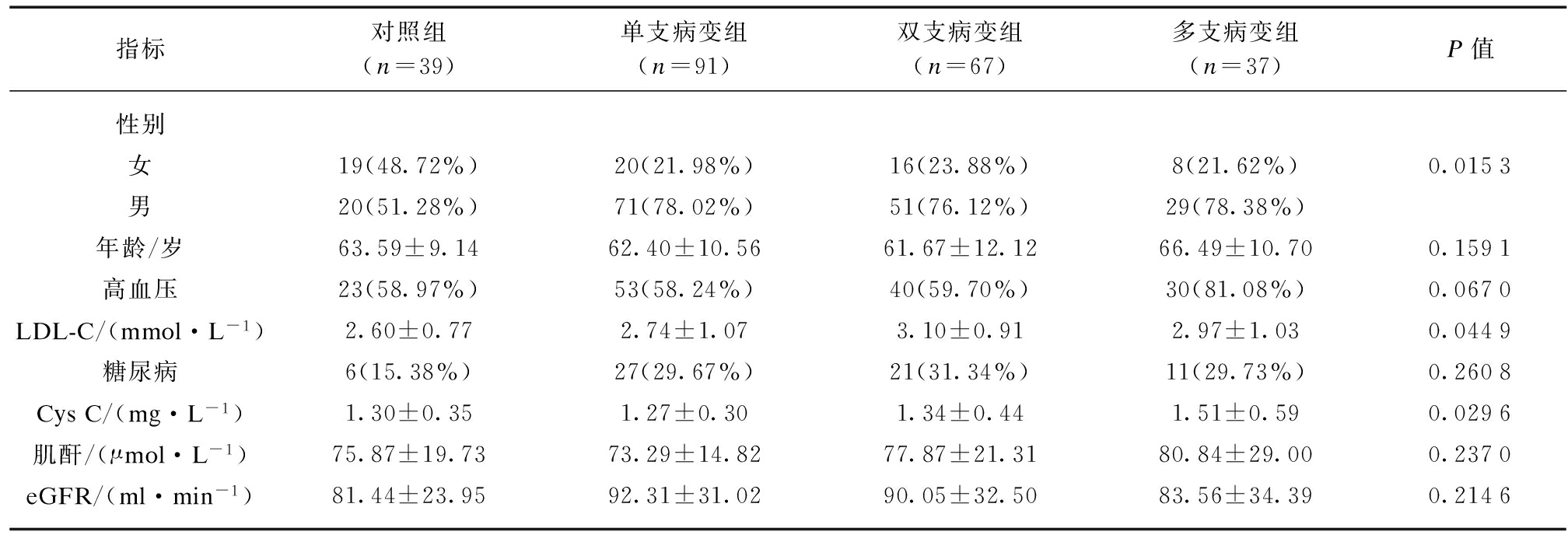
指标对照组(n=39)单支病变组(n=91)双支病变组(n=67)多支病变组(n=37)P值性别女19(48.72%)20(21.98%)16(23.88%)8(21.62%)0.0153男20(51.28%)71(78.02%)51(76.12%)29(78.38%)年龄/岁63.59±9.1462.40±10.5661.67±12.1266.49±10.700.1591高血压23(58.97%)53(58.24%)40(59.70%)30(81.08%)0.0670LDL-C/(mmol·L-1)2.60±0.772.74±1.073.10±0.912.97±1.030.0449糖尿病6(15.38%)27(29.67%)21(31.34%)11(29.73%)0.2608CysC/(mg·L-1)1.30±0.351.27±0.301.34±0.441.51±0.590.0296肌酐/(μmol·L-1)75.87±19.7373.29±14.8277.87±21.3180.84±29.000.2370eGFR/(ml·min-1)81.44±23.9592.31±31.0290.05±32.5083.56±34.390.2146
2.3 多因素有序Logistic回归分析及预测模型
在排除其他混杂因素后,Cys C、男性、LDL-C、高血压史均和ACS的血管病变支数呈正相关,其中胱抑素C的OR值为2.09。其预测价值为Cys C每增加1mg/L,血管病变数增加1支或1支以上的风险增加了1.09倍,见表3。
表3 各因素与ACS患者血管病变支数的关系
Tab.3 The relationship between the various factors and the count of vascular lesions in ACS patients
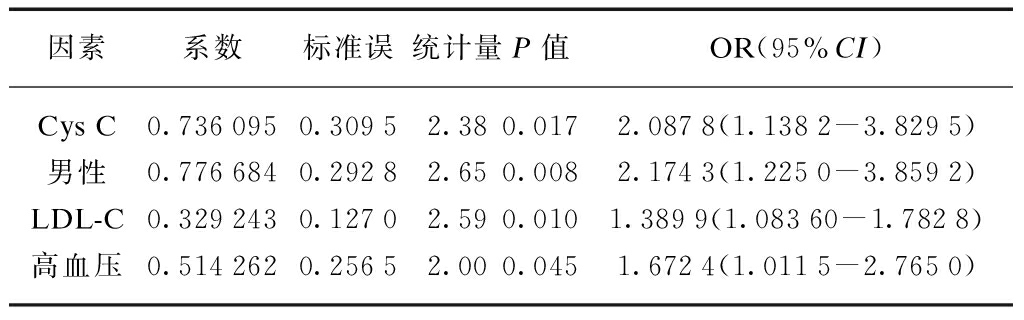
因素系数标准误统计量P值OR(95%CI)CysC0.7360950.30952.380.0172.0878(1.1382-3.8295)男性0.7766840.29282.650.0082.1743(1.2250-3.8592)LDL-C0.3292430.12702.590.0101.3899(1.08360-1.7828)高血压0.5142620.25652.000.0451.6724(1.0115-2.7650)
2.4 不同浓度水平的Cys C及不同肾功能水平与
ACS血管病变数的关系
通过比较不同浓度水平的Cys C(4个亚组)和eGFR(3个亚组)在ACS不同血管病变数各组中构成比的差异性,来判断不同浓度水平的Cys C及不同程度肾功能不全与ACS血管病变数的相关性。结果显示Cys C亚组中,Q1(低浓度的Cys C水平)构成比单支病变组>双支病变组>多支病变组,Q4(高浓度的Cys C水平)构成比多支病变组>双支病变组>单支病变组,且差异性有统计学意义(P<0.05)。eGFR亚组中,q1(中重度肾功能不全)构成比多支病变组>双支病变组>单支病变组,q2(轻中度肾功能不全)及q3(肾功能水平基本正常)构成比单支病变组>双支病变组>多支病变组,但差异性未达到统计学意义(P>0.05),见表4。
表4 ACS不同血管病变数中Cys C亚组和eGFR亚组 构成比的比较
Tab.4 Comparison of constituent ratio between Cys C subgroups and the eGFR subgroups in different vascular disease variables of ACS patients
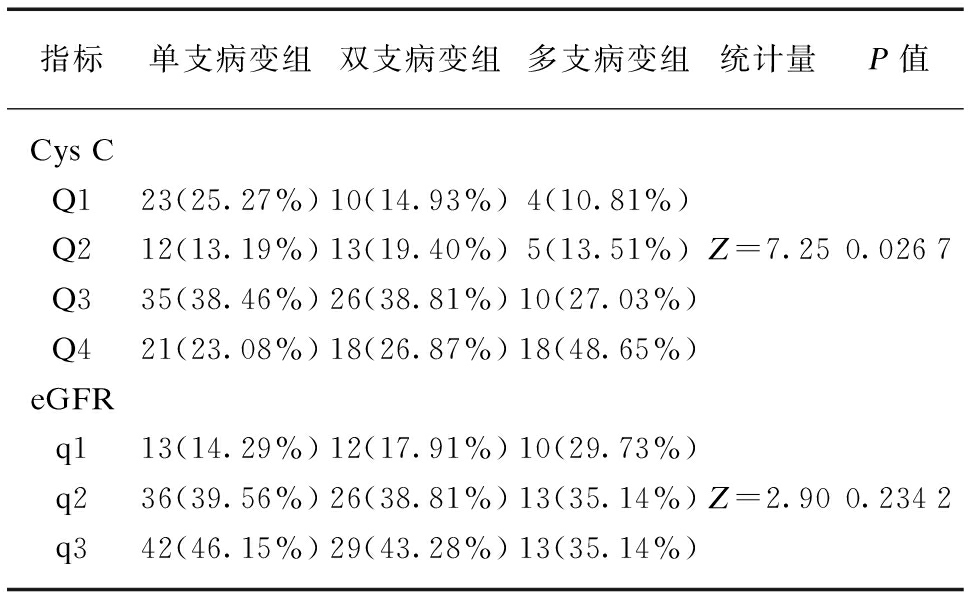
指标单支病变组双支病变组多支病变组统计量P值CysCQ123(25.27%)10(14.93%)4(10.81%)Q212(13.19%)13(19.40%)5(13.51%)Z=7.250.0267Q335(38.46%)26(38.81%)10(27.03%)Q421(23.08%)18(26.87%)18(48.65%)eGFRq113(14.29%)12(17.91%)10(29.73%)q236(39.56%)26(38.81%)13(35.14%)Z=2.900.2342q342(46.15%)29(43.28%)13(35.14%)
2.5 比较不同血管病变数下的Cys C中位数
根据不同血管病变数亚组的Cys C的取值范围及中位数的水平,可绘制出箱式图(box-plot)。从箱式图上可以看出,随着血管病变支数的增加,Cys C的中位数有增加的趋势。两者的Spearman等级相关系数为0.1576,P=0.0278,差异有统计学意义,见图1。
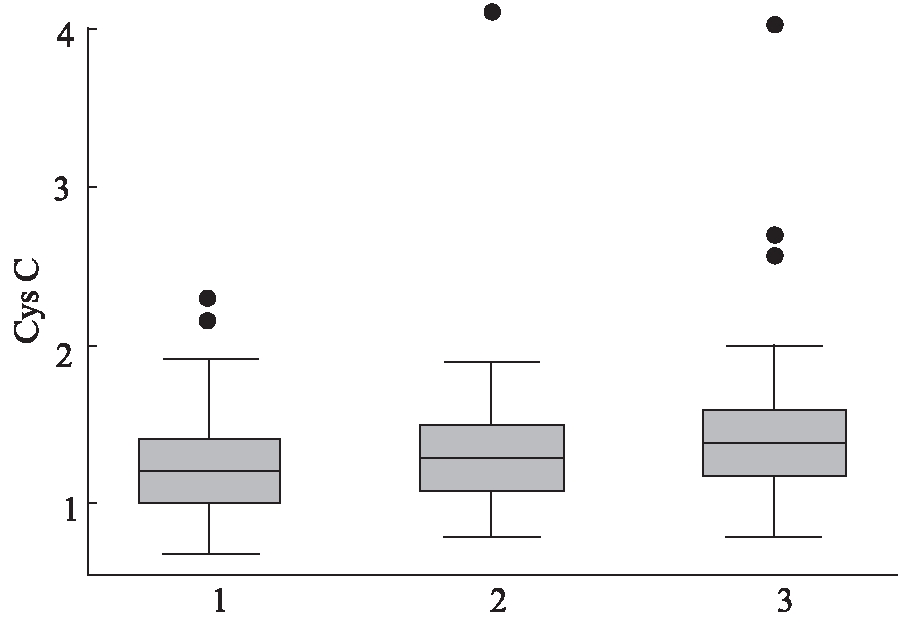
图1 不同血管病变数和Cys C中位数的相关性箱式图
Fig.1 Different vascular disease variables and the correlation of Cys C median by box-plot 横坐标1代表单支病变组,2代表双支病变组,3代表多支病变组,纵坐标代表Cys C的数值,方块中间横线代表中位数
2.6 比较不同血管病变数下的eGFR中位数
根据不同血管病变数亚组的eGFR的取值范围及中位数的水平,可绘制出箱式图。从箱式图上可以看出,随着血管病变支数的增加,eGFR的中位数有降低的趋势。两者的Spearman等级相关系数为-0.0993,P=0.1671,差异无统计学意义,见图2。
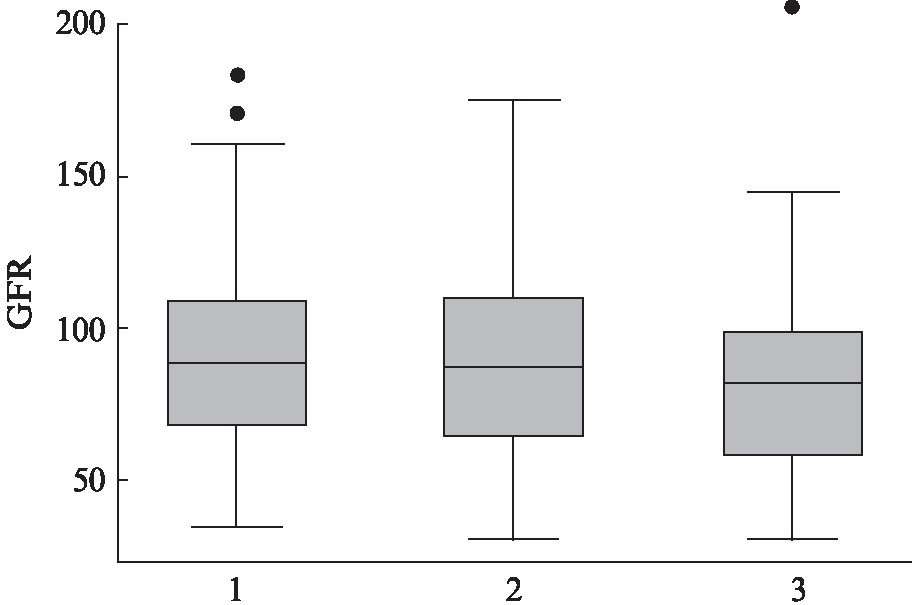
图2 不同血管病变数和eGFR中位数的相关性箱式图
Fig.2 Different vascular disease variables and the correlation of eGFR by box-plot 横坐标1代表单支病变组,2代表双支病变组,3代表多支病变组,纵坐标代表eGFR的数值,方块中间横线代表中位数
2.7 比较ACS患者血管病变支数与血管病变严重
程度的相关性
通过比较不同血管病变数亚组的Gensini积分的差异性,来判断ACS患者血管病变支数和Gensini的相关性。结果显示各组Gensini积分的分值在各亚组中有差异,多支病变组>双支病变组>单支病变组,且差异有统计学意义(67.32±40.04vs43.78±25.50vs30.20±22.92,P<0.0001)。
2.8 不同Cys C浓度水平ACS患者与血管病变严
重程度的相关性
通过比较Cys C不同亚组的ACS患者Gensini积分的差异性,来判断不同浓度Cys C水平与Gensini 积分的相关性。结果显示Gensini积分在Cys C各亚组中存在差异性,Q4组>Q3组>Q2组>Q1组,且差异有统计学意义(50.00±37.37vs42.67±30.40vs39.13±22.58vs30.24±22.25,P<0.05)。
2.9 不同肾功能水平ACS患者与血管病变严重程度的相关性
通过比较eGFR不同亚组的ACS患者Gensini积分的差异性,来判断不同程度肾功能不全与Gensini 积分的相关性。结果显示Gensini值在eGFR各亚组中存在差异性,q3组>q1组>q2组,但差异性未达到统计学意义(43.23±29.84vs41.54±35.65vs40.91±30.97,P>0.05)。
2.10 ACS患者Cys C、eGFR和Gensini积分的线性关系
通过Pearson相关系数计算出ACS患者中Cys C、eGFR和Gensini积分两两之间的线性关系。结果显示Cys C与eGFR呈负相关(r=-0.5073,P<0.0001),Cys C与Gensini积分呈正相关(r=0.1811,P<0.05),eGFR与Gensini积分呈正相关(r=0.0738,P>0.05)。
近年来,有研究发现肾功能损害与冠心病的血管病变程度有相关性[6]。Cys C和eGFR都是反映肾功能损害的较理想指标,同时Cys C作为半胱氨酸蛋白酶抑制剂超家族2中的成员之一,通过参与细胞内外蛋白水解的调控,保护细胞免受不适当的内源性或外源性蛋白水解酶,具有调节半胱氨酸蛋白酶活性的生理功能,是目前发现对组织蛋白酶B抑制作用最强的抑制物。Cys C通过调节蛋白酶的活性,调控细胞质基质降解和合成,在动脉壁蛋白溶解和抗蛋白溶解活性平衡以及血管壁重构过程中均发挥着重要作用。Shi等[7]认为Cys C的缺失以及蛋白水解酶与其抑制剂在血管壁的失平衡可能是动脉粥样硬化的发病机制之一。但Cys C与冠状动脉病变严重程度相关性研究的报道较少,且无一致性结果[2-3]。国内张安吉等[2]通过对338例冠心病患者的研究,发现随着冠脉病变狭窄支数和冠脉病变狭窄严重程度增加,Cys C水平呈下降趋势(P<0.01)。但埃及学者Osama等[3]的研究却发现Cys C和ACS患者病变血管支数呈中度正相关(r=0.419,P<0.01)。同时将Cys C水平用1.141mg/L作为分界点(这一点具有最大的灵敏度和特异性)分为两组,结果提示高水平Cys C组的血管病变支数明显高于低水平Cys C组(2.2±0.8vs1.7±0.775,P=0.005)。但该研究发现Cys C与血管狭窄发生的部位无明确相关性。
本研究结果不仅表明男性、LDL-C和高血压与ACS患者血管病变数呈正相关,而且Cys C水平可预测ACS患者的血管病变严重程度,随着血管病变支数的增加,Cys C值逐渐增高。多因素有序logistic 预测模型显示Cys C每增加1mg/L,血管病变数增加1支或1支以上的风险增加了近1.09倍。另外Sekizuka等[8]的研究也证实了随着病变动脉的数量增加,Cys C水平也趋于增加。Nicholls等[9]提出,在他们的研究中Cys C和冠心病的严重程度之间呈正相关。本研究同时发现由于eGFR与ACS患者血管病变数及血管严重程度并未显示出相关性,故Cys C与冠脉血管之间的关系并非仅是肾功能损害的结果,可能受炎症途径等其他因素影响[10]。通过本研究提示了Cys C对ACS多支血管病变有较好的预测价值,在一定程度上可反映ACS血管病变的严重程度,并可作为ACS多支病变的危险因素。ACS患者的血管病变严重程度和预后往往取决于血管病变支数。Corpus等[11]发现,急性心肌梗死伴多支血管病变患者,1年随访期内死亡、再次心肌梗死、再次血运重建等主要心血管不良事件的发生率均明显高于单支血管病变的患者。其他研究发现[12-14]Cys C的升高与初发冠脉缺血事件,以及冠心病或ACS患者再次发生心血管事件(包括死亡,非致命性心肌梗死和缺血性脑血管疾病)及总死亡率增加等有关。由此根据检查结果Cys C可区分ACS低危及高危患者,在早期即可加强高危患者的管理及随访,故可以作为ACS患者的常规筛选检查而得到普及和推广。
综上所述,本研究作为前瞻性研究,结果发现Cys C水平与ACS患者的血管病变支数及冠脉血管病变严重程度有一定的相关性,随着ACS患者冠脉血管病变支数的增加和血管病变程度的加重,Cys C水平呈上升趋势,故Cys C水平可以在一定程度上反映冠状动脉粥样硬化病变的严重程度,有可能成为ACS患者冠脉硬化的预测指标,对临床实践具有指导意义,该结果还有待更大规模的临床研究来证实。
【参考文献】
[1] Dharnidharka VR, Kwon G, Stevens G.Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta analysis [J]. Am J Kidney Dis, 2002,40: 221-227.
[2] 张安吉,王海昌,李成祥,等.血清胱抑素C水平与冠状动脉狭窄程度的关系研究.实用医学杂志,2010,26(21): 3943-3945.
[3] Osama T,Amal R, Ahmed M, et al. Cystatin C as a predictor for major adverse cardiac events in patients with acute coronary syndrome[J]. The Egyptian Heart Jounal, 2012,64(3): 87-95.
[4] Kushner FG, Hand M, Smith SC. 2009 focused updates: ACC/AHA guidelines for the management of patients with ST elevation myocardial infarction (updating the 2004 guideline and 2007 focused update) and ACC/AHA/SCAI guidelines on percutaneous coronary intervention (updating the 2005 guideline and 2007 focused update): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2009,54: 2205-2241.
[5] Gensini GG. A more meaningful scoring system for determining the severity of coronary heart disease[J]. Am J Cardiol, 1983,51(3): 606.
[6] Khalique O, Aronow WS, Ahn C, et al.Relation of moderate or severe reduction in glomerular filtration rate to number of coronary arteries narrowed>50% in patients undergoing coronary angiography for suspected coronary artery disease[J]. Am J Cardiol, 2007,100(3): 415-416.
[7] Shi GP, Sukhova GK, Grubb A, et al. Cystatin C deficiency in human atherosclerosis and aortic aneur-ysms [J]. Chin Invst, 1999,104(9): 1191-1197.
[8] Sekizuka H, Akashi Y J, Kawasaki K, et al. Cystatin C: a better marker to detect coronary artery sclerosis[J]. Jpn Coll Cardiol, 2009,54: 359-367.
[9] Nicholls SJ, Tuzcu EM, Crowe T. Relationship between cardiovascular risk factors and atherosclerotic disease burden measured by intravascular ultrasound[J]. J Am Coll Cardiol, 2006,47: 1967-1975.
[10] Szekanecz Z, Shah MR, Pearce WH, et al.Human atherosclerotic abdominal aortic aneurysms produce IL-6 and interferon gamma in vascular inflammation[J]. Agents Action, 1994,42: 159-162.
[11] Corpus RA, House JA, Marso SP, et al.Multivessel percutaneous coronary intervention in patients with multivessel disease and acute myocardial infarction[J]. Am Heart J, 2004,148(3): 493-500.
[12] Luc G, Bard JM, Lesueur C, et al.Plasma cystatin-C and development of coronary heart disease: The PRIME Study[J]. Atherosclerosis, 2006,85(2): 375-380.
[13] Koenig W, Twardella D, Brenner H, et al. Plasma concentrations of Cystatin C in patients with coronary heart disease and risk for secondary cardiovascular events: more than simply a marker of glomerular filtration rate[J]. Clin Chem, 2005,51(2): 321-332.
[14] Jernberg T, Lindahl B, James S, et al. Cystatin C: a novel predictor of outcome in suspected or confirmed non-st elevation acute coronary syndrome[J]. Circulation, 2004,110: 2342-2348.
Association of serum cystatin C levels with disease severity in patients with acute coronary syndrome
【Abstract】Objective To assess the association of serum cystatin C (Cys C) levels with the severity of coronary artery disease in patients with acute coronary syndrome (ACS). Methods One hundred and ninety five patients with ACS and 39 patients without ACS (control group) were enrolled in the study. All subjects underwent coronary angiography, among ACS patients, 91 had sin gle-vessel disease (SVD group), 67 had double-vessel disease (DVD group) and 37 had multi-vessel disease (MVD group); patients in control group had ACS symptoms but were excluded with coronary artery disease by coronary angiography. Serum Cys C levels were measured within 24h after admission. Serum Cys C levels were compared among groups and the association between serum Cys C level and the severity of coronary artery disease was analyzed. Results There were significant differences in serum Cys C levels among SVD, DVD and MVD groups(1.27±0.30mg/L, 1.34±0.44mg/L and 1.51±0.59mg/L, respectively,P<0.05). Cys C levels in patients with higher quartile of Gensini score were significantly higher than those in patients with lower quartile of Gensini score (50.00±37.37vs30.24±22.25,P<0.05). Box-plot figure revealed that median Cys C had a tendency to increase with the increa sin g vascular lesion counts (Spearman rank correlation coefficient 0.1576,P=0.0278). Multivariate ordinal log istic prediction models showed that OR of serum Cys C levels for number of diseased coronary arteries was 2. 09 (95%CI1.1382-3.8295,P<0.05). Conclusion Serum Cys C levels in patients with ACS are correlated to the severity of coronary artery disease.
【Key words】serum cystatin C; acute coronary syndrome; number of coronary artery disease; severity of coronary artery disease
doi:10.16118/j.1008-0392.2015.02.016
收稿日期:2014-10-27
【中图分类号】R 541.4
【文献标志码】A
【文章编号】1008-0392(2015)02-0068-06