·基础研究·
【摘要】目的 观察不同雌、孕激素水平对子宫内膜上皮细胞Claudin-4表达的影响。方法 RL95-2细胞系培养于含10%胎牛血清培养基中,在培养基中加入雌、孕激素,一组孕酮的浓度恒定为0.025μmol/L,雌二醇终浓度分别为1、0.5、0.25、0.125、0.0625和0nmol/L;另一组雌二醇的浓度恒定为0.25nmol/L,孕酮终浓度分别为0.1、0.05、0.025、0.0125、0.00625和0μmol/L。两组分别培养24、48和72h,RT-PCR和Western印迹法检测RL95-2细胞的Claudin-4基因和蛋白表达。结果 在雌激素恒定的条件下,RL95-2细胞的Claudin-4基因和蛋白表达随着孕激素水平的升高而升高(P<0.01),随着培养时间的延长,其表达Claudin-4基因和蛋白水平升高(P<0.01)。在孕激素恒定的条件下,RL95-2细胞的Claudin-4基因和蛋白表达随着雌激素水平的升高而降低(P<0.01),随着培养时间的延长,其表达Claudin-4基因和蛋白水平降低(P<0.01)。结论 Claudin-4在子宫内膜细胞的表达水平与雌孕激素的水平具有密切的联系,Claudin-4可能参与子宫容受性的形成和胚泡在子宫的着床有关。
【关键词】雌激素; 孕激素; 紧密连接; 子宫内膜
胚泡在子宫着床的过程中,子宫内膜起到关键性的作用,寻找合适的子宫容受性指标成为临床医师十分关切的问题之一[1]。紧密连接蛋白复合物是维持细胞离子和溶质细胞间渗透的主要物质,其主要成分为紧密连接蛋白Claudins[2],近年来的研究表明Claudin-4在子宫内膜的种植窗其表达明显上调,故认为Claudin-4在子宫的容受性形成和子宫着床等方面具有重要作用,可能成为子宫容受性和子宫内膜种植窗期的标志物[3]。本研究通过体外模拟孕激素和雌激素水平的生理性变化,观察子宫内膜细胞的Claudin-4表达,旨在观察Claudin-4在子宫内膜的表达及其与子宫内膜容受性的形成和胚泡着床的关系,为Claudin-4是否可以成为子宫内膜容受性标志物提供实验依据。
1.1 试剂
雌激素、孕激素、无酚红DMEM/F12培养基均购自美国Sigma公司;子宫内膜上皮细胞(RL95-2)购自中国典型培养物保藏中心(China Center for Type Culture Collection, CCTCC);胎牛血清(FBS)由杭州四季青生物制剂有限公司提供;TRIzol试剂盒购自美国Invitrogen公司;DNA酶I购自美国Fermentas公司;TagDNA聚合酶及反应缓冲液购自武汉博士德股份有限公司。
1.2 方法
1.2.1 细胞培养和分组 用10%FBS的DMEM/F12(1∶1,含0.005mg/ml胰岛素)培养基中培养RL95-2细胞,其培养条件为维持在5%CO2和37℃恒温。将指数生长的RL95-2细胞制备成浓度为1×104/ml,按照190μl/孔的方法将细胞接种到96孔的培养板上,经过24h培养后,将RL95-2细胞接种到16个60mm培养皿中,待细胞生长至汇合时,分别加入雌二醇和孕酮。一组孕酮的浓度恒定为0.025μmol/L,雌二醇终浓度分别为1、0.5、0.25、0.125、0.0625和0nmol/L。另一组雌二醇的水平保持在0.25nmol/L,孕酮浓度分别为0.1、0.05、0.025、0.0125、0.00625和0μmol/L。生长24、48、72h分别收获细胞,每组设1个阴性对照。
1.2.2 RT-PCR检测Claudin-4的mRNA表达 内标基因选择GAPDH,上游引物序列: 5′-ACCGCAAAGACTGTGGATGC-3′,下游引物序列: 5′-TGAGCTTGACAAAGTGGTCG-3′,其产物大小为546bp,Claudin-4上游引物序列: 5′-GTGCCTTG-CTCACCGAAAC-3′,下游引物序列: 5′-CCACCAC-TGCCCAAACCT-3′,目标片段的大小为137bp。采用总RNA提取试剂TRIzol提取各组处理后RL95-2细胞的总RNA;取1μl总RNA、AMV反转录酶0.5μl进行反转录;取cDNA 2.5μl为模板,分别加入0.1μl聚合酶Ex Taq HS,0.1μl上游和下游的引物,将上述物质进行混合和反应。94℃预变性 2min,及40s的变性,在温度为50~65℃的条件下40s的退火,和时间持续为1min在72℃温度条件下的延伸,总共循环进行35个。将PCR产物在-20℃ 的冰箱条件下进行保存。每组均以GAPDH作为内参照,同样条件下分管进行扩增。取6μl PCR产物,在电压120V,电流100mA的条件下2%琼脂糖凝胶电泳30min。电泳结束时,将凝胶放置在EB液中5min后,将凝胶取出。结果判定: 电泳条约逾期大小片段大小一致为阳性 RT-PCR 片段。应用Quantity One software(Bio-Rad Inc)分析电泳结果进行灰度扫描和分析。以目的基因片段的灰度值与GAPDH的灰度比值来表述目的基因mRNA产物的相对表达量。
1.2.3 Western印迹法检测Claudin-4的蛋白表达 提取各组处理后RL95-2细胞蛋白,将各组的蛋白加入到12%的SDS-PAGE凝胶上进行电泳,80V的电压条件下进行电泳,再用120V电压的条件下进行电泳至样品距凝胶下端1cm左右。用甲醇对PVDF膜进行浸泡5min,然后用缓冲液(主要由20%甲醇,25mmol/L Tris-HCl和 192mmol/L 甘氨酸组成,最终pH值为8.3,)浸泡10min后,并将凝胶上的蛋白质通过电转移的方式转移印迹到PVDF膜上,在120V电压的条件下总共转移的时间为70min。在4℃用5%FBS在PVDF膜进行封闭。先用1∶2000的Claudin- 4一抗,在室温的条件下反应1h,用0.05%吐温20 PBS液对PVDF膜进行清洗,每次10min,共进行3次。然后用1∶8000的山羊抗人IgG二抗,在室温的条件下3h,再用0.05%吐温20PBS液进行洗膜,每次洗膜 10min,清洗3次。ECL试剂显色: 将等比例的ECL试剂盒中的A和B液,分别与膜进行反应 1min,并通过凝胶成像系统进行显影,并进行拍摄照片。结果用 ImageJ 1.44对胶片扫描并进行平均密度值(average density values, ADV)测定,与GAPDH的比值作为各组产物相对吸光度值。
1.3 统计学处理
正态分布的计量资料数据采用![]() ±s表示,多组数据的比较采用方差分析(ANOVA),多组间的两两比较使用最小显著差法(LSD法),两组比较采用t检验,P<0.05为差异有统计学意义。
±s表示,多组数据的比较采用方差分析(ANOVA),多组间的两两比较使用最小显著差法(LSD法),两组比较采用t检验,P<0.05为差异有统计学意义。
2.1 孕激素对RL95-2细胞Claudin-4基因和蛋白表达的影响
在雌激素恒定的条件下,RL95-2细胞的Claudin-4基因和蛋白表达随着孕激素水平的升高而升高(P<0.01),随着培养时间的延长,其表达Claudin-4基因和蛋白水平升高(P<0.01),见图1、2。
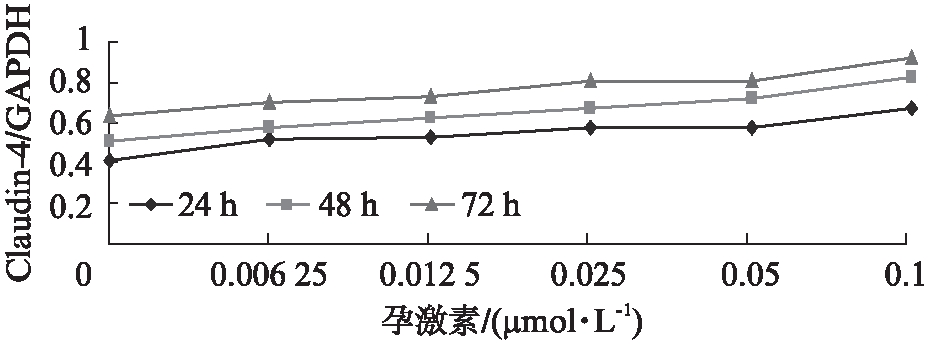
图1 不同浓度孕激素对 RL95-2细胞 Claudin-4基因表达的影响
Fig.1 The expression of Claudin-4 mRNA in RL95-2 cells with different concentrations of estrogen
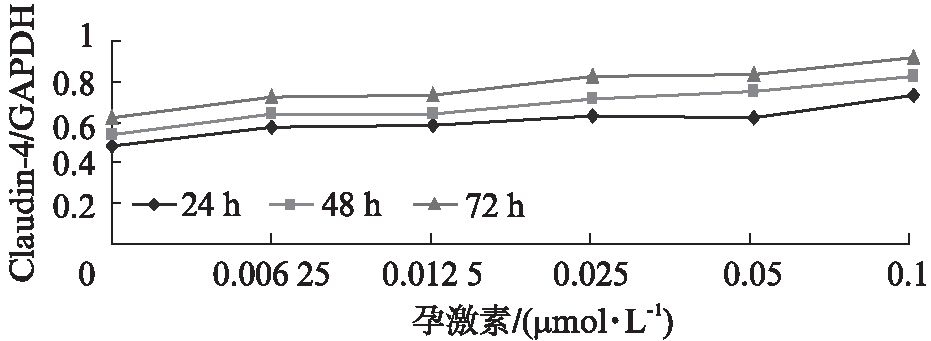
图2 不同浓度孕激素对 RL95-2细胞 Claudin-4蛋白表达的影响
Fig.2 The expression of Claudin-4 protein in RL95-2 cells with different concentrations of estrogen
2.2 雌激素对RL95-2细胞Claudin-4基因和蛋白表达的影响
在孕激素恒定的条件下,RL95-2 细胞的Claudin-4基因和蛋白表达随着雌激素水平的升高而降低(P<0.01),随着培养时间的延长,其表达Claudin-4基因和蛋白水平降低(P<0.01),见图3、4。
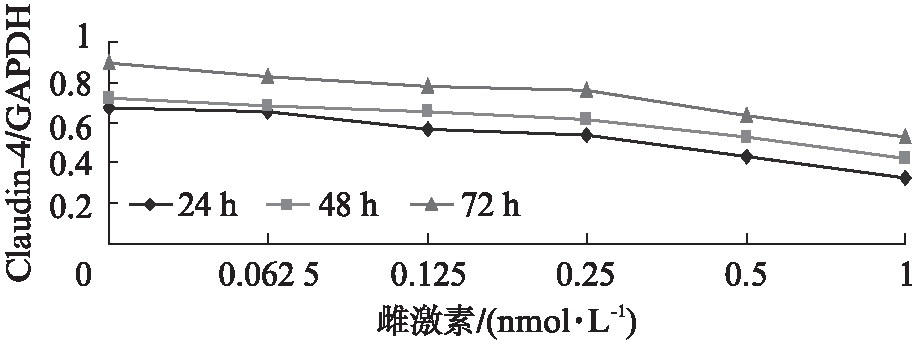
图3 不同浓度雌激素对 RL95-2细胞 Claudin- 4基因
表达的影响
Fig.3 The expression of Claudin- 4 mRNA in RL95-2 cells with different concentrations of progesterone
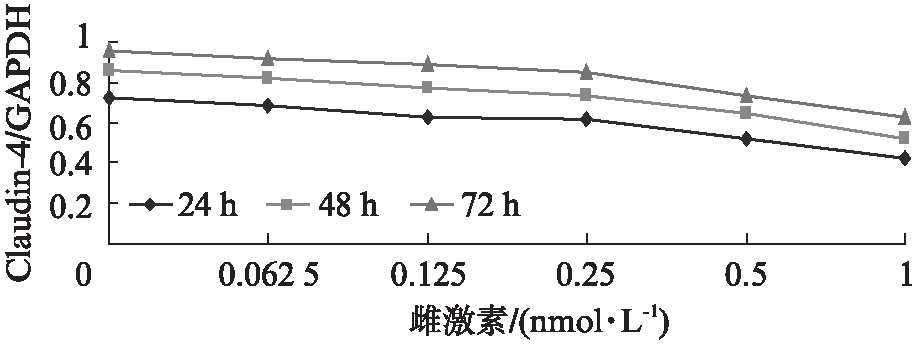
图4 不同浓度雌激素对 RL95-2细胞 Claudin- 4 蛋白表达的影响
Fig.4 The expression of Claudin- 4 protein in RL95-2 cells with different concentrations of progesterone
细胞黏附方式有多种,紧密连接为重要的一种,主要存在内皮细胞和上皮细胞形成的复合体中,主要功能是调控离子或者溶质的扩散作用,起到从细胞一侧向另一侧的屏障,同时紧密连接在细胞的顶侧,可以防止细胞基底部成分与顶侧成分的混合,决定了内皮细胞的极性,并对细胞的运动、增殖和分化等具有重要的调节作用[4-5]。紧密连接主要由膜蛋白和胞浆蛋白组成,其中膜蛋白主要为Claudin、Occludin和黏附分子[6]。Claudin是旁细胞转运的决定因子,其介导转运主要与分子大小和电荷具有明显的相关性。当Claudin在细胞出现异常表达时,出现内皮和上皮细胞出现结构和功能紊乱,甚至导致损害,可能参与了多种疾病发生和发展。
Claudin蛋白为多基因家族,有24个家族成员,Claudin-4是该家族最重要的家族成员之一,定位在染色体7q11.23,由209个氨基酸组成,主要存在于小肠、结肠,脑,肾和子宫内膜等[7]。Claudin-4与其他成员一样,具有4个疏水区,2个细胞外的环状结构和胞质中的氨基酸和羧基组成,由于羧基端具有磷酸化作用的位点,当羧基端发生磷酸化时,对Claudin蛋白的紧密连接复合体具有显著的调节作用。磷酸化参与紧密连接的调节,其作用的靶向位点: 肌动蛋白和肌球蛋白,肌球蛋白和肌动蛋白连接定位于从底部到顶部的连接复合物,肌球蛋白的结构收缩可以对紧密连接膜产生离心性的牵引作用,从而起到调节紧密连接的渗透性[8]。近年来,学者们发现胚胎滋养层细胞中有Claudin-4的表达,当Claudin-4受到抑制时,小鼠的滋养层细胞的屏障功能受到破坏,而且导致胚泡的形成受到显著的抑制,从而导致小鼠的胚胎的形成受到明显的抑制[9],故认为Claudin-4与胚泡的形成具有明显的联系。
近年来学者们通过基因芯片技术筛选与子宫容受性基因,发现Claudin-4在子宫内膜种子期表达量明显上调,表明Claudin-4可能在子宫内膜容受期具有重要作用,可能成为子宫内膜容受期的特异性指标[10]。本组研究表明在雌激素恒定的条件下,RL95-2细胞的Claudin-4基因和蛋白表达随着孕激素水平的升高而升高,随着培养时间的延长,其表达Claudin-4基因和蛋白水平升高;在孕激素恒定的条件下,RL95-2细胞的Claudin-4基因和蛋白表达随着雌激素水平的升高而降低,随着培养时间的延长,其表达Claudin-4基因和蛋白水平降低。与文献报道结果类似: 正常生育妇女的子宫内膜在增殖期到分泌期,Claudin-4表达逐渐增加,到分泌中期Claudin-4表达出现高峰,分泌晚期表达降低。目前的研究发现子宫的容受期仅仅为排卵后的6~10d,此时子宫内膜出现最大的胚泡种植的容受性。Claudin-4的高表达与子宫内膜容受期一致,即与子宫内膜的雌孕激素的水平变化一致,提示Claudin-4参与了子宫内膜的容受期,故可以认为Claudin-4表达水平的增加有利于胚泡黏附和植入,在胚胎着床的过程中发挥重要的作用。现有文献支持Claudin-4 参与了肿瘤细胞的侵袭和转移,并与肿瘤的分化和黏附有关[11-12],故Claudin- 4是否在胚泡在子宫内膜定位和黏附,是否与穿透上层基底层的连接细胞和内膜基质等需要进一步的研究。
总之,Claudin-4在子宫内膜细胞的表达水平与雌孕激素的水平具有密切的联系,Claudin-4可能参与子宫容受性的形成和胚泡在子宫的着床有关。
【参考文献】
[1] Forde N, Lonergan P. Transcriptomic analysis of the bovine endometrium: What is required to establish uterine receptivity to implantation in cattle?[J]. J Reprod Dev, 2012,58(2): 189-195.
[2] Zinner B, Gyongyosi B, Babarczi E, et al. Claudin 1 expression characterizes human uterine cervical reserve cells[J]. J Histochem Cytochem, 2013,61(12): 880- 888.
[3] Santin AD, Bellone S, Siegel ER, et al. Overexpre-ssion of Clostridium perfringens enterotoxin receptors claudin-3 and claudin-4 in uterine carcinosarcomas[J]. Clin Cancer Res, 2007, 13(11): 3339-3346.
[4] 马怡然,尚德淑,方文刚,等.细胞紧密连接的结构组成及其调控的研究进展[J].解剖科学进展,2010,16(1): 71-74.
[5] Koval M. Claudin heterogeneity and control of lung tight junctions[J]. Annu Rev Physiol, 2013,75: 551-567.
[6] 袁超,王学民.紧密连接的结构组成及其屏障功能研究进展[J].国际皮肤性病学杂志,2011,37(5): 297- 299.
[7] Poon CE, Madawala RJ, Day ML, et al. Claudin 7 is reduced in uterine epithelial cells during early pregnancy in the rat[J]. Histochem Cell Biol, 2013,139(4): 583-593.
[8] Sandbichler AM, Egg M, Schwerte T, et al. Claudin 28b and F-actin are involved in rainbow trout gill pavement cell tight junction remodeling under osmotic stress[J]. J Exp Biol, 2011,214(Pt 9): 1473-1487.
[9] Moriwaki K, Tsukita S, Furuse M. Tight junctions containing claudin 4 and 6 are essential for blastocyst formation in preimplantation mouse embryos[J]. Dev Biol, 2007,312(2): 509-522.
[10] 章汉旺,饶群,马亚平,等.Claudin 4在人月经周期子宫内膜的表达[J].中国妇幼保健,2008,23(35): 5044-5046.
[11] Hwang TL, Changchien TT, Wang CC, et al. Claudin-4 expression in gastric cancer cells enhances the invasion and is associated with the increased level of matrix metalloproteinase-2 and -9 expression[J]. Oncol Lett, 2014,8(3): 1367-1371.
[12] Hwang TL, Lee LY, Wang CC, et al. Claudin-4 expression is associated with tumor invasion, MMP-2 and MMP-9 expression in gastric cancer[J]. Exp Ther Med, 2010,1(5): 789-797.
Correlation of estrogen and progesterone levels with Claudin-4 expression in endometrial epithelial cells
【Abstract】Objective To investigate the association of estrogen and progesterone levels with Claudin-4 expression in endometrial epithelial cells. Methods Endometrial epithelial RL95-2 cells were cultured in 10% FBS-containing medium, and different concentrations of estrogen and progesterone were added into the culture medium. When the concentration of progesterone maintained at 0.025μmol/L, the final concentrations of estradiol were 1, 0.5, 0.25, 0.125, 0.0625 and 0nmol/L; or when the estradiol concentration maintained at 0.25nmol/L, the final concentration of progesterone were 0.1, 0.05, 0.025, 0.0125, 0.00625 and 0μmol/L, RL95-2 cells were cultured for 24h, 48h and 72h, respectively, the expression of Claudin-4 mRNA and protein was detected by RT-PCR and Western blotting. Results Under constant concentration of estrogen, the expression of Claudin-4 mRNA and protein in RL95-2 cells was increased as the progesterone levels increased or as the culture time was elongated(P<0.01). Under constant conditions of progesterone, the expression of Claudin-4 mRNA and protein was decreased in RL95-2 cells as estrogen levels increased or as the culture time was elongated(P<0.01). Conclusion The expression of Claudin-4 in endometrial epithelial cells is closely correlated with estrogen and progesterone levels, indicating that Claudin-4 may be involved in the formation of uterine receptivity and embryo implantation.
【Key words】estrogen; progesterone; closely connection; endometrial
doi:10.16118/j.1008-0392.2015.02.011
收稿日期:2014-10-20
基金项目:上海市卫生局项目(2011Y059)
【中图分类号】R 711
【文献标志码】A
【文章编号】1008-0392(2015)02-0045-04