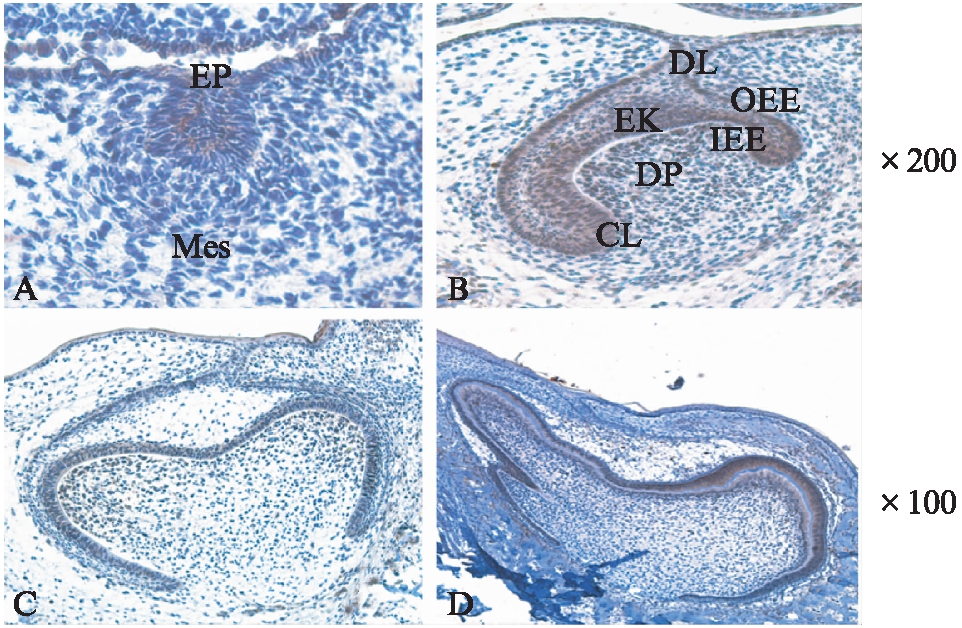
图1 SD大鼠磨牙牙胚发育所选4个阶段标本 免疫组织化学染色结果
Fig.1 Immunohistochemical staining of 4 stages during rat tooth germ development
A: E14.5(蕾状期);B: E16.5(帽状期);C: E18.5(钟状早期);D: P1(钟状晚期)免疫组化染色结果;EP: 牙源性上皮;Mes: 牙源性间充质;DL: 牙板上皮;OEE: 外釉上皮;IEE: 内釉上皮;CL: 颈环;DP: 牙乳头;EK: 釉结
·基础研究·
【摘要】目的 检测Cav 1.2羧基末端水解片段在SD大鼠下颌第一磨牙牙胚发育早期的表达,探讨其在牙胚发育过程中的作用。方法 制备大鼠磨牙牙胚各发育阶段标本(胚胎14.5、16.5、18.5d及出生后1d),采用免疫组织化学的方法分析Cav 1.2羧基末端水解片段在牙胚组织中的表达与分布。结果 Cav 1.2羧基末端水解片段在牙胚发育早期的不同发育阶段表达各异,P1钟状晚期在牙尖部位的成牙本质细胞呈强阳性表达,由牙尖部向根方阳性逐渐减弱。结论 Cav 1.2羧基末端水解片段在牙胚发育过程中呈时间-空间特异性表达,推测它可能与牙胚的发育及细胞的分化过程密切相关。
【关键词】Cav 1.2羧基末端水解片段; 牙胚发育
细胞内钙离子在细胞的生命活动中发挥着重要作用,从细胞的分裂、分化直到凋亡。L型钙离子通道是细胞外钙离子内流的主要途径,根据其主要的功能单位α1亚基的不同,而分为4个亚型,Cav 1.1、Cav 1.2、Cav 1.3、Cav 1.4[1]。前期研究[2]表明,人的牙髓细胞中主要表达Cav 1.2和Cav 1.3;在大鼠牙胚发育早期过程中,Cav 1.2呈时空特异性表达[3]。1994年De Jongh等发现在神经细胞与心肌细胞中,Cav 1.2的羧基末端可以发生裂解。近期研究表明,Cav 1.2羧基末端水解后可形成一个靠近通道的羧基末端PCT(proximal C-terminus)和胞浆中的羧基末端水解片段DCT(distal C-terminus),DCT可通过核膜转至胞核与核蛋白结合从而调控神经细胞的多基因转录[4-5]。目前已知DCT是Cav 1.2的一段十分重要的功能片段,对于Cav 1.2在牙齿发育过程中的表达情况已有初步研究,而国内外学者对于DCT的研究主要集中在神经细胞及心肌细胞中。本研究采用免疫组织化学的方法,检测DCT在牙胚发育早期过程中的表达,探讨其在牙胚发育过程中的作用。
1.1 切片制备
3月龄SD大鼠由同济大学动物中心提供,雌雄比1∶2,合笼,次日晨起以观察到阴道栓定为胚胎发育的0.5d(development day 0.5, E0.5),分别取E14.5,E16.5,E18.5的胎鼠及出生后1d(postnatal day 1, P1)的新生鼠,断颈处死,分离出下颌骨用PBS清洗后置于新鲜配制的4%多聚甲醛(pH 7.4)4℃固定24h,梯度乙醇脱水,二甲苯透明,石蜡定向包埋,冠状切片,制成5μm 厚的组织切片。
1.2 免疫组织化学染色
采用SABC法按照试剂盒(武汉博士德公司,中国)说明书步骤进行: 常规脱蜡至水,30ml/L过氧化氢封闭内源性过氧化物酶活性,微波抗原修复,5%BSA室温封闭 30min,滴加一抗即兔抗鼠 Cav 1.2羧基末端水解片段多克隆抗体(GL Biochem,美国)4℃湿盒过夜,0.01mol/L PBS漂洗后滴加生物素标记二抗室温下30min,PBS漂洗后滴加SABC室温下30min,PBS漂洗后滴加新鲜配制的DAB显色液于显微镜下控制显色,苏木精轻度复染细胞核,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜检拍照。阴性对照用0.01mol/L PBS代替一抗。
E14.5牙胚处于蕾状期,可见牙板末端的上皮细胞增生形成上皮芽状如花蕾。DCT在牙板及牙蕾上皮细胞胞体均呈阳性表达,与上皮紧邻的间充质细胞呈弱阳性表达(图1A)。E16.5牙胚处于帽状期,表现为外釉上皮、内釉上皮和星网状细胞形成了成釉器。DCT在牙板上皮、外釉上皮、内釉上皮、釉结、颈环及靠近内釉上皮的外层牙乳头细胞均呈阳性表达,在部分深层牙乳头细胞及牙囊则呈弱阳性表达(图1B)。

图1 SD大鼠磨牙牙胚发育所选4个阶段标本 免疫组织化学染色结果
Fig.1 Immunohistochemical staining of 4 stages during rat tooth germ development
A: E14.5(蕾状期);B: E16.5(帽状期);C: E18.5(钟状早期);D: P1(钟状晚期)免疫组化染色结果;EP: 牙源性上皮;Mes: 牙源性间充质;DL: 牙板上皮;OEE: 外釉上皮;IEE: 内釉上皮;CL: 颈环;DP: 牙乳头;EK: 釉结
El8.5牙胚处于钟状早期,在该期随着成釉器的发育,内釉上皮凹陷更深,形似吊钟。此期DCT在内釉上皮及其相邻的牙乳头细胞在未来牙尖形成区处呈阳性表达,逐渐减弱,至颈环处呈弱阳性表达,星网状层细胞阴性表达,见图2。
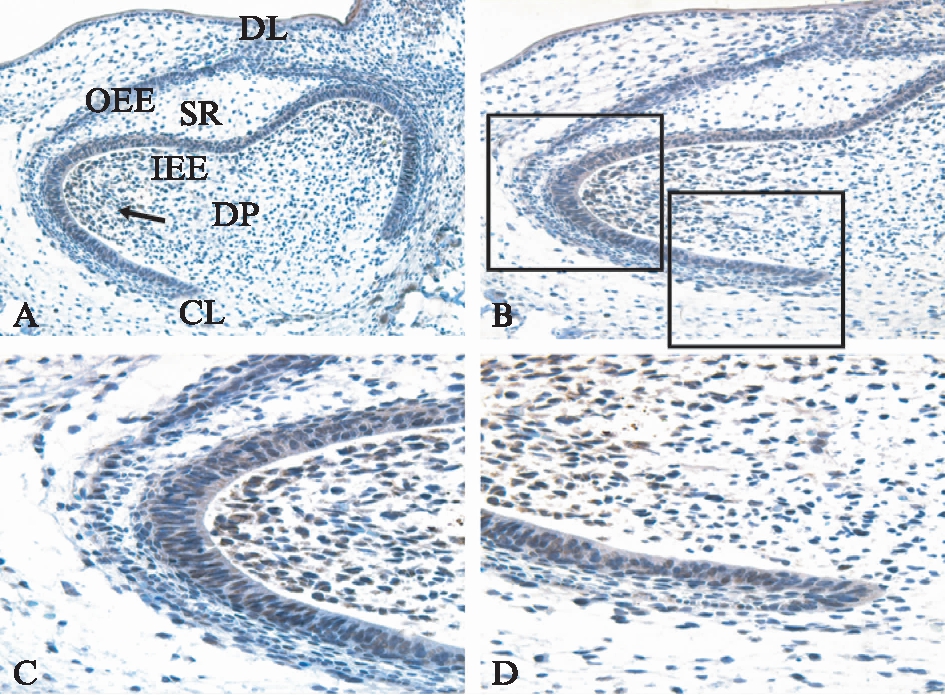
图2 E18.5(钟状早期)SD大鼠磨牙牙胚 免疫组织化学染色结果
Fig.2 Immunohistochemical staining of E 18.5 rat tooth germ development 图C、D为图B中黑色方框左、右部分的放大。图
A: ×100;图B: ×200;图C、D: ×400(SR星网状层)
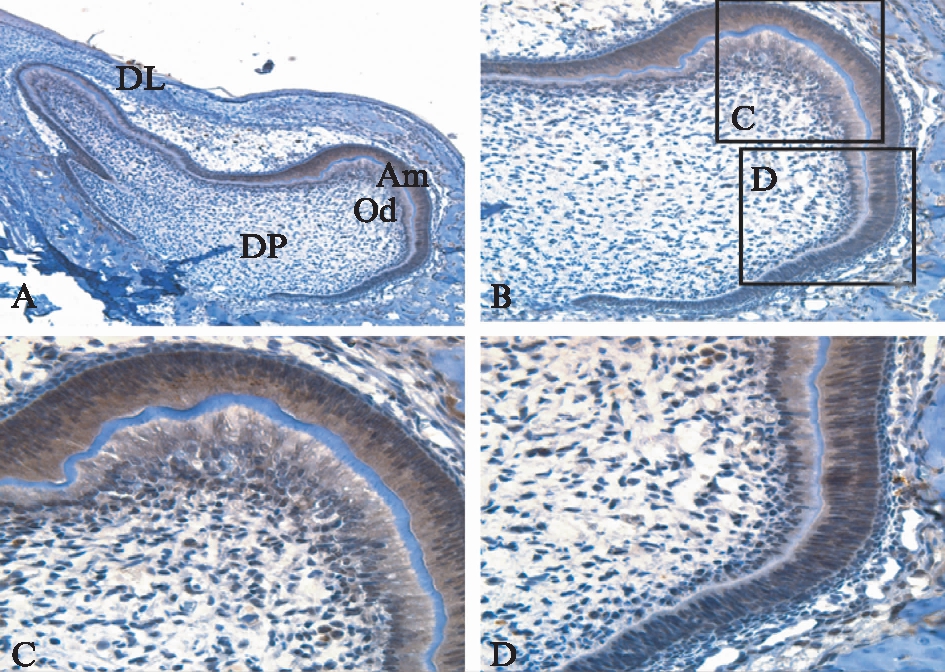
图3 P1(钟状晚期)SD大鼠磨牙牙胚 免疫组织化学染色结果
Fig.3 Immunohistochemical staining of P1 rat tooth germ development 图C、D为图B中黑色方框左、右部分的放大。
A: ×100;B: ×200;C、D: ×400;Am: 成釉细胞;Od: 成牙本质细胞
P1牙胚处于钟状晚期,内釉上皮细胞与相邻的牙乳头细胞分化为高柱状的成釉细胞和成牙本质细胞,并有少许牙本质形成。成牙本质细胞在牙尖部为高柱状细胞,向根方逐渐变为立方形甚至扁平状细胞。DCT在成牙本质细胞的表达由牙尖部向根方逐渐减弱,呈空间特异性,见图3。牙板上皮呈阴性表达。实验结果显示,在所检测的各个不同发育阶段,DCT呈时间-空间特异性表达。
牙齿的发育是一个连续而复杂的过程,是由外胚层来源的口腔上皮与其下方的间充质相互作用的结果,包括了上皮-间充质相互作用、细胞分化、形态发生、组织矿化和牙萌出,而细胞分化及形态发生是其核心过程[6]。L型钙离子通道是主要的钙离子进入通道,在各种兴奋细胞及其胞膜上都有大量存在,介导各种细胞功能,其中包括了神经递质释放、兴奋收缩耦联、信号转导等[7-8]。影响L型钙离子通道表达的因素很多,目前研究多集中于细胞内钙离子浓度变化、某些激素(血管紧张素Ⅱ和β肾上腺素等)的刺激、某些病理生理变化(细胞肥大和炎症刺激等)等[9-12]。
本研究发现DCT明显表达于牙胚发育早期过程中细胞增殖活跃的部位。从E14.5开始,牙源性上皮不断增殖,DCT呈阳性表达,至E18.5牙胚形态基本形成DCT在牙板上皮的表达减弱,直至P1基本无表达。牙胚发育期间,上皮与邻近上皮的间充质细胞的信号传导十分活跃,需要大量钙离子参与。Gao等[13]研究发现,在DCT片段上有通道抑制结构域,与含完整羧基末端的Cav 1.2通道相比而言,只要截去该羧基末端的147个氨基酸便可明显缓解该抑制作用,而使钙内流增加。此时DCT强阳性表达可能与Cav 1.2通道的表达增加及为增加钙内流而大量水解形成DCT有关。很多研究都证实了DCT对通道的自身抑制功能。Hulme等[14]的研究表明,Cav 1.2羧基末端水解后产生的截通道可以上调钙离子的转运能力,使钙内流增加。当细胞内钙离子浓度过高,DCT可重新与截通道的PCT以非共价键方式结合,形成自抑制复合体,从而发挥对Cav 1.2的强抑制作用,而且比原先以共价键方式结合的完整的Cav 1.2的抑制作用更强,如果阻断这一反应则可以消除DCT的抑制作用。在神经细胞中,Cav 1.2的羧基末端裂解形成的DCT片段可进入细胞核,参与调控多种基因的表达,并且可刺激神经突触的生长[15]。在E16.5的釉结和颈环处,DCT表达阳性。釉结是调控牙早期的形态发生的重要结构,是信号传递的中心,可调控多种不同的信号分子,包括Shh、FGF、BMP、Wnt家族的许多成员,而颈环处存在“干细胞龛”,与未来成釉细胞、成牙本质细胞的形成及牙根的发育密切相关,各种信号分子传递十分活跃,提示DCT可能参与牙早期的形态发生的信号传递过程。
有研究发现,L型钙离子通道与细胞的分化有着密切的关联。1994年,Seux等以1,4-二羟吡啶为抗体,采用免疫组化方法研究发现L型钙离子通道在大鼠第一磨牙成牙本质细胞分化时有表达,且表达随分化而变化。前期研究已发现,L型钙离子通道与牙胚发育过程中细胞的分化有关。Gomez-ospina等[15]发现Cav 1.2的末端水解片段在细胞质中水解后可穿越核膜分布到多种神经元的细胞核中,分布的部位和量随着神经元的分化而变化。本研究中,E18.5邻近内釉的牙乳头细胞开始向成牙本质细胞分化,免疫组化染色结果从未来牙尖区至牙颈部牙乳头细胞阳性染色逐渐变浅。P1成牙本质细胞已经形成,牙尖处成牙本质细胞呈强阳性表达,向牙颈部逐渐减弱,至颈环处几乎无表达。这可能是由于牙尖处成牙本质细胞分化成熟,有牙本质形成,细胞功能旺盛,需要大量的钙离子参与,此时Cav 1.2羧基末端大幅水解,使大量的Cav 1.2通道呈截通道形式表现,并消除了DCT的抑制作用,为成牙本质细胞活跃的功能和牙本质形成提供充足的钙内流。在同一时期颈环处低分化的成牙本质细胞表达较弱,未分化的更是基本无表达,表明DCT与成牙本质细胞的分化有着一定关联。
综上所述,Cav 1.2羧基末端水解片段在大鼠磨牙发育过程具有一定的时空表达特异性,参与牙胚发育早期的细胞增殖、分化及牙的形态发生,与成牙本质细胞的分化与牙本质形成密切相关,其具体机制有待进一步研究。然而本实验仅采用免疫组化这一定性研究方法有很大的局限性。由于在心肌细胞中DCT可进入细胞核参与基因调控,而本实验中可以看出DCT与成牙本质细胞的分化有着一定联系,后期课题组将从细胞层面研究DCT在成牙本质细胞中是否发生核转位现象,进一步探讨DCT在牙胚发育过程中的影响。
【参考文献】
[1] Belkacemi L, Bedard I, Simoneau L, et al. Calcium channels, transporters and exchangers in placent
A: a review[J]. Cell Calcium, 2005,37(1): 1-8.
[2] 谢亚佳,余晶,许多,等.周期性张应变对人牙髓细胞L型钙离子通道基因表达的影响[J].牙体牙髓牙周病学杂志,2009,19(8): 435-437.
[3] 梁丽,李艳,许多,等.Cav 1.2在大鼠磨牙牙胚发育中的时空表达[J].北京口腔医学,2010,18(6): 301-303.
[4] Dolmetsch RE, Pajvani U, Fife K, et al. Signaling to the nucleus by an L-type calcium channel-calmodulin complex through the MAP kinase pathway[J]. Science, 2001,294: 333-339.
[5] Hulme J, Yarov-Yarovoy V, Lin T, et al. Autoin-hibitory control of the Cav 1.2 channel by its proteol-ytically processed distal C-terminal domain[J]. J Physiol, 2006,576(1): 87-102.
[6] Pispa J, Thesleff I. Mechanisms of ectodermal organogenesis [J]. Dev Biol, 2003,262(2): 195- 205.
[7] Gao T, Puri TS, Gerhardstein BL,et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes[J]. J Biol Chem, 1997,272(31): 19401-19407.
[8] Catterall WA, Perez-Reyes E, Snutch TP,et al. International Union of Pharmacolog. XLVIIL. Nomen-clature and structure-function relationships of voltage-gated calcium channels[J]. Pharmacol Rev, 2005,57(4) : 411-425.
[9] Fu Y, Westenbroek RE, Yu FH, et al. Deletion of the distal C terminus of Cav 1.2 channels leads to loss of β-adrenergic regulation and heart failureinvivo[J]. J Biol Chem, 2011,286(14): 12617-12626.
[10] Domes K, Ding J, Lemke T, et al. Truncation of murine Cav 1.2 at Asp-1904 results in heart failure after birth[J]. J Biol Chem, 2011,286(39): 33863-33871.
[11] Saada NI, Carrillo ED, Dai B, et al. Expression of multiple Cav 1.2 transcripts in rat tissues mediated by different promoters[J]. Cell Calcium, 2005,37: 301- 109.
[12] Yang L, Katchman A, Samad T, et al. β-adrenergic regulation of the L-type Ca2+channel does not require phosphorylation of α1C Ser1700[J]. Circ Res, 2013,113(7): 871-880.
[13] Gao T, Cuadra AE, Ma H, et al. C-terminal fragments of the alpha 1C (Cav 1.2) subunit associate with and regulate L-type calcium channels containing C-terminal-truncated alpha 1C subunits[J]. J Biol Chem, 2001, 276(24): 21089-21097.
[14] Hulme JT, Konoki K, Lin TW, et al. Sites of proteolytic processing and noncovalent association of the distal C-terminal domain of Cav 1.1 channels in skeletal muscle[J]. Proc Natl Acad Sci USA, 2005,102(14): 5274-5279.
[15] Gomez-Ospina N, Tsuruta F, Barreto-Chang O, et al. The C terminus of the L-type voltage-gated calcium channel Ca(V)1.2 encodes a transcription factor[J]. Cell, 2006,127(3): 591-606.
Expression of distal carboxyl-terminal fragments of Cav 1.2 in rat tooth germ development
【Abstract】Objective To investigate the expression of distal carboxyl-terminal fragments of Cav 1.2 during rat tooth germ development. Methods Samples were collected from SD rat at various time points (embryonic d14.5,16.5,18.5 and postnatal d1). Immunohistochemistry technique was used to detect the expression of distal C-terminal fragments of Cav 1.2. Results The expression of distal C-terminal fragments of Cav 1.2 varied at different stages of embryo. At postnatal d1, it gradually weakened from the tip of the tooth to the root in enameloblasts and odontoblasts. Conclusion The expression of distal C-terminal fragments of Cav 1.2 is in a temporal-spatial specific pattern, which may be closely related to the tooth germ development and cell differentiation process.
【Key words】distal carboxyl-terminal fragments of Cav 1.2; tooth germ development
doi:10.16118/j.1008-0392.2015.02.007
收稿日期:2014-07-28
【中图分类号】R 78
【文献标志码】A
【文章编号】1008-0392(2015)02-0029-04