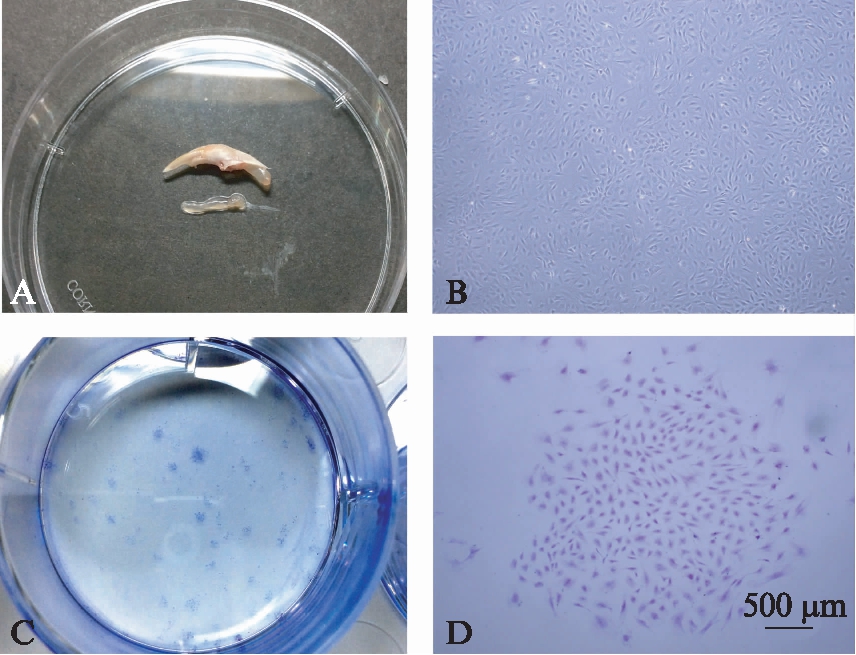
图1 牙乳头干细胞的原代分离、培养
Fig.1 The Isolation and culture of SCAPs
A: 大鼠完整牙髓组织;B: 培养10d时的牙乳头干细胞(×40);C: P2牙乳头干细胞克隆平板实验;D: 为结晶紫染色单个克隆结节(×40)
·基础研究·
【摘要】目的 利用慢病毒转染系统构建Cav 1.2基因沉默的大鼠根尖牙乳头干细胞(stem cells from apical papilla, SCAPs),探讨Cav 1.2在大鼠牙乳头干细胞成牙向分化中的作用。方法 取3周龄SD大鼠,采用酶消化法获取大鼠根尖牙乳头干细胞,取第二代大鼠根尖牙乳头干细胞进行克隆平板实验鉴定其增值能力;采用慢病毒转染的方法构建Cav 1.2基因沉默Sh-Cav 1.2牙乳头干细胞及对照组Luc-Cav 1.2牙乳头干细胞, RT-PCR及Western印迹法鉴定其转染效率,并诱导其向成牙本质细胞样细胞分化;在成牙向诱导分化第10天,RT-PCR及茜素红S染色观察Cav 1.2对大鼠根尖牙乳头干细胞成牙向分化的影响。结果 分离获得较强增殖能力的大鼠牙乳头干细胞,其中每200个细胞可形成6~10个克隆;荧光倒置显微镜下转染48h,Sh-Cav 1.2及Luc-Cav 1.2均呈现绿色荧光,转染效率均达到90%;在两组细胞成牙向诱导过程中,实验组Sh-Cav 1.2牙乳头干细胞成牙相关基因DSPP的表达及钙化结节的形成均明显低于对照组Luc-Cav 1.2。结论 L型钙离子通道Cav 1.2对大鼠根尖牙乳头干细胞成牙向分化有重要作用。
【关键词】根尖牙乳头干细胞; L型钙离子通道; 基因沉默; 成牙向分化
根尖牙乳头干细胞(stem cells from apical papilla, SCAP)是从未发育完全的牙根尖牙乳头分离获取的未分化间充质细胞,具有自我更新、多向分化能力,能够通过复合HA/TCP生物陶瓷在裸鼠皮下形成牙髓牙本质复合体样结构,成为近年来组织工程研究热点[1-2]。钙离子作为细胞内重要的第二信使,可以调节细胞内一系列的生命活动,而钙离子内流主要是通过L型钙离子通道。近期研究显示,使用尼莫地平阻断L型钙离子通道,能够明显抑制MTA对牙髓干细胞成牙分化的促进作用[3]。但是,根尖牙乳头干细胞成牙向分化过程中,L型钙离子通道是否直接发挥作用尚未见文献报道。本实验通过慢病毒转染系统介导pLVX-shRNA2质粒(阴性对照分别为荧光素酶序列)在牙乳头干细胞中表达,抑制牙乳头干细胞中L型钙离子通道Cav 1.2的表达,检测Cav 1.2在牙乳头干细胞成牙向分化过程中的作用。
1.1 主要试剂和仪器
3周龄SD大鼠购自上海斯莱克实验动物有限责任公司;α-MEM培养基、胎牛血清(FBS)购自美国Hyclone公司;谷氨酰胺(Glutamine)购自美国Sigma公司;I型胶原酶、中性蛋白酶购自美国Gibco公司; pLVX-shRNA2质粒购自美国Clontech公司, SCAP-Cav 1.2沉默基因慢病毒质粒、包装质粒pRSV-REV、pMDLg/RRE、VSVG由同济大学口腔医学院葛剑平博士惠赠;兔抗大鼠Cav 1.2多克隆抗体购自以色列Alonmon公司;超净工作台,细胞培养箱购自美国Thermo公司;倒置荧光相差显微镜购自日本Nikon公司。
1.2 根尖牙乳头干细胞的获取和鉴定
1.2.1 原代培养 3周龄SD大鼠6只,平均体质量(120±20)g,参照Gronthos等[4]的方法断颈处死,分离下颌骨、下颌切牙,取出牙髓,剪去上段2/3牙髓组织,保留下段1/3牙乳头,充分剪碎后,用 3mg/ml Ⅰ型胶原酶和4mg/ml中性蛋白酶联合消化1h,终止消化后,通过70μm滤膜获取单细胞悬液,接种于含有10%胎牛血清、2mmol/L 谷氨酰胺、100U青霉素和100mg/ml链霉素的α-MEM培养基中,置0.5%CO2、37℃细胞培养箱中培养,2~3d 换液,取P2~P5用于后续研究。
1.2.2 自我增殖能力鉴定 取P2 SCAPs, 0.25%胰酶消化收集细胞,制备单细胞悬液,调整细胞浓度,以200~300/孔的密度接种于6孔板,标准条件下培养10d后,弃去培养液,4%多聚甲醛固定 10min,0.5%结晶紫染色12h,显微镜下进行细胞克隆计数(>50个细胞作为1个克隆)。
1.3 SCAPs慢病毒介导的转染及鉴定
1.3.1 慢病毒颗粒包装浓 缩取对数期293T细胞于10cm培养皿中,待细胞长至70%,使用磷酸钙转染试剂盒(深圳,百思维)转染,18h后去除含有慢病毒的培养基,加入10ml新鲜培养液。分别于48h、72h荧光倒置显微镜下观察计数GFP阳性细胞,收集病毒液并进行高速离心,离心半径11.5cm,6230r/min,4℃离心2.5h,弃上清液,100μl去离子水溶解回收慢病毒颗粒至 1.5ml EP管内,-80℃ 保存备用。
1.3.2 Cav 1.2基因沉默慢病毒颗粒转染SCAPs 实验组为转染并携带有SCAP-Cav 1.2 siRNA的SCAPs(sh-SCAPs组),对照组为转染携带有pLVX-shRNA2的SCAPs(Luc-SCAPs组)。取P2~P5对数期牙乳头干细胞,接种到10cm培养皿中,待细胞长至50%,将浓缩制备的慢病毒颗粒以每皿100μl加入,18h后更换培养液,48h后于倒置荧光显微镜下观察绿色荧光蛋白阳性的细胞,72h后传代并收集细胞,进行下一步的检测。
1.3.3 Cav 1.2基因沉默鉴定 转染72h后,RT-PCR检测Cav 1.2基因。TRIzol提取两组细胞总RNA,反转录为cDNA。Cav 1.2上游引物: 5′-ATCCAAGTTCAGCCGCTACT-3′;下游引物: 5′-GTTGTAGTGTTCGGAGGCAA-3′;GAPDH上游引物: 5′-CGGCAAGTTCAACGGCACAG-3′;下游引物: 5′-CGCCAGTAGACTCCACGACAT-3′。PCR反应条件: 95℃ 5min,95℃、15s,60℃、60s,40个循环。
转染72h后,Western印迹法检测Cav 1.2蛋白。RIPA裂解细胞,提取细胞总蛋白,BCA法测蛋白浓度,行8%SDS-PAGE电泳,转印PVDF膜,5%脱脂奶粉室温震荡封闭1h,与兔抗大鼠Cav 1.2抗体4℃孵育过夜(抗体滴度,1∶200),二抗室温孵育1h,加入ECL显色液显影。
1.4 SCAPs成牙向诱导
取转染后Cav 1.2基因沉默及对照组SCAPs,以2×104密度接种至12孔板,更换培养液为矿化培养液: 10%胎牛血清,2mmol/L谷氨酰胺、100U青霉素和100mg/ml链霉素,50μg/ml抗坏血酸,10mmol/L β甘油磷酸钠,10nmol/L地塞米松,2~3d 换液。1.4.1 RT-PCR检测Cav 1.2基因沉默SCAPs成牙分化过程中DSPP表达 诱导培养第10天时,提取两组细胞总RNA,反转录cDNA(步骤同前)。DSPP上游引物: 5′-ACGCCACTAACGACGAT-TC-3′,下游引物: 5′-CCTCCTACGGCTATCGA-CTC-3′。
1.4.2 茜素红染色 诱导培养第14天时取出12孔板,吸去培养基,PBS洗3次,95%乙醇固定 10min,加入0.1%茜素红Tris-Hcl(pH: 4.2)37℃,30min,显微镜下观察结果。
1.5 统计学处理
数据采用统计学软件SPSS 13.0进行分析,两组之间采用t检验,P<0.05为差异有统计学意义。
2.1 牙乳头干细胞形态及克隆形成率
不同于牙髓干细胞,大鼠根尖牙乳头取自于完整牙髓下段1/3(图1A)。倒置显微镜下观察显示: 大鼠根尖牙乳头干细胞体积形态类似于成纤维细胞,较为短小(图1B)。牙乳头干细胞低密度培养10d可见明显克隆形成,每200个细胞可形成 6~10个克隆(图1C、D)。

图1 牙乳头干细胞的原代分离、培养
Fig.1 The Isolation and culture of SCAPs
A: 大鼠完整牙髓组织;B: 培养10d时的牙乳头干细胞(×40);C: P2牙乳头干细胞克隆平板实验;D: 为结晶紫染色单个克隆结节(×40)
2.2 Cav 1.2基因沉默效率检测
荧光倒置相差显微镜下SCAPs转染情况,转染后48h可见两组细胞均呈现绿色荧光(图2A、2B),阳性率达90%以上,细胞形态未见明显变化。RT-PCR检测两组牙乳头干细胞中Cav 1.2 mRNA的表达,实验组SCAPs Cav 1.2 mRNA与对照组相比明显降低(P<0.05),见图2C。Western印迹法检测Cav 1.2-sh牙乳头干细胞中Cav 1.2蛋白的表达,实验组对照组均在190000左右出现目的条带,实验组牙乳头干细胞Cav 1.2表达与对照组相比显著降低(图2D)。
2.3 Cav 1.2在牙乳头干细胞成牙向分化中的作用
Cav 1.2-sh牙乳头干细胞成牙诱导后第10天RT-PCR显示实验组成牙相关基因DSPP转录水平的表达量明显低于对照组,表示Cav 1.2sh可能对牙乳头干细胞成牙过程中DSPP的表达有抑制作用(图3)。
成牙诱导第14天时茜素红染色结果显示,实验组与对照组茜素红染色均为阳性。Cav 1.2-sh组茜素红染色相比对照组较浅,钙结节含量偏低,提示Cav 1.2在牙乳头细胞成牙分化过程中起较为重要的作用,见图3。
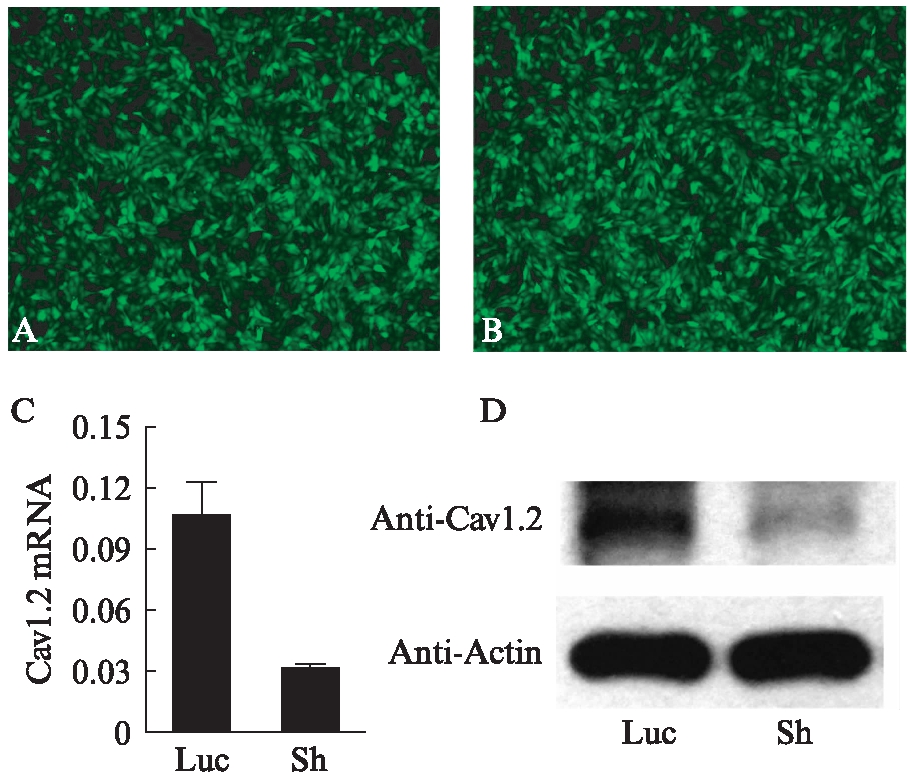
图2 L型钙离子通道Cav 1.2基因沉默牙乳头 干细胞的转染及鉴定
Fig.2 The transfection of pLVX-shRNA2 and identification of Cav 1.2 gene silence in SCAPs
A: 对照组Luc-SCAPs;B: 实验组sh-SCAPs;C: 慢病毒颗粒感染SCAPs 72h后RT-PCR检测Cav 1.2基因表达情况;D: 慢病毒颗粒感染SCAPs 72h后Western印迹法检测Cav 1.2蛋白表达情况
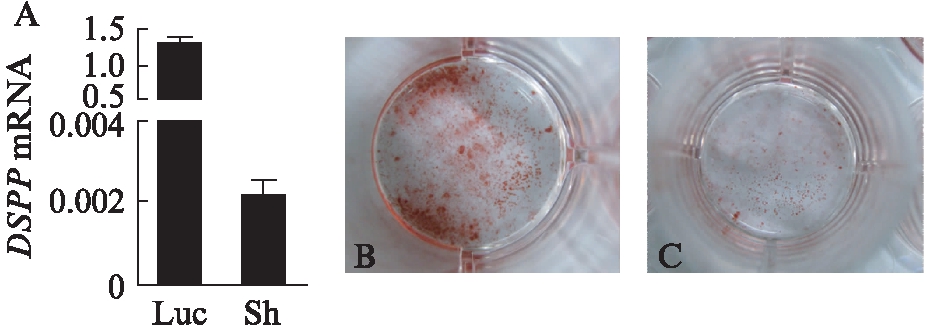
图3 L型钙离子通道Cav 1.2在大鼠牙乳头 干细胞成牙向分化中的作用
Fig.3 The role of L-type calcium channel Cav 1.2 in odontoblastic differentiation of SCAPs
A: 两组牙乳头干细胞成牙向诱导10d 时DSPP基因表达水平;B: 对照组茜素红染色;C: 实验组茜素红染色
牙乳头在牙齿发育过程中起着重要的作用,根尖部牙乳头细胞能够在内釉上皮层的诱导下分化为成牙本质细胞,分泌牙本质基质,并矿化形成牙本质,从而参与根部牙本质的形成。与牙髓干细胞相比,牙乳头干细胞显现出不同于牙髓干细胞(dental pulp stem cells, DPSCs)的生物学特性,如牙乳头干细胞具有更强的群体倍增能力,成牙本质能力及体内形成牙髓牙本质复合体结构的能力[5]。本实验采用大鼠根尖牙乳头干细胞作为研究对象,体外获取稳定的牙乳头干细胞,细胞生长良好,具有克隆形成能力,具备干细胞的特性。
在牙齿发育过程中,牙本质的形成需要大量的钙离子参与,钙离子作为细胞内重要的第二信使,通过L型钙离子通道进出细胞,调节肌肉收缩,细胞分泌,离子转运,细胞增殖、分化等多种生命活动[6-9]。研究[10]发现,神经干细胞的分化与L型钙离子通道特别是Cav1密切相关,激活或者阻断L型钙离子通道可以明显地促进或者抑制神经干细胞的分化[10],早期文献[11-12]也已报道骨髓间充质干细胞中表达L型钙离子通道,在骨髓间充质干细胞分化研究中显示,L型钙离子通道对骨髓间充质干细胞增殖和成骨向分化有关键作用,调节钙离子浓度亦能促进间充质干细胞成骨向分化[13]。牙髓干细胞中高表达L型钙离子通道Cav 1.2亚型,并对牙髓干细胞成神经向分化具有关键的调节作用[14]。本研究中,通过慢病毒介导的RNA干扰技术,在牙乳头干细胞中特异性的抑制Cav 1.2基因的表达后,发现牙乳头干细胞成牙向分化的能力及成牙相关基因的表达都有明显的下降,据此推测牙乳头干细胞中 Cav 1.2基因沉默后,Cav 1.2表达减少,钙离子内流减少,而成牙需要大量的钙离子,因此Cav 1.2基因沉默抑制了牙乳头干细胞成牙向分化,故推测细胞外钙离子进入牙乳头干细胞参与组织钙化主要是通过L型钙离子通道Cav 1.2。综上所述,Cav 1.2基因沉默主要是通过减少细胞内钙离子流而对牙乳头干细胞成牙向分化产生抑制作用。除此之外,Cav 1.2羧基末端可以被蛋白水解酶水解,从而产生一个远离中心的DCT和残留的截通道[15],研究发现截通道可以上调钙离子的转运能力,而水解下来的片段DCT与截通道的再结合可以明显抑制钙流,从而形成负反馈机制[16],对L型钙离子通道产生一个自我抑制作用。故推测,Cav 1.2与其末端DCT通过相互作用影响钙离子内流,从而对牙乳头干细胞的成牙向分化产生一个相互调节作用。
本研究证实了体外培养的牙乳头干细胞具有克隆形成能力和较强的成牙能力,初步探讨了L型钙离子通道在牙乳头干细胞成牙向分化中的作用,从而为牙本质的形成提供了一定的理论基础。然而,Cav 1.2具体通过激活哪条信号通路而调控牙乳头细胞成牙向分化有待进一步的研究。
【参考文献】
[1] Sonoyama W, Liu Y, Yamaza T, et al. Charac-terization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study[J]. J Endod, 2008,34(2): 166-171.[2] Sonoyama W, Liu Y, Fang D, et al. Mesenchymal stem cell-mediated functional tooth regeneration in swine[J]. PLoS One, 2006,1(1): e79.
[3] Woo SM, Hwang YC, Lim HS, et al. Effect of nifedipine on the differentiation of human dental pulp cells cultured with mineral trioxide aggregate[J]. J Endod, 2013,39(6): 801-805.[4] Gronthos S, Mankani M, Brahim J, et al. Postnatal human dental pulp stem cells ( DPSCs) in vitro and in vivo[J]. Proc Natl Acad Sci USA, 2000,97(25): 13625-13630.
[5] Bakopoulou A, Leyhausen G, Volk J, et al. Comparative analysis of in vitro osteo/odontogenic differentiation potential of human dental pulp stem cells (DPSCs) and stem cells from the apical papilla (SCAP)[J]. Arch Oral Biol, 2011,56(7): 709- 721.
[6] Zhang L, Tang A, Zhou Y, et al. Tumor-conditioned mesenchymal stem cells display hematopoietic differentiation and diminished influx of Ca2+[J]. Stem Cells, 2012,21(9): 1418-1428.
[7] Deisseroth K, Mermelstein PG, Xia H, et al. Signaling from synapse to nucleus: the logic behind the mechanisms[J]. Curr Opin Neurobiol, 2003,13(3): 354-365.
[8] Spitzer NC, Root CM, Borodinsky LN. Orchestrating neuronal differentiation: patterns of Ca2+spikes specify transmitter choice[J]. Trends Neurosci, 2004,27(7),415-421.
[9] Thompson WR, Rubin CT, Rubin J. Mechanical regulation of signaling pathways in bone[J]. Gene,2012,503(2): 179-193.
[10] D’Ascenzo M, Piacentini R, Casalbore P, et al. Role of L-type Ca2+channels in neural stem/progenitor cell differentiation[J]. Eur J Neurosci, 2006,23(4): 935- 944.
[11] Li GR, Deng XL, Sun H, et al. Ion channels in mesenchymal stem cells from rat bone marrow[J]. Stem Cells, 2006,24(6): 1519-1528.
[12] Wen L, Wang Y, Wang H, et al. L-type calcium channels play a crucial role in the proliferation and osteogenic differentiation of bone marrow mesenchymal stem cells[J]. Biochem Biophys Res Commun, 2012,424(3): 439-445.
[13] Sun S, Liu Y, Lipsky S, et al. Physical manipulation of calcium oscillations facilitates osteodifferentiation of human mesenchymal stem cells[J]. FASEB J, 2007,21(7): 1472-1480.
[14] Ge J, Ju Y, Xue Z, et al. Distal C terminus of Cav 1.2 channels plays a crucial role in the neural differentiation of dental pulp stem cells[J]. PLoS One, 2013,8(11): e81332.
[15] Satin J, Schroder EA, Crump SM. L-type calcium channel auto-regulation of transcription[J].Cell Calcium, 2011,49(5): 306-313.
[16] Gao T, Cuadra AE, Ma H, et al. C-terminal fragments of the alpha 1C (Cav 1.2) subunit associate with and regulate L-type calcium channels containing C-terminal-truncated alpha 1C subunits[J]. J Biol Chem, 2001,276(24): 21089-21097.
Effect of L-type calcium channels Cav 1.2 on odontoblasticdifferentiation in rat apical papilla cells
【Abstract】Objective The stem cells from apical papilla(SCAPs) which Cav 1.2 gene was silenced with a Lentivirus-mediated gene knock down system were constructed to clarify the effect of L-type calcium channel-Cav 1.2 in the process of the odontoblastic differentiation of the apical papilla cells in rats. Methods The apical papilla cells were isolated from 3-weeks-old SD rats by enzyme digestion methods. Then the proliferation ability were measured by calculating the colony forming efficiencyinvitro. The SCAPs were transfected with a Sh-Cav 1.2 Lentivirus vector, while the Luc-Cav 1.2 vector as a negative control. The expression of Cav 1.2 gene in differentially treated SCAPs was determined by RT-PCR and Western blotting. The odontoblastic differentiation of differentially treated SCAPs was evaluated via Alizarin red S staining and detecting the expression of dentin sialoph osphoprotein(DSPP) in SCAPs. Results The SCAPs obtained from SD rats had a strongly proliferation ability, and the colony forming efficiency of isolated SCAPs was 6 to 10 clones in 200 cells. The expression of green fluorescent protein in differentially treated SCAPs were both >90% at 48h after transfection. Besides, the expression of DSPP gene and the formation of calcific nodules were dramatically decreased in the Cav 1.2 gene silenced SCAPs compared with the control group. Conclusion L-type calcium channel-Cav 1.2 has a critical role in the odontoblastic differentiation of SCAPs.
【Key words】apical papilla cells; L-type calcium channels; gene silencing; odontoblastic differentiation
doi:10.16118/j.1008-0392.2015.02.006
收稿日期:2014-11-02
基金项目:国家自然科学基金(81070825,81170951);上海市科委医学引导项目(10411964600)
【中图分类号】R 78
【文献标志码】A
【文章编号】1008-0392(2015)02-0024-05